Kontrolle der Genexpression
Werbung

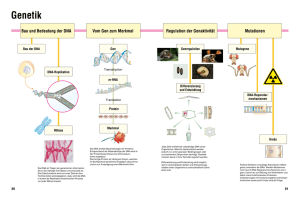
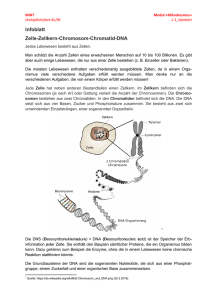
Kapitel 31 Kontrolle der Genexpression Diese Zusammenfassung basiert ausschliesslich auf dem „Stryer“ (d.h. Vorlesungsstoff ist nicht enthalten)! Genexpression ist der Oberbegriff für die Transkription eines Gens in mRNA, die Weiterverarbeitung dieser mRNA, und (bei proteincodierenden Genen) die Translation in ein Protein. Die Art der Genexpression hängt vom Zelltyp, sowie von Einflüssen wie z.B. Wachstumsfaktoren ab. Die Regulation der Genaktivität findet auf Ebene der Transkription statt. 31.1) DNA-bindende Proteine heften sich an Regulationsstellen in den Operons Aufbau eines Operons Eine Einheit der koordinierten Genexpression bezeichnet man als Operon. Die genetischen Elemente des Operonmodells sind ein Regulatorgen, eine als Operatorstelle bezeichnete regulierende DNASequenz und eine Gruppe von Strukturgenen. Das Regulatorgen codiert ein Repressorprotein, das an die Operatorstelle bindet und damit die Transkription verhindert. Im Lactose- oder lac-Operon codiert das Gen i den Repressor, o ist die Operatorstelle und die Gene z,y und a codieren für drei versch. Enzyme, welche aber in ein einziges mRNA-Molekül (polygenes Transkript) transkribiert werden, das alle drei Proteine codiert. Ausserdem enthält das Operon einen Promotor, der als p bezeichnet wird und die RNA-Polymerase an die richtige Transkriptionsstartstelle führt. Die DNA des lac-Operators besitzt eine annähernde Spiegelsymmetrie, d.h. eine umgekehrte Sequenzwiederhohlung (invertet repeat) ist vorhanden. Das lac-Repressorprotein Bakterien wie E.Coli nutzen Glucose als Energieliferanten, können ihren Kohlenstoff jedoch auch aus Lactose beziehen, denn Lactose wird mit einem Enzym (Beta-Galactosidase) zu Galactose und Glucose hydrolisiert, d.h. viel Lactose-> viel Beta-Galactosidase durch Expression des lac-Operons. Der Repressor kann als Dimer vorliegen, wobei sich häufig zwei solche Dimere zu einem Tetramer zusammenlagern. Sofern kein Lactose vorhanden ist, bindet er an den Operator und verhindert eine Synthese des RNA-Stranges. Wie findet der lac-Repressor nun die Operatorstelle? -> Das Repressorprotein bindet an die DNA des Operators um den Faktor 4x106 stärker als an andere Stellen im Genom von E.Coli-> hohe Spezifität. Die hohe Assoziationskonstante (1010M-1s-1) weist darauf hin, dass der Repressor nicht aus dem wässrigen Medium auf den Operator trifft (dreidimensionale Suche), sondern entlang der DNA diffundiert (eindimensionale Suche) und ihn auf diese Weise findet. Jedes Monomer des lac-Repressors besteht aus einer kleinen aminoterminalen Domäne, welche die DNA bindet, und einer grösseren carboxyterminalen Domäne, die für die Bildung des Dimers und Tetramers sorgt. Die funktionsfähige DNA- bindende Einheit entsteht, wenn zwei aminoterminale Domänen zusammentreffen. Der Repressor bindet an die DNA, indem er eine alpha-Helix in die grosse Furche der DNA einbringt und Kontakte mit den Aussenseiten der Basenpaare sowie dem Phosphodiesterrückgrat herstellt. Ligandenbindung löst Strukturveränderungen aus Interessanterweise löst nicht die Lactose selbst die Expression des lac-Operons in Gang, sondern die Allolactose, eine Verbindung aus Galactose und Glucose (durch eine alpha-1,6-Bindung), welche auch als Induktor bezeichnet wird. Sobald der lac-Repressor den Induktor gebunden hat, geht seine Affinität für die DNA des Operons stark zurück. Der Induktor bindet in der Mitte einer grossen Domäne jedes einzelnen Monomers, was zu Konformationsänderungen führt, welche die Wechselwirkung zwischen DNA-bindenden Domänen und DNA schwächen-> Die Operatorstelle ist nun nicht mehr besetzt und die RNA-Polymerase kann die Gene transkribieren, welche für eine effiziente Nutzung der Lactose erforderlich sind. Bearbeitet von Dominic Reinfried 1 Kapitel 31 Umgekehrt können sich gewisse Repressoren auch erst nach der Bindung eines kleinen Moleküls, das als Corepressor bezeichnet wird, spezifisch an die DNA heften. Stimulation der Transkription Das Katabolitaktivatorprotein (CAP) regt die Transkription der Gene für den Lactosestoffwechsel an. CAP ist ein Dimer aus zwei gleichen Untereinheiten und bindet im lac-Operon an eine umgekehrte Sequenzwiederholung. Der Grund für die Stimulation liegt darin, dass zwischen CAP und der RNAPlolymerase energetisch günstige Protein-Protein Kontakte auftreten. Deshalb befindet sich die Bindungsstelle für CAP neben der Position, an der sich die RNA-Plolymerase anlagert. Ein steigender cAMP-Spiegel fördert die Bildung von CAP-cAMP Komplexen und somit auch die Transkription von Genen für vielfältige Enzyme des katabolen Stoffwechsels. Das Helix-turn-Helix-Motiv Die DNA-bindende Oberfläche bei vielen Proteinen besteht aus zwei alpha-Helices, die durch eine scharfe Kehre (turn) verbunden sind. Die Aminosäuren der ersten Helix stellen den Kontakt mit dem Rückgrat der DNA her. Die zweite Helix geht in die grosse Furche der DNA, wo die Aminosäuren mit den Basenpaaren Kontakt aufnehmen. 31.2) Die Komplexität der Eukaryotengenome Bei Eukaryoten ist die Genregulation komplizierter als bei Prokaryoten: 1) Das Genom, das reguliert werden muss, ist beträchtlich grösser. Das E.Coli-Genom ist ein einzelnes, ringförmiges Chromosom von 4,6 Mb (1Mb=103kb=106 Basen). Die menschliche DNA beinhaltet 3000 Mb (23 Chromosomenpaare). 2) Viele verschiedene Zelltypen bei höheren Organismen. 3) Eukaryotische Gene sind in der Regel nicht in Operons organisiert, sondern im ganzen Genom verstreut. 4) Transkription und Translation sind bei Eukaryoten nicht gekoppelt. Nucleosomen sind Komplexe aus DNA und Histonen Die DNA in den Chromosomen von Eukaryoten ist an kleine, basische Proteine gebunden, die man als Histone bezeichnet. Der gesamte Komplex aus DNA und Histonen wird Chromatin genannt. Es gibt 5 wichtige Histone: Die ersten vier H2A, H2B, H3, H4 lagern sich aneinander, das fünfte heisst H1. Histone sind basisch, weil sie viel Lysin und Arginin enthalten. Das Chromatin besteht aus sich wiederholenden Einheiten (Nucleosomen), die jeweils 200 bp DNA und je zwei Exemplare von H2A, H2B, H3 und H4 enthalten, was man als Histonoktamer bezeichnet. Abbau des Chromatins liefert ein verkürztes DNA-Fragment aus 145 bp, das ebenfalls noch an das Histonoktamer gekoppelt ist. Dieser verkürzte Komplex wird Nucleosomen-Core-Partikel genannt. Die acht Histonmoleküle des Cores sind zu einem Tetramer mit der Struktur (H3)2(H4)2 und zwei Dimeren der Form H2A-H2B zusammengelagert und bilden eine linksgängige, superspiralisierte Rampe, um die sich die DNA wickeln kann. Ausserdem besitzen die Histone am Aminoende biegsame Schwänze aus vielen Lysin- und Argininresten. Das Histon H1, das sich in seiner Struktur von den anderen Histonen unterscheidet, „verschliesst“ das Nucleosom an der Stelle, wo die VerbindungsDNA in es eintritt und es wieder verlässt. Die DNA wird durch das Nucleosomen-Core um den Faktor 7 dichter gepackt (Verkürzung auf 10 nm). Die Nucleosomen bilden ihrerseits eine spiralförmige Anordnung (Durchmesser 36 nm), deren übereinandergestapelte Windungen einen Abstand von 11 nm haben. Die Nucleosomenfasern werden dann noch zu Schleifen zusammengefaltet. Umgestaltung des Chromatins zugunsten der Genexpression In der DNA existieren Bereiche, in denen die Nucleosomen entweder ganz fehlen oder in einer veränderten Konformation vorliegen (hypersensitive Stellen), z.B. Abschnitte in der Nähe eines aktiven Gens. An diesen Stellen können Enzyme wie die DNase besonders gut spalten. Die Lockerung der Chromatinstruktur ist also eine Voraussetzung für die Genexpression. Bearbeitet von Dominic Reinfried 2 Kapitel 31 Enhancer Enhancer sind DNA-Sequenzen, welche bei Eukaryoten die Aktivität vieler Promotoren steigern, und selbst dann, wenn sie mehrere tausend Basenpaare von dem exprimierten Gen entfernt sind. Ein Enhancer dient als Bindungsstelle für ganz bestimmte Regulationsproteine. Ein solches DNAbindendes Regulationsprotein beeinflusst und stört räumlich begrenzt die Chromatinstruktur und legt so ein Gen frei. Deshalb können Enhancer über grössere Distanzen wirken. DNA-Modifikationen Die Modifikationen der DNA sind neben der Verpackung mit Histonen ein weiterer Mechanismus, mit dem die Genexpression verhindert werden kann. Z.B. werden im Genom der Säugetiere gewisse Sequenzen in der C5-Position des Cytosins methyliert-> die Methylgruppe ragt dann in die grosse Furche und kann somit die Bindung von Proteinen beeinträchtigen, welche eine stimulierende Wirkung auf die Transkription haben. 31.3) Aktivierung und Repression der Transkription durch ProteinProtein-Wechselwirkungen Anders als bei den Prokaryoten, haben bei Eukaryoten die Transkriptionsfaktoren alleine keine Auswirkungen auf die Transkription. Stattdessen zieht jeder Faktor andere Proteine heran, sodass grosse Komplexe entstehen, die die Transkription aktivieren/unterdrücken können. Vorteil: Ein einzelnes Regulationsprotein kann unterschiedliche Wirkungen entfalten. Steroide und hydrophobe Moleküle heften sich an DNA-bindende Rezeptoren Östrogene sind Steroidhormone und leiten sich vom Cholesterin ab. Sie sind hydrophob und diffundieren dementsprechend durch Zellmembranen. In der Zelle heften sie sich an Zellkernhormonrezeptoren, welche zwei Domänen enthalten: eine DNA-bindende und eine Ligandenbindende. Die DNA-bindende Domäne enthält neun konservierte Cysteinreste. Ein Zinkion ist mit den ersten vier Cysteinresten verknüpft, ein zweites mit der zweiten Vierergruppe-> 2 Zinkfingerdomänen. Die Zinkionen stabilisieren die Stuktur. Am Ende der ersten Zinkfingerdomäne beginnt eine alpha-Helix, welche in die grosse Furche der DNA ragt. Östrogenrezeptoren binden als Dimer in der DNA an Stellen, welche als Östogen-Response-Elemente bezeichnet werden und eine symmetrische Nukleotidsequenz aufweisen. Die Ligandenbindende Domäne besteht fast ausschliesslich aus alpha-Helices, die in drei Schichten angeordnet sind. Der Ligand bindet an eine Vertiefung in der Mitte dieser Anordnung von Helices. Die Anheftung des Signalmoleküls führt zu einer Umordnung der Struktur, v.a. die letzte als Helix 12 bezeichnete alpha-Helix klappt bei der Anheftung des Liganden in eine flache Vertiefung des Rezeptors. Coaktivatoren und Corepressoren Coaktivatorproteine enthalten in ihrer Mitte drei Sequenzen der Form Leu-X-X-Leu-Leu, welche alpha-Helices bilden und somit die Ligandenbindungsdomäne von Zellkernhormonrezeptoren binden können. Die Bindungsstelle für den Coaktivator bildet sich nur dann vollständig aus, wenn der Ligand gebunden ist-> die Bindung eines Liganden setzt also eine Konformationsänderung in Gang, welche die Hinzuziehung eines Coaktivators ermöglicht. Fehlt der Ligand, verbinden sich die Ligandenbindungsdomänen mit Corepressorproteinen. Die Anheftung des Liganden bewirkt die Loslösung des Corepressors-> Coaktivator kann binden. Steroidhormonrezeptoren sind Angriffspunkte für Medikamente Wirkstoffe wie Östradiol, die an einen Rezeptor binden und einen Signaltransduktionsweg auslösen, nennt man Agonisten. Sportler nehmen manchmal solche Agonisten für den Androgenrezeptor (ein Bearbeitet von Dominic Reinfried 3 Kapitel 31 Zellkernhormonrezeptor), um die Expression von Genen zu stimulieren, welche die Zunahme der Muskelmasse verstärken (anabole Steroide). Auf der anderen Seite gibt es auch Antagonisten, die an der selben Stelle wie Agonisten binden. Sie enthalten jedoch chemische Gruppen, welche verursachen, dass die Helix 12 anstelle ihrer üblichen Bindung nun an die Stelle bindet, an die normalerweise der Coaktivator andockt-> Keine Bindung des Coaktivators-> keine Aktivierung der Transkription. Bsp. für einen Agonisten: Dianabol/ Bsp. für einen Antagonisten: Tamoxifen. Kovalente Modifikation der Histonschwänze Die Wirkung von Coaktivatoren und Corepressoren ist darauf zurückzuführen, dass sie die Schwänze am Aminoende der Histone kovalent modifizieren. Manche Coaktivatoren katalysieren die Übertragung von Acetylgruppen vom Acetyl-CoA auf spezifische Lysinreste im aminoterminalen Schwanz der Histone. Die Enzyme für solche Reaktionen heissen Histon-Acetyl-Transferasen (HAT`s). Folgen der Acetylierung: Lysin hat bei normalem pH eine positiv geladene Ammoniumgruppe. Kommt eine Acetylgruppe hinzu, entsteht eine ungeladene Amidgruppe-> Affinität des Histonkomplexes für die DNA nimmt ab. Ausserdem treten die acetylierten Lysinreste mit einer spezifischen Acetyllysinbindungsdomäne (=Bromodomäne) in Kontakt. Proteine mit solchen Domänen sind Bestandteile von zwei grossen Komplexen: 1. TAF`s (Proteine, welche sich mit dem TATA-Box-Bindeprotein zusammenlagern): TAFII250 enthält zwei Bromodomänen, welche jeweils an zwei Acetyllysinreste im Histon H4 binden können-> TATA-Box-Bindeprotein wird also hinzugezogen. 2. Chromatinumformungsmotoren (chromatin-remodeling-engines): Diese Komplexe verschieben mit Hilfe von ATP die Position von Nucleosomen entlang der DNA-> Konformationsänderungen. Die Acetylierung der Histone aktiviert die Transkription über drei Mechanismen: Die Affinität der Histone für die DNA vermindert sich, weitere Bestandteile des Transkriptionsapparats werden hinzugezogen und die aktive Umformung des Chromatins wird in Gang gesetzt. Bei der Repression eines zuvor aktiven Gens wird das acetylierte Lysin wieder durch HistonDeacetylasen deacetyliert. Bindung eines Liganden führt zu einer Phosphorylierungskaskade Der Übertragungsweg, der durch die Bindung des Adrenalins ausgelöst wird, führt zur Phosphorylierung eines Transkriptionsfaktors, zur Hinzuziehung eines Coaktivators und zur Zusammenlagerung von Komplexen, die an der Umgestaltung des Chromatins und der Initiation der Transkription mitwirken. 31.4) Kontrolle der Genexpression nach der Transkription Attenuation Bei Bakterien codiert das Transkript eines Operons, eine mRNA, Enzyme für die Umwandlung von Chorismat in Typtophan. Neben den Abschnitten für diese Enzyme liegt ein kurzes offenes Leseraster, das ein Leader-Peptid codiert. Auf dieses offene Leseraster folgt ein als Attenuator bezeichneter Abschnitt der RNA, der mehrere Strukturen ausbilden kann. Ein Ribosom kann den Leader-Abschnitt nur dann translatieren, wenn Tryptophan in ausreichender Menge vorhanden ist. Ist dies der Fall, bildet der Attenuator eine Stamm-Schleife-Struktur, welche die Loslösung der RNA-Polymerase von der DNA verursacht. Falls Tryptophan knapp ist, kommt die die Translation zum Stillstand, weil sie auf Trp-tRNA warten muss. Dann bleibt ausreichend Zeit, damit sich in der RNA eine andere Struktur bilden kann, die nicht für eine Beendigung der Transkription sorgt-> RNA-Polymerase kann über die Attenuatorstelle hinaus weiterlesen. Die Attenuation ist also ein Mittel, mit dem die Zelle die zur Proteinsynthese notwendige Tryptophanversorgung misst. Bearbeitet von Dominic Reinfried 4 Kapitel 31 Analog dazu existieren auch weiter Operons (z.B. das Phenylalaninoperon), welche auch durch Attenuation reguliert werden. Regulation über Translation (Eisenstoffwechsel) Bei Tieren hat sich ein System entwickelt, das in Zeiten knapper Versorgung die Akkumulation von Eisen ermöglicht und für eine Speicherung sorgt. Entscheidend sind dabei Proteine wie Transferrin, das Eisen im Blutserum transportiert, der Transferrinrezeptor, ein Membranprotein, das mit Eisen beladenes Transferrin speichert und in die Zelle einschleust und Ferritin, ein Eisenspeicherprotein. Ist Eisen knapp, nimmt die Menge des Transferrinrezeptors zu, Ferritin wird jedoch in geringem Umfang hergestellt. Die Ferritin mRNA enthält eine Stamm-Schleife-Struktur, die man als EisenResponse-Element (IRE) bezeichnet. Diese Struktur bindet ein IRE-bindendes Protein (IRE-BP), welches die Translation blockiert. Bei steigender Eisenkonzentration bindet jedoch IRE-BP das Eisen, wobei IRE-BP sich nicht mehr mit der RNA zusammenlagern kann (Bindungsstellen überlappen sich). -> Ferritin-mRNA wird translatiert-> entsehendes Ferritin bindet überschüssiges Eisen. Transferrinrezeptor: Bei steigender Eisenkonzentration binden das IRE-BP nicht mehr an die Transferrinrezeptor-mRNA-> wird abgebaut. Bearbeitet von Dominic Reinfried 5