Gleichgewichte und Massenwirkungsgesetz
Werbung

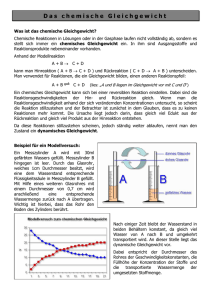
3.0 Gleichgewicht und Massenwirkungsgesetz 3.1 Einführung und Definition Versuch: Silber-Ionen und Eisen(II)-Ionen reagieren zu elementarem Silber und Eisen(III)-Ionen (Hinreaktion): Ag+ + Fe2+ Ag + Fe3+ (Fe3+-Nachweis!) Andererseits reagiert kolloidales Silber mit einer Eisen(III)-Ionen enthaltenden Lösung unter Auflösung (Ag+-Ionen )(Rückreaktion): Ag + Fe3+ Ag+ + Fe2+ In beiden Reaktionen können immer neben den Produkten auch die Edukte noch nachgewiesen werden, d. h. Hin- und Rückreaktion laufen nicht vollständig ab. Es stellt sich je nach äußeren Bedingungen immer ein bestimmtes Verhältnis zwischen den Stoffmengen der End- und der Ausgangssubstanzen ein. Def. : Reaktionen, die in beiden Richtungen ablaufen können, die also umkehrbar (reversibel) sind, nennt man Gleichgewichtsreaktionen. Den Zustand, den sie bei bestimmten äußeren Bedingungen erreichen, bezeichnet man als Gleichgewichtszustand. In der Reaktionsgleichung wird dies mit der Schreibweise als Doppelpfeil gekennzeichnet: Hinreaktion + 2+ Ag + Fe ‹ Ag + Fe3+ Rückreaktion Beispiele für reversible Reaktionen CaCO3 + CO2 + H2O H2 + I2 CH3COOH + CH3CH2OH ‹ Ca(HCO3)2 ‹ 2 HI ‹ CH3COOC2H5 (Kalkproblematik) (Musterbeispiel) + H2O (Estergleichgewicht) Zur Einstellung eines Gleichgewichts muss der Reaktionsraum abgeschlossen sein; beim Auftreten von Gasen dürfen diese den Reaktor nicht verlassen können. Für die Einstellung eines Gleichgewichts und damit für das konkret vorliegende Stoffmengenverhältnis ist es gleichgültig, ob von der Edukt- oder der Produktseite ausgegangen wird. 1- Vor Reaktionsbeginn Gleichgewichtszustand o o * o Vor Reaktionsbeginn # + o * o o + # + o * + + # o * o + o + * + * # + # + * o + o o o c(A):c(B):c(C):c(D) = konstant nur A und B o + nur C und D o Darstellung des Gleichgewichtszustands o für eine Reaktion A + B ‹ C + D o o Bei einer bestimmten Temperatur überwiegt in der Regel eine der beiden Seiten; dies drückt o im Gleichgewichtsdoppelpfeil aus. So liegt man durch unterschiedlich lange Reaktionspfeile z. B. das Gleichgewicht o H2 + I2 2 HI bei Raumtemperatur sehr auf der Produktseite, d. h. Wasserstoff und Iod reagieren fast vollständig. 3.2 Kinetische Deutung Betrachtet wird das allgemeine chemische Gleichgewicht A+B ‹ C+D als Kopplung zweier entgegengesetzt verlaufender Reaktionen. Bei einer Reaktion von der Eduktseite aus sind zunächst nur die Ausgangssubstanzen A und B vorhanden. Ihre Stoffmengenkonzentration nimmt mit wachsender Reaktionszeit ab und damit sinkt auch die Reaktionsgeschwindigkeit der Hinreaktion. v c (mol/l) c(A), c(B) vHin Ggw-Lage eingestellt Ggw-Lage eingestellt c( C), c(D) vRück Zeit t Konzentrations-Zeit-Diagramm (Produktseite überwiegt) Zeit t Reaktionsgeschwindigkeits-Zeit-Diagramm 2- Die Konzentration der Produkte beginnt von Null aus zu steigen und damit auch die Reaktionsgeschwindigkeit der Rückreaktion. Hat sich das Gleichgewicht eingestellt, tritt keine Veränderung der Konzentrationen mehr ein, die Reaktionsgeschwindigkeiten der Hinund Rückreaktion sind gleich groß. Im Gleichgewichtszustand werden in einer Zeiteinheit ebenso viele Teilchen A und B durch die Hinreaktion verbraucht wie durch die Rückreaktion entstehen. Die Zusammensetzung des Gemischs verändert sich im Gleichgewichtszustand nicht mehr (alle Stoffmengenkonzentrationen bleiben konstant), obwohl beide Vorgänge permanent ablaufen. Es liegt ein dynamisches Gleichgewicht vor. 3.3 Massenwirkungsgesetz Eine quantitative Erfassung des chemischen Gleichgewichts erfolgt durch das Massenwirkungsgesetz. Es lässt sich aus der Betrachtung der Reaktionsgeschwindigkeiten von Hin- und Rückreaktion ableiten. Bei konstanten äußeren Bedingungen hängt die Reaktionsgeschwindigkeit nur von den Konzentrationen der Reaktionspartner ab. Für das Gleichgewicht H2 + I2 ‹ 2 HI Edukte Produkte gilt: vhin = khin . c(H2) . c(I2) und vrück = krück . (c(HI))2 Bei Einstellung des Gleichgewichtszustands sind Hin- und Rückreaktion gleich groß, also gilt: vhin = vrück und damit folgt: khin . c(H2) . c(I2) = krück . (c(HI))2 k hin k rück = (c( HI )) 2 c( H 2 ) c( I 2 ) Fasst man die Bruchkonstanten zu einer neuen Konstanten, der Gleichgewichtskonstanten K zusammen, so ergibt sich mit K = (c( HI )) 2 c( H 2 ) c( I 2 ) das Massenwirkungsgesetz für diese Reaktion. Die Konstante K ist nur von der herrschenden Temperatur abhängig. Für die allgemeine Gleichgewichtsreaktion aA + bB ‹ lautet das Massenwirkungsgesetz (MWG): 3- dD + eE K = (c( D)) d (c( E )) e (c( A)) a (c( B)) b Die Koeffizienten aus der Gleichung werden zu Exponenten im MWG. Die Einheiten von K müssen in jedem Einzelfall konkret berechnet werden. Es wird nun zur Vereinfachung das Gleichgewicht nur mit den Koeffizienten Eins betrachtet A + B ‹ D + E die beiden Ausgangskonzentrationen sollen zudem gleich groß sein. Für K-Werte größer als 1 liegt dann das Gleichgewicht mehr auf der Produktseite, die Edukte werden sich überwiegend umwandeln. Bei K-Werten kleiner 1 liegt das Gleichgewicht mehr auf der Eduktseite mit kleinem Maß an Reaktion von der Eduktseite weg. Der Wert der Gleichgewichtskonstante ist eine charakteristische Konstante für das jeweilige Gleichgewicht. Die nachfolgende Tabelle zeigt den Zusammenhang zwischen Gleichgewichtskonstante und Gleichgewichtskonzentrationen für diesen einfachen Fall. Gleichgewichtskonstante K 10-2 10-1 100 102 Ausgangskonzentrationen (mol/l) A B D E 1 1 0 0 1 1 0 0 1 1 0 0 1 1 0 0 Gleichgewichtskonzentrationen (mol/l) A B D E 0,91 0,91 0,09 0,09 0,76 0,76 0,24 0,24 0,50 0,50 0,50 0,50 0,09 0,09 0,91 0,91 Auswirkung der K-Werte auf die Gleichgewichtskonzentrationen Für ein gegebenes Gleichgewicht ist die Gleichgewichtskonstante K nur von der Temperatur abhängig. Für das Gleichgewicht H2 + I2 ‹ 2 HI hat K bei 425 oC immer den Wert 54 und bei 1000 oC den Wert 18, unabhängig von den Ausgangskonzentrationen im Experiment. Temperatur in 0C 425 425 425 425 1000 1000 Ausgangszustand c(H2) c(HI) 5,33 4,34 0 0 0 5,33 c(I2) 5,38 2,42 0 0 0 5,38 0 2,66 13,94 5,34 5,34 0 Gleichgewichtszustand Gleichgewichtskonstante K c(H2) c(I2) c(HI) 1,12 2,28 1,49 0,57 0,85 1,70 1,17 0,37 1,49 0,57 0,85 1,73 8,42 6,77 10,96 4,20 3,64 7,28 54,10 54,33 54,10 54,29 18,33 18,02 Gleichgewichtskonstanten bei verschiedenen Temperaturen und unterschiedlichen Startkonzentrationen 4- 3.4 Beeinflussung der Gleichgewichtslage 3.4.1 Einfluss der Konzentration Versuch: In einer verdünnten Lösung von Eisen(III)-thiocyanat liegt vereinfacht folgendes Gleichgewicht vor: Fe3+aq. + 3 SCN-aq. gelb ‹ Fe(SCN)3 farblos blutrot Bei stöchiometrisch korrekten Ausgangskonzentrationen entsteht überwiegend der rote Farbkomplex. Diese Lösung wird nun so lange verdünnt, bis eine Farbaufhellung eintritt. Das Gleichgewicht hat sich nach links verschoben durch das Wasserüberangebot. In diese Gleichgewichtslage werden nun in zwei Versuchen Eisen(III)-Ionen bzw. Thiocyanat-Ionen zugesetzt. In beiden Fällen tritt Rotfärbung ein, d. h. das Gleichgewicht hat sich auf die Seite des Farbkomplexes verschoben. Fe3+aq. + 3 SCN-aq. Fe(SCN)3 In beiden Fällen erfolgt eine Erklärung über das MWG. K = c( Fe( SCN ) 3 ) c( Fe 3 ) (c( SCN )) 3 Der Nenner wird jeweils von außen vergrößert. Da K eine konstante, nur temperaturabhängige Größe ist, muss der Wert des Zählers zum Ausgleich ebenso vergrößert werden, d. h. die Konzentration des roten Farbkomplexes steigt an. Versuch: Eine gelbe Lösung von Kaliumchromat wird mit Mineralsäure versetzt bis zur Orangefärbung (Dichromat-Ionen entstehen); diese orangefarbige Lösung wird mit einer Lauge versetzt bis zur Gelbfärbung, usw. . 2 CrO42- + 2 H3O+ ‹ Cr2O72- + 3 H2O (Gleichung beim Ansäuern) Die Erklärung der Farbumschläge erfolgt ebenfalls wieder über das MWG. K = c(Cr2 O72 ) (c( H 2 O)) 3 (c(CrO42 )) 2 (c( H 3 O ) 2 Vorgang und Erklärung beim Versetzen mit Lauge im Überschuss als Hausaufgabe. Beide Versuche und ihre Auswertung zeigen, dass sich durch Änderung der Konzentration von Reaktionsteilnehmern die Lage des Gleichgewichts beeinflussen lässt. Die Gleichgewichtskonstante K und damit der Bruchwert im MWG verändern sich nicht Bei Konzentrationserhöhung eines Stoffs verschiebt sich das Gleichgewicht so, dass dieser Stoff verstärkt verbraucht wird. Eine Konzentrationserniedrigung ruft eine Nachbildung dieser Substanz hervor, bis sich ein Gleichgewichtszustand eingestellt hat. 5- 3.4.2 Einfluss des Drucks Versuch: In einem Erlenmeyerkolben reagieren Kupferspäne mit konzentrierter Salpetersäure unter Freisetzung von braunem Stickstoffdioxid. Das Gas wird nach Verdrängung der Reaktorluft in einem Kolbenprober abgeschlossen. Kolbenprober NO2 HNO3 konzentriert Cu-Späne Versuchsanordnung für die NO2-Erzeugung Dieses Gasvolumen wird nun ruckartig komprimiert bzw. über den Ausgangszustand entspannt und die Veränderung der Farbintensität beobachtet. Im verkleinerten Volumen (Überdruck) müsste nach der Farblehre eine Intensivierung eintreten (mehr Farbträger pro Raumeinheit), eine Aufhellung tritt aber ein. Ebenso ergibt sich im Unterdruckfall statt eines Verblassens eine Farbintensivierung. Der rotbraune Farbträger Stickstoffdioxid steht mit farblosem Distickstofftetraoxid in einem chemischen Gleichgewicht. 2 NO2 2 mol Gas ‹ N2O4 H = - 57,3 kJ/mol 1 mol Gas Bei Anlegen eines Überdrucks verschiebt sich das Gleichgewicht nach rechts auf die Seite mit geringerem Raumbedarf, das Gas hellt sich auf. Umgekehrt bilden sich mehr NO2-Moleküle bei Unterdruckbedingungen aus, da ein größeres Raumangebot vorliegt (nach Avogardo). In einem Gleichgewichtszustand begünstigt eine Druckerhöhung Vorgänge, die unter Volumenverminderung ablaufen. Druckerniedrigung fördert Reaktionsrichtungen, die mit Volumenvergrößerung verbunden sind. Druckabhängigkeit der Lage eines chemischen Gleichgewichts kann nur auftreten bei volumenverändernden Reaktionen, d. h. wenn Gase auf der Edukt- und Produktseite mit unterschiedlichen Stoffmengen beteiligt sind. 6- 3.4.3 Einfluss der Temperatur Versuch Durch Einwirken von konzentrierter Salpetersäure auf Kupferspäne entsteht ein Stickstoffdioxid-Distickstofftetraoxid-Gasgemisch. Mit diesem Gas werden drei Spitzkolben identisch gefüllt. Der Kolben I wird in heißes Wasser (ca. 50-60 0C) getaucht, der Kolben II in eine Kältemischung von ca. 0 oC, der Kolben III dient als Farbvergleich. NO2 NO2 HNO3 konzentriert I Cu-Späne II III Spitzkolben mit gleichmäßiger NO2/N2O4-Füllung Im Kolben I tritt eine Farbintensivierung ein, im Kolben II ist eine deutliche Aufhellung im Vergleich zum Kolben III zu bemerken. Die Farbvertiefung bzw. –aufhellung lässt auf eine Verschiebung der Gleichgewichtslage zwischen den beiden vierwertigen Stickoxiden schließen. 2 NO2 ‹ N2O4 H = - 57,3 kJ/mol Die Temperaturerhöhung führt zu einer vermehrten Stickstoffdioxidbildung über die endotherme Rückreaktion, die Abkühlung begünstigt die exotherme Hinreaktion zu N2O4 . Versuch Ammoniumchlorid wird in einem großen, schräg gehaltenen Reagenzglas vorsichtig trocken erhitzt. Mittig im Reagenzglas ist in einem Wattebausch ein feuchtes Indikatorpapier fixiert, das von den entstehenden Gasen umspült wird. Im unteren Bereich kommt es zu einer Rotfärbung (sauer), im oberen Bereich zu einer Blaufärbung (alkalisch). 7- Nach einiger Zeit sublimiert am oberen Rand des Glases Ammoniumchlorid wieder. NH4Cl ‹ NH3 + HCl H = + 174,5 kJ/mol gelb - blau Indikatorpapier gelb - rot NH4Cl Glaswolle/Watte NH4Cl Reagenzglas mit NH4NO3, Wattebausch und Indikatorpapier Ammoniumsalze ähneln in vielen Situationen den Kaliumsalzen, sind aber thermisch nicht stabil, sondern zerfallen schon bei relativ niedrigen Temperaturen. Aufgrund der größeren Molekülmasse und Größe des Chlorwasserstoffgases verweilen diese Moleküle etwas länger bei gleicher Thermik unterhalb des Wattefilters (kleinere Diffusionsgeschwindigkeit; Rotfärbung des Indikators durch die Brönstedsäure HCl) als die kleineren und leichteren Ammoniakmoleküle (Blaufärbung durch die Brönstedbase NH3). Bei Abkühlung an der kalten Reagenzglaswand am oberen Rand tritt eine Rückbildung des Salzes ein. Hier wird durch die Temperaturerhöhung am Reagenzglasboden die endotherme Hinreaktion gefördert, im kalten Randbereich läuft vermehrt die exotherme Rückreaktion ab. Die K-Werte im Massenwirkungsgesetz sind temperaturabhängig. Bei höheren Temperaturen erhöhen sich die Reaktionsgeschwindigkeiten von Hin- und Rückreaktion und der Gleichgewichtszustand wird schneller erreicht. Die Gleichgewichtskonstanten der beiden Reaktionsrichtungen steigen aber in unterschiedlichem Maß an, die Aktivierungsenergie bei einer exothermen Reaktion ist prinzipiell kleiner als bei der endothermen Gegenreaktion. Eine Temperaturerhöhung begünstigt damit die endotherme Richtung mehr. Temperaturerhöhung begünstigt die endotherme Reaktion, das Gleichgewicht verschiebt sich auf die Seite der energiereicheren Substanzen. Temperaturerniedrigung fördert exotherme Reaktionsrichtungen, also die Bildung energieärmerer Stoffe durch Änderung der Gleichgewichtslage. 8- 3.4.4 Prinzip von Le Chatelier Die Wirkung äußerer Einflüsse (Konzentration, Druck und Temperatur) auf chemische Gleichgewichtssysteme wird nach Braun und Le Chatelier im Prinzip vom kleinsten Zwang zusammengefasst. Wird auf ein im Gleichgewicht befindliches Stoffsystem durch Veränderung von Konzentration, Druck oder Temperatur ein Zwang ausgeübt, dann verschiebt sich die Gleichgewichtslage so, dass durch den ablaufenden Vorgang dieser Zwang gemildert wird. Praktisches Beispiel Kalkproblematik: CaCO3 + schwerlöslicher Kalk CO2 + H2O ‹ Ca(HCO3)2 lösliches Hydrogencarbonat CO2-angereichertes Regen- oder Oberflächenwasser reagiert beim Durchsickern im Kalkstein unter Bildung von wasserlöslichem Calciumhydrogencarbonat (Bildung von Höhlen in Kalkgebirgen; hartes Wasser entsteht durch vermehrte Hinreaktion). Die Rückreaktion wird begünstigt durch Abfallen der CO2-Konzentration im Wasser (Wassertropfen an der Höhlendecke; CO2-Abgabe an Umgebungsluft oder Auftreffen des Wassertopfens am Höhlenboden; Abgabe an Umgebungsluft; Ausbildung von Tropfsteinen durch vermehrte Bildung von CaCO3). Die Kalkbildung in offenen Warmwassersystemen (Brauchwarmwasser; Wasserboiler, Kaffeemaschinen) erklärt sich aus dem endothermen Vorgang der Rückreaktion, die Kalkablagerung an Wasserhähnen folgt aus der Druckerniedrigung am offenen Leitungsende (CO2-Ab-gabe wird erleichtert). Ein Einsatz von wirksamen Katalysatoren beeinflusst die Gleichgewichtslage nicht, da er Hin- und Rückreaktion gleichermaßen begünstigt. Er sorgt aber für eine deutlich schnellere Einstellung des Gleichgewichts (wichtig bei einer gezielten Verschiebung durch Veränderung äußerer Bedingungen wie Konzentration, Druck oder Temperatur). 9-