Pillen aus dem PC
Werbung

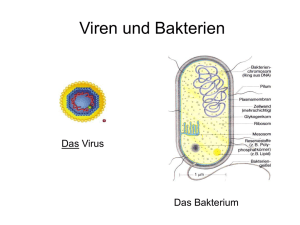
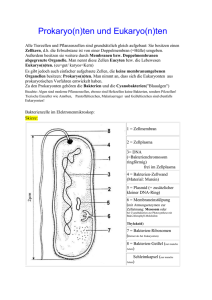
Kantonsschule Freudenberg Medikamente gegen Viren S. 1 Klaus-Heinrich Röhm Pillen aus dem PC Wirkstoffentwicklung heute Auszug aus dem Buch "Expeditionen in die Wissenschaft", Band 1, S. 201-205, Wiley-VCH Verlag, Weinheim (2006) Kleine Killer Die zweite Gruppe von Wirkstoffen, die uns als Beispiel für die gezielte Entwicklung von Medikamenten dienen soll, wurde bei ihrer Einführung Ende der 1990er-Jahre zu Recht gefeiert und ist durch die Vogelgrippe erneut ins Rampenlicht gerückt: Es geht um Wirkstoffe zur Bekämpfung der Influenza. Influenza, die »echte« Virusgrippe, sollte nicht mit banalen Erkältungskrankheiten verwechselt werden. Erkältungen werden zwar ebenfalls durch Viren ausgelöst, nehmen aber - wie wir aus eigener Erfahrung wissen - meist einen harmlosen Verlauf und klingen in der Regel nach einer Woche von selbst wieder ab. Im Gegensatz dazu fordern weltweite Influenza-Epidemien (so genannte Pandemien) immer wieder unzählige Todesopfer. So starben an der Spanischen Grippe, die im Winter 1918/19 wütete, weitaus mehr Menschen als an den Folgen des Ersten Weltkriegs. Obwohl die Medizin heute besser gegen Grippeepidemien gewappnet ist als damals, gibt es auch heute erst eine Handvoll wirksamer Grippemedikamente, die nicht die Symptome lindern, sondern die Viren direkt attackieren. Um ihre Wirkungsweise zu verstehen, müssen wir zunächst einen Blick auf den Aufbau von Viren und ihre Vermehrung werfen. Viren sind - streng genommen - keine Lebewesen. Die nur im Elektronenmikroskop sichtbaren Viruspartikel bestehen im einfachsten Fall aus Erbmaterial (RNA oder DNA), das in einer Hülle aus Proteinmolekülen eingeschlossen ist. Komplizierter gebaute Viren wie das Influenza-Virus sind zusätzlich von einer Lipidhülle umgeben, die der Zellmembran des Wirts ähnelt und ebenfalls Proteine enthält. Das Influenza-Virus trägt zwei Arten von Oberflächenproteinen: Eines, das so genannte Hämagglutinin, dient dem Virus dazu, an seine Wirtszellen anzudocken. Dazu bindet das VirusHämagglutinin an N-Acetylneuraminsäure (kurz: NeuAc), eine Art Zucker, der als Teil von Zuckerketten auf der äußeren Membran aller Zellen reichlich vorkommt. Diese Bindung veranlasst die betroffene Zelle dazu, das angedockte Viruspartikel aufzunehmen und auf eigene Kosten massenhaft zu vermehren. Die neu gebildeten Viren werden schließlich aus der (dann sehr kranken) Wirtszelle entlassen, bleiben aber zunächst an ihr hängen, da das Virus-Hämagglutinin erneut an NAcetylneuraminsäurereste der Zelloberfläche bindet. Hier kommt nun das zweite Oberflächenprotein des Virus zum Einsatz: Es handelt sich um ein Enzym namens Neuraminidase, das dazu dient, die NeuAc-Moleküle von der Oberfläche der Wirtszelle abzuspalten. Dies vermindert die »Klebrigkeit« der Zelloberfläche so stark, dass sich die neu gebildeten Viruspartikel ablösen und weitere, noch gesunde Zellen in der Nachbarschaft befallen können. Auch die Schleimsubstanzen, die die Viren durchdringen müssen, um die Atemwege des Wirts zu infizieren und im Wirtsorganismus von Ort zu Ort zu gelangen, enthalten N-Acetylneuraminsäure. Ohne Neuraminidase würden die Viren in diesen Schleimbarrieren stecken bleiben und hätten nur geringe Chancen, sich auszubreiten. In anderen Worten: Die Aktivität der Virus-Neuraminidase ist unentbehrlich für die Vermehrung des Virus! Im ominösen Kürzel H5N1 für das Vogelgrippevirus steht das »H« übrigens für Hämagglutinin und das »N« für Neuraminidase. Von beiden Proteinen gibt es eine Reihe von Varianten, die in Virusstämmen unterschiedlich kombiniert auftreten können. So trägt Stamm H5N1 das Hämagglutinin vom Typ 5 und Amadeus Bärtsch FS 2015 Kantonsschule Freudenberg Medikamente gegen Viren S. 2 eine Neuraminidase des Typs 1. Der Erreger der Spanischen Grippe von 1918 war - wie man heute weiß - vom Typ H1N1, während die Hongkong-Grippe von 1967, die etwa 700 000 Todesopfer forderte, von einem Virus des Typs H3N2 verursacht wurde. Schau genau hin Was wir eben über die Rolle der Neuraminidase gelernt haben, war auch schon Mitte der 1980er-Jahre bekannt. Es war der junge australische Chemiker Mark von Itzstein der - gerade von einem Aufenthalt aus Deutschland zurückgekehrt - die richtigen Schlüsse daraus zog und sich zusammen mit seinen Kollegen aufmachte, Hemmstoffe der Virus-Neuraminidase zu entwickeln. Im Gegensatz zu Cushman und Ondetti konnten sich die Australier dabei auf eine Kristallstruktur des Virusenzyms stützen, die bereits 1983 veröffentlicht worden war. Auch ein Hemmstoff der Neuraminidase war schon bekannt. Diese Verbindung mit der Kurzbezeichnung NeuAc2en unterscheidet sich vom natürlichen Liganden der Neuraminidase NeuAc nur durch die Doppelbindung im Sechsring. Allerdings reichte die Bindungsstärke von NeuAc2en noch nicht aus, um die Substanz mit Aussicht auf Erfolg gegen Viren einsetzen zu können. Von Itzstein und seine Gruppe begannen deshalb damit, das aktive Zentrum des viralen Enzyms genauer zu studieren. Sie nutzten dazu die gerade aufgekommene Möglichkeit, komplexe Molekülstrukturen im Computer dreidimensional darzustellen. Ebenso hilfreich war ein kurz zuvor entwickeltes Computerprogramm mit Namen GRID, das es ermöglichte, ebenfalls im Computer Modelle von Ligandenmolekülen in die Bindetasche eines Enzyms einzupassen und die Stärke der Wechselwirkungen zwischen diesen virtuellen Strukturen vorherzusagen. Auf diese Weise testeten von Itzstein und Mitarbeiter viele Wirkstoffkandidaten und wählten schließlich ein Molekül aus, in dem die OH-Gruppe im Ring von NeuAc2en durch eine stark basische Guanidinogruppe ersetzt war. Die Verbindung (4-GuanidinoNeuAc2en) wurde synthetisiert und übertraf alle Erwartungen: Ihre Hemmwirkung ist 100 000-mal besser als diejenige von NeuAc2en. Das heisst, dass sie zwar die VirusNeuraminidase blockiert, die menschliche Neuraminidase aber kaum hemmt. Von ltzsteins Substanz, die den Freinamen Zanamivir erhielt und 1999 unter dem Handelsnamen Relenza® auf den Markt kam, hatte in der Anwendung am Menschen allerdings einen entscheidenden Nachteil - sie war nicht oral wirksam und musste deshalb inhaliert werden. Um dieses Problem zu lösen, machten sich Wissenschaftler der kalifornischen Firma Gilead Sciences daran, das Molekül weiter zu modifizieren. Sie zeigten, dass es vor allem die wasserfreundliche (polare) Seitenkette ist, die die orale Aufnahme von Zanamivir verhindert. Durch Austausch der Seitenkette gegen die unpolare 1-Ethylpropoxy-Gruppe kamen sie zu auch oral verfügbaren Verbindungen. Außerdem stellte sich heraus, dass sich die ebenfalls polare Guanidinogruppe durch eine Amino(NH2-)-Gruppe ersetzen ließ, Amadeus Bärtsch FS 2015 Kantonsschule Freudenberg Medikamente gegen Viren S. 3 ohne die Hemmwirkung zu beeinträchtigen. Ein auf diese Weise verändertes Molekül mit der Bezeichnung GS4071 passt perfekt in die Bindetasche der Virus-Neuraminidase. Eine gut resorbierbare Vorstufe von GS4071, das Oseltamivir, kam nicht lange nach Relenza® unter dem Namen Tamiflu® in die Apotheken und setzte sich wegen der viel einfacheren Art der Verabreichung rasch gegen Zanamivir durch. Ob die beschriebenen Neuraminidase-Hemmer eine neue Grippe-Pandemie verhindern könnten, ist schwer zu sagen. Sicher ist, dass sie - rechtzeitig eingenommen - einer Infektion durch die bekannten Virusvarianten vorbeugen und auch bei Einnahme in den ersten Tagen nach Infektion den Krankheitsverlauf mildern und verkürzen. Sollte allerdings eines Tages eine neue, gegen Oseltamivir unempfindliche Virusvariante auftauchen, wäre mit Sicherheit Gefahr im Verzug. Auftrag: Erklären Sie mit einer Skizze wie Medikamente gegen Viren wirken. Amadeus Bärtsch FS 2015