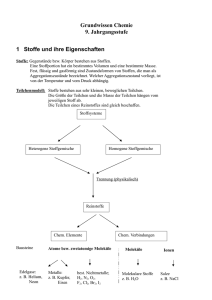
3.13 Die metallische Bindung
Werbung

Grundlagen der Chemie Gliederung WS 2005/06 Umfang in USt. 1 Gegenstand der Chemie 1 24.10. 1 24.10. 2 07.11. 2 14.11. 2 Allgemeine Chemie 2.1 Der Stoffbegriff 2.2 Atombau 2.3 "Teilchen" 2.4 Radioaktivität 2.5 Das PSE Folien Kapitel 2, PowerPoint XP, 1.8 MB 3 Der Weg zum Molekül 3.01 Die Oktettregel 3.02 Elektronegativität 3.03 Die Kovalente Bindung 3.3.1 Zwischen gleichartigen Atomen 3.3.2 Zwischen unterschiedlichen Atomen 3.3.3 Vorschau auf andere Bindungsarten 3.04 Die Struktur binärer Verbindungen 3.05 Die Wertigkeit 3.06 Chemische Gleichungen 3.07 Benennung binärer Verbindungen 3.08 Die polare Bindung 3.09 Aggregatzustände 3.9.1 Beschreibung 3.9.2 Übergänge 3.9.3 Besonderheiten bei Gasen 3.9.4 Anomalien bei Wasser 3.10 Zwischenmolekulare Kräfte 3.10.1 Dipolkräfte 3.10.2 Van-der-Waals-Kräfte 3.11 Die Ionenbindung 3.11.1 Beschreibung 3.11.2 Die Größe von Atomen und Ionen 3.11.3 Ionengitter 3.12 Der Lösungsvorgang in Wasser 3.12.1 Beschreibung 3.12.2 Energiebilanz 3.12.3 Bedeutung 3.13 Die metallische Bindung 3.14 Zusammenfassung 3.15 Sonderstellung des Kohlenstoffs Folien Kapitel 3, PowerPoint XP, 0.8 MB 4 Säuren und Basen 4.1 Saure Lösungen 4.2 Basische Lösungen 4.3 Säure-Base-Konzepte 4.3.1 Das Arrhenius-Konzept 4.3.2 Das Brönstedt-Konzept 4.3.3 Erweiterung durch Lewis 4.4 Indikatoren 4.5 Typische Reaktionen 4.5.1 Säuren mit Wasser 4.5.2 Basen mit Wasser 4.5.3 Säuren mit Basen 4.5.4 Die Rolle des Wassers 4.5.5 Säuren mit Metallen http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 1 14.11. 1 21.11. 2 21.11. 3 28.11. 3 05.12. 3 12.12. 1 4.6 Die Zahl der Oxoniumionen 4.6.1 Die Stärke von Säuren 4.6.2 Die aktuelle Konzentration Folien Kapitel 4, PowerPoint XP, 0.15 MB 5. Reaktionen 5.1 Grundformen 5.1.1 Synthese 5.1.2 Analyse 5.1.3 Umsetzung 5.2 Energiebeteiligung 5.2.1 Der Energieerhaltungssatz 5.2.2 Die Enthalpie 5.2.3 Die Entropie 5.2.4 Die freie Enthalpie 5.3 Redox-Reaktionen 5.3.1 Oxidation 5.3.2 Reduktion 5.3.3 Redox 5.3.4 Oxidationszahlen 5.3.5 Elektrolyse 5.3.6 Redoxreaktionen aus dem Alltag 3 19.12. 5.4. Das chemische Gleichgewicht 5.4.1 Chemische Systeme 5.4.2 Das Massenwirkungsgesetz 5.4.3 Das Prinzip vom kleinsten Zwang 5.4.4 Katalyse 5.5. Quantitative Betrachtungen 5.5.1. Der Molbegriff bei Feststoffen 5.5.2. Der Molbegriff bei Gasen 5.5.3. Der Molbegriff bei Lösungen 5.5.4. Zusammenfassung von Einheiten und Größen Folien Kapitel 5, PowerPoint XP, 0,1 MB 3 16.01. 6 Kohlenwasserstoffe 6.1 Alkane 6.2 Alkene 6.3 Alkine 6.4 Aromatische Verbindungen 6.5 Isomerie 6.6 Additionsreaktionen 6.7 Polymerisation 23.01. 7 Sauerstoffhaltige Kohlenwasserstoffe 7.1 Alkanole 7.2 Ether 7.3 Redox 7.4 Alkanale und Alkanone 7.5 Alkansäuren 7.6 Ester 30.01. 3 09.01. 8 Naturstoffe 8.1 Kohlenhydrate 8.2 Proteine 8.3 Fette Kolloquien. Themen und Grundwissen. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 06.02. 2 Einführung 1. Gegenstand der Chemie Material: V1: D: V1 Kristalle züchten Physikalischer und chemischer Vorgang Platindraht in der Flamme aufglühen lassen Mg anzünden 1. Platin glüht auf, erkaltet wieder. Keine Änderung sichtbar. 2. Magnesium brennt unter weißer, starker Lichterscheinung. Aus dem Metall entsteht ein weißer Stoff. B: E/I: 1. Platin erfährt eine vorübergehende Änderung seines Zustandes: ein physikalischer Vorgang. 2. Magnesium erfährt eine Umwandlung in einen anderen Stoff: ein chemischer Vorgang. Chemie ist die Lehre von Stoffen und Stoffänderungen. Abzugrenzen ist sie von der Physik: Physik ist die Lehre von den Zuständen und den Zustandsänderungen. In der Praxis wird man es in der Chemie häufig auch mit physikalischen Vorgängen zu tun haben. Dennoch sollten die Unterschiede den Schülern immer wieder bewusst gemacht werden. Literatur: 1. Holleman/Wiberg: Lehrbuch der anorganischen Chemie; W. deGruyter-Verlag, Berlin. 2. Christen: Grundlagen der allgemeinen und anorganischen Chemie. 2 Allgemeine Chemie 2.1 Der Stoffbegriff Ziel: Einordnen der Chemie als Wissenschaft, die sich mit der Umwelt des Menschen auseinandersetzt. Wir bewegen uns auf der (makroskopischen) Stoffebene. Material: Demonstration Versuche 1-3 Skript: Gliederung 2.1.1 Gemisch und Reinstoff In der Natur kommen meistens Gemische vor. Demonstration: Stoffgemische http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 3 trübes Wasser, mit NaCl angereichert brauner Zucker Holz. Will man Gesetzmäßigkeiten über Veränderungen herausfinden, die solche Stoffe unter bestimmten Bedingungen durchmachen, so wäre es günstiger, man hätte einen Stoff allein: erst dann könnte man sagen, dass ein bestimmtes Verhalten mit Sicherheit allein auf diesen Stoff zurückzuführen ist, und nicht auf einen anderen in einem vorliegenden Gemisch. Die Gemische müssen so lange aufgetrennt werden, bis man Reinstoffe erhält. Reinstoffe bestehen nur aus einer einzigen Stoffart und besitzen ganz charakteristische Eigenschaften. Sie können nicht allein durch Mischen anderer Stoffe erhalten werden. Sie können auch nicht in andere Stoffe gespalten werden, ohne ihre Eigenschaften zu verlieren. Zur Trennung von Stoffgemischen bedient sich der Chemiker einer Reihe von Methoden. Ihr Einsatz hängt zunächst hauptsächlich von den Eigenschaften ab und dem Zustand der beteiligten Mischungspartner ab. V1: M: Auftrennen von Brausepulver Brausepulver Petrischale Becherglas 400ml (hohe Form) D: Brausepulver in der Petrischale betrachten ins Becherglas (mit ca. 200ml Wasser) hineinschütten, nicht umrühren Lösung dekantieren, Feststoff auf das Filterpapier. Probieren. Durch bestimmte Trennmethoden lassen sich Stoffe aus Stoffgemischen heraustrennen. http://www.uni-bayreuth.de/departments/didaktikchemie/ s_lebensmittel/brausetrennung.htm B: WWW: Glasstab Filterpapier Spatel Sieb Hinweis: Suspension, Emulsion, homogenen Gemischen Demonstration: Speiseöl/Wasser-Gemisch Dies sind genau messbare physikalische Eigenschaften. Ist der Stoff wirklich rein, so entspricht sein Verhalten genau den gemessenen Zahlenwerten. Mischbare Stoffe und ihre Trennung: Feststoff Trennung: Flüssigkeit Trennung: Gas Trennung: Feststoff NiMet.: Gemisch Metall: Legierung spezifisch Lösung eindampfen Lösung austreiben Flüssigkeit Gas Lösung Lösung eindampfen Gemisch/Lösung destillieren Lösung austreiben austreiben Lösung austreiben Gemisch spezifisch Flüssigkeit Suspension filtrieren Emulsion dekantieren Nebel filtrieren Gas Rauch filtrieren Nebel filtrieren ----- Nichtmischbare Stoffe und ihre Trennung Feststoff Trennung: Flüssigkeit Trennung: Gas Trennung: Feststoff Gemenge spezifisch Suspension filtrieren Poren austreiben http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 4 2.1.2 Verbindungen und Elemente Über eine Destillation lässt sich aus Teichwasser chemisch reines Wasser erhalten. Kann man aber das Wasser noch weiter zerlegen? V2: M: V: D: E: I: Zerlegung von Wasser mit Hilfe des elektrischen Stromes verd. H2SO4 Hoffm. Zerlegungsapparatur 2 Platinelektroden Netzgerät, U=15V Wasser mit mind. 1/10 Schwefelsäure versetzen. Nicht anfärben! Laufzeit mind. 10 Minuten. Beobachtung? Dann Test, ob Gas Wasserdampf sein könnte (Temperatur fühlen: müsste heiß sein). Es entstehen zwei Gase. Davon ist keines Wasserdampf! Wasser + Energie -----> Gas 1 + Gas 2 Hinweis: Erste chemische Gleichung: links Edukte (Stoffe?), Reaktionspfeil, rechts Produkte. Erst später wird die Energie anders notiert. V3: M: D: Hinweis: Nachweis der Gase 2 RG Bunsenbrenner/Feuerzeug Holzspan Knallgasprobe auf Wasserstoff Glimmspanprobe auf Sauerstoff Wasser-Niederschlag als Ergebnis der Knallgasprobe. Umkehrung der Zersetzungsreaktion. Wasser + el. Strom -----> Wasserstoff + Sauerstoff Wasserstoff und Sauerstoff sind nicht mehr weiter zerlegbar. Reinstoffe, die in andere Stoffe zerlegbar sind, nennt man Verbindungen. Reinstoffe, die chemisch nicht mehr weiter zerlegbar sind, heißen Elemente. Tafelskizze: Zusammenfassung http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 5 2.2 Atombau Ziele: Material: 1. Welche Vorstellung können wir uns von den Teilchen machen, mit denen man in der Chemie umgehen muss? Lassen sich aus ihrem Bau Eigenschaften ableiten? 2. Wir bewegen uns auf der (submikroskopischen) Modellebene! 3. Naturwissenschaftliche Arbeitsweise: der Umgang mit Modellvorstellungen und die Genese von Modellen. Handspektroskop Modellversuch „Gummiband“ 2.2.1 Vorstellungen in der Antike Folie: Zeitachse; Teil 1 von 3: Antike Vorstellungen vom Bau der Materie Die erste überlieferte Vorstellung über die Natur der Materie ist die vom EMPEDOKLES, 490-430 v. Chr.: er führte den Bau aller Dinge zurück auf die vier Elemente Luft Wasser Feuer und Erde Demokrit, 460-380 v.Chr., ging noch weiter, und seine Vorstellung klingt heute noch sehr modern: Materie, also die vier Elemente des Empedokles, einschließlich der Seele, ist zusammengesetzt aus: unteilbaren beweglichen und unwahrnehmbar kleinen Masseteilchen. „Die kleinsten Teilchen der Seele sind besonders fein, leicht und glatt“. Auf Demokrit geht der Begriff des Atoms (atomos = gr. unteilbar) zurück. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 6 Noch viel überraschender ist die Entwicklung der Atomvorstellung durch EPIKUR, 341-270 v. Chr.: seine Haken an verschiedenen Atomen und die durch Pfeile symbolisierte ungeordnete Bewegung würden wir heute als chemische Bindung bzw. Brownsche Molekularbewegung (Wärmebewegung) bezeichnen. Folie: Epikur-Atome Der wahre Verdienst Demokrits ist nicht so sehr der Inhalt seiner Hypothese, sondern die Methodik: die Suche nach guten, möglichst vielseitigen Erklärungen für Vorgänge in der Natur. Sein Weltbild war kausal: Vorgänge hatten eine Ursache, er brauchte keine Götter. Vom „Großmeister der antiken Wissenschaft“ ARISTOTELES, 384-322 v. Chr., kamen nicht etwa neue, moderne Impulse, sondern genau das Gegenteil: sein Weltbild war teleologisch, d.h. Vorgänge sind für ihn immer an einem Zweck orientiert. Die Erfüllung des Zwecks liegt in der Zukunft, deshalb benötigt Aristoteles eine „planende Hand“: Götter bzw. einen Gott. Der christlichen Kirche war diese Vorstellung sehr genehm: sie übernahm sie und wer sie anzweifelte, galt als Ketzer. Folie: Zeitachse; Teil 2 von 3: Das Kirchenloch Zitat: A. March, Physiker, 1891-1957, über Aristoteles: „Es besteht für Naturwissenschaftler kein Grund, in die Verehrung einzustimmen, die A. genießt. Er hat durch seine Ablehnung des Atomismus den Fortschritt der Wissenschaft zwei Jahrtausende lang aufgehalten. Und was vielleicht noch schlimmer ist: er hat als Urheber einer Geistesrichtung, die alle Grundsätze des physikalischen Denkens verkannte und die er mit dem ganzen Gewicht seiner ungeheuren Autorität vertrat, auf die spätere Entwicklung nicht bloß der Physik, sondern auch der übrigen Naturwissenschaften den verderblichsten Einfluss genommen.“ Beide, die katholische Kirche und Aristoteles, sind dafür verantwortlich, dass die Naturwissenschaften 2000 Jahre lang keine Weiterentwicklung zeigten. Folie: Zeitachse; Teil 3 von 3: Wiedererwachen der Naturwissenschaft Erst im 17. Jh. wurde das Aristotelische Weltbild durch GALILEI, KEPPLER und, bezüglich der Atomvorstellung, durch GASSENDI (1592-1655) ernsthaft in Frage gestellt und unter Lebensgefahr revidiert. Gleichzeitig setzte sich eine entscheidende Methodik durch: Das spekulative Vorgehen verliert an Bedeutung, das Erfahrbare wird zum Kriterium für „Wahrheit“. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 7 Hinweis: Heutige Trennung in Geisteswissenschaften mit einem sehr hohen spekulativen Anteil, und Naturwissenschaften, die sich i.d.R. am Erfahrbaren und Messbaren orientieren. 2.2.2 Atomhypothesen im 18./19. Jh. John DALTON, 1766-1844: Typisch für die heutige naturwissenschaftliche Betrachtungsweise ist das Vorgehen in der Reihenfolge: Hypothesenbildung: Hypothesen sind reine Gedankengebäude, subjektive Vorstellungen, spekulativ. Theorien sind durch experimentelle Befunde erhärtete Hypothesen. Beweise im strengen naturwissenschaftlichen Sinn sind leider selten. Daltons Hypothese war folgende: 1. Alle Elemente bestehen aus Atomen, die unteilbar sind. 2. In Verbindungen behalten diese Atome ihre Individualität, d.h. sie können aus ihnen unverändert wieder hervorgehen. Alle Atome desselben Elementes sind untereinander gleichartig, gleich groß und von gleicher Masse. 3. In Verbindungen findet man ganzzahlige Mengenverhältnisse. Die kleinste Einheit dabei besteht aus zwei Atomen. Kritik aus heutiger Sicht: Unteilbar? Isotope? Dalton`s Hypothese brachte zwei chemische Gesetze "unter einen Hut": Den Massenerhaltungssatz (A. Lavoisier, um 1770): Masse wird durch chemische Vorgänge nicht vermehrt oder vernichtet. Das Gesetz der konstanten Proportionen (oder 1. Verbindungsgesetz, J. Proust, 1799): das Massenverhältnis bestimmter Elemente in einer chemischen Verbindung ist konstant. Beispiele: Man findet bei der Analyse von Wasser oder von Quecksilberoxiden verschiedenster Herkunft immer die gleichen Massenverhältnisse: m(H) : m(O) = 1 : 7.936 * 2 = 2 : 15.872 m(H) : m(Hg) = 1 : 12.537 *16 = 16 : 200.592 Selber formulierte er: Das Gesetz der multiplen Proportionen (oder 2. Verbindungsgesetz): bildet ein bestimmtes Element (z.B. O) mit einem anderen (z.B. Cu) zwei verschiedene chemische Verbindungen, so findet man jeweils ganzzahlige Massenverhältnisse. Kritik aus heutiger Sicht: Nichtdaltonide (nichtstöchiometrische, berthollide Verbindungen, z.B. Legierungen, Keramiken, dotierte Halbleiter...) Beispiel: 1 Teilchen Cu bindet in CuO an 1 Teilchen O. 2 Teilchen Cu binden in Cu2O an 1 Teilchen O. Das Ausmaß, in dem die Daltonsche Atomhypothese gültig war, konnten erst die Atomphysiker 100 Jahre später (Beginn dieses Jahrhunderts) ermessen und bestätigen. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 8 Amedeo Avogadro, 1776 - 1856: Im Sinne der Daltonschen Verhältnisse fand er bald, dass sich bei Reaktionen zwischen Gasen ganzzahlige Volumenverhältnisse zwischen den Edukten und Produkten einstellten: H2 z.B.:1.3 RT 1 + + : Cl2 1.3 RT 1 -----> -----> : 2 HCl 2.6 RT 2 Avogadro ging davon aus, dass jedes Gasteilchen, ob Atom (Edelgas) oder mehratomiges Molekül (H2, HCl) das gleiche, bestimmte Volumen beansprucht, sofern man Druck und Temperatur konstant hielt. Also konnte er weiter folgern, dass man von dem Verhältnis der Volumina V(H2) : V(HCl) = 1 : 1 auf das Verhältnis der Teilchenzahlen schließen könne. Das führte ihn zum Molbegriff und zur AvogadroKonstanten (siehe später). 2.2.3 Atommodelle im 20. Jh. Das eigentlich erste Atommodell stammt von J. J. THOMSON, 1856 - 1940. Sein „Rosinenkuchen“-Modell ging von einer gleichmäßigen Verteilung positiver und negativer Ladungen im Atom aus. Damit konnten die Faradayschen Experimente und die Entstehung von Ionen erklärt werden, aber die Anordnung der Teilchen im Atom war noch schleierhaft. Ernest RUTHERFORD, 1871 - 1937: Letztendliche Beweise für den Aufbau der Atome lieferte nach 1900 die Erforschung der Radioaktivität z.B. durch Rutherford: die Entdeckung der α-Strahlung; Identifizierung als zweifach positiv geladener He-Kern; damit gekoppelt: Elementumwandlung durch Aussendung von α-Strahlen Rutherford-Experiment: Beschuss der Goldfolie mit α-Teilchen Tafelskizze/Folie: Der Rutherford-Versuch Die Zahl der α-Teilchen mit großem Streuwinkel ist der Dicke der Goldfolie proportional. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 9 Modellbeschreibung: 1. Atome sind kugelförmige Gebilde mit einem Radius von ca. 10-10m und bestehen aus einem Kern und einer Hülle. 2. Der Atomkern besitzt einen Radius von ca. 10-14m, besteht (mindestens) aus positiven Ladungsträgern (Protonen) und enthält fast die gesamte Masse des Atoms. 3. In der Hülle bewegen sich negative Ladungsträger (Elektronen) sehr geringer Masse auf kreisförmigen Bahnen mit so hoher Geschwindigkeit, dass ihre Zentrifugalkraft FZ die Coulombanziehung FC (durch den Kern) kompensiert. Tafelskizze: Vektordarstellung von FZ und FC am Elektron Hinweis: Die abgestrahlte Energie (auch in Form von sichtbarem Licht möglich) ist der Umlauffrequenz proportional. Sie müsste also, wird das Elektron immer schneller oder langsamer, ein kontinuierliches Spektrum („Regenbogen“) ergeben. BALMER fand aber (für Wasserstoff) ein Linienspektrum, d.h. die Elektronen senden nur bestimmte Energiewerte aus. Demonstration: Spektrallinien des Leuchtstoffröhren-Lichtes Hinweis: Bis hierher reicht zunächst die Tiefe der Betrachtung des Atombaues. Geschichtlich ist das der Stand des Jahres 1912. Auf Wunsch (und nach Zeit) erfolgt am Ende der Vorlesung eine Erweiterung auf die Orbitaltheorie. 2.2.4 Elektronenbesetzung Folie: Theoretisches Modellexperiment Ionisierungsenergien Die Vorstellung von der Anordnung der Elektronen um den Kern haben sich mit den Atommodellen entwickelt: THOMSON´s „Erdbeermodell“ vermutete die Elektronen festsitzend auf der Oberfläche einer positiv geladenen Kugel. RUTHERFORD´s Elektronen umkreisen einen positiven Kern, jedes auf einer eigenen Kreisbahn. BOHR formulierte nur bestimmte Kreisbahnen, auf denen aber mehrere Elektronen Platz haben. Dazwischen gab es „verbotene Zonen“. PAULI postulierte 1925, dass sich die Elektronen einer Bahn in mindestens einem Parameter unterscheiden müssten. Die Elektronenbahnen (BOHR / SOMMERFELD) waren nicht mehr ausschließlich kreisförmig. HEISENBERG und SCHRÖDINGER sahen die Elektronen dann nicht mehr als Teilchen, sondern als Wellen an. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 10 Demonstration: Gummiband schwingt. Folien: Orbital-Geometrien (s, p, d, f) Sie konnten geometrische Formen von Schwingungszuständen (Orbitalen) berechnen und eine Formel angeben, nach der man die Zahl der Elektronen errechnen kann, die in einer „Schale“ Platz haben: 2n2 , wobei n=Schalennummer. Beispiele: Schale 1: 2 Elektronen. Schale 2: 8 Elektronen. Schale 3: 18 Elektronen. Schale 4: 32 Elektronen.... Worin sich die Elektronen einer Schale genau unterscheiden ist Teil der Orbitalvorstellung, die in diesem Rahmen nur auf Wunsch der Teilnehmer vorgestellt wird. 2.2.5 Zusammenfassung: Teilchen Symbol Neutronen n Protonen p Elektronen e- Masse [g] 1.6748*10-24 1.6725*10-24 0.911*10-28 Masse [u] 1.008 1.007 5.5*10-4 Q 0 +1 -1 Ort Kern Kern Hülle 1. Atome sind nach außen hin neutral, d.h. die Zahl der Elektronen entspricht genau der Zahl der Protonen (Kernladungszahl Z). 2. Für jedes Proton enthält der Atomkern mindestens ein Neutron. Protonen Neutronen Elektronen Atommasse Name Symbol Sy p n e mA Bsp. 1 1 1 1 Wasserstoff H Bsp. 2 5 5 5 10 Bor B Bsp. 3 34 45 34 79 Selen Se 2.3 Teilchen Ziel: Den chemisch noch wenig scharfen Begriff des "Teilchens" fassen. Modell: Styropor-Applikationen Das vollständige Atomsymbol enthält eine Reihe von Angaben: Nucleonenzahl Ladungszahl X Protonenzahl Atomzahl Besitzt ein Teilchen mehr oder weniger Elektronen als Protonen, so nennen wir es Ion. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 11 Anionen sind negativ geladen: sie enthalten mehr Elektronen als Protonen: XKationen sind positiv geladen: sie enthalten weniger Elektronen als Protonen: X+ Die Nucleonenzahl (Protonen- und Neutronenzahl zusammen) gibt uns Aufschluss über die Masse des Atoms. A: Was passiert, wenn man im Atom die Zahl der p+ verändert? Die Protonenzahl charakterisiert ein chemisches Element. Ein chemisches Element enthält nur Atome mit gleicher Protonenzahl (Kernladungszahl Z). Hinweis: über die Zahl der Neutronen ist nichts ausgesagt worden. Es kann also sehr wohl "Elemente" verschiedenen Atombaues, dennoch gleicher Protonenzahl geben. Beispiele: 1 H Wasserstoff, 2H Deuterium, 3H Tritium; 12 C Kohlenstoff, 14C lies "Kohlenstoff 14". Isotope sind Atome gleicher Protonen- aber verschiedener Neutronenzahl. Alle Isotope eines Elementes besitzen die gleichen chemischen Eigenschaften. Anmerkung: die Gesetzmäßigkeit, dass pro Proton genau ein Neutron im Kern dazukommt reicht nur bis zu dem Element Calcium (Z=40), dann wird die Zahl der Neutronen größer. Neutronen spielen die Rolle von Kittsubstanz im Kern (lauter positiv geladene Teilchen auf engstem Raum!). Ergebnis: Atomsorten (Elemente) unterscheiden sich durch: die Anzahl der Nucleonen die Anzahl der Elektronen. Die chemischen Eigenschaften eines Elementes werden nur von der Zahl der Elektronen bestimmt. 2.4 Radioaktivität http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 12 Ziel: Phänomen, Aktualität Material: Geiger-Müller-Zähler Isotopengenerator 2.4.1 Radioaktive Strahlung Natürliche vorkommende Strahlungsquellen geben drei Strahlungsarten ab, die man mit den Anfangsbuchstaben des griechischen Alphabetes bezeichnet: alpha, beta und gamma. Die Entdeckung der natürlichen Radioaktivität beruhte auf einem Zufall: Pierre CURIE trug in seiner Hosentasche Pechblende aus Böhmen herum, bis er an seinem Oberschenkel eine Rötung feststellte. Der Übeltäter war, wie schon bei BECQUERELs Photoplatten, Uran, das im Mineral zu 75% enthalten war. Tafelskizze/Diskussion: Strahlungsarten Parameter Strahlungsart Teilchen alpha Teilchen beta Teilchen gamma Strahlung - Reichweite* in Luft: Reichweite* in Al: Quelle: 3 - 8 cm 0.02 mm 1-8m 0.5 mm weit 5 cm stark hohe Masse, geringe Geschw. mittelstark geringe Masse, geringe Geschw. schwach masselos ionisier. Wirkung Grund: *Reichweite: Strecke, nach der nur noch die Hälfte der Strahlung vorhanden ist! Hinweise: als Reichweite wird angegeben, nach welcher Strecke die Hälfte der Strahlung zurückgehalten wurde. die Reichweite ist gering, weil die großen Teilchen mit Luftmolekülen zusammenstoßen und ihre Energie abgeben von der ionisierenden Wirkung hängt das Ausmaß biologischer Schädlichkeit ab: Ionisierung bewirkt Änderung der chemischen Eigenschaften bis Zerstörung. Durch das Strahlen (nur alpha und beta) entstehen neue Elemente! Die Energie E, die von einem radioaktiven Präparat auf eine absorbierende Substanz X übertragen wird, sagt noch nichts über die Wirksamkeit aus: alpha-Strahlen geringer Energie sind z.B. für den Menschen viel schädlicher als gamma-Strahlen wesentlich höherer Energie. Grund: sie ionisieren auf ihrem Weg durch den Organismus wesentlich mehr Teilchen. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 13 2.4.2 Messung Folie: Zählrohr Demonstration: Geiger-Müller-Zähler Das Geiger-Müller-Zählrohr eignet sich für Teilchenstrahlung und energiereichere gamma-Strahlen. Hinweis: Daneben gibt es noch die Nebelkammer, mit der man Strahlung sichtbar machen kann. 2.4.3 Das Zerfallsgesetz A: Ist der radioaktive Zerfall eine chemische Reaktion? Der radioaktive Zerfall ist nur abhängig von der Zahl der vorhandenen Atome, nicht von äußeren Faktoren: es handelt sich um eine Reaktion 1. Ordnung. Man kann nicht voraussagen, welches Atom wann zerfallen wird. Nt = N0 * e-lambda*t (Zerfallsgesetz; wobei lambda = Zerfallskonstante [1/s]). Nach dieser Gleichung lässt sich die nach einer bestimmten Zeit noch vorhandene Zahl der radioaktiven Teilchen (=Radionuklide) berechnen. Die Geschwindigkeit des radioaktiven Zerfalls wird über die Halbwertszeit t1/2 beschrieben: es ist die Zeit, nach der von einer bestimmten Ausgangsmenge radioaktiven Materials die Hälfte noch vorhanden ist. 2.4.4 Das Grundprinzip eines Kernspaltungsreaktors Wieso lässt sich aus Atomkernen Energie gewinnen? Einfache Rechnung mit Schwierigkeiten: Zählt man die Massen aller Neutronen und Protonen in einem Kern zusammen, so "fehlt" zum Schluss, verglichen mit der tatsächlichen Masse des entsprechenden Kerns, ein bestimmter Betrag. Dieser ist z.B. für U-238 0,0555u = 10-25g. Den Massenunterschied zwischen der Summe der Nucleonenmassen und der genauen, tatsächlichen Kernmasse bezeichnet man als Massendefekt. Nun ist diese Masse nicht einfach "weg": das wäre ein Widerspruch zu dem grundlegenden Satz von der Erhaltung der Masse. EINSTEIN lieferte die Erklärung für diese Merkwürdigkeit: die Beziehung zwischen Masse und Energie. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 14 E = mc2 m = E/c2 Aussage: die Masse ist lediglich eine andere Erscheinungsform für Energie, also in diese umwandelbar. Die Energie, die frei wird, wenn man einen Kern aus Nucleonen zusammenbaut, nennt man Kernbindungsenergie. Bei der Zerlegung des Kerns in freie Nucleonen müsste sie wieder aufgewendet werden. Um die Größe der Kernbindungsenergieen zu erfassen, kann man sie mit der chemischen Bindung vergleichen. Die mittlere Bindungsenergie zwischen den Nucleonen beträgt: E (NB, 206Pb) = 8.3*10-9 J / 206 = 4 * 10-11 J/Nucleon Eine der energiereichsten chemischen Bindungen, also über gemeinsame Elektronen in der Schale, ist die zwischen zwei Wasserstoffatomen: E (B, H2) = 7.2 * 10-19 J/Molekül also um 8 Zehnerpotenzen niedriger. Folie: Stabilitätskurve bei Atomkernen Eisen besitzt den stabilsten Kern. Die Spaltung schwererer Kerne als Fe liefert Energie: dies wird in Spaltungsreaktoren und bei Atombomben ausgenutzt (Kernspaltung). Die Verschmelzung leichterer Kerne als Fe liefert Energie: dies wird in Fusionsreaktoren und bei Wasserstoffbomben ausgenutzt (Kernfusion). http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 15 Folie: Kettenreaktion (neutronenbetonte Spaltung von 238U) Werden bei einer durch ein Neutronen induzierten Kernreaktion mehr als eines wieder frei, so ergibt sich eine Kettenreaktion. In Wirklichkeit werden im Schnitt je Molekül 235U 2.46 Neutronen frei. Um die Kettenreaktion zu vermeiden, somit die Energiefreisetzung zu bremsen, ist es nötig, die Zahl der Neutronen zu steuern: man benötigt eine reversible Bremse. Ein für die Energienutzung geeigneter Reaktor muss also aus folgenden Grundelementen bestehen: Folie: Grundschema eines Kernreaktors Grundsätzlich sind alle Isotope als Brennstoff geeignet, die durch Neutronenbeschuss spaltbar und schwerer als Fe sind. Nur wenige jedoch liefern gleichzeitig so viele neue Neutronen, dass eine Kettenreaktion durch einfachen Neutronenbeschuss zustande käme. 238 U fängt Neutronen ab. Das ist auch der Grund, warum in reichhaltigen Uran-Erzen mit einem Gehalt um 50% U keine Kettenreaktion zustande kommt: der Gehalt an 235U beträgt nur 0.7% bezogen auf reines UMetall. Über Isotopentrennverfahren wird das natürliche Gemisch auf den erforderlichen Gehalt von 2-4% 235 U angereichert. Eingesetzt wird das Material meistens als Brennstäbe, eingeschweißt in Stahl, damit radioaktive Produkte nicht entweichen können. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 16 Entscheidend für den geregelten Betrieb ist der Neutronenvermehrungsfaktor k. Er wird beschrieben von der Beziehung: k= n(gebildet) -----------------n(verbraucht) Nun muss die entstandene Wärme aus dem Bereich der Brennstäbe zur stromerzeugenden Turbine transportiert werden. Dazu gibt es Kernkraftwerkstypen mit einem Kreis zwei Kreisen (primär und sekundär). Hinweis: Der Reaktor in Tschernobyl war ein Graphit moderierter Reaktor mit Wasserdampf als Wärmetransportmittel. Diesen Reaktortyp wurde nur in der früheren UdSSR gebaut. (Exkurs: Kernfusion) Bei der Kernspaltung wird bis zu 0.1% der Kernmasse in Energie umgewandelt. Bei der Kernfusion sind es 0.4% bzw. 0.7% (ggf. mehr?) der Kernmassen. Man versucht, durch Verschmelzung von zwei Kernen das stabile, also energetisch niedrigere 4He zu erreichen. Die Energiedifferenz steht dann zur Verfügung. Problem 1: Lösung 1: Problem 2: Lösung 2: Problem 4: Lösung 4: In welchem Gefäß kann man Gase bei 108 K halten? Die temperaturfestesten Materialien schmelzen bereits bei 3000K. Die "Magnetische Flasche" ist ein Edelstahlgefäß, in dem Magnetfelder das heiße Material von den Wänden fernhalten. Wie erzeugt man die hohe Zündtemperatur? Später würde der Fusionsprozess die Wärme für die Aufrechterhaltung der Reaktion liefern. Noch keine. Bisher sind Temperaturen von ca. 107 K erzeugt worden. Das ist zwar nur um den Faktor 5 zu wenig, aber die Temperaturen wurden auch nur für sehr kurze Zeiten aufrecht erhalten. Woher nimmt man den Brennstoff? Deuterium kommt in der Natur in genügender Menge vor und kann mit Isotopentrennverfahren isoliert werden. Tritium ist selten und muss aus Li über Neutronenbeschuss hergestellt werden. Lithium selber ist allerdings nicht allzu häufig: 0.003% der Erdhülle. Auch ist das reine Metall wegen seines hohen Redoxpotentials relativ schwer gewinnbar. 2.4.5. Strahlenwirkung Strahlenbelastung (Deutschland, Stand ca. 1990): Kosmische Strahlung: 0m 2000 m 4000 m Terrestrische Strahlung: In Gebäuden: In Milch: Raucher: Gesamtbelastung: Belastung durch Tschernobyl: Kinder 1.Jahr Erwachsene 1.Jahr Kinder 50 J. Erwachsene 50 J. 3*10-4 Gy/a 6*10-4 Gy/a 20*10-4 Gy/a bis 250*10-4 Gy/a 1.4x (222Rn, 40K) 40 Bq/l aus 40K +1.3*10-4 Gy/a ca. 0.2 rem/a 1.4 rem 0.8 rem 4 rem 2.6 rem Gy ist die Einheit (in J/kg) für die Energiedosis D: sie beschreibt die Energie, die von einem radioaktiven Präparat auf die Masse m einer Substanz übertragen wird. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 17 rem ist die Einheit für die Äquivalentdosis. Sie entsteht aus der Energiedosis D multipliziert mit einem Erfahrungsfaktor k, der die biologische Wirksamkeit beschreibt. Beispiele: k(alpha)=10, k(beta, gamma)=1. Bq ist eine Einheit für die Aktivität eines radioaktiven Präparates in Zerfällen/s. Man unterscheidet: primäre Wirkungen im Bereich der Elektronenhülle (Anregung, Ionisierung, Radikalisierung) Bei geringer Strahlenbelastung können vorhandene Enzyme (Katalasen) Wasserstoffperoxid zersetzen, bei hohen schaffen sie es nicht. Hinweis: Tumorzellen enthalten kaum Katalase, deshalb können Tumore durch beta-Strahlen aus CoKanonen beeinflusst werden. sekundäre Wirkungen auf Ebene chemischer Reaktionen (Ionen, Radikale mit Enzymen) tertiäre Wirkungen: Fehlfunktionen im Organismus infolge sekundärer Wirkung (fehlende Enzyme) quartäre Wirkungen: fühlbare oder äußerlich sichtbare Symptome (Übelkeit, Hautveränderungen) Besonders wirksam sind inkorporierte, also in den Körper aufgenommene radioaktive Isotope: sie werden in Organe eingebaut und verweilen deshalb lange im Körper: 90 Sr und 140Ba sind Ca ähnlich, tauchen in Knochen auf, Cs ist K ähnlich und gelangt in Nervenzellen, 131 I wird wie 127I ins Thyroxin der Schilddrüse eingebaut. 137 Wirkungen kurzer Strahlenbelastung: bei sehr niedrigen Dosen (3.5-1000mSv/a): Schäden werden repariert bei niedrigen Dosen (-2000mSv/a): "Strahlenkater" = Störung des Allgemeinbefindens (Kopfweh, Übelkeit, Erbrechen, Missgeburten) bei mittleren Dosen (-5000mSv/a): kurzfristig Hautverbrennungen, Durchfall, Kreislaufschwäche, mittelfristig Geschwüre, langfristig Leukämie, Krebs, Strahlen-AIDS bei hohen Dosen (>5000mSv/a): Schäden am ZNS, Sterilität, Tod. Bei geringer Strahlenbelastung über größere Zeiträume wirkt sich die Mutagenität der Strahlen aus: es treten vererbbare Schäden (im Genmaterial der Geschlechtszellen) und nicht vererbbare Schäden (im Genmaterial der Körperzellen) auf. 2.5 Das Periodensystem der Elemente Ziel: Wie kriegt man Ordnung in die (theoretisch) unbegrenzte Zahl möglicher Atomsorten? Material: Modell mehrdimensionales PSE V 1-2 2.5.1 Ordnungskriterien Um die Ordnung bei chemischen Elementen hat sich bereits um 1870 MENDELEJEW gekümmert: er schrieb sie einfach der Reihe nach auf, und zwar nach steigender Atommasse. Tafelskizze: 1H, 4He, 6Li, 8Be, 10B, 12C, 14N, 16O... Nummeriert man die Elemente im PSE durch beginnend mit 1 für den Wasserstoff, so erhält man Ordnungszahlen. Sie sind identisch mit der Zahl der Protonen im Kern. Ergänzung der Tafelskizze: 11H, 24He, 36Li, 48Be, 510B, 612C, 714N, 816O... http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 18 Dabei fielen ihm zwei Dinge auf: 1. Die Massen der Elemente steigen regelmäßig um zwei bis drei Einheiten an. Grund: sie hängt von der Zahl der Nucleonen ab und diese tragen immer einen ganzzahligen Wert bei. Mendelejew wusste allerdings noch nichts von Elementarteilchen. Folien: Mendelejews Periodensystem Folie: heutige Form Hinweis: Mendelejew fand allerdings auch "Unregelmäßigkeiten": wo der Massensprung von einem Element zum nächsten mehr als die üblichen 2-3u betrug hatte er genügend Selbstvertrauen, nicht an seiner Regel zu zweifeln sondern einen Platz für ein noch unbekanntes Element freizuhalten. Beispiel: Germanium 32Ge. 2. In gewissen Abständen folgten Elemente, deren Eigenschaften sehr ähnlich waren. Modell: mehrdimensionales PSE http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 19 Diese schrieb er untereinander und erhielt so das noch heute gültige Periodensystem der Elemente (PSE), "perioden" deshalb, weil sich Eigenschaften periodisch wiederholen. Die senkrechten Spalten im PSE heißen Gruppen. Alle Elemente einer Gruppe zeigen sehr ähnliche Eigenschaften. Grund: sie besitzen die gleiche Zahl von Elektronen auf ihrem letzten Energieniveau. Beispiel: Li, Na, K in den Niveaus L, M, N je 1 Elektron. Die waagrechten Spalten im PSE heißen Perioden. Die Elemente einer Periode füllen die gleichen Energieniveaus mit Elektronen auf. Ordnungskriterien im PSE sind also: Atommasse Eigenschaften. 2.5.2 Gruppeneigenschaften V1: Vergleich von Eigenschaften der Alkalimetalle M: Lithium Messer Natrium Papier als Unterlage Kalium Tiegelzange 3 Petrischalen D1: hohe Reaktivität gegenüber Luft (Aufbewahrung unter Petroleum) Demonstration: Härte (Natrium) Demonstration: metallischer Glanz (Lithium) Demonstration: geringe Dichte (Lithium) D2: Reaktion mit Wasser: etwa gleichgroße Stückchen in den Petrischalen mit Wasser reagieren lassen Beobachtung zur Reaktionsgeschwindigkeit? E: Lithium, Natrium und Kalium zeigen gemeinsame Eigenschaften. Sie sind Metalle, erkennbar am metallischen Glanz der guten elektrischen Leitfähigkeit und relativ hohem Schmelzpunkt sie besitzen im Vergleich zu anderen Metallen geringe Härte und Dichte sie zeigen hohe Reaktivität gegenüber Wasser; diese nimmt in der Gruppe von oben nach unten zu. Hinweis: andere Alkalimetalle im PSE Die Hauptgruppen des PSE werden mit den (alt) römischen Ziffern I-VIII, oder (neu) zusammen mit den Nebengruppen mit den arabischen Ziffern 1-18 durchnummeriert und erhalten folgende Namen: alt I II III IV V VI VII VIII neu 1 2 13 14 15 16 17 18 Bezeichnung Alkalimetalle U Laugen(Basen)bildner Erdalkalimetalle Borgruppe Kohlenstoffgruppe Stickstoffgruppe Chalkogene (Sauerstoffgruppe) Halogene = Salzbildner Edelgase = die, die nicht reagieren (="tote Hunde") Arbeitsblatt: Eintrag der Gruppennummern und Namen; Periodennummern http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 20 2.5.3 Periodeneigenschaften Perioden werden mit den Zahlen 1-7 oder den Buchstaben K-Q bezeichnet. V2: M: D: Elemente der 3. Periode Na P weiß Mg-Band S (Stangen) Al-Platte Chlor im Kolben Si "Ar" = leerer Kolben Demonstration abnehmender metallischer Eigenschaften. Es fällt auf, dass die ersten drei Elemente einander ähnlicher sind als die anderen: Metalle gegenüber Nichtmetallen. In den anderen Perioden sind es nicht die ersten drei, sondern nach unten hin mehr, nach oben hin weniger pro Periode. Von H zu Po verläuft in den Hauptgruppen eine Diagonale, die im PSE Metalle (links) von Nichtmetallen (rechts) trennt. Hinweis: Diagonale im PSE 2.5.4 Die Häufigkeit von Elementen Hinweis: nicht ganzzahlige Massen 2.5.5 Zusammenfassung: Aussagen des PSE 1. Die Elemente sind nach steigender Atommasse und nach Eigenschaften geordnet. 2. Die Gruppennummer gibt die Anzahl der Elektronen auf dem letzten Energieniveau an. Elemente mit sehr ähnlichen Eigenschaften stehen in der gleichen Gruppe. 3. Die Periodennummer gibt die Zahl der Energieniveaus an. 4. Die Ordnungszahl ist identisch mit der Kernladungszahl, d.h. sie gibt die Gesamtzahl der Protonen (somit auch der Elektronen) an. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 21 3 Der Weg zum Molekül Ziel: Wichtigste Frage der Chemie: Warum reagieren Stoff überhaupt miteinander? Warum entstehen gerade die beobachteten Produkte? Gibt es erkennbare Baueigentümlichkeiten des Atoms, die für chemische Reaktionen verantwortlich sind? Material: V1 Magnetmodell Kugel-Stäbchen "Tetraeder" 3.1 Die Oktettregel Beispiel 1: Ergebnis: Edelgase reagieren nicht mit anderen Elementen A: Zeigen Sie eine Besonderheit bezüglich des Atombaues (andere Eigenschaften kennen wir noch nicht, können wir nicht betrachten)? E: Ihrer äußerste Schale ist (außer bei He) gerade mit 8 Elektronen besetzt. Edelgase besitzen auf ihrer äußersten Schale 8 Elektronen. Dies ist offenbar ein stabiler Zustand. Beispiel 2: V1: M: V: D: B: Reaktionen von Wasserstoff mit Sauerstoff Eudiometer Stativ, 2 Muff., 2 Klemmen Pneumatisch Wanne Wasserstoff Zündgerät Sauerstoff Eudiometer füllen, befestigen Volumenverhältnis 1:1=H2:O2 einfüllen; zünden 1. Wasserstoff reagiert mit Sauerstoff heftig nach elektrischer Zündung. 2. Beim eingesetzten Volumenverhältnis von 1:1 = Wasserstoff : Sauerstoff bleibt 1 Teil Gas zurück. (Bedeutung dieser Beobachtung später). Gleichung für die Vorgänge aus dem Versuch: 1. Annäherung A: Sind die Atome "zufrieden" (in einem energetisch günstigen Zustand)? Wasserstoff ja: "will" nur 2 Elektronen, damit ist die erste Schale voll. Sauerstoff nein: es fehlt noch 1 Elektron zur vollen Schale. A: Lösung? http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 22 2. Annäherung: Moleküle sind Atomverbände. Sie werden durch chemische Bindungen zusammengehalten. Was haben die Atome dadurch erreicht, dass sie miteinander reagiert haben? das Sauerstoffatom "sagt", wenn man nachfragt, es hätte 8 Elektronen auf seinem letzten Energieniveau. Es tut so, als ob es das Edelgas Neon wäre (Unterschied? Nukleonen!) und von den Wasserstoffatomen je ein Elektron aufgenommen hätte. das Wasserstoffatom "sagt", wenn man nachfragt, es hätte 2 Elektronen auf seinem letzten Energieniveau. Es tut so, als ob es das Edelgas Helium wäre (Unterschied? Nucleonen!) und vom Sauerstoffatom ein Elektron aufgenommen hätte. Beobachtung: Elemente zeigen das Bestreben, ihre Schalen wie die nächsten Edelgase mit Elektronen zu besetzten. Ab der 2. Periode bedeutet das, auf der letzten Schale 8 Elektronen zu besitzen (Oktettregel). Der Umkehrschluss ist zulässig: Teilchen mit unvollständig besetzten Schalen sind instabil. Sie versuchen unter allen Umständen, bezüglich ihrer Elektronenzahl die Edelgaskonfiguration zu erreichen, indem sie entweder Elektronen aufnehmen oder abgeben. W: Je höher die Ladung, desto instabiler, seltener ist das entsprechende Ion. Die Edelgaskonfiguration wird am einfachsten erreicht, indem: die Elemente der Gruppen 1-13 Elektronen abgeben. Es entstehen Kationen. Dabei muss Ionisierungsenergie aufgewendet werden. die Elemente der Gruppen 15-17 Elektronen aufnehmen: Es entstehen Anionen. Dabei wird eine Energie frei, die man Elektronenaffinität nennt. Würden die Elemente der Gruppen 15-17 alle Elektronen der letzten Schale abgeben, so entstünden Kationen mit sehr hohen Ladungen, die wegen der hohen Ladungsdichte wiederum ungünstig sind: also kein Stabilitätsgewinn. Die Elemente der Gruppe 14 stehen in der Mitte zwischen zwei Edelgasen. Sie können, je nach Bedarf, Elektronen aufnehmen oder abgeben. Zusammenfassung: 1. Chemie ist ein Gerangel der Atome um Elektronen. 2. Um die Eigenschaften bestimmter Atomsorten abzuschätzen, reicht es in den meisten Fällen aus, die Elektronen der letzten Schale zu betrachten. Diese nennt man Valenzelektronen. Übung: Können folgende Atompaare miteinander reagieren? Erste Näherung! O + Li, K + Cl, Li + Na, N + H. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 23 3.2 Elektronegativität Ionisierungsenergie und Elektronenaffinität beschreiben die Beziehung eines Atoms zu seinen Valenzelektronen, somit das chemische Verhalten das Atoms. Pauling fasste den Einfluss beider Energien zum Begriff der Elektronegativität zusammen. Dabei erhält man Zahlenwerte mit eine bestimmten Maßeinheit für das gemeinsame Ausmaß, in dem ein Atom seinen Valenzelektronen festhält und andere anzieht. Die Zahlenwerte verteilte Pauling folgendermaßen: Folie: Elektronegativitäten; rote Zahlen = Werte zum merken. Das elektronegativste Element, Fluor, erhält den Zahlenwert 4 zugewiesen (keine Einheit!). Fluor hält seine Valenzelektronen am stärksten fest und hat gleichzeitig den größten „Hunger“ nach zusätzlichen Elektronen. Die Tendenz zur Bildung von Anionen ist sehr ausgeprägt. Das Verhalten der anderen Elemente wird relativ zu Fluor bewertet. Ergebnis: Die Elektronegativität sinkt im PSE von rechts nach links und von oben nach unten. Übung: Beschreiben Sie das Verhältnis von Stickstoff zu seinen Elektronen auf der letzten Schale. Begründen Sie! Faustregeln zum leichteren Umgang mit den Werten: Alle Metalle erhalten die EN = 1. Von F nach links und nach unten fällt die EN von Element zu Element um den Wert 0.5 (Genauigkeit für die Zwecke der Einstiegschemie ausreichend!) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 24 3.3. Die Kovalente Bindung Ziel: Wie verhalten sich Atome, die nur mit Ihresgleichen zusammentreffen, also dEN=0! Material: Molekül-Magnetmodelle zur Kovalenten Bindung Diamant und Diamant-Gittermodell 3.3.1 Zwischen gleichartigen Atomen Beispiel 1: Brom Beide Atome "ziehen" genau gleich stark an den einzelnen Elektronen: sie besitzen identische EN. Deshalb bleiben die beiden Elektronen zwischen den Atomen und werden als Elektronenpaar von beiden Atomen gleichzeitig beansprucht. Dadurch bleiben die Atome aneinander gebunden: eine chemische Bindung ist entstanden. Chemische Bindungen entstehen dadurch, dass in der Regel zwei Atome ein Elektronenpaar gemeinsam besitzen. Das gemeinsame Elektronenpaar befindet sich immer zwischen den Atomen. Es wird in der Valenzstrichformel durch einen waagrechten Strich dargestellt. Erweiterung 1: So bei allen Halogenen! Beispiel 2: Elektronenformel Wasserstoff Bei Reaktionen zwischen Atomen wird Energie frei. Sie entspricht dem Ausmaß, in dem der gebundene Zustand energetisch stabiler ist als der ungebundene. Modell: Magnete als Bindungen; H2 und X2 Die Energie, die bei der Entstehung einer chemischen Bindung frei wird, nennt man Bindungsenergie. Soll die Bindung zerstört werden, müsste die Bindungsenergie wieder aufgewendet werden. Die Bindungsart zwischen Nichtmetallen, bei denen der dEN bis etwa 0.8 beträgt, heißt Kovalente Bindung (=Atombindung). Atombindungen sind nicht oder kaum polarisiert, da die Bindungspartner gleich stark sind. Sie sind deshalb sehr stark, d.h. die entsprechenden Bindungsenergien sind sehr hoch. Es entstehen Moleküle. Beispiel 3: Tafelskizze Elektronenformel Sauerstoff O=O Den Bindungstyp, bei dem zweimal je 2 Elektronen gemeinsam benützt werden nennt man Doppelbindung. Erweiterung 2: nicht S2! S8-Ring mit 8 Einfachbindungen. Erster Hinweis auf die Grenze der Oktettregel. Beispiel 4: Tafelskizze Elektronenformel Stickstoff http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 25 Den Bindungstyp, bei dem dreimal je 2 Elektronen gemeinsam benützt werden nennt man Dreifachbindung. Erweiterung 3: nicht P2! P4-Tetraeder mit 4 Einfachbindungen. Derselbe Grund wie bei S. Beispiel 5: Tafelskizze Elektronenformel Kohlenstoff Es gibt keine Vierfachbindungen (bei Hauptgruppenelementen). Folie: Natürlich vorkommende Elementmoleküle und Vereinbarung über die Formulierung in Gleichungen. Die zwischen den Molekülen wirkenden Kräfte sind sehr schwach. Hinweis: Bis auf wenige Ausnahmen sind alle betroffenen Verbindungen gasförmig. Grund: außen befinden sich jeweils Elektronen, die zu einer Abstoßung der Moleküle führen. Mit Ausnahme des C bilden alle Atomverbindungen Moleküle. Hinweis/Demonstration: Diamant und Diamant-Gittermodell. 3.3.2 Zwischen unterschiedlichen Atomen A: Suchen Sie Beispiele! Schwierigkeit: woher erfährt man die Zahl der möglichen Bindungspartner? Klärung im nächsten Kapitel! Beispiele: Tafelskizze HI, CH4, (BH3, Sextett!) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 26 3.3.3 Vorschau auf andere Bindungsarten Folie: Bindungsarten und dEN Die Einteilung der chemischen Bindung in Bindungstypen ist künstlich: die Grenzen zwischen Atombindung, polarer Bindung und Ionenbindung sind fließend. 3.4 Die Struktur binärer Verbindungen Material: Modell Tetraeder Modell Wassermolekül Kalottenmodelle Kugel/Stäbchenmodell Welches Atommodell ist nun das Richtige, um das Verhalten von Atomen zu verstehen? Diese Frage ist falsch gestellt, denn es handelt sich nicht um eine Frage des "falsch" oder "richtig", sondern des Ausmaßes an Exaktheit in der Beschreibung von Atomen und der Nützlichkeit für einen bestimmten Lehrzweck. Wir müssen also vielmehr fragen: welche Modelldarstellung ist für unseren Zweck (hier: grundlegendes Verständnis von chemischen Bindungen) hilfreich und hinreichend? In vielen Schul- und Lehrbüchern wird das Bohrsche Schalenmodell verwendet. Tafelskizze/Folie: Bohrsche Schalen http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 27 Über eine gewisse Strecke ist das Modell hilfreich: es erklärt, warum sich p+ und e- nicht so weit anziehen, dass Elektronen in den Kern stürzen, und es erklärt die diskreten Energiezustände der Elektronen im Atom, die sich in den Spektrallinien äußern. Nach der im vorausgehenden Kapitel "Atombindung" verwendeten Schreibweise müssten in Methan ausschließlich rechte Winkel vorkommen, während Wasser entweder linear oder rechtwinklig gebaut wäre: Tafelskizze: Methan, Wasser in der projizierten Form (90°-Winkel!) Gleichzeitig erhebt sich die Frage: wie kann es zu einer permanenten Bindung kommen, wenn die Elektronen innerhalb der Schalen stets in Bewegung sind? Diese Widersprüche zwingen uns, zu einem anderen Atommodell zu greifen, um die beobachtete Struktur von Molekülen zu verstehen (Beweise dafür folgen im Teil "Polare Bindung"). Das Modell der Wahl heißt Kugelwolkenmodell (nach Kimball): Folie 1: Entstehung der Bindung Folie 2: Darstellung Methan 1 Folie 2': Darstellung Methan 2 Das Kugelwolkenmodell beschreibt die Anordnung von Elektronen der letzten Schale um ein Atom kurz vor dem Schließen von Bindungen. Strukturformeln geben den exakten räumlichen Bau einer Verbindung an. Das Modell von der Elektronenpaarabstoßung (VSEPR) beschreibt den Bau eines Moleküls kurz nach dem Schließen von Bindungen: die Liganden ordnen sich so um das Zentralteilchen an, dass sie im Raum den größtmöglichen Abstand voneinander einnehmen; Grund: die Bindungselektronen stoßen sich ab. freie Elektronenpaare des Zentralteilchens werden wie Liganden behandelt (manchmal beanspruchen sie sogar mehr Platz als Liganden, z.B. Wasserstoff). Übungen: CF4 109.5° idealer Tetraeder NH3 106.8° "pyramidal", dennoch Tetraeder H2O 104.5° "gewinkelt", dennoch Tetraeder HCl 180°(?) "linear", dennoch Tetraeder WICHTIG: Strukturformeln lassen sich nur für Moleküle angeben, d.h. für Atomverbände, die von kovalenten oder polaren Bindungen zusammengehalten werden! http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 28 Demonstration: Die Aussagekraft unterschiedlicher Molekülmodelle. Kalottenmodell Kugel-Stäbchen-Modell 3.5 Die Wertigkeit Ziel: Woher weiß man, vor allem bei unterschiedlichen Bindungspartnern, wie viele sich jeweils miteinander verbinden können? Die Wertigkeit eines Elementes gibt an, wie viel Einfachbindungen es ausbilden müsste, um die nächste Edelgaskonfiguration zu erreichen. Ein Wasserstoffatom verbindet sich mit einem Chloratom. Wasserstoff ist immer einwertig. Sauerstoff bildet zwei Einfachbindungen aus: er ist zweiwertig. Übung: CH4, LiF A: Regel ableitbar? Die Wertigkeit der Elemente kann bei Hauptgruppenelementen aus dem PSE abgelesen werden (in Klammern für die alte Nummerierung): bei den Gruppen 1-2 (I-III) entspricht sie der Gruppennummer, bei Gruppe 13 aus 13-10, (neue Nummerierung problematisch!) bei den Gruppen 14-18 (IV-VIII) errechnet sie sich aus: 18 (VIII) - Gruppennummer. Hinweis 1: Edelgase sind 0-wertig. Hinweis 2: Hierbei handelt es sich um eine Regel mit begrenzter Aussagekraft: ab der 3. Periode sind auch höhere Wertigkeiten bei den Hauptgruppenelementen möglich, bei den Nebengruppen häufig (bis Wertigkeit 7). Wir beschränken uns nach Möglichkeit auf die Wertigkeiten, die mit o.g. Regeln aus dem PSE ableitbar sind. Ausnahmen in diesem Sinn werden stets angegeben. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 29 3.6 Chemische Gleichungen Ziel: Das Aufschreiben der neuen Zustände der Edukte (Elementmoleküle), der Reaktionen, die zu Molekülen führen und die Bestimmung richtiger Produktnamen. Einstieg: CH4 + 2O2 ---> CO2 + 2H2O Eine Verbrennung ist im chemischen Sinn eine Reaktion zweier Stoffe miteinander, wobei Energie frei wird. Regeln zum Aufstellen chemischer Gleichungen 1. Notieren Sie die Edukte in der Form ihres natürlichen Vorkommens bzw. in der vereinbarten Form (Kap. 3.3). 2. Stellen Sie die Wertigkeiten (Kap. 3.5) der beteiligten Elemente fest und notieren Sie sie mit arabischen Ziffern über den Elementsymbolen. 3. In der Summenformel des Produktes wird jenes Element zuerst geschrieben, das die geringste EN (Kap. 3.1) besitzt. 4. Die Wertigkeiten erscheinen beim jeweils anderen Element (über Kreuz) als Index (Kreuzungsregel). Besonderheiten: - das Verhältnis der Indices muss immer das kleinstmögliche sein; nötigenfalls "kürzen". - Index=1 wird nicht notiert. 5. Gleichen Sie die Atom- bzw. Molekülzahlen auf Seiten der Edukte und Produkte durch Probieren aus. An Indices darf jetzt nichts mehr geändert werden!!! Wiederholung: bei manchen Elementmolekülen wird vereinfacht. Metalle werden als einzelne Atome behandelt. Edelgase kommen in Gleichungen auf diesem Niveau naturgemäß nicht vor. 1. Übung: Reaktion von Wasserstoff mit Brom (Verbrennung von Brom in Wasserstoff) 1. Edukte: H2 + Br2 ----> ? 2. Wertigkeiten: 1 1 3. Produkt: ----> HBr 4. Ausgleich: H2 + Br2 ----> 2 HBr Warum nicht H2Br2? (Kreuzregel) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 30 3.7 Benennung binärer Verbindungen Binäre Verbindungen bestehen nur aus zwei Atomsorten. Regeln: 1. Erst wird der weniger elektronegative Bindungspartner mit seiner Wertigkeit genannt. Geschrieben wird die Wertigkeit mit römischen Zahlen in Klammern. Beispiel: CO2. EN(C) = 2.5, EN(O) = 3.5, EN(C) < EN(O), also: Kohlenstoff(IV)-... 2. Danach nennt man den elektronegativeren Bindungspartner und fügt an seinen Atomnamen die Endung -id an. Beispiel: Kohlenstoff(IV)-oxid (nicht -sauerstoffid; siehe Beispiele unten). 3. Besonderheiten: - Bei Elementen, die immer die gleiche Wertigkeit besitzen, wird sie nicht eigens genannt; das gilt für Wasserstoff und alle Hauptgruppenmetalle. - Als Elementnamen werden z.T. lateinische, z.T. verkürzte deutsche Namen verwendet (siehe Beispiele). - Für manche binären Verbindungen sind alte oder Trivialnamen (bei den Bsp. unterstrichen) weit gebräuchlicher als der (neue) wissenschaftliche Namen. Stoffklasse Halogenide Oxide Sulfide Nitride Phosphide Carbide Hydride Formel HF CCl4 NaCl H2O CO2 P2O3 MgO H2S As2S3 NH3 AlN PH3 Li3P CH4 Li4C LiH BH3 Namen Wasserstofffluorid Kohlenstoff(IV)-chlorid, Tetrachlorkohlenstoff Natriumchlorid, Kochsalz Wasserstoffoxid, Wasser Kohlenstoff(IV)-oxid, Kohlendioxid Phosphor(III)-oxid Magnesiumoxid Wasserstoffsulfid, Schwefelwasserstoff Arsen(III)-sulfid Wasserstoffnitrid, Ammoniak Aluminiumnitrid Wasserstoffphosphid, Phosphan Lithiumphosphid Wasserstoffcarbid, Methan Lithiumcarbid Lithiumhydrid Borhydrid, Boran Übungen: Benennen Sie: NH3, SiC, BCl3, Li3B, BN, OF2, CaSe, Pb3As4, GaAs, BiBr3, NaCl Schreiben Sie die Formel auf für: Phosphor(V)-oxid, Schwefel(VI)-carbid, Sauerstoffoxid, Calciumbromid, Magnesiumarsenid, Blei(IV)-sulfid, Wasserstoffiodid, Wasseroxid. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 31 3.8 Die polare Bindung Material: V1 M D E V1 Ablenkung eines Wasserstahls durch statische Ladung Hartgummi Polyester-Lappen Hartgummistab durch Reiben aufladen Ein Wasserstrahl kann durch die Ladung abgelenkt werden A: Lässt sich dieses Phänomen aus den bisherigen Kenntnissen über Wasser erklären? Molekülformel: H2O Elektronenformel Valenzstrichformel: H-O-H dEN: 2.2 - 3.5 = 1.3, also keine kovalente Bindung. Bei dEN zwischen 1.8 und 0.8 werden Bindungselektronen zwar gemeinsam benutzt, wobei allerdings der elektronegativere Partner einen höheren Anteil zu sich ziehen kann. Es entstehen polare Bindungen. Die Summenformeln beschreiben Moleküle. Hinweis: Der Begriff "Summenformel" ist problematisch und weder durch IUPAC noch durch DINBestimmungen gedeckt. Er wird in dieser Veranstaltung vermieden. Neu ist: die Pfeil-Schreibweise für polarisierte Bindungen und die Bezeichnung "gewinkelter Bau". Folie: Wasser Weitere Beispiele: H-Cl, H-S-H, NH3 Tafelskizze / Folien: Partialladungen und Dipol http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 32 An den einzelnen Atomen ergeben sich Partialladungen. Bei nicht kugelsymmetrischen Molekülen führt die polare Bindung zu Dipolen. Übung: HCl und H2O sind Dipole, nicht jedoch CF4 (kugelsymmetrisch). Erklärung des Ergebnisses aus Versuch 1: unterschiedliche Ladungen ziehen sich an Wassermoleküle besitzen Teilladungen, sind Dipole die Stabladung richtet die Dipole zunächst aus, da die Stabladung den entgegengesetzten Pol anzieht die weitere Anziehung bewirkt die Ablenkung. 3.9 Aggregatzustände Ziel: Wie unterscheidet sich Eis von Wasser und Dampf auf Molekülebene? Material V1 Trockeneis, ca. 50g 3.9.1 Beschreibung Tafelskizze / Folie: Aggregatzustände Der Festpunkt Fp. (Schmelzpunkt Smp., Mp.) und der Kochpunkt Kp. (Siedepunkt Sdp., Bp.) sind physikalische Kenngrößen eines Stoffes: ist der Stoff sehr rein, so zeigt er (unter jeweils gleiche äußeren Bedingungen wie z.B. Druck) stets denselben Kp. bzw. Fp. V1: M: D: B: Demonstration eines Schmelzpunktes Alu Folie Bunsenbrenner, Feuerzeug Rolle aus Alufolie knüllen in der BB-Flame erhitzen Aluminium schmilzt plötzlich. Hinweis: Der Übergang Rotglut-Weißglut-Schmelze bei Eisen ist eine Ausnahme. Er erscheint bei reinem Eisen auch nicht so deutlich wie bei Stahl. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 33 3.9.2 Übergänge Demonstration: Trockeneis Die Energie, die nötig ist, um einen Stoff aus einem geordneten Aggregatzustand in einen ungeordneten zu überführen, dient der Überwindung der Anziehungskräfte zwischen den Teilchen und dem Übertritt in das umgebende Medium. Umgebungsmedium ist in der Regel Luft des Luftdrucks um 1013 hPa. Wird der Druck erhöht, siedet eine Flüssigkeit später (Wasser z.B. erst bei 150°C), wird er erniedrigt, früher (auf dem Mt. Everest siedet Wasser bei unter 70°C). Bei Umwandlung in umgekehrter Richtung wird diese Energie wieder frei. Hinweis: Frostschutz bei Obstbäumen in der Blüte 3.9.3 Besonderheiten bei Gasen Mit Gasen gehen physikalische Chemiker gerne um, weil die Teilchen in diesem Aggregatzustand minimale Wechselwirkung zeigen. Um auch diese minimalen WW auszuschalten, formuliert man ein ideales Gas: Bei einem idealen Gas: sind alle Teilchen kugelförmig zeigen untereinander keine WW und verteilen sich von selbst in einem gegebenen Raum gleichmäßig (Diffusion). Hinweis: Temperatur ist die mittlere Geschwindigkeit von Teilchen. Daraus ergibt sich folgende Vorstellung: Ideale Gasteilchen sind gleichmäßig im zur Verfügung stehenden Raum verteilt; daraus ergibt sich die Eigenschaft Volumen. Sie bewegen sich alle mit einer mittleren Geschwindigkeit; daraus ergibt sich die Eigenschaft Temperatur. Dabei stoßen sie miteinander (H2 z.B. 1,6*1010 mal/s) und mit der Gefäßwand zusammen; daraus ergibt sich die Eigenschaft Druck. Gay-Lussac und Boyle-Mariotte formulierten die Abhängigkeit dieser Variablen voneinander: Zustandsgleichung idealer Gase. Oder, wenn man das Gas unter beliebigen Bedingungen betrachtet: Eine Seite der Gleichung kann man normieren, damit berechnete Zahlenwerte für verschiedene Gase verglichen werden können: http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 34 wobei n=Normalbedingungen. Normalbedingungen sind: p=1013 mbar (hPa) T= 273 K (0°C) V=n*VM, wobei VM = 22,4 l/mol Durch Einsetzen ergibt sich: p*V=n*R*T allgemeine Gasgleichung. Wobei: n=Molzahl R=8.31 J/Kmol (allgemeine Gaskonstante). Was leisten die Gasgesetze? a. Voraussage des absoluten Temperatur-Nullpunktes Tafelskizze/Folie: V/T-Kurve und absolute Temperatur Verlängert man die für gasförmige Stoffe gefundenen Kurven, so erreichen sie alle V=0 bei -273,15°C. b. Das Molvolumen 1 Mol eines idealen Gases nimmt unter Normalbedingungen immer das (Mol)Volumen von 22,4 Litern ein. Hinweis 1: Ideal verhalten sich über den größten Temperaturbereich nur H2 und He. Alle anderen bei RT gasförmigen Stoffe (O2, N2, CO2...) verhalten sich nur bei größerer Verdünnung (p≤1At) und oberhalb 0°C weitgehend ideal. Hinweis 2: Zwischen realen Gasen herrschen mindestens vdW-Kräfte. Ab einem bestimmten Druck oder unterhalb einer bestimmten Temperatur werden sie flüssig oder sogar fest. Ein ideales Gas würde diese Eigenschaften nicht zeigen. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 35 3.9.4 Anomalien bei Wasser Beobachtung: Eis schwimmt auf dem Wasser, d.h. es müsste eine geringere Dichte besitzen als das Wasser. Widerspruch zur Skizze „Aggregatzustände“! Wasser bildet tatsächlich eine Ausnahme. Das ist so bedeutend, dass man annimmt, nur deshalb sei Wasser so eng mit dem Leben verbunden. Wasser besitzt die größte Dichte bei +4°C: 1.0000 g/cm3. Bei 0°C ist die Dichte des Wassers 0.9999, die des Eises 0.9168. Bedeutung: Kühlt ein See im Herbst an der Oberfläche ab, so tut er das zunächst bis +4°C. Diese schwerste Form sinkt ab, wärmeres steigt nach oben (Konvektion) und wird ebenfalls abgekühlt. Das geht so lange, bis der See auf seine gesamte Tiefe auf +4°C abgekühlt ist. Erst dann gefriert der See von oben nach unten zu. In unserem Klima entstehen dabei Eisschichten von max. 40cm Dicke, d.h. darunter befindet sich immer flüssiges Wasser der Temperatur +4°C. Bestünde keine Anomalie, würde das dann schwerere Eis absinken, der See würde von unten nach oben einfrieren, mit katastrophalen Folgen für das Leben darin. In Verbindung mit der schlechten Wärmeleitfähigkeit des Wassers kann man berechnen, dass in unseren Breiten die meisten Seen im Sommer nur an der Oberfläche auftauen würden. Exkurs: Eine einfache Rechnung dazu: 0,9999 : 0,9168 = 1,0906. Das ist eine Ausdehnung um 1/11 oder 9%! Hinweis 1: Das Sprengen von Gestein durch die Erhöhung des Volumens (=Erniedrigung der Dichte) beim Gefrieren ist ein wesentlicher Erosionsfaktor: beim Abbau von Gebirgen und bei der Entstehung von Boden. Hinweis 2: Eisbergproblem: „Wie groß ist die Spitze eines Eisberges“? In reinem Wasser 1/11 der Masse, in Meerwasser etwas größer (9/10), da es eine größere Dichte als reines Wasser besitzt. Hinweis 3: Früher war 1g definiert als die Masse von 1cm3 Wasser bei 4°C. Im Prinzip gilt das heute noch bis zu einer Genauigkeit von 5 Stellen hinter dem Komma (im Gramm-Bereich 10µg). http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 36 3.10 Zwischenmolekulare Kräfte Ziel: Kann man aus dem Molekülbau auf physikalische und/oder chemische Eigenschaften schließen? 3.10.1 Dipolkräfte Folie: Schmelzpunkte einiger Verbindungen Dipolkräfte sind die stärksten zwischenmolekularen Kräfte: polare Verbindungen schmelzen erst bei höheren Temperaturen als unpolare. Bsp.: H2O, HF, (NH3) 3.10.2 Van-der-Waals-Kräfte Auch zwischen vollkommen unpolaren Molekülen gibt es Anziehungskräfte, sonst müssten alle unpolaren Verbindungen schon beim absoluten Nullpunkt verdampfen. Zwischen unpolaren Molekülen wirken sehr schwache Kräfte: van-der-Waals-Kräfte. Sie lassen sich mit der Ihnen bekannten Atomvorstellung nicht erklären. Vorstellung: auch unpolare Moleküle sind sehr schwache Dipole, die aber sehr schnell die Pole wechseln (schwingen). Es ergeben sich momentane Dipole. Diese beeinflussen benachbarte Moleküle so, dass sich die Schwingung ihrer Dipole im Gegentakt einstellt: Folie: Momentaner und induzierter Dipol Es entsteht ein induzierter Dipol. Erweiterung: Die Fest- und Kochpunkte hängen nicht nur von den zwischenmolekularen Kräften ab, sondern auch von der Molekülmasse. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 37 Folie: Siedepunkte einiger Verbindungen Beispiele: Halogen x: M(x): F2(g) 38 Cl2(g) 71 Br2(l) 160 I2(s) 254 Will man Kp.-Unterschiede diskutieren, so verfolgt man zwei Einflüsse: den der Molekülmasse und den der zwischenmolekularen Kräfte. Hinweis: Bei der Ionenbindung (also im Ionengitter) wirken noch stärkere Anziehungskräfte als Dipolkräfte: elektrostatische Anziehung zwischen Elementarladungen oder einem Vielfachen davon. Das sind aber keine zwischenmolekularen Kräfte, da es bei Salzen keine Moleküle gibt. Die Summenformeln geben das kleinste Zahlenverhältnis der beteiligten Ionen an! A: Geben Sie Erklärungen für die Siedepunkte folgender Verbindungen: NaCl 1441 MgCl2 1412 AlCl3 183 SiCl4 58 PCl3 76 SCl2 59 Cl2 -34 3.11 Die Ionenbindung Ziel: Abschließen des Spektrums Material: V 1-2 Kugel-Stäbchen-Modell des Kochsalz-Gitters Kochsalz-Gittermodell (Wattekugeln) selbst gezüchtete Ionenkristalle: NaCl, K/Cr-Alaune, CuSO4, Blutlaugensalze, Phosphat(e) Ferrero-Modell A: Wovon hängt die Bindungsstärke ab? "Elektronenhunger" (EN) der beteiligten Atome. Welche Folgen ergeben sich daraus für den Zusammenhalt der Atome in Molekülen und für ihr chemisches Verhalten? http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 38 3.11.1 Beschreibung V1: Synthese von AlBr3 M: Stativ, Muffe, Halter Becherglas 400ml mit Sand Brom Stopfen Aluminium-Späne Spritzflasche RG groß D: ca. 1ml Brom ins RG, einige Al-Späne einwerfen. Vorsicht: Reaktion startet mit Verzögerung! B: 1. Aluminium reagiert heftig unter Flammenerscheinung. 2. Es entsteht ein weißes, pulveriges Produkt. 3. Das Produkt reagiert mit Wasser unter Zischen. Ergebnis: 2 Al Al-Atome Element + 3 Br2 Br-Moleküle Element ----> 2 AlBr3 Aluminiumbromid Verbindung dH<0 A: Reaktionstyp? Betrachten wir die Bindungselektronen genauer: Tafelskizze / Folie: Kugelwolkenmodell AlBr3 Br ist der größere "Geizkragen" und wird die Bindungselektronen mehr zu sich herziehen. Bei einer ENDifferenz von 2-2.5 ist die Polarisierung noch vollkommen, d.h. es entstehen Ionen: AlBr3 ------> Al3+ Aluminiumkation Verhältnisformel + 3 BrBromidanion Ionenschreibweise Ab einem dEN von ca. 1.8 entsteht eine Ionenbindung. Das elektronegativere Atom beansprucht das ganze Bindungselektronenpaar für sich: es entstehen Anionen und Kationen. Die Ionenbindung kann folgerichtig nicht mit Valenzstrichformeln dargestellt werden. Zulässig ist lediglich die Verhältnisformel oder die Ionenschreibweise. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 39 3.11.2 Die Größe von Atomen und Ionen Demonstration Kristalle 1: Alaun-Kristalle Ziel: Antwort auf die Frage: Woher "wissen" Ionen, wie sie sich anordnen müssen, um ein so regelmäßiges Kristallgitter zu bilden? Bevor man voraussagen kann, wie sich "Ionenkügelchen" im festen Aggregatzustand gruppieren werden (also welche Kristallform sie bilden), muss man ihre Größe kennen: sind sie alle gleichgroß, haben wir ein Erklärungsproblem; sind sie unterschiedlich groß, könnte das ein Erklärungsansatz sein. Demonstration: Kugel-Stäbchen-Modell des Kochsalzes Dazu ist es als erstes nötig, die Vorstellung von den Atomen und Ionen zu überprüfen: 1. Atome sind "Kügelchen" bestehend aus einem Kern und einer Schale mit unterschiedlichen Energieniveaus. 2. Ionen sind "geladene Kügelchen", mit zu wenig (Kationen) oder zu viel Elektronen (Anionen). A: Wovon hängt die Größe eines Atoms ab? Kern oder Schale? A: Wo ist das kleinste, wo das größte bekannte Atom im PSE zu finden? Folie: Periodensystem, Teil Atomradien. Die Größe von Atomen hängt im Wesentlichen von der Anzahl der Elektronenschalen ab. Sie wird als Radius mit der Einheit 1 pm = 10-12 m angegeben. Hinweis 1: 1 pm = 10-12m Hinweis 2: rH = 30 pm Würde man 1mm und ein H-Atom um den gleichen Faktor vergrößern, so dass das H-Atom 3 mm groß würde, so würde der mm 2.5mal um den Äquator reichen (100.000 km). Mit 30pm ist das H-Atom um den Faktor 10.000 zu klein, als dass es mit dem besten Elektronenmikroskop gesehen werden könnte. A: Gibt es eine Gesetzmäßigkeit, der die Größe der Atome folgt? http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 40 Der Atomradius nimmt: innerhalb der Perioden von links nach rechts ab, da die steigende Kernladung die Schalen immer stärker zu sich heranzieht; in den Gruppen von oben nach unten zu, da die Zahl der Elektronenschalen zunimmt. A: Treffen Sie Voraussagen, ausgehend von den Atomradien: wie verhalten sich die entsprechenden Ionenradien? Folie: Periodensystem, Teil Ionenradien Metalle geben Elektronen ab und bilden Kationen. Je höher ihre Ladung ist, umso kleiner ist ihr Radius. Grund: die erhöhte Kernladung zieht die Elektronenschalen stärker an es fehlen die Elektronen der letzten Schale. Innerhalb einer Gruppe nimmt der Kationenradius von oben nach unten zu (es gibt mehr Schalen). Nichtmetalle nehmen Elektronen auf und bilden Anionen. Je höher ihre Ladung ist, umso größer ist ihr Radius. Grund: die verminderte Kernladung vermag die Elektronenschalen nicht so stark anzuziehen die letzte Schale ist mit Elektronen aufgefüllt. Innerhalb einer Gruppe nimmt auch der Anionenradius von oben nach unten zu (es gibt mehr Schalen). Hinweis: je höher die Ladung eines Ions wird, umso instabiler ist es, d.h. um so seltener tritt es auf. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 41 3.11.3 Ionengitter Folie: Schneeflocken Zurück zur Frage: woher "weiß" der Kristall, was er tun muss, um so regelmäßig zu wachsen? V2: M: D1: B1: I1: D2: B2: Der Kristallisiervorgang Ferrero Rocher + Dose halb so kleine Kugeln Dosendeckel OHP Nur große Kugeln in den Dosendeckel geben. Kugeln ordnen sich von selbst in regelmäßigen Mustern an. Treibende Kraft ist dabei die elektrostatische Anziehung und die (angenommene) Kugelform der Ionen. Kleine Kugeln dazugeben (Lücken). Die kleinen Kationen sitzen in den Lücken zwischen den großen Anionen. Hinweis: Wird ohne Deckel auf der OHP-Fläche operiert, muss im Modell ein Rahmen verwendet werden, weil zwischen den Kugeln keine Anziehung besteht wie zwischen Anionen und Kationen. Die elektrostatische Anziehung der Ionen wirkt in alle Raumrichtungen. Deshalb entstehen nicht nur Ketten oder Schichten sondern dreidimensionale Strukturen: Kristalle. Die Entfernung der Schichten wird von einem Kompromiss bestimmt: gegenseitigen Abstoßung der großen Anionen auf Grund gleicher Ladung (trotz Ausgleich durch Kationen) und dem Bestreben, eine möglichst dichte Packung der Ionen zu erreichen. Die regelmäßige Anordnung von Ionen in Kristallen nennt man Ionengitter. Alle Salze bilden in festem Zustand Ionengitter aus. Durch die elektrostatische Anziehung entstehen "Riesenmoleküle": Kristalle mit unzähligen (aber bestimmbaren Anzahlen) Anionen und Kationen. Demonstration: Kochsalz-Gittermodell; jedes Ion ist von 6 entgegengesetzt geladenen Ionen umgeben. A: Welches Kation gehört zu welchem Anion? Nicht feststellbar. Deshalb: Im Ionengitter (und in Ionenschmelzen) gibt es keine Moleküle. Die Formel (z.B. NaCl) gibt bei Ionenverbindungen das Zahlenverhältnis von Kationen zu Anionen an und heißt deshalb Verhältnisformel. Hinweis: Bei Molekülen ist jederzeit feststellbar, welche Atome zusammengehören: NH3, O2, SO2, SO42-. Demonstration Kristalle 2: selbst gezüchtete Kristalle (Kupfersulfat, Chimären, Kochsalz). Exkurs: Vorgang des Wachstums bei unbelebter Materie Nicht alle Kristalle bestehen aus Ionen. A: Wovon hängt die Bindungsstärke ab? Die Bindungsstärke hängt im Wesentlichen von der Ladung der Ionen im Gitter ab: je höher die Ladungen umso größer ist sie. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 42 Zusammenfassung: Eigenschaften von Ionengittern sind: Der Zusammenhalt der Teilchen (Ionen) geschieht über elektrostatische Anziehung. Das Verhältnis von Anionen zu Kationen ist eine Konstante und hängt von ihrer Wertigkeit ab; die Wertigkeit von Ionen entspricht genau ihrer Ladung. Ionengitter sind nach außen hin neutral. Formeln für Ionenverbindungen geben das Verhältnis von Anionen und Kationen wider (Verhältnisformel, Bruttoformel). Sie sind spröde. Sie lösen sich gut in Wasser. Eine Erklärung der beiden letzten Eigenschaften folgt im Verlauf der nächsten Einheiten. 3.12 Der Lösungsvorgang in Wasser Ziel: Wenn die Kräfte zwischen Ionen so stark sind, wieso kann Wasser sie offenbar aufbrechen? Dazu zunächst eine Beschreibung Material V 1-3 3.12.1 Beschreibung V1: Lösen eines Salzes M: NH4NO3 2 RG Gummiring D: 1 RG voll Salz nach und nach in 1/4 RG Wasser lösen. Gummiringmarkierung: ursprünglicher Flüssigkeitsstand. Abschätzung des Gewichtes? B: 1. Die Kristallstruktur verschwindet: es entsteht eine klare Lösung. 2. Die Masse bleibt erhalten. 3. Das Volumen der Flüssigkeit nimmt zu. 4. Die Lösung kühlt ab. I: Erklärung? Energie "geht verloren", wird benötigt, um Gitterenergie aufzubringen! A: In welcher Form, wenn nicht als Gitter, findet man Salze in Lösung? Hypothesen? Vorsicht: es gibt keine Moleküle! Löse(ungs)mittel sind meist flüssige Stoffe, die in großem Überschuss vorhanden sind (z.B. Wasser). Lösestoffe sind meistens feste Stoffe, die im Lösungsmittel aufgelöst werden sollen. Tafelskizze / Folie: Der Lösungsvorgang http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 43 Ionenverbindungen liegen in wässriger Lösung in Form von Ionen vor. Diese sind von Lösungsmittelteilchen (Solvensteilchen) umgeben und heißen deshalb solvatisierte Ionen. A: Wie könnte man den freien Charakter der Ionen beweisen? W: Ionenlösungen leiten den elektrischen Strom. Ionen sind in Lösung frei beweglich. Deshalb leiten Lösungen den elektrischen Strom. Man bezeichnet sie als Leiter 2. Klasse. (Bei Leitern erster Klasse = Metalle werden Elektronen, nicht Ionen, bewegt). 3.12.2 Die Energiebilanz eines Lösungsvorganges Wir haben noch nicht erklärt, warum sich die Lösung abkühlt. Wann wird sich ein fester Stoff in einem flüssigen lösen? wenn der Gesamtvorgang exotherm ist (!?) wenn im Lösungsmittel eine bestimmte Konzentration des Stoffes noch nicht erreicht ist. Beispiel: NaCl dHB = 770 kJ/mol H2O dHW = 20 kJ/mol Na+ dHH = -400 kJ/mol CldHH = -380 kJ/mol dHL = 10 kJ/mol (schwache Abkühlung) dHL = Lösungsenthalpie Stoffe, bei denen dHL nur wenig größer ist als 0, lösen sich unter Abkühlung des Lösungsmittels. Sie entnehmen die nötige Energie aus der Umgebung. W: NH4NO3 V2: M: D: B: Lösen von KOH(s) in Wasser KOH(s) RG, Stopfen 5 Plätzchen KOH in 2ml Wasser lösen. Das RG erwärmt sich kräftig. Spatel Stoffe, bei denen dHL < 0, lösen sich gut und unter Erwärmung des Lösungsmittels. Beispiel H-Cl H+ H2O Cl- Beispiel AgCl H2O Ag+ Cl- dHB = dHH = dHW = dHH = dHL = dHB = dHW = dHS = dHS = dHL = 433 kJ/mol -1088 kJ/mol 20 kJ/mol -380 kJ/mol -1015 kJ/mol (starke Erwärmung) 877 kJ/mol 20 kJ/mol - 470 kJ/mol - 380 kJ/mol 47 kJ/mol (keine Reaktion) Stoffe, bei denen dHL >> 0, lösen sich praktisch nicht. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 44 3.12.3 Bedeutung (von Lösungen) V3: Reaktion in Lösung M: SbCl3 oder Pb(NO3)2 RG, Stopfen Na2S Wasser D1: SbCl3 (s) und Na2S (s) mischen B1: Keine Reaktion beobachtbar. D2: Wasser zugeben, schütteln B2: Schnelle Reaktion zu einem orangefarbenen bzw. schwarzen Produkt. 2 SbCl3 + 3 Na2S -----> Sb2S3 + 6 NaCl 3.13 Die metallische Bindung Ziel: Klärung der Frage, warum Metalle bei der Atombindung ausgeklammert wurden. Material: Gallium Modell Metallgitter Einstieg: W: Definition für die Atombindung: gilt nur für Nichtmetalle. Zwischen Metallatomen können auch Bindungen mit dEN=0 existieren! Zwischen Metallatomen gleicher Art (dEN=0) bilden sich Metallbindungen aus. Es entstehen Metallgitter. Demonstration: Metallgitter-Modell Tafelskizze / Folie: Atomrümpfe und Elektronengas Metallgitter = Atomrümpfe + "Elektronengas" Atomrumpf = Atomkern + vollbesetzte Elektronenschalen Elektronengas = Valenzelektronen Es gibt keine Metallmoleküle. Metalle lassen sich untereinander meistens gut mischen. Es entstehen Legierungen. Beispiele: Bronze (>70% Kupfer + <30% Zinn) Messing (>60% Kupfer + <40% Zink). Die Elektronen des Elektronengases sind frei beweglich. Deshalb leiten Metalle den elektrischen Strom (Leiter 1. Ordnung). http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 45 W: Leiter 2. Ordnung: Ionenlösungen. Typische Metalleigenschaften: metallischer Glanz elektrische Leitfähigkeit Verformbarkeit hoher Schmelzpunkt. Hinweis: dabei handelt es sich um physikalische Eigenschaften, die Populationen von Teilchen betreffen, d.h. auch erst bei Ansammlungen von einer Mindestanzahl auftreten. Für einzelne Atome lassen sie sich nicht angeben. Tafelskizze / Folie: Vergleich des Metall- und Ionengitters (Sprödigkeit). 3.14 Zusammenfassung Wir unterscheiden die kovalente, polare, ionische und metallische Bindung. Kriterien für die Einordnung sind dEN und sEN. Folie: Chemische Bindungen in Schubladen Folie: Chemische Bindungen http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 46 Folie: Chemische Bindungen einschließlich metallischer Bindung Kovalente und polare Bindung liefern Moleküle und werden mit Molekülformeln beschrieben. Zwischen Molekülen herrschen van-der-Waals- oder Dipol-Kräfte. Ionische und metallische Bindung liefern Gitter und werden mit Verhältnisformeln beschrieben. Zwischen verschieden geladenen Ionen herrscht elektrostatische Anziehung. Metalle werden von delokalisierten Valenzelektronen ("Elektronengas") zusammengehalten. Der Aggregatzustand bei Raumtemperatur hängt von der molaren Masse und den Kräften zwischen den beteiligten Teilchen ab. 3.15 Die Sonderstellung des Kohlenstoffs Ziel: Das Leben basiert auf dem Element Kohlenstoff: aus Kohlenstoffketten bestehen sowohl Pflanzen als auch Tiere. Gibt es dafür eine Erklärung ausgehend von seinem Atombau bzw. chemischen Verhalten? Material: - flüssiges Alkan, - festes Alkan, - Kohlestücken, - Graphit Heute sind etwa 50x mehr Verbindungen des C bekannt als aller anderen Elemente zusammen (100.000). bevorzugt Einfachbindung, auch zu sich selbst: Möglichkeit von Ketten theoretisch unbegrenzter Länge. Kohlenstoff zeit die höchste der häufigen Wertigkeiten (4): Möglichkeit für Verzweigungen. zeigt gleichstarke Tendenz, Elektronen aufzunehmen oder abzugeben: Möglichkeit zur Bildung von Verbindungen mit elektronegativen (rechts im PSE stehend) wie elektropositiven (links im PSE stehend) Elementen. eine der häufigsten Verbindungen, CO2, ist gasförmig und verteilt den C auf der ganzen Erde (für Si würden fast alle obigen Kriterien auch stimmen, aber SiO2 ist polymer, somit fest und liegt folglich in der Lithosphäre fest!) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 47 4 Säuren und Basen Material: V 1-2 4.1 Saure Lösungen Wenn man von Chemie spricht, denkt der Laie in erster Linie an "alles verätzende Säure". Den Säuren als Stoffklasse kommt tatsächlich eine große Bedeutung zu, doch sind sie weit weniger zu fürchten als es der Volksmund vermuten lässt, vor allem dann, wenn man ihr chemisches Verhalten kennt. V1: M: D1: B1: D2: B2: I: Ein Nichtmetalloxid Schwefel Verbrennungslöffel Sauerstoff Brenner/Feuerzeug großer Standzylinder, Abdeckpl. Sauerstoff und etwas Wasser in den Zylinder füllen, etwas S in den Verbrennungslöffel und in den Zylinder einführen. Es passiert nichts. Grund? Aktivierungsenergie: anzünden, dann einführen. Schwefel brennt in Sauerstoff heftig mit blauer Flamme. Es entsteht ein gasförmiges, weißen Nebel bildendes Produkt. Bei dem Produkt handelt es sich um ein Schwefeloxid. Der weiße Nebel ist ein nebenher entstehender Anteil an SO3, was in der Gleichung vernachlässigt wird. S(s) + O2(g) -----> SO2(g) dH<0 ; es entsteht Schwefel(IV)-oxid. Nichtmetalloxide kann man über eine Synthese aus den Elementen herstellen. Hinweis: Schwefel nimmt eine andere Wertigkeit an, als die Berechnung nach der Regel ergeben würde. Periode höher als 2! Bei Elementen aus den Perioden 3-7 sind: Wertigkeiten größer 4 und mehrere Wertigkeiten beim gleichen Element möglich. Wir erschließen diese Wertigkeit aus der der Bindungspartner. V2: M: D: B: I: Nichtmetalloxid und Wasser Lackmuslösung RG Zylinder mit dem Wasser schütteln. Dann etwas Lackmuslösung in das RG und in den Zylinder geben und Vergleich der Farben. Diese Lösung färbt Lackmuslösung nach rot um. Schwefel(IV)-oxid hat mit Wasser reagiert. Das Produkt färbt die Lackmuslösung nach rot um. SO2 + H2O -----> H2SO3 dH<0 ; es entsteht schweflige Säure. Nichtmetalloxide reagieren mit Wasser zu Säuren. Man erkennt sie an der allgemeinen Formel: HnR. wobei: n = Zahl der Säure-Wasserstoffkationen (wird später erklärt) R = Säurerest. und an der typischen Umfärbung von Indikatoren (=Säure-Anzeiger). http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 48 Name Sauerstoffhaltige Säuren: Schweflige Säure Schwefelsäure Salpetersäure Salpetrige Säure Kohlensäure Phosphorsäure Wasser Sauerstoffreie Säuren: Salzsäure H + Rest Name Rest H2 SO3 H2 SO4 H NO3 H NO2 H2 CO3 H3 PO4 H2 O Sulfit Sulfat Nitrat Nitrit Carbonat Phosphat Oxid H Cl Chlorid Hinweis: es gibt eine wichtige sauerstofffreie Säure; man stellt sie aus den Elementen her und löst das Produkt in Wasser: H2(g) + Cl2(g) -----> 2 HCl(g) dH<0 ; es entsteht Wasserstoffchlorid. HCl(g) + aq -----> H+(aq) + Cl-(aq) dH<0 ; es entsteht Salzsäure. Vereinbarung: falls nur "HCl" angegeben wird, verstehen wir unter dieser Schreibweise die Salzsäure, d.h. die Lösung von HCl(g) in Wasser. Den Reinstoff HCl(g) kennzeichnen wir durch den Zusatz (g)! Zusammenfassung: Säuren: schmecken sauer, färben Indikatoren in charakteristischer Weise um, bestehen aus Säurewasserstoff und einem Säurerest (Nichtmetall). Sauerstoffhaltige Säuren entstehen aus Nichtmetalloxiden und Wasser. z.B.: CO2(g) + H2O(l) -----> H2CO3 dH<0 Kohlensäure ihre Zerlegung liefert wieder Wasser und Nichtmetalloxide: H2CO3 --------> H2O(l) + CO2(g) dH>0 http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 49 Tafelskizze / Folien: Struktur von Säuren und ihren Resten Das Phänomen, dass eine Ladung in einem Molekül über mehr als ein Atom verteilt sein kann, bezeichnet man als Mesomerie (besser: Resonanz). Bei der Darstellung der Resonanz in Strukturformeln haben wir gewisse Schwierigkeiten, die nicht auf Tatsachen sondern allein auf der Schreibweise beruhen. Daraus hilft man sich mit der Formulierung der beiden Extreme, der Grenzstrukturen, die es aber in Realität nicht gibt: in Wirklichkeit liegt die Struktur genau dazwischen. Hinweis: Das Phänomen kann erst mit der Orbitaltheorie der chemischen Bindung erklärt werden. 4.2 Basische Lösungen Material: V 1-2 NaOH(s) A: Was passiert bei der Reaktion eines Metalls mit Sauerstoff? Warum die Unterscheidung: Nichtmetalloxid und Metalloxid? V1: M: Verbrennung von Natrium an der Luft Natrium großer Standzylinder D: Sauerstoff in den Zylinder füllen etwas Na in den Verbrennungslöffel, in der BB-Flamme anzünden; in den Zylinder einführen Natrium brennt in Sauerstoff heftig mit gelber Flamme. Es entsteht ein festes, farbloses, pulverig verteiltes Produkt. 4 Na(s) + O2(g) -----> 2 Na2O(g) dH<0 Natriumoxid Auflösen des Produktes in Wasser dest. Wasser Lackmuslösung etwas Wasser in den Zylinder einspritzen; schütteln Lackmuslösung zugeben; Farbe? Natriumoxid löst sich in Wasser auf. Die Lackmuslösung färbt sich nach blau um. Metalloxide reagieren mit Wasser anders als Nichtmetalloxide. Na2O(s) + H2O(l) -----> "Na2H2O2" = 2 NaOH(s) dH<0 Natriumhydroxid E: R: V2: M: D: B: I: R: http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ Verbrennungslöffel Abdeckplatte Bunsenbrenner/Feuerzeug 50 Hinweis: Die Zugabe eines Überschusses von Wasser löste das entstandene NaOH(s). Erst in Lösung zeigt der Stoff seine basischen Eigenschaften: NaOH(s) + aq -----> Na+(aq) + OH-(aq) dH<0 Natronlauge Hinweis: OH- als Molekülanion. Demonstration: NaOH(s) Eine Lösung von Hydroxiden in Wasser heißt Lauge. Metalloxide reagieren also mit viel Wasser zu Laugen. Man erkennt sie i.d.R an der allgemeinen Summenformel: M(OH)n wobei: M = Metallkation, OH = Hydroxid-Anion, n = Zahl der im Molekül enthaltenen Hydroxidanionen = Wertigkeit des Metalls M. Übereinkunft: unter der Verhältnisformel "NaOH" verstehen wir die "Natronlauge", also eine Lösung von NaOH(s) in Wasser. Soll in bestimmten Fällen das feste NaOH gemeint sein, so steht dahinter die Ergänzung (s)! Name des Hydroxids/Gases Hydroxid-Basen: Natriumhydroxid Kaliumhydroxid Calciumhydroxid Nichthydroxid-Basen: Ammoniak M + Rest Name d. Lösung Na OH K OH Ca (OH)2 Natronlauge Kalilauge Kalkwasser NH3 Ammoniakwasser W: Woran erkennt man Basen? Metall + Hydroxid-Gruppe. N2(g) + 3 H2(g) -----> 2 NH3(g) dH<0 Ammoniak(gas) NH3(g) + n H2O -----> "NH4OH"(aq) dH<0 Ammoniumhydroxid / Ammoniumwasser Hinweis: Ammoniumhydroxid in dieser Form gibt es nicht. Erklärung im Kapitel "Reaktionen"! Übereinkunft: unter der Molekülformel "NH3" verstehen wir das "Ammoniakwasser", also eine Lösung von Ammoniak in Wasser NH3(aq). Soll in bestimmten Fällen der Reinstoff Ammoniak NH3(g) gemeint sein, so steht dahinter die Ergänzung (g)! Zusammenfassung: Basen schmecken seifig, fühlen sich schmierig an, färben Indikatoren in charakteristischer Weise um (Lackmus von violett nach blau), führen in Wasser zu Hydroxid-Anionen, können i.d.R aus Metalloxiden und Wasser hergestellt werden. Lauge ist eine alte Bezeichnung und ein Sonderfall von Basen. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 51 4.3 Säure-Base-Konzepte Ziel: Überblick Von Säuren spricht man schon seit dem 12. Jh.: damals erkannte man sie am Geschmack. Glücklicherweise kannte man damals nur saure Pflanzensäfte. Im 16. Jh. definierte man Säuren als „Stoffe, die mit Kreide aufbrausen“ und Basen solche als Stoffe, die Säuren neutralisieren. 4.3.1 Das Arrhenius-Konzept Die erste Theorie zur Natur von Säuren und Basen stellte ARRHENIUS 1883 auf. Er nahm an, dass in Lösung Ionen vorliegen, ohne das dazu eine elektrische Spannung angelegt werden muss. Säuren sind Wasserstoffverbindungen, die in Wasser Protonen (H+) abgeben können: HCl ----> H+ + ClBasen sind Hydroxyverbindungen, die beim Auflösen in Wasser Hydroxid-Anionen (OH-) freisetzen: NaOH ----> Na+ + OHDie eigentliche Reaktion bei einer Neutralisation ist dann die zwischen H+ und OH-. Leistungen: bringt die Stoffklasse der Säuren mit der der Basen in Verbindung Verstehen der Stärke von Säuren und Basen (Gleichgewichtskonstante der Dissoziation) Mängel: Beschränkung auf das Lösungsmittel Wasser Beschränkung der Basen auf Hydroxy-Verbindungen. 4.3.2 Das Brönstedt (Lowry)-Konzept In den 20er Jahren wirkte Brönstedt als Professor für PC in Kopenhagen. Sein Konzept, veröffentlicht 1923, besagt: Säuren sind Verbindungen, die Protonen abgeben können (Protonendonatoren): AH ----> A- + H+ Basen sind Verbindungen, die Protonen aufnehmen können (Protonenakzeptoren): B + H+ ----> BH+ Die Reaktionen oben können als Reaktion und Rückreaktion verstanden werden. Leistungen: ist nicht auf wässrige Systeme beschränkt Basen sind notwendig, damit Säuren überhaupt ihr Proton abgeben können; man spricht vom korrespondierenden Säure/Base-Paar, in dem die Säure mit ihrer korrespondierenden Base um das Proton konkurrieren: BH + H2O ----> H3O+ + BBH = Säure, B- = Base, zusammen: korrespondierendes Paar Rolle von H2O? erklärt, warum man in Säuren keine freien H+ findet: http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 52 HCl + H2O ----> H3O+ + ClOxonium- oder Hydroniumkationen sind zwar nochmals von 3 weiteren Wassermolekülen umgeben; diese werden aber nicht geschrieben. Mängel: nur auf wasserstoffhaltigen Verbindungen anzuwenden. 4.3.3 Die Erweiterung durch Lewis 1923, im gleichen Jahr also, erweiterte Lewis, Professor für PC in Berkley, das S/B-Konzept von Brönstedt auf Nichtwasserstoff-Verbindungen: Säuren sind Elektronenpaarakzeptoren, Basen Elektronenpaardonatoren. Eine Säure-Base-Reaktion führt demnach zur Entstehung einer Atombindung. Leistungen: erklärt viele Reaktionen und Teilchen neu (besonders Komplexchemie). Nachteile: Viele Brönstedt-Säuren sind keine Lewis-Säuren (H2SO4). Die Stärke hängt nicht mehr von der Art des Stoffes ab, sondern von der Reaktion. Nicht Stoffe sind S/B, sondern Teile davon In der Schulchemie beschränkt man sich in der Regel auf den Brönstedt-Begriff; der Lewis-Begriff wird ggf. in der höheren Chemie parallel verwendet. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 53 4.4 Indikatoren Einstieg: Weitere, "buntere" Beispiele für Indikatoren, denn es ist auf die Dauer gesundheitsschädlich, konzentrierte Säuren über den Geschmack zu testen. Material: V1: M: D: V1 Indikatorfarben verd. HCl verd. NaOH 18 große RG 3 RG-Gestelle Universalindikator Farben demonstrieren; Tabelle anlegen Indikator * Phenolphthalein * Bromthymolblau * Lackmus Methylorange Rote Bete Blaukraut Universalindikator Phenolphthalein Bromthymolblau Lackmus Methylorange Rote Beete/Blaukraut sauer farblos gelb (rot) rot rot rot rot rot neutral farblos grün violett rot violett violett grün basisch rot blau blau gelb blau grün (stark basisch) blau * diese Indikatoren mit ihren typischen Farben sind Grundwissen! Indikatoren zeigen den sauren oder basischen Charakter eines Stoffes durch eine charakteristische Farbe an. Hinweis: Der Universalindikator ist ein Gemisch aus mehreren verträglichen Indikatoren mit unterschiedlichen Umschlagbereichen. Man kann deshalb nicht nur erkennen, ob es sich um eine Säure oder Base handelt, sondern man kann auch die Konzentration abschätzen. Demonstration: Farbskala für Universalindikatoren Grundprinzip: Säure-Base-Reaktion In- + H3O+ Farbe 1 -----> InH + H2O Farbe 2 4.5 Typische Reaktionen von Säuren und Basen Material: V1-2 4.5.1 Die Reaktion von Säuren mit Wasser H2SO4 + H2O ----> HSO4Hydrogensulfat-Anion http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ + H3O+ Oxonium-Kation dH<0 54 Grund für die "Beweglichkeit" des Protons: stark elektronegative Nachbarn, deshalb schwache Bindung. Bei starken Säuren wie der Schwefelsäure wird auch das zweite Proton an Wasser abgegeben: HSO4- + H2O SO42SulfatAnion -----> + H3O+ OxoniumKation dH<0 4.5.2 Die Reaktion von Basen mit Wasser NH3(g) + H2O(l) -----> "NH4OH" "NH4OH" + aq NH4+(aq) AmmoniumKation -----> + OH-(aq) HydroxidAnion Hinweis: Bei Hydroxid-Basen ist nur das Hydroxid-Anion die Base: OH- + HCl -----> H2O + Cl- 4.5.3 Reaktion von Säuren mit Basen V1: Beweis, dass ein Chemielehrer säure- und basenfest ist. M: NaOH 0.1n HCl 0.1n 2 Pipetten 10ml Becherglas 50ml Indikatorpapier D: Mit den Pipetten je 10ml NaOH und HCl ins Becherglas einlaufen lassen. Trinken. Danach mit Indikator prüfen. E: Hinweis: Versuch NICHT nachmachen! Ist nur für den persönlichen Gebrauch bestimmt. Die Reaktion gleicher Mengen einer Base mit einer Säure ergibt eine neutrale Lösung. Hinweis: Bei Verwendung konzentrierterer Säuren und Basen würde eine Temperaturerhöhung fühlbar sein. HCl + NaOH -----> Säure + Base -----> NaCl + H2O dH<0 Salz + Wasser Diese Reaktion nennt man Neutralisationsreaktion. 4.5.4 Die Rolle von Wasser OH- + H2O -----> H2O + OH- Wasser hat ein Proton abgegeben und ist deshalb eine Brönstedt-Säure. HCl + H2O -----> H3O+ + OH- Wasser hat ein Proton aufgenommen und ist deshalb eine Brönstedt-Base. Wasser ist ein Ampholyt: es kann, je nach Partner, als Säure oder Base reagieren. (amphi=gr."beides") H2O + H2O -----> H3O+ + OHhttp://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 55 Wasser zeigt das Phänomen der Autoprotolyse. Hinweis: Von 600 Mio. Wassermolekülen ist nur eines dissoziiert! Wegen der großen Zahl von Molekülen je ml bedeutet das immer noch ca. 10 Trillionen H3O+-Ionen je ml! 4.5.5 Die Reaktion von Säuren mit Metallen V2: Beweis, dass ein Chemielehrer säure- und basenfest ist. M: Mg-Band HCl ca. 0.1n RG, Ständer D: In etwas verd. HCl ein Stück Mg-Band stellen. E: Die Reaktion liefert ein Gas und lässt Mg verschwinden. H: "löst sich auf"! Mg(s) + 2HCl(aq) Metall + Säure -----> -----> MgCl2(aq) + H2(g) dH<0 Salz + Wasserstoff Salze bestehen immer aus einem Metall und einem Säurerest. 4.6 Die Zahl der Oxonium-Ionen Material: V1 4.6.1 Die Stärke von Säuren 600.000.000.000.000 H2O -----> H3O+ + OH- + 599.999.999.999.998 H2O Vergleich 1: Salzsäure mit "genügend" Wasser; Modell (Vereinfachung der Zahlen): 100 H2O + 10 HCl -----> 10 H3O+ + 90 H2O + 10 Cl- Vergleich 2: Salzsäure mit wenig Wasser 10 H2O + 100 HCl V1: M: D: E: I: -----> 10 H3O+ + 90 HCl + 10 Cl- pH-Wert konzentrierter Essigsäure Eisessig, ev. getrocknet Universalindikatorpapier Wasser 1. Sehr schnell pH des Eisessigs prüfen, ablesen. 2. Wasser zugeben, erneut prüfen. Vergleich. 1. pH = 6-7 2. pH = 4 Erst steht kein Wasser für die Protolyse zur Verfügung. In beiden Fällen, ob wenig Säure in Wasser ist (verdünnt) oder ob eine konzentrierte Säure vorliegt: die Zahl der Oxoniumionen ist gleich. A: Sind die Lösungen deshalb gleich "gefährlich" z.B. für die Haut? http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 56 Die Zahl der Oxoniumionen, die in einer Lösung vorliegen, sagen nichts über die Stärke einer Säure aus. Die Säurestärke ist eine Eigenschaft jeder Säure an sich: sie kann nur beurteilt werden, wenn genügend Wasser (Überschuss) vorliegt. Erst mit einem Wasserüberschuss kann man erkennen, wie viele Oxoniumionen wirklich gebildet werden können, "wenn man die Säure lässt". Als Maß für die Säurestärke gilt deshalb das Verhältnis zwischen dissoziiertem und undissoziiertem Anteil der Säure in u.a. Form. Dieser Wert ist kennzeichnend für die Säure, also eine Stoffkonstante: HA + H2O -----> H3O+ + A- k= c(H3O+)*c(A-) ------------------c(HA) Exkurs: Beispiel Wasser: 600.000.000.000.000 H2O 1*1 k = -----------------------------599.999.999.999.998 -----> H3O+ + OH- + 599.999.999.999.998 H2O = 0.0000000000000016 = 1.6*10-15 Bei starken Säuren können entsprechend sehr hohe Zahlen vorkommen. Das ist unpraktisch. Deshalb vereinfacht man: man gibt nur die Anzahl der Stellen der Zahl an und um einen "schönen", positiven Wert zu erhalten, weil man es meistens mit stärkeren Säuren als Wasser zu tun hat, invertiert man das Ergebnis. Man erhält den sogenannten pK: pK = -log k (Hinweis: p von lat. "potentia") Beispiel Wasser: pK = -log 1.6*10-15 ~ 15 An hohen pK-Werten erkennt schwache, an negativen sehr starke Säuren. Dabei kann man Basen als extrem schwache Säuren auffassen. Beispiele für Werte: Name der Säure Perchlorsäure Chlorwasserstoff(!) Schwefelsäure Salpetersäure Chlorsäure HydrogensulfatAnion Schweflige Säure Phosphorsäure Fluorwasserstoff Essigsäure Kohlensäure Ammonium-Ion Wasser Hydroxid-Anion H+Rest H ClO4 H Cl Base ClO4Cl- pKS1 -9 -6 H2 SO4 H NO3 H ClO3 H SO4- HSO4NO3ClO3SO42- -3 -1.3 0 2 H2 SO3 H3 PO4 HF H OOC-CH3 H2 CO3 H+NH3 H2 O H O- HSO3H2PO4FH3C-COOHCO3NH3 OHO2- 2 2 3 4.7 6.5 9.2 15.7 24 http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 57 Faustregel nach Pauling: aus der Form XOm(OH)n m=0 sehr schwach m=1 schwach m=2-3 stark pKS1 : pKS2 : pKS3 = 1 : 10-5 : 10-10 4.6.2 Die aktuelle Konzentration In der Praxis ist allerdings der vorliegende Anteil Säure wichtiger, da in der Regel genügend Wasser vorliegt und die Säuren stark verdünnt sind. Aus den gleichen Gründen wie beim pK verwendet man auch hier lieber die Exponenten: pH = -log c(H3O+) Beispiel: 100 H2O + 10 HCl -----> 10 H3O+ + 90 H2O + 10 Cl- 100 H2O + 20 HCl -----> 20 H3O+ + 80 H2O + 20 Cl- c(H3O+) einer verdünnten Salzsäure sei 10-5 mol/l. Dann ist: pH = -log 10-5 = -(-5) = 5 In Wasser sind nur Oxoniumkonzentrationen zwischen pH=0 und 14 möglich: pH=0 bedeutet, dass alle Wassermoleküle als Oxoniumionen vorliegen pH=14 bedeutet, dass alle Wassermoleküle als Hydroxidionen vorliegen. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 58 5 Reaktionen Material: V1 5.1 Grundformen 5.1.1 Synthese Material: Metallschale Feuerzeug Wasserstoffflasche Sauerstoffflasche Chemikalien: Beispiel: 2 H2 + O2 -----> Glimmspan Waschmittel Wasser 2 H2O + E Die Eigenschaften des Produktes unterscheiden sich stark von denen des Eduktes. Beispiel Kochpunkt Kp (aus PSE ablesen): 2 H2 Sdp.: -253°C + O2 -183°C -----> 2 H2O + E +100°C Der Reaktionstyp, bei dem aus Elementen eine Verbindung entsteht, heißt Synthese. Reaktionen, bei denen Energie frei wird, sind exotherm. (von "exos" = draußen). Den Energieinhalt einer Verbindung nennt man Enthalpie H. Tafelskizze: Energieprofil einer exothermen Reaktion HProdukte - HEdukte < 0 dH<0 Bei exothermen Reaktionen ist die Differenz der Reaktionsenthalpien dH kleiner als Null: die Produkte sind energieärmer als die Edukte. Hinweis: Bemerkenswert am Energieprofil ist der "Energieberg" vor dem "Hang". Erklärung aus der Beobachtung der Reaktion? Zündung war nötig, d.h. man muss zunächst wenig Energie zuführen, bis die Reaktion in Gang kommt. Die Energie, die nötig ist, um eine an sich exotherme Reaktion zu starten, nennt man Aktivierungsenthalpie EA. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 59 5.1.2 Analyse W: Nachweismöglichkeiten? 2 H2O + E -----> 2 H2 + O2 Den Reaktionstyp, bei dem eine Verbindung in die Elemente zerlegt wird, nennt man Analyse. Reaktionen, bei denen Energie aufgewendet werden muss, sind endotherm. Tafelskizze: Energieprofil einer endothermen Reaktion Die Produkte einer endothermen Reaktion sind energiereicher als die Edukte, die Reaktionsenthalpie ist größer als Null: dH>0. 5.1.3 Umsetzung Typ: AB + C -----> AC + B W: Reaktion von Alkalimetallen mit Wasser 2 Na + 2 H2O -----> 2 NaOH + H2 Element Verbindung Verbindung Element HProdukte - HEdukte > 0 dH>0 Eine Reaktion, bei der sowohl auf der Edukt- als auch auf der Produktseite Verbindungen auftreten nennt man Umsetzung. 5.2 Energiebeteiligung Ziel: Kriterien für Freiwilligkeit von Reaktionen Material: V1 Einstieg: 1. Welche Vorstellung haben Sie vom Energiebegriff? 2. Beantwortung der 1. Frage: Woher stammt die Energie? Thermodynamik ist die Wissenschaft (Teilgebiet der Physik und Chemie), die sich mit Energieumsatz im weitesten Sinn beschäftigt. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 60 5.2.1 Der Energieerhaltungssatz Die Beschäftigung der Physiker des 18. und 19. Jh. erst mit der Wärmelehre, dann mit der Elektrizität, führte zu einigen allgemeinen Erkenntnissen über die Energie, die im Energieerhaltungssatz zusammengefasst sind: Energieerhaltungssatz: Energie geht weder verloren noch kann sie aus dem Nichts entstehen. Energie besitzt verschiedene Erscheinungsformen, die alle ineinander überführt werden können. Demonstration: potentielle Energie: Kreide hochheben kinetische Energie: auf den Kopf fallen lassen. (z.B. Licht, Wärme, Bewegung = kinetisch, Lage = potentiell, chemisch...) Energie ist die Fähigkeit, Arbeit zu leisten. Wärme"abfall" ist unvermeidbar. Deshalb gibt es kein "perpetuum mobile". Meistens hat man es auf die Arbeit W abgesehen. Sie ist nie zu 100% aus einer anderen Energieform erhaltbar: es stellt sich immer ein Verlust in Form von Wärme ein. 5.2.2 Die Enthalpie H Die Enthalpie H bezeichnet den Wärmeinhalt eines Systems, dH die Änderung dieses Wärmeinhalts. Bisher galt der Grundsatz: eine Reaktion verläuft dann freiwillig, wenn sie exotherm ist, also dH < 0. 5.2.3 Die Entropie S V1: Eine freiwillig verlaufende endotherme Reaktion M: NH4SCN (s) RG Ba(OH)2 (s) Spatel D: 2g Ba(OH)2 (s) im RG mit 1g NH4SCN (s) mischen. Beobachtung? B: Die beiden Feststoffe zerfließen (innerhalb von 10 Min.). Man stellt Ammoniakgeruch fest. Das Reaktionsgefäß kühlt ab. Interpretation: Ba(OH)2(s) + 2NH4SCN(s) -----> 2NH3(g) + 2H2O(l) + Ba(SCN)2(s) dH > 0 A: Warum läuft die Reaktion freiwillig ab, obwohl sie endotherm ist? Bisher wurde aus Gründen der Vereinfachung ein Kriterium für die Freiwilligkeit von Reaktionen vernachlässigt. Ein System strebt immer nach maximaler Unordnung. Der Grad der Unordnung wird als Entropie S bezeichnet. Welches ist die Unordnung bei der Reaktion? http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 61 aus 3 Teilchen (Edukte) werden 5 Teilchen (Produkte) aus dem geordneten Aggregatzustand 3x"s" werden die ungeordneteren 2x"g" und 2x"l" (und 1x"s") Beispiele: Illustrationen aus dem Alltag: Zimmer eines Studenten, Die Entropie nimmt von sich aus immer zu, d.h. der Grad der Unordnung steigt freiwillig. Will man das System, sprich Zimmer, wieder ordnen, muss (erhebliche) Energie aufgewendet werden. (Einschub: 0. Hauptsatz der Thermodynamik: Wärme bzw. Energie kann immer nur von einem Ort mit viel (Energie)Gehalt (also warm) zu einem Ort mit wenig Gehalt (also kalt) fließen, nie umgekehrt. Beispiel: Im Fall des Studenten bedeutet das: er muss zwangsläufig warten, bis seine innere Energie die des äußeren Systems übersteigt, bevor es überhaupt einen Sinn hat, dass er sich zum Ordnung machen aufrafft.) 5.2.4 Die freie Enthalpie G Für die Freiwilligkeit von Reaktionen muss man jetzt eine schärfere Formulierung treffen: dH ist immer noch Kriterium, aber nicht allein; wirkt antreibend, wenn dH < 0 dS wirkt mit antreibend antreibend, wenn dS > 0 Daneben besteht noch eine Temperaturabhängigkeit. Damit die neu entstehende Größe mit dH vergleichbar bleibt, erhält der Faktor T*dS ein negatives Vorzeichen: dG = dH - T * dS Diese Gleichung heißt Gibbs-Gleichung. Die Temperatur wird in K angegeben. Die freie Enthalpie G bezeichnet die aus einer Reaktion maximal zur Arbeitsleistung verfügbare Energie. dG < 0 bedeutet: Reaktion läuft freiwillig ab = exergonisch. Das System ist in der Lage, Energie freizusetzen. Dieser Fall ist auch dann möglich, wenn dH>0 aber T*dS>dH. dG = 0 bedeutet: das System befindet sich in einem energetischen GG. dG > 0 bedeutet: Reaktion verläuft nicht freiwillig = endergonisch. Das System nimmt freie Enthalpie aus der Umgebung auf. Hinweis: dS ist in der Regel viel kleiner als dH, kehrt also selten die Verhältnisse um. In der Regel ist nach wie vor eine stark endotherme Reaktion auch endergonisch. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 62 5.3 Redox-Reaktionen Ziel: Es gibt Reaktionen, bei denen man "durch Probieren" sehr schwer ausgleichen kann. Meistens handelt es sich dabei um Redox-Reaktionen. Material: V 1 5.3.1 Oxidation V1: M: Verbrennung von Eisen Balkenwaage, Gewichtesatz Alu-Folie zum unterlegen Stahlwolle Feuerzeug D: Alu-Folie auf die Schale mit der Stahlwolle, dann austarieren. Stahlwolle mit einem Feuerzeug anzünden. B: "Eisen" wird durch das Verbrennen an der Luft schwerer. I: 4 Fe + 3 O2 -----> 2 Fe2O3 dHR<0 Eisen-III-oxid Hinweis: Alte Definition: Reagiert ein Stoff mit Sauerstoff, so nennt man den Reaktionstyp Oxidation. Untersuchen wir, was mit den Metallen genau passiert ist. Dazu schauen wir uns die Elektronenhüllen vor und nach der Reaktion an: Fe -----> Fe3+ + 3eVorher Nachher Element Kation Fe lässt sich in Cl2 genauso verbrennen wie in O2. Bei beiden Reaktionen gibt Fe 3 Elektronen ab: 2Fe + 3 Cl2 -----> 2 FeCl3 dH<0 Eisen(III)-chlorid Moderne Definition: Oxidation bedeutet Elektronenabgabe (unabhängig vom Partner). Stoffe, die bestrebt sind, Elektronen aufzunehmen, nennt man Oxidationsmittel. A: Welche Elemente sind gute Oxidationsmittel? Die mit hoher EN, also Halogene und Sauerstoff. Hinweis: ELOX = ELektrische OXidation (von Aluminium) 5.3.2 Reduktion Untersuchung, was mit den Nichtmetallen passiert ist. Das Salz besteht aus: Fe2O3 -----> 2 Fe3+ + 3 O2Fe(III)-oxid Fe(III)-Kation Oxid-Anion Jedes Sauerstoffatom hat also zwei Elektronen aufgenommen (insgesamt das MOLEKÜL also 4!): O2 + 4 e- -----> 2 O2Moderne Definition: Reduktion bedeutet Elektronenaufnahme. Stoffe, die bestrebt sind, Elektronen abzugeben, nennt man Reduktionsmittel. A: Welche Elemente sind gute Reduktionsmittel? Die mit niedriger EN: Wasserstoff, Alkalimetalle, Erdalkalimetalle, Kohlenstoff. Hinweis: Reduktion von Eisen(III)-oxid mit Kohlenstoff beim Hochofenprozess! 2Fe2O3 + 3C -----> 4Fe + 3CO2 dHR<0 http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 63 5.3.3 Redox-Reaktionen Reduktion und Oxidation sind immer miteinander verknüpft: ein Element gibt nur dann Elektronen ab, wenn es auf ein anderes trifft, das diese Elektronen aufnimmt. Fe Fe3+ +3e*4 Teilgleichung : Oxidation O2 + 4e- 2O2*3 Teilgleichung : Reduktion, in der Schmelze -------------------------------------------------------------------------------------------------------4Fe + 3O2 2 Fe2O3 Summengleichung : Redox Fe Fe3+ +3e*4 Teilgleichung : Oxidation O2 + 2H2O + 4e- 4 OH- *3 Teilgleichung : Reduktion in H2O -------------------------------------------------------------------------------------------------------4Fe + 3O2 + 6H2O 4 Fe3+ + 12OH4Fe + 3O2 + 6H2O 4 Fe(OH)3Summengleichung : Redox (Nach dem Trocknen erhält man das gleiche Ergebnis wie oben). 4Fe(OH)3 2Fe2O3 + 6H2O 5.3.4 Oxidationszahlen Zum Aufstellen von Redoxgleichungen ist es hilfreich, wenn man für jedes Element einer Verbindung die Oxidationsstufe angeben könnte, zumal viele Elemente (ab der 3. Periode: Schwefel, Phosphor...) in unterschiedlichen "Wertigkeiten" (Oxidationsstufen) vorkommen können. Regeln zur Bestimmung von Oxidationszahlen (OZ) Die OZ wird als römische Zahl über dem Elementsymbol notiert. Zu jeder OZ gehört ein Vorzeichen, + oder -; bei positiver OZ kann das Vorzeichen weggelassen werden; die Art des Vorzeichens ergibt sich aus den folgenden Regeln. Die Summe aller OZ in einer Verbindung muss 0 (Null) ergeben. (Hinweis: Indices beachten!) Es gibt keine höheren OZ als +/-8! Ergibt sie sich dennoch, muss ein Fehler in der Berechnung vorliegen. Elemente erhalten immer die OZ = 0 (Null). Bei einatomigen Ionen ist die Ladung (Vorzeichen und Betrag) gleich der OZ. Bei mehratomigen Ionen ergibt sich die OZ aus u.a. Regeln, wobei zum Schluss der Betrag der Ionenladung von der errechneten OZ des Zentralatoms abgezogen werden muss! Vorgehen in der Reihenfolge der Auflistung: 1. 2. 3. 4. 5. 6. 7. Metallatome (einschließlich B und Si) erhalten i.d.R. eine positive OZ. Fluor erhält immer die OZ = -I. Wasserstoff erhält meistens die OZ = +I. Ausnahme: Hydride. Sauerstoff erhält meistens die OZ = -II. Ausnahme: Peroxide. Halogene erhalten meistens die OZ = -I. Ausnahme: Sauerstoff- und Fluor-Verbindungen. Bei Metallen entspricht die OZ der Wertigkeit. Die OZ von allen anderen Atomen werden so berechnet, dass Regel 1.3. erfüllt ist: die Summe aller OZ=0! Hinweis: Atome in höheren Verbindungen (mehrere Atomsorten vorh.): Feststellen der OZ nach den Regeln oben; dabei unbedingt Reihenfolge einhalten! Widersprechen sich zwei Regeln scheinbar, so erhält die vorausgehende den Vorrang! http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 64 Übungen dazu: Bestimmen Sie die Oxidationszahlen aller Teilchen aus folgenden Verbindungen: 1. 2. 3. 4. NH3, NH4+, Cl2, O2-, SO42-, CaO, AlBr3, S2O32-. H2CO3, NaNO3, K2Cr2O7, IO3-, LiH, KMnO4. Al2O3, Mg, H2O, H2SO3, H2S, H3PO3. H2O2, S8, H2SO4, H3PO4, CaHPO4. 5.3.5 Elektrolyse Atome sind in unterschiedlicher Weise bestrebt, Elektronen aufzunehmen oder abzugeben. Treffen zwei Atomsorten aufeinander, die gegensätzliches Bestreben zeigen, so erfolgt eine Elektronenwanderung: eine Redox-Reaktion hat stattgefunden. Problemfrage: Lassen sich Redox-Reaktionen, die von selbst nicht ablaufen, erzwingen? Kann man ein Element, das z.B. von einem anderen vorliegenden keine Elektronen aufnimmt, "zwingen", dies dennoch zu tun? Lösung: An einer künstlichen Stromquelle stehen uns am negativen Pol (Gleichstrom!) viele "überflüssige und tatendurstige" Elektronen zur Verfügung, abhängig von der Höhe der Spannung. Wiederholung: Gleichstrom und -spannung. Folie/Tafelskizze: Elektrodenprozesse Beispiel: Kathode: 2e- + Zn2+ -----> Zn Reduktion Anode: 2I -----> I2 + 2e Oxidation ---------------------------------------------------------------------------Summe: Zn2+ + 2 I- -----> Zn + I2 Redox-Reaktion Den Vorgang des Zerlegens einer Verbindung in die Elemente unter Einwirkung des elektrischen Stroms nennt man Elektrolyse. Sie ist eine erzwungene Redox-Reaktion und eine Sonderform des Reaktionstyps Analyse. Bedeutung: Aufladen von Akkumulatoren Gewinnung von Metallen aus Erzen (z.B. Al, Mg, Alkalimetalle, Si) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 65 5.3.6 Redoxreaktionen aus dem Alltag Ziel: Verknüpfung chemischer Theorie mit dem Alltag Material: V1 Beispiel Verbrennungsvorgang an Papier (alle organischen Stoffe): ausreichend O2 CxHyOz -------------------------> X CO2 + Y/2 H2O(g) vollständige Verbrennung wenig O2 CxHyOz -------------------------> X-? CO + Y/2 H2O + ? C unvollständige Verbrennung VERGIFTUNGSGEFAHR! Hinweis: exakte Stöchiometrien können nicht angegeben werden, da zu viele verschiedene Reaktionen gleichzeitig ablaufen. Deshalb darf auch keine Gleichung formuliert werden. Die korrekte Schreibweise ist das Reaktionsschema (wie oben). Beispiel Sprengstoff: 4C3H5(NO3)3 -----> Glycerintrinitrat, "Nitroglycerin" 12CO2 + 10H2O + 6N2 + O2 Beispiel Hochofenprozess (Darstellung von Eisen aus Erz): 2C (Koks) + (wenig) O2 Fe2O3 + 3CO Fe2O3 + 3C -----> -----> -----> 2CO 2Fe + 3CO2 (T=400-900°C) 2Fe + 3CO Beispiel Rostvorgang: Fe -----> Fe2+ + 2e+ 2H3O + 2e -----> H2 + 2H2O --------------------------------------------------- SÄURE NÖTIG! (Kohlensäure) Fe + 2H3O+ -----> Fe2+ + H2 + 2H2O 4x Fe2+ -----> Fe3+ + e*4 O2 + 4e- + 2H2O -----> 4OH-------------------------------------------------- SAUERSTOFF NÖTIG! 4Fe2+ + O2 + 2H2O -----> 4Fe3+ + 4OH1x 2H2O -----> H3O+ + OH- WASSER NÖTIG! 8x ------------------------------------------------------------4Fe + 8H3O+ + 4Fe2+ + O2 + 18H2O -----> 4Fe2+ + 4Fe(OH)3 + 4H2 + 8H3O+ + 8H2O 4Fe + O2 + 10H2O -----> 4Fe(OH)3 + 4H2 2Fe(OH)3 -----> Fe2O3 * H2O + H2O Rost Beispiel NiCd-Akku (Sekundärzelle): Cd + 2 OH-----> Cd(OH)2 + 2 eNiO2 + 2 H2O + 2 e -----> Ni(OH)2 + 2 OH---------------------------------------------------------- Alkalisches Milieu! Cd + NiO2 + 2H2O -----> Cd(OH)2 + Ni(OH)2 http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 66 Beispiel Photographie: V1: M: D: E: AgBr Modellversuch zur s/w-Photographie AgNO3-Lösung Tiegelzange HCl verd. BB, Feuerzeug Mg-Band 2RG, Gestell Hütchenpipette Alu-Folie In die RG ca. 3ml AgNO3 geben und mit HCl AgCl ausfällen. Ein RG mit Alu-Folie umwickeln, neben dem anderen das Mg-Band abbrennen. AgCl-Lösung wird durch Licht geschwärzt. Vergleiche abgedecktes und nicht abgedecktes RG. h*v -----> 2Ag + Br2 schwarz Bleichen: = Zerstören bestimmter unerwünschter Farbstoffe z.B. mit Hilfe von Oxidationsmitteln: Cr2O72-, MnO4- (Fette) SO2, H2O2 (Wolle, Seide, Leinen, Baumwolle, Zellulose, Haare, Horn, Früchte, Badeschwämme...) Cl2 (Altpapier, Holzschliff) Desinfizieren = Abtöten von Bakterien, Viren, Pilzen und Sporen, z.B. über Oxidation. Cl2 (Schwimmbäder) I2 (auf der Haut) H2O2 und Peressigsäure (Haut). 5.4 Das chemische Gleichgewicht Material: V1-2 5.4.1 Chemische Systeme V1: Reaktion von Marmor mit Salzsäure M: Marmor in Stücken verd. HCl RG mit Stopfen D: Marmor in das RG, dann mit HCl (und ggf. Wasser) bis fast zum Rand füllen, so dass nur noch ein sehr kleiner Gasraum übrig bleibt, wenn der Stopfen aufgesetzt ist. RG verschließen. E: Man beobachtet ein entweichendes Gas und (wenig) Wärmeentwicklung. Bei Verschluss stoppt die Reaktion. CaCO3 + 2 HCl -----> CaCl2 + H2O + CO2 dH<0 Man unterscheidet drei mögliche Zustände von chemischen Systemen: wenn sie Materie und Energie austauschen, bezeichnet man sie als offene Systeme; wenn sie nur Energie austauschen können, nennt man sie geschlossene Systeme; wenn sie weder Materie noch Energie austauschen können, sind sie isoliert oder abgeschlossen. Im offenen System verlaufen viele Reaktionen irreversibel. Zn + H2SO4 -----> ZnSO4 + H2 Wasserstoff entweicht so lange, bis die Schwefelsäure verbraucht ist. Dann stoppt die Reaktion. Würde man die Reaktion in einem geschlossenen, druckfesten Gefäß durchführen und zusätzlich Wasserstoff hineinpumpen, könnte man folgende Reaktion beobachten: http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 67 ZnSO4 + H2 -----> Zn + H2SO4 Das ist genau die Rückreaktion zu obiger Reaktion. In jedem Fall taucht irgendwann die Situation auf, dass die Gasentwicklung oder der Verbrauch aufhört. Dann ist: vR(hin) = vR(rück) Im abgeschlossenen System sind alle chemischen Reaktionen reversibel. Hinweis: Manche Reaktionen sind auch im offenen System merklich reversibel, falls dH nicht allzu groß ist, kein Gas entweicht oder kein NS entsteht. 5.4.2. Das Massenwirkungsgesetz V2: Modellversuch M: 2 Glasrohre verschiedenen 2 Zylinder 50ml Durchmessers Wasser mit Methylenblau angefärbt D: Schüler 1 ist die Hinreaktion, Schüler 2 die Rückreaktion. S1 füllt mit einem Glasrohr aus dem gefüllten Zylinder in den leeren, S2 umgekehrt. S3 protokolliert an der Tafel. E: Nach einer gewissen Zeit stellt sich ein GG (konstanter Wasserspiegel) ein. Beschreibung einer reversiblen Reaktion: t=0 Nur Edukte sind vorhanden. vR(hin) >> 0, vR(rück) = 0 t=1 Die Produktkonzentration steigt, damit die vR(rück). Die Eduktkonzentration sinkt, damit die vR(hin). t --> unendlich: Es stellt sich ein bestimmtes Gleichgewicht zwischen den Edukt- und Produktkonzentrationen ein. vR(hin) = vR(rück), d.h. die Reaktionen kommen nie zum Stillstand! Beim chemischen GG handelt es sich um ein dynamisches GG: im GG-Zustand ist die vR(hin) = vR(rück)! A + B -----> C + D v(hin) = k1 * c(A) * c(B) v(rück) = k2 * c(C) * c(D) GG: Das GG bei chemischen Reaktionen ist ein dynamisches GG. v(hin) = v(rück) k1 * c(A) * c(B) = k2 * c(C) * c(D) k1 c(C) * c(D) --- = ---------------- = K k2 c(A) * c(B) K>1 bedeutet, dass im GG viel von den Produkten vorliegt. K<1 bedeutet, dass im GG viel von den Edukten vorliegt. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 68 Im GG-Zustand ist der Quotient aus den Produktkonzentrationen und den Eduktkonzentrationen konstant. Diesen Zusammenhang nennt man Massenwirkungsgesetz (MWG). Für eine Reaktion mA + nB <===> p(C) + q(D) gilt das MWG wie folgt: c(C)p * c(D)q ------------------- = K c(A)m * c(B)n 5.4.3 Beinflussung der Lage des chemischen GG 5.4.3.1 Der Einfluss üblicher Konzentrationen: c und p 2 CrO42+ 2 H3O+ -----> Cr2O72+ 3 H2O Chromat, gelb Dichromat, orange K= c(Cr2O72-) * c(H2O)3 ---------------------------c(CrO42-)2 * c(H3O+)2 1. Wird die Konzentration eines Stoffes auf der linken Seite erhöht (hier: Zugabe von Säure), so stellt sich das GG neu so ein, dass rechts auch mehr Produkt entsteht (hier: Dichromat, merklich an der orangen Verfärbung). 2. Wird die Konzentration eines Stoffes auf der linken Seite erniedrigt (hier: Zugabe von Base, d.h. Säure wird "vernichtet"), so stellt sich das GG neu so ein, dass links weniger Produkt zu finden ist . Zn + H2SO4 <==> ZnSO4 + H2 Bei Gasen wirkt eine Veränderung des Drucks wie eine Veränderung der Konzentration bei gelösten Stoffen: 1. Wird der Druck in einem System erhöht, so stellt sich das GG so ein, dass die Anzahl der Gasteilchen vermindert wird. 2. Wird der Druck in einem System erniedrigt, so stellt sich das GG so ein, dass sich die Anzahl der Gasteilchen erhöht. 5.4.3.2 Der Einfluss merkwürdiger "Konzentrationen": T und eN2O4 "+ E" <===> 2 NO2 dH>0 farblos braun Distickstofftetraoxid Stickstoffdioxid p(NO2)2 K = ----------------p(N2O4) * "E" 1. Wird die Temperatur in einem System erhöht, so stellt sich das GG so ein, dass Energie verbraucht wird. 2. Wird die Temperatur erniedrigt, so stellt sich das GG so ein, dass Energie freigesetzt wird. Fe3+ + 3 e- -----> Fe c(Fe3+) * "c(e-)3" K = ----------------c(Fe) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 69 Bedeutung: Erhöhung der c(e-) bedeutet: elektrischer Strom fließt. man könnte Eisen durch Anlegen einer Spannung am rosten hindern! Verfahren wird tatsächlich zum Schutz von Schiffsrümpfen, Pipelines und unterirdischen Vorratstanks angewendet. Das Prinzip vom kleinsten Zwang (LeChatelier) sagt aus, dass, wird auf ein chemisches GG ein äußerer Zwang ausgeübt, dieses sich in der Weise verschiebt, dass es dem Zwang ausweicht. 5.4.4 Katalyse 2 H2O2 [MnO2] ---------> 2 H2O + O2 dH<0 Durch Untersuchung der Reaktion stellt man fest, dass nach ihrem Ablauf noch genau soviel MnO2 vorhanden war wie vorher. Braunstein taucht also in der Gleichung nicht auf. A 1: Formulieren Sie das MWG! A 2: Beeinflusst ein Katalysator die Lage des GG zugunsten von Wasser? System ist offen! keine GG-Verschiebung, nur Beschleunigung der Einstellung! A3: Entwerfen Sie ein Experiment, mit dem man nachweisen könnte, dass Katalysatoren die Lage des GG nicht beeinflussen! abgeschlossenes System, Druckmesser, einmal mit, einmal ohne Katalysator; Ergebnis: der gleiche Druck! Katalysatoren haben keinen Einfluss auf die Lage des chemischen GG. Sie beschleunigen lediglich seine Einstellung (erhöhen die vR). Tafelskizze: Energiergieprofil und Energieverteilungsdiagramm für die Katalysa-torwirkung Größen und Einheiten aus der quantitativen Chemie Größe NA Aussage Avogadro-Konstante; = Größe eines in der Chemie üblichen "Gebindes": 6,02*1023 Teilchen (vergl.: Dutzend, Sixpack, 100 Blatt etc.). n(x) molare Stoffmenge; = Zahl der "Gebinde" zu 6.02*1023 Teilchen. 2 Mol = 2*6*1023 Stück. molare Masse; = Masse von 1 Mol des Stoffes Wasser: 6.02*1023 Moleküle wiegen 18g, M(H2O) = 18g/mol Sauerstoff: 6.02*1023 Moleküle wiegen 2*16g, M(O2) = 32g/mol; aber: Sauerstoff: 6.02*1023 Atome wiegen 1*16g, M(O) = 16g/mol Atommasse; = Masse eines Atoms; z.B. von Sauerstoff: mA(O) = 16 u = 2.6*10-23 g. Masse; = Masse eines Stoffes, die man gerade hat; z.B. m(H2O) = 2 g. Stoffmengenkonzentration; = Anzahl der Mol-"Gebinde" je Liter Lösungsmittel (i.d.R.) Wasser: z.B. 2mol NaCl in 1l Wasser ergeben eine Lösung der Konzentration c(NaCl) = 2mol/L. Molvolumen; = Volumen, das ein 1-Mol-Gebinde einnimmt: z.B. für Eisen Vm(Fe) = 0.007 l = 7 cm3 (bei festen und flüssigen Stoffen unbedeutend). Molvolumen unter Normalbedingungen; z.B. Vmn(H2) = 22.43 l/mol. Bei Gasen wichtig! Normalbedingungen: T = 273°K (= 0°C), p = 1013 hPa (Hektopascal) M(x) mA(x) m(x) c(x) Vm(x) Vmn(x) http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ Einheit (Stück) mol g/mol u g mol/l l oder cm3 bei Gasen: 22.4 l/mol 70 Musterlösung zum stöchiometrischen Rechnen Schwierigster Aufgabentyp: Wieviel Liter Fluor benötigt man unter Normalbedingungen, um darin 10 g Aluminium vollständig zu verbrennen? 1. Schritt: Aufstellen der Reaktionsgleichung und Benennung des Produktes. 2 Al + 3 F2 2 AlF3 Aluminium(III)-fluorid 2. Schritt: Notieren der gegebenen und verlangten Größen. 1. m(Al) = 10 g 2. V(F2) = ? 3. 4. 3. Schritt: Feststellung der molaren Verhältnisse. (Tipp: Bemühungen auf die tatsächlich benötigten Stoffe beschränken, hier Al und F2; notieren in Feld 3!) 3. n(Al) = 2 Mol n(F2) = 3 Mol In Worten: um 2 Mol Al zu verbrennen benötigt man 3 Mol F2. 4. Schritt: Umrechnen der molaren in die verlangte Massen- oder Volumeneinheit Al Masse in Gramm, bei F2 das Volumen in Litern; Durchführung in Feld 4) m(Al) = n(Al) * M(Al) = 2 Mol * 27 g/mol = 54 g V(F2) = n(F2) * V(F2) = 3 Mol * 22.4 L/mol = 67.2 L In Worten: um 54 g Al zu verbrennen, benötigt man 67.2 L F2. (hier: bei 5. Schritt: Rechnen mit den gegebenen/verlangten Mengen (ebenfalls in Feld 4). Es ergeben sich Dreisatzaufgaben: entstehen aus 54 g Al.....................67.2 L F2 entstehen aus 10 g Al.....................x L F2 54 g/10 g = 67.2 L/x L; x = 10 g*67.2 L/54 g = 672/54 L = 12.4 L F2 6. Schritt: Formulierung der Antwort Um 10 g Al vollständig zu verbrennen, benötigt man 12.4 L F2. Merke: 1 Mol eines Stoffes enthält immer 6*1023 Teilchen. 1 Mol Gas nimmt unter Normalbedingungen immer ein Volumen von 22.4 L ein. http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 71 Kolloquiumsthemen „Grundlagen der Chemie“ Einzelne Grundbegriffe: -, -, -Strahlen Aggregatzustände Aktivierungsenergie Ammoniak chemische Bindung Dipol dynamisches Gleichgewicht Edelgaskonfiguration Elektrolyse Elektronegativität Element, Verbindung Elementarteilchen Energieprofil Allg. Gasgesetz Geiger-Müller-Zähler Gitter Halbwertszeit Indikator Isotope Kernspaltung Korrosion Legierung Lösungsvorgang mesomere Grenzformel Neutralisation Oktettregel Oxidation Oxidationsmittel Oxidationszahl Partialladung pH pKS Protolyse Reaktionsenthalpie Reduktion Reduktionsmittel Reinstoff, Gemisch Salzsäure Säurestärke Schmelzpunkt, Siedepunkt, Sublimation, Energiebeteiligung Valenzelektronen Verbrennung mit viel und wenig Sauerstoff Wertigkeit Zerfallsgesetz Zwischenmolekulare Kräfte Kapitel: Atombau: Teilchenvorstellung, Rutherford, Elementarteilchen PSE: Ordnungskriterien, Nutzen, Gruppeneigenschaften, Periodeneigenschaften, Oktettregel Chemische Bindung: Atombindung, Mehrfachbindungen, polare Bindung, Ionenbindung, metallische Bindung Wasser: Struktur, besondere physikalische Eigenschaften, Lösungsmittel Säuren und Basen: Herstellung, Benennung, Test, Salze, Arrhenius- und Brönsted-Konzept, Indikatoren, pH, pKS Redox-Reaktionen: Reaktion mit O2; Elektronenübergang, Oxidations- und Reduktionsmittel chemisches Gleichgewicht, Massenwirkungsgesetz Radioaktivität: Strahlungsarten, Messung, Wirkung, Halbwertszeit, Kernspaltung Fertigkeiten: Aufstellen chemischer Gleichungen Benennung binärer Verbindungen Struktur binärer Verbindungen Aufstellen von Redox-Gleichungen Bestimmen von Oxidationszahlen http://www.uni-bayreuth.de/departments/didaktikchemie/v_chemie/ 72