Verbrennungsenergie 14.11.2006 Marco Limburg Benjamin Grimme
Werbung

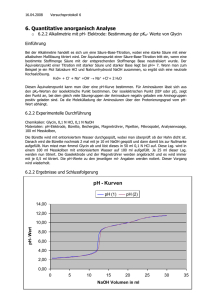
Verbrennungsenergie Marco Limburg 269948 14.11.2006 Benjamin Grimme 266814 Theorie: In diesem Versuch soll die molare Verbrennungsenergie einer Kohlenwasserstoffverbindung gemessen werden um daraus die molare Verbrennungsenthalpie und die Standartbildungsenthalpie zu berechnen. Die Verbrennungsenergie bezeichnet die Änderung der inneren Energie eines Systems in dem eine schnelle Oxidation bei konstanter Temperatur und konstantem Volumen abläuft. Die Verbrennungsenergie wird als cU bezeichnet und errechnet sich aus der Differenz der inneren Energie vor und nach der Reaktion. Nach dem 1.Hauptsatz der Thermodynamik gilt: dU dW dQ da in einem adiabatischen, isochoren System Q=0 ist und ausgenommen elektrischer und Reibungsarbeit W=0 folgt daraus: U 0 Der Prozess im vorliegenden Versuch jedoch ist nicht isotherm es tritt eine Temperaturänderung auf: T T T T T III I III II Man kann den experimentell durchgeführten Gesamtprozess mit U 0 aufspalten in einen isochoren, isothermen Prozess mit der Verbrennungsenergie cU und einen isochoren, nicht isothermen Prozess mit dem Unterschied der inneren Energie U ' Daraus folgt: U 0 U U ' c Was bedeutet dass die Verbrennungsenergie gleich dem negativen Zahlwert der Differenz der inneren Energie beider Zustände entspricht. Die Änderung der inneren Energie mit der Temperatur bei konstantem Volumen ist als Wärmekapazität Cv definiert: U ) Die Wärmekapazität ist eine Stoffkonstante die auf die Masse oder die T V Cv ( Stoffmenge bezogen werden kann. Die Wärmekapazität der Kaloriemeters wird Wasserwert CW genannt. Ist der Wasserwert bekannt lässt sich aus der Temperaturänderung bei der Reaktion die Verbrennungsenergie berechnen. Um den Wasserwert zu bestimmen wird ein Kalibrierungsversuch mit einem Stoff dessen Verbrennungsenergie bekannt ist durchgeführt; in unserem Fall die Benzoesäure. Für den Kalibrierversuch gilt folgende Gleichung: CU (B ) C W T(B ) Zwischen der Verbrennungsenergie und der Verbrennungsenthalpie besteht der Zusammenhang: H U (pV ) C C wobei ( pV ) die Differenz der Produkte aus Druck und Volumen nach und vor der Verbrennungsreaktion ist. Die Molare Verbrennungsenthalpie von Benzoesäure beträgt bei 25°C bei -3227,43 kJ/molVersuchsdurchführung Probenvorbereitung Es wurde ein Draht von ca. 20 cm Länge abgeschnitten, gewogen und zusammen gedreht. Dieser Zünddraht wurde durch die Bohrungen im Boden der Pressform gesteckt so dass eine Schlaufe von ca. 0,5cm im inneren des Presszylinders entsteht. Es wurde 1g Substanz abgewogen und ebenfalls in den Presszylinder gegeben. Nach dem Pressen wurde das Pressbrikett erneut gewogen. Kalibrierversuch: Zunächst wurde der Wasserwert des Kalorimeters mittels Benzoesäure ermittelt. Dazu wurde ein Pressbrikett mit Benzoesäure erstellt und wurde über dem Verbrennungsschälchen befestigt. Es wurden 5ml entsalztes Wasser auf den Boden der Bombe pipettiert. Die Bombe wurde verschlossen, mit Sauerstoff gespült und auf einen Innendruck von 20bar gebracht. Die Bombe wurde in das mit Wasser gefüllte Kalorimeter gesetzt, der Füllstand registriert und die Kontakte geschlossen. Die Pumpe wurde eingeschaltet und es wurde etwa 10 min gewartet. Nachdem sich eine konstante Temperatur unter 22°C eingestellt hatte wurde mit der Ablesung der Temperatur begonnen. Die Temperatur wurde minütlich abgelesen und notiert. Nach exakt 12 Messungen wurde die Zündung für 2 Sekunden betätigt. Nach der Zündung wurde weiterhin ca. 20 Minuten lang die Temperatur minütlich abgelesen. Die Bombe wurde dem Kalorimeter entnommen, der Druck abgelassen und die Bombe geöffnet. Die am Boden befindliche Flüssigkeit wurde quantitativ in einen ErlenmeyerKolben überführt und mit 0,1molarer NaOH titriert. Hauptversuch Analog zum Kalibrierversuch wurde ein Pressbrikett aus Analysesubstanz und Draht angefertigt und in die Bombe integriert. Die Bombe wurde in das mit Wasser gefüllte Kalorimeter gesetzt, der Füllstand auf ursprungswert des Kalibrierversuchs angepasst und die Kontakte geschlossen. Die Pumpe wurde eingeschaltet und es wurde etwa 10 min gewartet. Nachdem sich eine konstante Temperatur unter 22°C eingestellt hatte wurde mit der Ablesung der Temperatur begonnen. Die Temperatur wurde minütlich abgelesen und notiert. Nach exakt 17 Messungen wurde die Zündung für 2 Sekunden betätigt. Nach der Zündung wurde weiterhin ca. 15 Minuten lang die Temperatur minütlich abgelesen. Die Bombe wurde dem Kalorimeter entnommen, der Druck abgelassen und die Bombe geöffnet. Die am Boden befindliche Flüssigkeit wurde quantitativ in einen ErlenmeyerKolben überführt und mit 0,1molarer NaOH titriert. Auswertung: Kalibrierversuch t/min 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 t/°c +20°C 1,838 1,839 1,840 1,840 1,842 1,845 1,849 1,850 1,853 1,855 3,000 3,510 3,600 3,630 3,639 3,642 17 18 19 20 21 22 23 24 25 26 27 28 29 30 3,641 3,640 3,639 3,636 3,632 3,630 3,625 3,628 3,625 3,622 3,620 3,619 3,617 3,613 Die Werte wurden in einem Diagramm t/°C gegen t/min aufgetragen. Der Temperaturverlauf wurde Extrapoliert und Vor- wie Nachperiode durch eine Senkrechte die Parallel zur Ordinate verläuft geteilt. Die im Diagramm eingezeichneten, dabei entstehenden Flächen sollen gleich groß sein. Für T ergibt sich damit 3,658-1,870=1,788 Das Gewicht des Benzoesäurebriketts betrug 0,96g, davon 0,020g Nickeldraht. Nach der Verbrennung blieben 0,015g Nickeldraht zurück. U U ( B ) U ( Ni ) U ( N ) C C C C 2 J U ' ( B ) m ( B ) 26520 0 , 955 g C Wobei CU (B) = -25363,2 J g J U ' ( Ni ) m ( Ni ) 2720 0 , 005 g CU(Ni) C -13.6 J g J CU(N2) U ' ( N ) V ( NaOH ) 6 , 3 0 , 35 ml -2,205 J C 2 ml Insgesamt ergibt sich: C U = 26379,005 J U J C C 14735 , 68 W T K Hauptversuch: Bei der zu analysierenden Substanz handelte es sich um Benzoesäure. Die Einwagen betrugen: Pressbrikett: 0,98g, davon 0,021g Nickeldraht. Nach der Reaktion blieben 0,014g Nickeldraht über. Die Gleichung der Reaktion von Benzoesäure mit Sauerstoff lautet: C6H5COOH +7,5 O2 -> 7 CO2 + 3 H2O n0,5n(B ) 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 15,93 16,00 16,05 16,10 16,13 16,20 16,25 13,60 16,35 16,40 16,45 16,50 16,55 16,60 16,55 16,60 16,55 16,80 30,50 34,00 34,66 34,89 34,95 34,98 34,98 34,96 34,99 35,00 34,98 34,95 34,96 34,95 34,96 Analog zum Kalibrierversuch wurde ein Graph gezeichnet und die Senkrechte ermittelt. Für T ergibt sich: 3,505-1,676=1,829 U ( S ) C T U ( Ni ) U ( N ) C W C C 2 J U ' ( Ni ) m ( Ni ) 2720 0 , 007 g CU(Ni) C -19.04 J g J CU(N2) U ' ( N ) V ( NaOH ) 6 , 3 0 , 8 ml -5,04 J C 2 ml U ( S ) 14735 , 68 1 , 828 ) 19 , 04 ( 5 , 04 ) 26927 , 5 J C m(S ) n(S) = M (S ) 0,008mol U 3352 ,2 kJ C m H U ( S ) nRT 3352 , 2 kJ ( 0 , 5 8314 298 K ) 3358 kJ / mol C m C m Standartbildungsenthalpie: Aus den Standartbildungsenthalpien von Wasser und Kohlendioxid ergibt sich: H ( B ( cr )) 3 H ( H O ( l ) 7 H ( CO ( g ) H ( B ( cr )) f f 2 f 2 f m -274,9 kJ/mol Die Abweichung vom Literaturwert ( f H =383,2 kJ/mol) in Höhe von 28% ist zu erklären durch die Differenz des gemessenen C H m Wertes (-3358 kJ/mol) vom Literaturwert (3228,67 kJ/mol). Diese beträgt: 129,33 kJ, bzw. 4% Dieser Fehler pflanzt sich durch die Umrechnung in Standartbildungsenthalpie jedoch nicht Prozentuell sondern ganzzahlig fort. Fehlerfortpflanzung: Für den Fehler der Wärmekapazität des Kalorimeters gilt die Formel U ( Benzoesä e ) * m ( Benzoe e ) U ( Ni ) * m ( Ni ) U ( N ) * V ( Na ) c c c 2 c w T ( Benzoes e ) T ( Benzo e ) T ( Ben e ) c c c w w w c * m * m * V w m m V ( Benzoesäur e ) ( Ni ) ( NaOH ) T T T m 0 , 0005 g ( Waage ) V 0 , 08 ml 100 mlBürtte Rechenbeispiel: Für absoluten Fehler 26420 J /g ( 2720 J /g * 0 ,007 g ) ( 6 , 3 J /ml * 0 ,7 ml ) c * 0 ,0005 g w 1 , 928 K T , T ,m (Ni ), v (NaOH ) 26420 J /g * 0 , 948 g ( 2720 J /g ) ( 6 , 3 J /ml * 0 ,7 ml ) * 0 ,0005 g 1 , 928 K T ,m ( B ), V ( NaOH 26420 J /g * 0 , 948 ( 2720 J /g * 0 ,007 g ) ( 6 , 3 J /ml ) * 0 ,08 ml 1 , 928 K T ,m ( B ), m ( Ni ) c 13000 1054 , 37 J /K w Rechenbeispiel: Für relativen Fehler c , 948 g6,86J/K 0 , 007 g 7,20J/K 0 , 7 ml 1040,31J/ w 0 * * * c J / K 0 , 948 g13000 J0 , 007 g13000 J 0 , 7 ml w 13000 c w 8 , 11 % c w Fehlerfortpflanzung für die Verbrennungsenergie der Ursubstanz: Gleichung: Für Absoluten Fehler U ( S ) c T ( S ) U ( Ni ) * m ( Ni ) U ( N ) * V ( NaOH ) c ´ w c c 2 U ( S ) U ( S ) c c U ( S ) * c m ( Ni ) c w * c m ( Ni ) w T , c T , m ( Ni ) w U ( S ) ( 26948 J 71 , 61 J ) c Gleichung für relativen Fehler: U (S ) c 0 ,27 % +2,12 U (S ) c