6.2 alkalimetrie K+ Bestimmung
Werbung

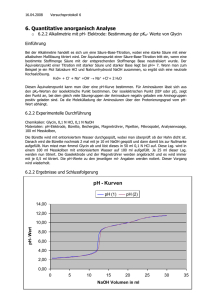
16.04.2008 Versuchsprotokoll 7 6. Quantitative anorganische Analyse 6.2.3 Alkalimetrie mit Farbindikator: K+ -Bestimmung durch Ionenaustausch Einführung Ionenaustauscher sind feste unlösliche Stoffe, die an örtlich festen Ladungen austauschbare Ionen (Anionen oder Kationen) tragen. Man unterscheidet in Anionen- oder Kationenaustauscher, je nachdem welche Ionen austauschbar sind, ist es ein Kationen- oder Anionenaustauscher. Kationenaustauscher: 2 NaX (s) +CaCl2 (aq.) CaX (s) + 2 NaCl (aq.) Anionenaustauscher: 2 XCl (s) + Na2SO4 (aq.) X2SO4 (s) + 2 NaCl (aq.) In diesen Beispielen liegt der Kationenaustauscher in erst Natriumform und dann in Calciumform vor. Der Anionentauscher dementsprechend erst in Chloridform und dann in Sulfatform. In der Regel handelt es sich bei Ionenaustauschern um Makromoleküle die hochpolymer, dreidimensional vernetzt sind. Diese tragen charakteristische Gruppen (X), an denen der Ionenaustausch stattfindet. Durch einen Ionenaustauscher, einen Kationenaustauscher, kann man z.B. die Stoffmenge der K+ -Ionen die in einer Lsg. enthalten sind bestimmen. Indem man die K+ - Ionen durch die Zugabe von anderen Ionen (in diesem Fall H+-Ionen) fest an den Ionenaustauscher bindet. Die Menge an Ionen und den ausgetauschten Ionen ist dann die gleiche. Bei dem Vorgang sind Ladung, Größe und Konzentration der Ionen von Bedeutung. Es bestehen Wechselwirkungen zwischen den freien Ionen und dem Ionenaustauscher, diese beruhen auf elektrostatischen Kräften. Je größer die Anziehung zwischen den Ionen, umso größer die Affinität des Ions zum Ionenaustauscher. Durch unterschiedliche Affinitäten verdrängen die Ionen sich gegenseitigen und der Ionenaustauscher ist regenerierbar und wieder neu einsetzbar. In der Affinitätsreihe auf Seite 106 im Skript, sieht man das K + rechts von H+ steht. Das heißt das die K+ - Ionen die H+-Ionen verdrängen. So können diese, da sie äquivalent sind, alkalimetrisch bestimmt werden. HX + K+ (aq.) KX + H+ (aq.) 6.2.3 Experimentelle Durchführung Chemikalien: 2 N HCl, 0,1 N NaOH, Kationenaustauscher, Materialien: Becherglas, pH- Papier, Pipetten, Bürette, Pinzette Zuerst wird der Ionenaustauscher mit 100 ml HCl gewaschen. X- + HCl XH + ClNach der letzten Zugabe von HCl wird die Säule solange mit entionisiertem Wasser gespült bis die austropfende Lsg. den pH- Wert des Wassers hat. 25 ml der Analysenlsg. werden portionsweise in die Säule gegeben und wird tropfenweise abgelassen. Zwischendurch den pH- Wert überprüfen, der aufgrund der H+ Ionen wieder fallen müsste vom vorigen Wert des Wassers. Nach Verbrauch der 25 ml wird wieder mit ent. Wasser gewaschen, bis der pH-Wert des Wassers wieder erreicht wird. Dann wird die Lsg. mit 0,1 NaOH mit einer 50 ml Brürette titriert H+ + NaOH H2O + Na+ zuvor wurden ein paar Tropfen eines Indikators z.B. Bromthymolblau oder Phenolphthalein dazugegeben. Ist kein H+ mehr vorhanden, findet ein Farbumschlag von farblos zu rosa/ pink statt. HInd + OH- Ind- + H2O Die Titration wird 3mal durchgeführt. Danach wird die Ionenaustauscher wieder gewaschen, erst mit HCl und dann mit Wasser, bis die Lsg. Chlorid frei ist. Dies kann man testen indem man eine SilberhaltigeLsg. (z.B. AgNO3) mit der auslaufenden Flüssigkeit versetzt und prüft ob AgCl ausfällt. 22 16.04.2008 Versuchsprotokoll 7 Phenolphthalein H2In farblos bei pH 0-8 In2pink/rosa ab pH 8- 12 6.2.3 Ergebnisse und Schlussfolgerung Berechnung der Menge an K+: M (K+) = 39.09 g/mol V (NaOH) = 11,67 ml C (NaOH) = 0,1 mol/l n (NaOH)= V(NaOH) * c (NaOH) = 11,67 ml * 0,1 mol/l = 1,167 mmol n (NaOH) =n (H+) = n (K+) = 1,167 mmol » m (K+) = n (K+) * M (K+) = 1,167 mmol * 39,098 g/mol = 45,627366 mg = 182,50 mg Man berechnet zuerst die Stoffmenge n (NaOH) mit der Formel: n (NaOH) = c (NaOH) * V (NaOH) Der Faktor 4 kommt zustande, da man von 100ml Analysenlösung nur ¼ nämlich 25 ml benutzt hat sich aber auf die gesamten 100ml beziehen will. Die Multiplikation mit M (K+) kommt durch die Formel: m (K+) = n (NaOH) * M (K+) zustande, da für jedes Mol Na+ ein Mol K+ verbraucht wird d.h. laut Reaktionsgleichung: NaOH + K+ ↔ KOH + Na+ Und daraus folgt: n(NaOH) = n(KOH) Literatur: H.Fleischer Praktikum Chemie für Biologen: Anorganische, Organische und Physikalische Chemie, Mainz, 2004 23