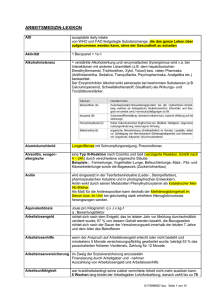
Anorganische Chemie 1
Werbung

ch_aoc.doc/14.05.16/Seite 1 BERUFSSCHULE FÜR CHEMIE WIEN ANORGANISCHE CHEMIE 1 1. UND 2. KLASSE ch_aoc.doc/14.05.16/Seite 2 18. GRUPPE ODER (0. ODER) 8. HAUPTGRUPPE VIIIA (ALT) – EDELGASE ................ 3 17. GRUPPE ODER 7. HAUPTGRUPPE VIIA (ALT) - HALOGENE................................... 4 WASSERSTOFF H ............................................................................................................ 20 16. GRUPPE ODER 6. HAUPTGRUPPE VIA (ALT) - CHALKOGENE ............................ 23 METALLE .......................................................................................................................... 46 15. GRUPPE ODER 5. HAUPTGRUPPE VA (ALT) - STICKSTOFFGRUPPE ................. 60 14. GRUPPE ODER 4. HAUPTGRUPPE IVA (ALT) – KOHLENSTOFFGRUPPE ........... 88 13. GRUPPE ODER 3. HAUPTGRUPPE IIIA (ALT) - ERDMETALLE ............................ 103 2. GRUPPE ODER 2. HAUPTGRUPPE IIA (ALT) - ERDALKALIMETALLE .................. 111 1. GRUPPE ODER 1. HAUPTGRUPPE IA (ALT) - ALKALIMETALLE .......................... 127 ch_aoc.doc/14.05.16/Seite 3 18. Gruppe oder (0. oder) 8. Hauptgruppe VIIIa (alt) – EDELGASE Name OZ He Ne Ar Kr Xe Rn 2 10 18 36 54 86 Atommasse 4,0026 20,183 39,948 83,80 131,3 222 Fp(°C) Kp(°C) -272,1 -248,6 -189,4 -157,2 -111,8 -71 -268,98 -246,03 -185,87 -152,9 -107,1 -63 krit.T(°C) -267,9 -228,7 -120 -62,5 +16,6 +104,5 Vorkommen: alle in der Luft Krypton als Spaltprodukt in Kernkraftabgasen Helium in der Sonne als Fusionsprodukt, im Erdgas, in Mineralien als Reaktionsprodukt des radioaktiven Zerfalls Herstellung: 1. Aus der Luft durch fraktionierte Destillation flüssiger Luft (siehe Sauerstoff) 2. Helium aus Erdgas: CO2 wird durch Druckwäsche mit Wasser und Kalkmilch entfernt, das Restgas auf -205°C abgekühlt. Man erhält ein Gasgemisch aus 97-98 V% He und 2-3 V% Stickstoff Eigenschaften: Farb- und geruchlose, einatomige Gase, die sehr reaktionsträge sind. Deshalb konnten erst in letzter Zeit einige Verbindungen, besonders von Xe hergestellt werden. Verwendung: He: Füllungen für Gasthermometer, Luftschiffe und Ballone, in der Rüstungsindustrie, für Beleuchtungskörper (liefert weißes Licht), He/O 2Tauchgemische Ne: Füllung für Beleuchtungskörper (liefert rotes, mit Hg-Spuren blaues, mit HgSpuren in braunem Glas grünes Licht) Ar: Schutzgas in der Chemie besonders bei hohen Temperaturen und beim Schweißen Kr und Xe: Füllung für Glühlampen (ermöglicht höhere Glühtemperatur des W-Fadens und damit weißeres Licht) Beantworte folgende Fragen: 01. Nenne alle Edelgase mit Namen und chem Zeichen! 02. Wo kommen die Edelgase vor? 03. Wie können Edelgase gewonnen werden? 04. Wie kann Helium gewonnen werden? 05. Nenne einige Eigenschaften der Edelgase! 06. Nenne einige Verwendungsmöglichkeiten für Edelgase! ch_aoc.doc/14.05.16/Seite 4 17. Gruppe oder 7. Hauptgruppe VIIa (alt) - HALOGENE Der Name bedeutet Salzbildner. Name OZ Atommasse F Cl Br I At 9 17 35 53 85 18,9984 35,453 79,909 126,904 Metallcharakter Reaktionsfähigkeit FLUOR F Vorkommen: CaF2 Flußspat, wichtigstes Fluorvorkommen, verwendet als Flußmittel, für optische Prismen und Linsen, da er UV- und IR-durchlässig ist. 3 Ca3(PO4)2.Ca(OH,Cl,F)2 Hydroxyl-, Chlor- oder Fluorapatit Na3AlF6 Kryolith Herstellung: Aus CaF2 wird entweder KHF2 oder wasserfreie H2F2 hergestellt. Das KHF2 wird schmelzflußelektrolysiert. (Anode: F2, Kathode: K, H2). Die wasserfreie H2F2 wird elektrolysiert (Anode :F2, Kathode: H2). H2 und F2 müssen getrennt abgeführt werden, da sie sonst explosionsartig miteinander reagieren würden. Eigenschaften: Fast farbloses bis schwach grünlichgelbes, stechend riechendes, sehr reaktionsfähiges Gas, Schleimhautgift. In Reaktionen wird immer das F - gebildet, da das Fluor das elektronegativste Element ist. RG: RG: Verwendung: Als Raketentreibstoff und zum Hochtemperaturschweißen bis 4500°C. RG: Verbindungen: Fluorwasserstoff(säure), Flußsäure, Fluoride HF, H2F2, F-, F22Allgemeines: Die genaue Formel lautet (HF)x, wobei x im Durchschnitt 3,5 ist, da infolge der starken Polarität es zu einer Wasserstoffbrückenbildung kommt. (Siehe Allgemeine Chemie, Atombindung) Herstellung: ch_aoc.doc/14.05.16/Seite 5 Umsetzung von Flußspat mit conc. Schwefelsäure (siehe Vorproben mit conc. Schwefelsäure) RG: Eigenschaften: Aufbewahrung in Ag-, Cu-, Stahl- oder Kunststoffbehältern, da sie stark ätzend ist. Verwendung: Zum Glasätzen, zur Herstellung von Fluorierungsmitteln, zur Herstellung von Fluoralkanen (siehe Org. Chemie). ch_aoc.doc/14.05.16/Seite 6 CHLOR Cl Vorkommen: NaCl Steinsalz gelöst im Meerwasser Cl:Br:I = 2500:10:1 K+,Mg2+,Cl-,SO42- Staßfurter Abraumsalze im Magensaft (0,1M HCl) Herstellung: 1. Labor: Einwirken von HCl auf Chlorkalk CaOCl2 (=CaCl.ClO) im Kipp´schen Apparat: RG: 2. Weldon-Verfahren (alt): Vorstufen für die Oxidation sind das ”Berliner”- und ”Mannheimer”-Salzsäureverfahren (siehe auch Vorprobe mit conc. H2SO4) RG ”Berliner”-Salzsäure-Verfahren: RG ”Mannheimer”-Salzsäure-Verfahren: RG Oxidation: RG Regeneration: 3. Chloralkalielektrolysen (heutige Verfahren): a) Schmelzflußelektrolyse von NaCl (abnehmende Bedeutung) RG Anode: RG Kathode: b) Elektrolyse von HCl- oder NaCl-Lösung (in Schmelze nur zur Na-Herst.): Diaphragma- oder Glocken- und Membranverfahren Amalgamverfahren RG Anode: RG Kathode: Zersetzer: RG: ch_aoc.doc/14.05.16/Seite 7 ch_aoc.doc/14.05.16/Seite 8 Redox-Vorgänge am Beispiel der Chloralkalielektrolyse (Herstellungsverfahren) Chloralkalielektrolyse in Schmelze Anodengleichungen * Primärrk., Elektrode * Sekundärrk., Elektrode 2 Cl- 2 Cl + 2 e2 Cl Cl2 Kathodengleichungen * Primärrk., Elektrode * Sekundärrk., Elektrode * Tertiärrk., Zersetzer Endprodukte Anmerkungen 2 Na+ + 2 e- 2 Na ----Na, Cl2 --Chloralkalielektrolyse in wäßriger Lösung AMALGAM-VERFAHREN MEMBRANVERFAHREN Anodengleichungen * Primärrk., Elektrode * Sekundärrk., Elektrode Kathodengleichungen * Primärrk., Elektrode * Sekundärrk., Elektrode * Tertiärrk., Zersetzer Endprodukte Anmerkungen DIAPHRAGMAVERFAHREN 2 Cl- 2 Cl + 2 e2 Cl Cl2 2 Na+ + 2 e- 2 Na 2 Na + 2 Hgx 2 Na;Hgx 2 Na + 2 H2O 2 NaOH + H2 --2 Na;Hgx + 2 H2O -> 2 NaOH + H2 + 2Hgx NaOH, H2, Cl2 NaCl-freie NaOH, da die NaCl-freie NaOH, NaOH enthält ca. NaOH-Bildung im Zersetzer da die Membran 1% NaCl, da das statt in der Elektrolysezelle nur für Kationen Diaphragma für alle erfolgt, Umweltprobleme mit durchlässig und Ionen durchlässig Hg die NaOH-Bildung ist und die NaOHin chloridfreier Ls Bildung in der erfolgt NaCl-Ls (Sole) erfolgt ch_aoc.doc/14.05.16/Seite 9 Eigenschaften: Gelbgrünes, erstickend riechendes, die Schleimhäute stark angreifendes Gas, 2,5mal schwerer als Luft, leicht verflüssigbar und gut wasserlöslich (Chlorwasser). In den Handel kommt es verflüssigt in grau gestrichenen Gasflaschen oder Kesselwagen. Es ist sehr reaktionsfähig und verbindet sich bei Zimmertemperatur mit vielen Elementen (Ausnahmen N2 und O2).unter Wärmeentwicklung. Feuchtigkeit begünstigt die Reaktionsfähigkeit. Mit Wasserstoff im Verhältnis 1:1 bildet es das Chlorknallgas: RG: Vielen Organischen Verbindungen Chlorwasserstoff-Bildung: RG: entreißt das Chlor den Wasserstoff unter ch_aoc.doc/14.05.16/Seite 10 Verwendung: Desinfektionsmittel für Trinkwasser, Bäder und Abwasser, Chlorierungs- und Bleichmittel, Herstellung von HCl, HClO und HClO3 und ihrer Salze. Verbindungen: Chlorwasserstoff(säure), Salzsäure, Chloride (-1) HCl, Cl-Herstellung: siehe Chlorwasserstoff(säure)-Herstellung (Fließbild) Eigenschaften: Farbloses, stechend riechendes Gas, in Wasser leicht löslich (Salzsäure). Conc. HCl ist 35-36%ig (rauchende 39-40%ig). Bei der Destillation bildet 20%ige Salzsäure ein azeotropes Gemisch (Azeotrop). Bei azeotropen Gemischen ist die Zusammensetzung der Lösung gleich der Zusammensetzung des Dampfes. Dieses Gemisch kann durch Destillation nicht mehr getrennt werden. Unlösliche Chloride: AgCl, TlCl, PbCl2 und Hg2Cl2 Unterchlorige Säure, Hypochlorige Säure, Chlor(I)säure, Hypochlorite, Chlorate (I), +1, HClO, ClOAllgemeines: Die freie Säure ist nur bis 5% beständig, sie wirkt oxidierend. Ihr Anhydrid ist das Dichloroxid Cl2O. Wichtiger sind ihre Salze, wie NaClO und CaCl2O (Chlorkalk). Herstellung: Die Salze werden durch Einleiten von Chlor in starke Basen hergestellt, wobei es disproportioniert. Bei einer Disproportionsreaktion geht ein Element einer bestimmten Oxidationszahl (Cl20) in eine höhere (Cl+1) und eine niedrigere (Cl-1) Oxidationsstufe über. 1. Natriumhypochlorit NaClO: RG: 2. Chlorkalk: CaCl2O, Calciumchloridhypochlorit: Elektrolyse von Calciumchlorid in wässriger Lösung RG: Verwendung: Starkes Oxidationsmittel, Desinfektionsmittel und Bleichmittel für Papier. Chlorsäure, Chlor(V)säure, Chlorate, Chlorate(V) +5, HClO3,, ClO3Herstellung: 1. Elektrolyse von NaCl-Lösung unter Rühren bei 60°C. RG: 2. Umsetzung von HClO mit NaClO (praktisch: NaClO mit wenig HCl ansäuern): RG: ch_aoc.doc/14.05.16/Seite 11 3. Umsetzung von Bariumchlorat mit Schwefelsäure, liefert sehr reine Chlorsäure: RG: Eigenschaften: bis 40% konzentrierbar, starkes Oxidationsmittel, Salze reagieren beim Verreiben mit oxidierbaren Substanzen explosiv. Verwendung: Sprengmittel-, Feuerwerkindustrie, Zündholz- und Perchloratherstellung, Totalherbizid (Pflanzenvernichtungsmittel), nasse Verbrennung organischer Substanzen (Euchlorin: KClO3 + HClconc) Perchlorsäure, Chlor(VII)säure, Dichlorheptoxid, +7, Cl2O7 Perchlorate, Chlorate (VII), HClO4,, ClO4 -, Herstellung: 1. Erhitzen von Chloraten (Disproportionsreaktion): RG: 2. Mit conc. Schwefelsäure aus den Salzen austreiben: RG: 3. Durch Entwässern von Perchlorsäure mit Dichlorheptoxid (Anhydrid der Perchlorsäure): RG: Phosphorpentoxid entsteht das Eigenschaften: Das Anhydrid Cl2O7 ist destillierbar. Die Säure oxidiert organische Substanzen explosiv, sie bildet bei 72% ein Azeotrop. Auf der Haut entstehen schwer heilende Wunden. ch_aoc.doc/14.05.16/Seite 12 CHLORWASSERSTOFF(SÄURE);SALZSÄURE 1. Chlorwasserstoff (unrein) als Nebenprodukt Bei diesen Verfahren fällt die größte Menge an. Man unterscheidet zwei prinzipielle Verfahren: 1.1. Berliner- und Mannheimer- Salzsäureverfahren (alt): Chlorwasserstoff wird bei der Natriumsulfat-Herstellung im Sulfatofen (1) aus Kochsalz und conc. Schwefelsäure frei. Diese Reaktion wird in zwei Stufen mit unterschiedlicher Temperatur durchgeführt: 1. Stufe: normale Temperatur RG: 2. Stufe: 300-600°C RG: 1.2. Chlorierung organischer Verbindungen (neu): Hierbei werden Wasserstoffatome durch Chloratome substituiert (ersetzt), wobei das verdrängte H-Atom an Cl unter der Bildung von HCl gebunden wird. z.B.: Chlorbenzol: RG: Chloressigsäure: RG: Diese Chlorierungen erfolgen entweder exotherm (Kühlung) oder endotherm (Heizung) und werden in Chlorierungskesseln (2) durchgeführt. 2. Chemisch reiner Chlorwasserstoff (neu): Kochsalz wird im Lösegefäß (4) mit Wasser gelöst und die Lösung elektrolysiert (3). Es werden Diaphragma-, Glocken- oder Amalgamverfahren (2g Hg werden pro Tonne Chlor emittiert). Bei der Elektrolyse (3) werden Chlor und Wasserstoff als Hauptprodukte und Natronlauge als Nebenprodukt gebildet. Die Gase werden getrennt aufgefangen und weiterverarbeitet. 2.1. Aufbereitung der Rohstoffe: Das bei der Elektrolyse (3) gebildete Chlor wird im Kühler (5) gekühlt, im Gaswäscher (6) mit Wasser gewaschen und anschließend im Absorber (7) mit conc. Schwefelsäure getrocknet. Die Schwefelsäure wird über den Kühler (8) im Kreislauf geführt. Das trockene Chlor wird in Kiesfiltern (9) nochmals gereinigt und in der Pumpe (10) auf Verbrennungsdruck komprimiert. Der Wasserstoff wird getrennt gekühlt (11), getrocknet (12), wie beim Chlor, und komprimiert (13). ch_aoc.doc/14.05.16/Seite 13 Fließbild Chlorwasserstoff-Herstellung 1 xxx ch_aoc.doc/14.05.16/Seite 14 2.2. Chlor-Wasserstoff-Verbrennung Die Reaktion von Chlor mit Wasserstoff zu Chlorwasserstoff (Chlorknallgasreaktion, eine Elementarsynthese) verläuft stark exotherm und ist sehr heftig. Um eine kontrollierte Reaktion zu gewährleisten, verbrennt man im Chlor-Wasserstoff-Brenner (14), der wie ein Schneidbrenner (Daniell´scher Hahn) aufgebaut ist. Die beiden Gase treten erst im Augenblick der Reaktion beim Verlassen des Brenners zusammen. Im Brenner sind Drahtnetze eingebaut, die ein Zurückschlagen der Flammen verhindern. Der Brenner ist aus Quarz (Korrosionswirkung von Chlor und Chlorwasserstoff) und mit dem Verbrennungsofen (15), der mit keramischen Platten ausgekleidet ist, verbunden. In den Graphitröhren des Verbrennungsofens (15)wird die Reaktionswärme durch Kühlung mit Wasser abgeführt. (alternativ kann man die Verbrennung von Chlorknallgas auch über Aktivkohle als Katalysator durchführen). RG: 2.3. Kondensierung und Konzentrierung Chlorwasserstoff wird für die direkte Vermarktung im Tiefkühler (16), der aus Graphit besteht (Kühlmittel ist Eiswasser), gekühlt, im Kompressor (17) komprimiert und anschließend in Stahlflaschen abgefüllt. Bei der Herstellung von Chlorwasserstoffsäure (Salzsäure, häufigster Fall), wird der Chlorwasserstoff zusammen mit verdünnter Salzsäure aus dem Umlauf in Graphitkühler (18) mit Wasser gekühlt und anschließend im wassergekühlten Graphitkondensator (19) zu konzentrierter Salzsäure umgesetzt (kommt in gummierten Tanks, Kesselwagen, Korbflaschen usw. in den Handel). Das im Graphitkondensator (19) nicht absorbierte HCl-Gas wird im Schlußabsorber (20) im Gegenstrom mit Wasser berieselt und die entstehende verdünnte Salzsäure im Graphitkühler (21) mit Wasser gekühlt und über die Umlaufpumpe in den Graphitkühler (18) eingespeist. Beantworte folgende Fragen: 01. Wie kann unreiner Chlorwasserstoff gewonnen werden? (Mit allen RG) 02. Elektrodenbezogene RG für die Elektrolyse von wäßrigen Kochsalzlösungen. 03. Beschreibe die Reinigung der Gase! 04. Wie ist der Chlorknallgasbrenner aufgebaut und warum? 05. Warum wird bei der Kondensierung und Konzentrierung nur Graphit als Werkstoff eingesetzt? 06. Zeichne das Fließbild für die Chlorwasserstoffherstellung mit der Konzentrierung! 07. Welche Produkte entstehen bei der Elektrolyse von wäßrigen NaCl-Lösungen? ch_aoc.doc/14.05.16/Seite 15 Fließbild Chlorwasserstoff-Herstellung 2 xxx ch_aoc.doc/14.05.16/Seite 16 NATRIUMCHLORID-AUFBEREITUNG 1.Aufbereitung der Rohstoffe Für die Herstellung von technischen Steinsalz (15) wird das aus ober- oder unterirdischen Lagern stammende Steinsalz mit 3-5% Verunreinigungen nur mechanisch gereinigt und zerkleinert. Für den menschlichen Genuß geeignetes Speisesalz (17+18) muß gereinigt werden. Das bergmännisch gewonnene Steinsalz (2) oder die Salzsole (1) werden im Lösegefäß (3) und im Sättiger (4) auf eine konzentrierte Lösung gebracht. Die unlöslichen Bestandteile werden in Filterpressen (5) abgetrennt. 2. Reinigung Die klare gesättigte Sole wird im Fällbottich (6) mit Kalkmilch und Natriumsulfatlösung versetzt. Die klare, magnesiumfreie Sole wird oben abgezogen und in den Fällbottich (8) geleitet. Magnesiumhydroxid setzt sich am Boden des Fällbottichs (6) ab und wird über eine Filterpresse (7) entfernt. Das klare Filtrat wird in den Fällbottich (8) geleitet. RG: Im Fällbottich (8) wird die Sole mit ammonsulfathaltiger Mutterlauge aus der Zentrifuge (12) mit weiteren Ammonsulfat versetzt. Gleichzeitig wird Kohlendioxid eingeleitet, wodurch die aus der Kalkmilch stammenden Calciumsalze wieder ausfallen und sich am Boden absetzen. Über die Filterpresse (9) wird der Niederschlag abgetrennt. Das klare Filtrat wird gemeinsam mit der klaren Lösung, die aus dem Fällbottich (8) oben abgezogen wurde in die Eindampfpfanne (10) geleitet. RG: RG: 3. Siederei und Kristallisation Die klare, Natriumchlorid und leicht lösliches Ammonsulfat enthaltende Sole wird in der Eindampfpfanne (10) so stark eingedampft, daß das Kochsalz auskristallisiert, das Ammonsulfat aber in Lösung bleibt. Es setzt sich an den Rändern eine Kruste (”Pfannenstein”) ab, der von Zeit zu Zeit abgekratzt, gemahlen (11) und als Viehsalz (19) verkauft wird. In der Zentrifuge (12) wird der Kristallbrei in Salz und Mutterlauge getrennt. Die Mutterlauge enthält außer Natriumchlorid das gesamte Ammonsulfat und wird entweder dem Fällbottich (8) zugeführt oder als Badesalz (16) verarbeitet. Die noch feuchten Natriumchloridkristalle werden im Muldentrockner (13) getrocknet. Beim schnellen Eindampfen bei 100° entsteht Grobsalz (17), bei langsamen Trocknen bei 60° entsteht Feinsalz (18). ch_aoc.doc/14.05.16/Seite 17 Fließbild Natriumchlorid-Herstellung xxx ch_aoc.doc/14.05.16/Seite 18 BROM Br Vorkommen: gelöst im Meerwasser Cl:Br:I = 2500:10:1 AgBr Bromargyt Mg(Cl,Br)2.K(Cl,Br).6H2O Bromcarnallit (Staßfurter Abraumsalze) Herstellung: Umsetzung von Bromiden mit Chlor (siehe Nachweis von Brom mit Chlorkalk): RG: Eigenschaften: Brom ist neben Quecksilber das einzige bei Normaltemperatur flüssige Element. Tiefbraune, rotbraune Dämpfe entwickelnde, erstickend riechende, die Schleimhäute reizende Flüssigkeit, die bei sinkender Temperatur heller wird. Es ist weniger reaktionsfreudig als Chlor (reagiert z.B. bei normaler Temperatur mit Wasserstoff und Natrium nicht). Starkes Oxidationsmittel. Verwendung: Organische Farbstoffe werden durch Substituierung mit Brom vertieft. Verbindungen: Bromwasserstoff(säure), Bromide HBr, Br-, -1 Herstellung: 1. Elementarsynthese: Durchleiten durch ein mit Platinschwamm gefülltes oder mit Aktivkohle beschichtetes heißes Rohr: RG: 2. Umsetzung von weißem Phosphor (P4) mit Brom und anschließender Hydrolyse des Zwischenprodukts: RG: Eigenschaften: Farbloses, die Schleimhäute reizendes Gas, das an der Luft Nebel bildet. In Wasser besser löslich als HCl. Bildet bei 48% in azeotropes Gemisch. Unlösliche Salze: AgBr, PbBr2 Verwendung: AgBr in Filmen als lichtempfindliches Salz, früher KBr als Beruhigungsmittel ch_aoc.doc/14.05.16/Seite 19 IOD I Vorkommen: gelöst im Meerwasser Cl:Br:I = 2500:10:1 Seetangasche, Staßfurter Abraumsalze im Chilesalpeter als NaIO3 oder Ca(IO3)2 Herstellung: Meist aus den Mutterlaugen des Chilesalpeters durch Reduktion mit Schwefeliger Säure, wobei nur 5/6 der benötigten Menge an Schwefeliger Säure zugesetzt werden. RG: Eigenschaften: Grauschwarze, metallisch glänzende, sublimierbare, in KI- und HI-Lösungen leicht lösliche, in organischen Lösungsmitteln (braun, rot, violett) leicht lösliche Schuppen, bildet beim Erwärmen violette Dämpfe. Ähnlich den Chlor und Brom , nur reaktionsträger. Freies Iod bildet mit Stärke blaue Einschlußverbindungen, die beim Erwärmen farblos und beim Erkalten wieder blau werden. Verwendung: Iodtinktur, iodometrische Titrationen Beantworte folgende Fragen: 01. 02. 03. 04. 05. 06. 07. 08. 09. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. Nenne die Elemente der 7. Hauptgruppe mit allgemeinen Eigenschaften! Vorkommen von Fluor mit der chem. Formel der Verbindung! Herstellung von Fluor Eigenschaften und Verwendung von Fluor Herstellung von Fluorwasserstoff (+ RG) Hauptvorkommen von Chlor mit Formel Herstellung von Chlor nach dem Weldon-Verfahren (+RG) Schmelzflußelektrolyse von NaCl-Schmelze mit elektrodenbezogenen RG Elektrolyse von wäßrigen NaCl-Lösungen mit elektrodenbezogenen RG Was entsteht bei der Schmelzflußelektrolyse von NaCl? Was entsteht bei der Elektrolyse von wäßrigen NaCl-Lösungen? Wie kann Chlor im Labor gewonnen werden ?(+RG) Herstellung von Chlorwasserstoff (3 Möglichkeiten, +RG) Was sind Azeotrope? Herstellung von Hypochloriten (+RG) Was ist eine Disproportionsreaktion? Herstellung von Chloraten und Perchloraten (+RG) Vorkommen von Brom mit Formel Herstellung von Brom (2 Möglichkeiten + RG) Herstellung von Bromwasserstoff (2 Möglichkeiten +RG) Vorkommen von Iod mit Formel Herstellung von Iod (+RG) Eigenschaften und Verwendung von Iod. ch_aoc.doc/14.05.16/Seite 20 WASSERSTOFF H Vorkommen: Wasser H2O (11,2%) frei in der Atmosphäre nur in Spuren (Vulkane) Herstellung: 1. Technische Herstellung: 1.1. Zersetzungszellen: Wasser wird zur besseren Leitfähigkeit mit NaOH oder NaCl versetzt. Es sind mehrere Zellen hintereinander geschaltet. RG: 1.2. Als Nebenprodukt bei der Chloralkalielektrolyse (siehe ChlorHerstellung) 1.3. Wassergasprozeß: Man leitet Waserdampf über glühende Kohlen oder Koks. RG: Das gebildete CO wird mit weiteren Wasserdampf an einem Fe 2O3-Katalysator, der etwas Chrom(III)oxid enthält zu CO2 und H2 konvertiert (siehe NH3-Herstellung). RG: 2. Herstellung im Labor: 2.1. Elektrolyse im Hofmann´schen Zersetzungsapparat: Er ist anfänglich bis zu den Hähnen mit Wasser gefüllt. RG: 2.2. Aus Säuren mit Metall: Es werden Metalle, die unedler als Wasserstoff sind (siehe elektrochemische Spannungsreihe) mit Säuren umgesetzt. Man arbeitet meist mit Zink im Kipp´schen Apparat: RG: ch_aoc.doc/14.05.16/Seite 21 Eigenschaften: 1. Physikalische Eigenschaften: Thermische Daten: Kp = -252,8°C = 20,4 K (farblose Flüssigkeit) Fp = -259,3°C = 14,1 K (hexagonal) Kritische Daten: Tkrit. = -239,9°C Die kritische Temperatur ist jene Temperatur, bei der ein Gas gerade noch verflüssigbar ist. Oberhalb dieser Temperatur ist es nicht möglich. pkrit. = 12,8 atm = 12,97 bar Der kritische Druck ist der Druck, der bei der kritischen Temperatur notwendig ist, um ein Gas zu verflüssigen. krit. = 0,031g/cm3 Die kritische Dichte ist die Dichte, die das Gas und die Flüssigkeit bei der kritischen Temperatur und dem kritischen Druck haben. Diffusionsvermögen: Ist die Fähigkeit sich - auch durch ein poröses Material- in ein anderes Medium auszubreiten. Die Diffusionsgeschwindigkeit ist indirekt proportional der Wurzel aus dem Molekulargewicht. Wasserstoff diffundiert daher als leichtestes Gas am schnellsten (auch durch Eisen, Platin, etc., wichtig für den Gerätebau). Löslichkeit: In Wasser gering, besser in Alkohol, in vielen Metallen sehr gut, (so löst Palladium-(Pd)schwamm, gemessen am Eigenvolumen, das 850fache Volumen an Wasserstoff. Pd-Schwamm wird daher als Hydrierkatalysator eingesetzt). 2. Chemische Eigenschaften: Brennbar, verbrennt an der Luft mit fahlblauer Flamme. RG: Knallgas: Gemisch Wasserstoff:Sauerstoff = 2:1. Die Umsetzung erfolgt bei Zimmertemperatur nur langsam, in der Wärme oder mit Katalysatoren explosionsartig. Verwendung: Zum autogenen Schweißen und Schneiden. Die Schweißnaht wird aus dem Metall selbst erzeugt. Die Verbrennung erfolgt im Daniell´schen Hahn (Knallgasgebläse) mit Sauerstoff. Verbrennungstemperaturen: H2/O2 2700°C H2/Luft 2000°C Acetylen C2H2/O2 3000°C Reduktionsmittel: Wasserstoff entzieht vielen Verbindungen den Sauerstoff. Hydrid-Bildung mit Metallen (z.B. NaH, CaH2,), und Hydrogen..ide mit Nichtmetallen (z.B. HCl,H2S) Hydrierung: Anlagerung von Wasserstoff an ungesättigte organische Verbindungen (z.B. Fetthärtung) Wasserstoff kommt in roten Stahlflaschen unter Druck in den Handel. ch_aoc.doc/14.05.16/Seite 22 Atomarer Wasserstoff: Er ist weit reaktionsfähiger als normaler Wasserstoff. Man erhält ihn durch Energiezufuhr aus normalen Wasserstoff: RG: Herstellung: 1. nach Wood: Molekularer Wasserstoff wird unter stark verminderten Druck einer elektrischen Entladung ausgesetzt. 2. nach Langmuir: Zwischen Wolfram-Elektroden wird in einer Wasserstoffatmosphäre ein Lichtbogen gezündet. Durch eine Düse wird ein scharfer Wasserstoffstrahl geblasen. Diese Langmuir-Fackel wird zum Schmelzen und Schweißen hochschmelzender Metalle (z.B. W, Ta) und Metalloxide (z.B. ThO2) verwendet. Die Temperatur von ca. 4700°C wird durch die Rückbildung zu molekularem Wasserstoff erreicht. Wasserstoff in status nascendi (im Zeitpunkt des Enstehens): Er tritt bei allen chemischen und elektrischen Wasserstoffherstellungsverfahren auf. Es handelt sich um atomaren Wasserstoff, der weit reaktionsfähiger ist. Er ist nur kurze Zeit beständig. Wasserstoffisotope: Man kennt 3, die infolge ihrer unterschiedlichen physikalischen Eigenschaften trennbar sind. 1. Leichter Wasserstoff oder Protium 1H oder H: Er stellt zu 99,98% den natürlichen Wasserstoff dar. 2. Schwerer Wasserstoff oder Deuterium 2H oder D: Zu 0,02% im natürlichen Wasserstoff enthalten. Herstellung aus Wasser oder technischen Elektrolytlaugen, wo er sich in der zurückbleibenden Flüssigkeit anreichert. Neben dem leichten Wasser H2O gibt es daher das halbschwere Wasser HDO, das schwere Wasser D2O und das sehr schwere Wasser T 2O. Das schwere Wasser findet in Reaktoren als Neutronenbremse Verwendung. 3. Überschwerer Wasserstoff oder Tritium 3H oder T: Spurenweise in der Natur, Herstellung meist künstlich durch Neutronenbeschuß von Lithium. Er ist radioaktiv und wird zu Markierungszwecken verwendet. Beantworte folgende Fragen: 01. Nenne das Hauptvorkommen von Wasserstoff! 02. Wie wird Wasserstoff im Labor gewonnen? (mit RG) 03. Nenne 2 elektrolytische Verfahren zur Herstellung von Wasserstoff (mit elektrodenbezogenen RG) 04. Wie wird Wasserstoff durch den Wassergasprozeß gewonnen? (Mit RG) 05. Was ist die kritische Temperatur? 06. Wie verhält sich das Diffusionsvermögen eines Gases im Verhältnis zum Molekulargewicht? 07. Nenne einige Verwendungsmöglichkeiten von Wasserstoff! 08. Was ist Wasserstoff ”status nascendi”? 09. Nenne alle Wasserstoffisotopen mit ihrer Atommasse und chemischen Zeichen! ch_aoc.doc/14.05.16/Seite 23 16. Gruppe oder 6. Hauptgruppe VIa (alt) - CHALKOGENE Der Name bedeutet Erzbildner. Name OZ Atommasse O S Se Te Po 8 16 34 52 84 15,9994 32,064 78,96 127,60 210 Metallcharakter Eigenschaften SAUERSTOFF O Vorkommen: 1. frei: in der Luft zu 20,9Vol-% 2. gebunden: in Wasser andere Verbindungen wie Oxide und Salze von Oxosäuren. in der Erdrinde ist Sauerstoff das häufigste Element. Herstellung: Aus der Luft: durch fraktionierte Tieftemperatur-Druck-Destillation flüssiger Luft in einer Linde-Anlage (O2 + 0,7% Ar +0,3%N2) Eigenschaften: Farbloses, geruchloses und geschmackloses Molekulargas. Er ist sehr reaktionsfähig und ein gutes Oxidationsmittel. Rasche Oxidation bei höherer Temperatur unter Licht und Wärmeentwicklung heißt Verbrennung. Langsame Oxidation findet beim Verwesen, Verrotten und Rosten statt. Enzymatisch gesteuerte Verbrennung ist Atmung (Assimilation bei Pflanzen ist der umgekehrte Vorgang). RG: Verwendung: Oxidationsmittel, flüssiger Sauerstoff für Raketentreibstoff (mit Hydrazin, Wasserstoff oder Kohlenwasserstoffe), Sprengstoff (Oxyliquid) und eventuell als Kühlmittel. ch_aoc.doc/14.05.16/Seite 24 Verbindungen: Wasser H2O: wird in einem eigenen Kapitel behandelt. Ozon O3: Vorkommen: Blitzentladungen, Funkenstrecken (Schweißen),UV-Strahlung, kurzwelliger Strahlung (und Röntgenstrahlung), radioaktive Präparate, chemische Vorgänge (z.B.: feuchter, weißer Phosphor an der Luft, Kaliumpermanganat KMnO 4 und Schwefelsäure). Herstellung: Siemens´schen Ozonisator: Bei niedriger Temperatur und einer Spannung von mehreren tausend Volt erfolgt eine stille elektrische Entladung, die im besten Fall 15% Ozon liefert. RG: Abb. xxx Eigenschaften: Bis in große Verdünnungen riechbar (ozonos = Gestank). Es zerfällt leicht unter Energieabgabe in molekularen Sauerstoff. Es ist ein starkes Oxidationsmittel und ist in größerer Konzentration ein Lungengift. Verwendung: Luftverbesserung, Luft- und Trinkwassersterilisation, Strukturaufklärung organischer Verbindungen, Bleichmittel, Oxidationsmittel. Wasserstoffperoxid, Wasserstoffsuperoxid, Perhydrol, Dihydrogendioxid H 2O2 : Herstellung: 1. Katalytische Hydrierung von Anthrachinon (I) zu Anthrahydrochinon (II) und anschließende Oxidation mit Sauerstoff: RG: 2. Elektrolytische Oxidation von Schwefelsäure an der Anode und anschließende Hydrolyse. Die Elektrolyse erfolgt bei starker Kühlung und hoher Stromdichte an der Anode: RG: Reaktionsablauf: RG: Verwendung: ch_aoc.doc/14.05.16/Seite 25 Bleichmittel, Perboratherstellung (siehe Bor), Desinfektionsmittel. ch_aoc.doc/14.05.16/Seite 26 LUFTZERLEGUNG (Linde-Verfahren) Verfahrensprinzip: ist die fraktionierte Tieftemperatur-Druck-Destillation flüssiger Luft. Die atmosphärische Luft ist ein Gasgemisch von nachstehender mittlerer Zusammensetzung: 78,10 Vol% Stickstoff (kann produktionsbedingt Edelgase enthalten) 20,90 Vol% Sauerstoff 0,95 Vol% Edelgase (können Stickstoff enthalten) 0,05 Vol% Kohlendioxid und Wasserdampf (sind zu Beginn zu entfernen) Will man daraus Stickstoff und Sauerstoff gewinnen, so muß dieses Gemisch auf physikalischen Weg zerlegt werden. Luftverflüssigung: Zur Stofftrennung ist es notwendig, daß die Luft zuerst durch Abkühlen auf -200°C verflüssigt wird. Diese Luftverflüssigung gelang Carl von Linde, indem er sich des JouleThomson-Effektes bediente. Joule-Thomson-Effekt: Ein komprimiertes Gas, das auf einen niedrigeren Druck entspannt wird, kühlt sich ab (0,25°C pro bar Druckabnahme). Die aufgewendete Arbeit für die Ausdehnung führt zu einem Energieverlust und damit zur Abkühlung des Gases. Arbeitsweise: Die Luft wird komprimiert und die bei der Kompression freiwerdende Wärme abgeführt. Danach wird entspannt. Die so abgekühlte Luft wird zur Vorkühlung nachkommender Luft verwendet, die dann bei der Entspannung eine tiefere Temperatur erreicht. Durch ständige Wiederholung dieses Vorganges wird die Luft bei -200°C verflüssigt. Luftzerlegung: Aus der flüssigen Luft kann durch fraktionierte Tieftemperaturdestillation der bei -196°C siedende Stickstoff und der bei -183°C siedende Sauerstoff getrennt gewonnen werden. (Die Siedepunkte sind auf den Normaldruck von 1013,25 mbar bezogen) Arbeitsweise: Luftverflüssigung: Die angesaugte Frischluft wird im Filter (F1) von festen Verunreinigungen befreit und in den ersten beiden Stufen des Kompressors (V1) auf 8 bar verdichtet. Die verdichtete Luft wird im Waschturm (C1) mit Lauge zur Entfernung des CO 2 berieselt. Die so vorgereinigte Luft wird in der 3. und 4. Stufe des Kompressors auf 80 bar verdichtet. Anschließend wird der Luftstrom geteilt und in 2 Wärmetauscher geführt. Die Durchgangsröhren sind von kalten Sauerstoff (W1) und von kalten Stickstoff (W2) umspült. Durch diese Abkühlung wird die in der Luft enthaltene Feuchtigkeit in Form von Wasser in den Abscheidern (F2, F3) abgetrennt. Eventuell vorhandenes Ethin wird im Ethinabscheider (F4) abgetrennt. Die kalte Luft gelangt nun in zwei weitere Wärmetauscher, wo ihr sehr kalter Stickstoff (W3) und sehr kalter Sauerstoff (W4) unmittelbar vom Trennapparat her entgegenströmt. ch_aoc.doc/14.05.16/Seite 27 Am Ende der beiden Wärmetauscher hat die Luft nahezu Verflüssigungstemperatur erreicht. Über ein Entspannungsventil (V101) wird die Luft im unteren Teil des Trennapparates (K1) auf 6 bar entspannt, wodurch Verflüssigung eintritt. Trennapparat: Die Destillierkolonne (K1) ist in der Mitte durch einen Kondensator in zwei getrennte Druckbereiche unterteilt. Der Kondensator besteht aus einer Siebplatte, in deren Löcher Rohre eingelassen sind, die in einer Haube münden. Das Innere des Kondensators (Rohre und Haube) steht nur mit dem unteren Teil des Trennapparats in Verbindung. Trennvorgang: Die vom Entspannungsventil kommende Luft wird in der unteren Trennsäule flüssig. Der niedriger siedende Stickstoff verdampft größtenteils und geht nach oben, während eine sauerstoffreiche Luft als Flüssigkeit im Sumpf zurückbleibt. Die flüssige Luft führt man über ein Entspannungsventil (V102) in die obere Trennsäule und entspannt dabei auf 1,5 bar. Dabei tritt eine weitere Abkühlung ein und die Luft trennt sich in den gasförmig verbleibenden Stickstoff und den sich in flüssigen Zustand um die Kondensatorrohre sammelnden Sauerstoff. Dadurch wird der noch komprimierte Stickstoff (6 bar) innerhalb des Kondensators teilweise flüssig und fließt in die Rinne. (Abhängigkeit des Siedepunktes vom Druck!) Zur Verstärkung der Trennwirkung wird der flüssige Stickstoff aus der Rinne und der gasförmige Stickstoff aus der Kondensatorhaube über die beiden Entspannungsventil (V103 und V104) in den Kopf der oberen Trennsäule geführt. Durch die Entspannung bleibt nur mehr reiner, gasförmiger Stickstoff am Trennsäulenkopf über. Der reine gasförmige Stickstoff verläßt am Kopf die Trennsäule und dient in den Wärmetauschern (W3 und W2) als Kühlmittel, bevor er seiner Verwendung zugeführt wird. Der Sauerstoff sammelt sich in flüssiger Form um die Kondensatorrohre im oberen Teil der Trennsäule. Er geht über die Wärmetauscher (W4 und W1) zur Abfüllung. Beantworte folgende Fragen: 1. Durch welche Allgemeine physikalische Methode kann flüssige Luft zerlegt werden? 2. Wie lautete der Joule-Thomson-Effekt? 3. Welcher Bestandteil der flüssigen Luft (N2 oder O2) hat den tieferen Siedepunkt? 4. Beschreibe das Verfahren anhand des Fließbildes! ch_aoc.doc/14.05.16/Seite 28 Fließbild LUFTZERLEGUNG (Linde-Verfahren) xxx ch_aoc.doc/14.05.16/Seite 29 WASSER Dieses Kapitel beschäftigt sich mit chemisch technischen Verfahren zur Aufbereitung des Rohwassers und zur Reinigung von Abwässern. Natürliches Wasser: 1. Regenwasser: reinstes natürliches Wasser, enthält geringe Mengen CO2, Staub, Nitrate und SO2. 2. Grund- und Quellwasser: durchfließt mehrere Bodenschichten, die Schwebstoffe herausfiltern. Es enthält gelöste Salze, die die Wasserhärte bilden. 3. Oberflächenwasser (Bäche, Flüsse, Seen und Meere): Oberflächenwasser ist durch Schwebstoffe getrübt, da es keine Bodenschichten durchläuft. Im Wasser gelöste Stoffe und Wasserhärte: siehe Kesselspeisewasser (Fließbild) Anomalie des Wassers Wasser hat bei 4°C die größte Dichte. Unter und über dieser Temperatur sinkt die Dichte ab. Beim Gefrieren dehnt es sich um 1/11 aus (Leitungen platzen). Verwendung des Wassers: 1. Trinkwasser: Die Anforderungen unterliegen dem Lebensmittelcodex (=Gesetz), die sehr hoch sind. 2. Nutz- und Brauchwasser: Es handelt sich um Wasser für Gewerbe und Industrie, an das je nach Verwendungszweck verschiedene Anforderungen gestellt werden. a) Kesselspeisewasser: Wasser zur Dampferzeugung muß aufbereitet werden, wobei das Wasser für moderne Kessel enthärtet, entsalzt und gasfrei sein muß. Kesselstein legt sich an den Rohrwänden an und behindert den Wärme austausch. Im Wasser gelöste Gase greifen die Metallwände des Kessels an, wobei die Korrosion durch Cl--Ionen beschleunigt wird. b) Kühlwasser: Da Kühlwasser aus Kostengründen heute meist im Kreislauf geführt wird muß es frei von Schwebestoffen und Mikroorganismen sein und eine geringe Salzkonzentration haben. c) Lebensmittel-, pharmazeutische Industrie und Medizin: In der Lebensmittelindustrie darf nur Trinkwasser verwendet werden. In Medizin und pharmazeutischer Industrie wird fast ausschließlich Aqua bidestillata (doppelt destilliertes Wasser) verwendet. ch_aoc.doc/14.05.16/Seite 30 KESSELSPEISEWASSERAUFBEREITUNG 1. Allgemeines: Die Hauptmenge des in der Industrie genutzten Wassers wird für Kühlzwecke und als Kesselspeisewasser zur Dampferzeugung verwendet. Im Dampfkesselbetrieb ist die Beschaffenheit des Wassers von größter Bedeutung, da die Verunreinigungen des Wassers entweder den Kesselbaustoff unmittelbar zerstören können oder sich als Kesselstein abscheiden. Dieses kann leicht zur Überhitzung und zum Ausbeulen der Rohre führen. Natürliches Wasser enthält stets eine Anzahl von Verunrenigungen, z.B. 1. Schwebestoffe und Mikroorganismen 2. Gelöste Gase aus der Luft: N2, O2, CO2, NOx, SO2 Die Löslichkeit von Gasen ist vom Gas, Druck und Temperatur abhängig. Bei großem Druck und tiefer Temperatur sind Gase besser löslich. 3. Gelöste Stoffe aus der Erde: O2, CO2, NH3, Ca2+, Mg2+, Na+, K+, Fe3+, NO2-, NO3-, Cl-, HCO3-, SO42-, gelöste organische Stoffe Für Gebrauchszwecke wird das Wasser nach dem Gehalt an gelösten Stoffen eingestuft. Ca2+- und Mg2+-Salze bilden die Wasserhärte, Alkalisalze sind die Salze des Wassers. Wasserhärte: Gelöste Calcium- und Magnesiumsalze werden als Härte des Wassers bezeichnet. Man unterscheidet folgende Härtearten: 1. Karbonat-, temporäre oder vorübergehende Härte: Diese Härte wird vor allem durch die Hydrogencarbonate von Ca 2+, Mg2+ und Fe3+ hervorgerufen. Sie stört bei der Verwendung als Kesselspeisewasser und Kühlwasser durch die Bildung von schwerlöslichen Kesselstein. RG: 2. Mineralsaure-, Nichtcarbonat-, permanente oder bleibende Härte: Sie wird vor allem durch die Chloride und Sulfate der Erdalkalien gebildet. Diese Salze scheiden sich beim Erwärmen nicht ab und werden deshalb als bleibende Härte bezeichnet. 3. Gesamthärte: Sie ist die Summe aus temporärer und permanenter Härte. Einheiten der Wasserhärte: 1°d (deutsche Härte) = 10 mg CaO/l (Mg wird in Ca umgerechnet) 1 ppm (part per million) = 1 mg CaCO3/l (USA) Einteilung des Wassers nach °d: 0 – 4 sehr weich 4 – 8 weich 8 – 12 mittelhart 12 – 18 ziemlich hart 18 – 30 hart über 30 sehr hart Hochquellenwasser in Wien hat die Härte 7-8. Oberflächenwasser ist meist härter als Grundwasser. ch_aoc.doc/14.05.16/Seite 31 2. Wasserenthärtung und Wasserentsalzung: Es kommen zwei Verfahren zur Anwendung, die meistens kombiniert werden. 1. Chemische Enthärtung: Die Härtebildner werden in schwerlösliche Salze oder stabile lösliche Komplexverbindungen übergeführt. a) Kalk(milch)-Soda-Verfahren (Fällungsverfahren): Die Karbonathärte wird zur Gänze entfernt, da die Hydrogencarbonate mit Kalkmilch als unlösliche Niederschläge ausgefällt werden. RG: Die permanente Härte wird durch eine äquivalente Menge NaCl oder Na 2SO4 ersetzt. Resthärte 1-2°d. RG: b) Phosphatverfahren (Komplexierungsverfahren): xxx 2+ Heute verwendet man Polyphosphate, die Ca schwerlösliche Verbindungen oder lösliche Verbindungen liefern. Resthärte ca. 0,3°d. RG: 2. Entsalzung mittels Ionentauscher (Beseitigung der Resthärte, A=Austauscher): Man setzt Neutrale oder saure Kationen- und basische Anionentauscher ein. Ionentauscher sind hochmolekulare Kunststoffe mit lose gebundenen H +, Na+ oder OH--Ionen, die gegen gleichgeladene Ionen ausgetauscht werden können. Dies führt zur Vollentsalzung des Wassers. Die verbrauchten Tauscher können durch Behandeln mit verdünnten Säuren oder Laugen regeneriert werden. Neutrale Kationentauscher ersetzen Kationen (Ca 2+, Mg2+...) gegen Na+ (seltener eingesetzt): RG (Tausch): RG (Regeneration): Saure Kationentauscher ersetzen Kationen gegen H+ (häufiger eingesetzt): RG (Tausch): RG (Regenartion): (Basische) Anionentauscher ersetzen Anionen gegen OH-: RG (Tausch): RG (Regeneration): ch_aoc.doc/14.05.16/Seite 32 Anwendung der Harztauscher: Enthärtung geschieht meist mit Neutraltauschern und ist fast vollständig möglich. Enthärtung und Entsalzung ist bis zu ca. 97- 98 % möglich. Es werden zuerst die Kationen und dann die Anionen getauscht. Bei zu harten Wässern ist eine chemische Vorenthärtung notwendig. Die erzielte Wasserqualität entspricht einem einfach destillierten Wasser, es ist aber nicht gasfrei. 3. Arbeitsweise: Dem Fällungsbehälter (C1) fließt kontinuierlich Rohwasser zu, das mit Kalkmilch versetzt wird, wobei die Hydrogencarbonate größtenteils ausfallen. Kolloidale Fällungen werden durch Zugabe von Eisentrichlorid ausgeflockt. Der zu Boden sinkende Fällschlamm kann ausgeschleust werden, während das Überlaufwasser über einen Kiesfilter (F1) gepumpt (P1) wird. Im Kationentauscher (F2) werden nun die Metallionen der nicht umgesetzten Hydrogencarbonate und der anderen Salze gegen H +-Ionen getauscht. Das im Kationentauscher entstehende CO2 wird durch Einblasen von Luft (V1) in einem Entgaser (C2) entfernt. Im Anionentauscher (F3) erfolgt der Austausch der Säurerestionen gegen OH--Ionen. Ein nachgeschaltetes Mischbett (F4), welches Kationen- und Anionentauscher gleichzeitig enthält, führt zur vollständigen Entsalzung des Wassers. Die Entfernung des noch gelösten Sauerstoffes erfolgt durch chemische Entgasung (C3) mittels Hydrazin. RG: Das so behandelte Wasser kann für die Dampferzeugung verwendet werde. Beantworte folgende Fragen: 01. 02. 03. 04. 05. 06. Welche Stoffe bilden die temporäre bezw. die permanente Härte? Wie wird die Wasserhärte angegeben (Einheit)? Nennen Sie die zwei grundsätzlichen Methoden zur Wasserenthärtung! Was versteht man unter ”Ionentauscher”? Wie werden Kationen- bezw. Anionentauscher regeneriert? Beschreibe die Kesselspeisewasseraufbereitung an Hand des Fließbildes! ch_aoc.doc/14.05.16/Seite 33 Fließbild KESSELSPEISEWASSERAUFBEREITUNG xxx ch_aoc.doc/14.05.16/Seite 34 BIOLOGISCHE ABWASSERREINIGUNG 1. Allgemeines: Abwasser ist ein durch häuslichen, landwirtschaftlichen und industriellen Gebrauch verschmutztes Nutzwasser. Im weiteren Sinn wird auch das von Dächern, Höfen, Straßen und Plätzen abfließende Niederschlagswasser dazu gerechnet. Auch Sickerwasser (Fremdwasser) von organisierten Drainagen (Entwässerungsanlagen), Sickerleitungen, künstlichen Grundwasserabsenkungen, sowie von Grundwässern, die durch undichte Stellen der Abflußrohre und -bauwerke in die Kanalisation fließen, wird in die Berechnung der Abwasserbeseitigungsanlagen eingeschlossen. Hauptmerkmal eines Abwassers ist die Herabsetzung der ursprünglichen Qualität, die sich in der Verschlechterung der Gewässergüte ausdrückt. Um die Wassergüte vor dem Einleiten in natürliche Gewässer zu verbessern, müssen Abwässer biologisch aufbereitet werden. 2. Verfahrensprinzipien: Ziel der Abwasserreinigung ist die weitgehende Entfernung aller im Abwasser enthaltenen Schadstoffe. Zur Erreichung dieses Zieles stehen mehrere Verfahren zur Verfügung, die meist miteinander kombiniert werden: mechanische Verfahren (3a und 3b) biologische Verfahren (3c und 3d) chemisch-physikalische Verfahren (3e) 3. Arbeitsweise: a) Mechanische Reinigungsstufe (Rechen und Sandfang): Aus der Kanalisation gelangt das Abwasser in die mechanische Reinigungsstufe der Kläranlage, in der zuerst das grobe Rechengut und der Sand abgefangen werden. Je nach der lichten Weite zwischen den Rechenstäben unterscheidet man zwischen Grobund Feinrechen. Die laufende Reinigung von angelagertem Material ist eine Schlüsselaufgabe für den einwandfreien Betrieb einer Anlage. b) Vorklärbecken: Anschließend gelangt das Abwasser in große Absetzbecken, in denen es ein bis zwei Stunden verweilt. Während dieser Vorklärung setzen sich die ungelösten, absetzbaren Schwebstoffe auf dem Boden als Schlamm ab. ch_aoc.doc/14.05.16/Seite 35 c) Belebungsbecken: Meist längsdurchströmte, rechteckige Becken. In ihnen befinden sich die Mikroorganismen, welche die Wasserinhaltstoffe aufnehmen. Das Belebtschlammverfahren ist ein kontinuierlich beschickter Reaktor mit einem biologisch geschlossenen System. Die Mikroorganismen werden im System gehalten, es fließt ihnen beständig Nährlösung (NH4NO3, Phosphate) zu. Der aus der Verwertung der Nährlösung resultierende Organismenzuwachs wird aus dem System entfernt. Der technische Grundtyp besteht aus einem Reaktionbecken, in dem die Organismen vorhanden sind und dem ständig Nährlösung zugeführt wird. Zur Sauerstoffversorgung und um die Organismen (aerob=sauerstoffverbrauchend) in Schwebe zu halten, wird belüftet und umgewälzt. Belüfter-Bauarten: Oberflächenbelüfter Tiefenbelüfter Schlauchbelüfter mit Druckluft Verweilzeit im Becken: Die Verweilzeiten im Belebungsbecken betragen etwa 2 bis 3 Stunden. Während dieser Zeit wandeln die Mikroorganismen den vorhandenen biologisch abbaubaren, organischen Schmutz in 50% Zellmasse (Belebtschlamm) und 50% CO2 um. Bedingungen: * pH-Wert: 6,5 bis 8,5 (wenn schwach alkalisch, fallen die meisten Schwermetalle schon im Vorklärbecken aus und werden entfernt, da sie Bakteriengifte sind) * ausreichende Sauerstoffzufuhr * Vorhandensein von Nährstoffen, wie Stickstoff und Phosphor, sowie Spurenelementen d) Nachklärbecken: Der Belebtschlamm wird in ein nachfolgendes Klärbecken geleitet und wird dort beruhigt, so daß sich die Organismen absetzen (Sedimentation) können. Um die Schlammenge im Belebungsbecken konstant zu halten, ist es notwendig, eine gewisse Menge an Schlamm in das Belebungsbecken zurückzuführen (Rücklaufschlamm). Der Restschlamm (Hauptmenge) wird vom größten Teil des Wasser abfiltriert bezw. abzentrifugiert und verbrannt oder einer anaeroben (ohne Sauerstoff) Gärung zugeführt. (Faulturm - BiogasHerstellung CH4) e) Chemische Klärung: Die chemische Klärung von Abwässern erfolgt vor allem in Industrie- und Gewerbebetrieben. Durch pH-Einstellungen und Zusatz von Fällungsmitteln werden die betreffenden Stoffe unlöslich gemacht, über Sandfilter oder Filterpressen herausfiltriert und danach als vorgereinigtes Wasser (in den meisten Fällen) der Kläranlage zugeführt. ch_aoc.doc/14.05.16/Seite 36 Fließbild BIOLOGISCHE ABWASSERREINIGUNG (Kauptkläranlage Wien) 1) Schotterfang 2) Schneckenpumpen 3) Rechenanlage 4) Sandfang 5) Vorklärbecken 6) Belebungsbecken 7) Nachklärbecken 8) Kaplanturbine 9) Eindicker 1] Hauptsammelkanal u. EbS Abwasser 2] Preßgut aus dem Schotterfang 3] Preßgut aus der Rechenanlage 4] Sandfanggut 5] Primärschlamm 6] Sekundärschlamm 7] Rücklaufschlamm 8] Überschußschlamm 9] Phosphatfällung 10] elektr. Energie 11] geklärtes Wasser 12] Dünnschlamm Das über die Hauptsammelkanäle [1] einlangende Abwasser wird - nach Abscheidung der Grobstoffe im Schotterfang (1) - durch sechs Schneckenpumpen (2) gehoben, die bis zu 24 m³/s bewältigen können. In der Rechenanlage (3) - 6 Rechen - werden dem Abwasser die Schwimm- und Schwebstoffe entnommen, das Rechengut [3] kommt nach Entwässerung in geschlossenen Containern zur Verbrennung. Auch das Schotterfanggut [2] und das Sandfanggut [4]- vorwiegend Schwerstoffe mineralischer Natur wie Sand, Asche etc. - wird nach der Entwässerung verbrannt. Letzte Stufe der mechanischen Reinigung des Wiener Abwassers ist die mechanische Vorklärung in acht Becken (5). Durch die Verringerung der Fließgeschwindigkeit setzen sich die im Abwasser verbliebenen Schwebstoffe ab. Der sich am Boden der Vorklärbecken bildende Schlamm (Primärschlamm) [5] wird durch Räumer in Sammelrinnen geschoben und dann zu den Eindickern (9) gepumpt. Durch die mechanische Reinigung des Abwassers lassen sich bis zu 30 % der Schmutzstoffe entfernen. Die biologische Reinigung beginnt in den vier Belebungsbecken (6), wo Mikroorganismen die gelösten Schmutzstoffe abbauen. Der für den Abbauprozeß benötigte Sauerstoff wird durch 32 Kreiselbelüfter zugeführt. In den 16 Nachklärbecken (7) erfolgt die endgültige Trennung des Schlammes vom Abwasser. Das gereinigte Abwasser gelangt über Zahnschwellen in den Ablaufkanal (11). Der Rücklaufschlamm [7] wird in die Belebungsbecken rückgeführt, um die Anreicherung mit Mikroorganismen zu beschleunigen. Der Anfallende Überschußschlamm [8] wird aus dem Rücklaufschlamm in die Eindicker (9) gepumpt. Im Ablauf des Belebungsbecken erfolgt auch die Phosphatfällung [9]. Die Eindicker (9) für Primär [5]- und Überschußschlamm [8] haben ein Fassungsvermögen von 13.500 m 3. Von diesen gelangt der Schlamm [12] in die EbS, wo jener entwässert und verbrannt wird. Zur Ausschaltung von Geruchsbelästigungen, wie sie bei ungünstigen meteorologischen Situationen auftreten können, wurden Schotterfang, Schneckenpumpwerk, Sandfang, Eindicker und die Schlammrinnen abgedeckt. Die abgesaugte Abluft wird durch Biofilter gereinigt. ch_aoc.doc/14.05.16/Seite 37 SCHWEFEL S Vorkommen: frei in der Nähe von Vulkanen gebunden als: Sulfide (Kiese, Glanze und Blenden), z.B.: Kupferkies CuFeS2 Bleiglanz PbS Zinkblende ZnS Sulfate (Spate ausgenommen Flußspat CaF2), z.B.: Gips CaSO4.2H2O Schwerspat BaSO4 Bestandteil der Eiweißstoffe Herstellung: 1. Aus den natürlichen Vorkommen durch Ausschmelzen des Schwefels mit Hilfe der Schwefelpumpe nach Frash. ch_aoc.doc/14.05.16/Seite 38 2. Aus Schwefelwasserstoff durch Verbrennen mit Katalysatoren im Claus-Ofen: RG: Eigenschaften: Physikalische Eigenschaften: Schwefel kommt in mehreren festen und flüssigen Formen (Modifikationen) vor. -Schwefel rhombisch gelb -Schwefel monoklin gelb fester Schwefel -Schwefel) zähflüssig CS2-unlöslich braun flüssiger Schwefel (-Schwefel flüssig, CS2löslich, gelb (S8 S6 S4 S2) orangegelb rot strohgelb temperaturabhängiges Gleichgewicht dampfförmiger Schwefel Chemische Eigenschaften: Schwefel verbindet sich bei mäßig erhöhter Temperatur mit vielen Metallen und Nichtmetallen. Verwendung: Herstellung von Schwefelsäure, Vulkanisieren von Kautschuk, Kunststofferzeugung (Thiokole), Schädlingsbekämpfungsmittel ch_aoc.doc/14.05.16/Seite 39 Verbindungen: Schwefelwasserstoff(säure), Sulfide, H2S, S2Herstellung: 1. Aus den Elementen: RG: 2. Aus Sulfiden (FeS) mit Säure im Kipp´schen Apparat (siehe H): RG: Eigenschaften: Farbloses, nach faulen Eiern riechendes, stark giftiges, in Wasser lösliches Gas. Er verbrennt an der Luft zu Wasser und Schwefeldioxid. Die wäßrige Lösung zersetzt sich an der Luft unter Lichteinfluß zu Schwefel und Wasser. Er ist ein Reduktionmittel. Schwefeldioxid, Anhydrid der schwefeligen Säure, SO 2 Herstellung: siehe Schwefelsäure-Herstellung (Fließbild) Eigenschaften: Farbloses, stechend riechendes, in Wasser lösliches Gas. Es ist ein Reduktionsmittel. Verwendung: Bleichmittel für empfindliche Fasern, zum Ausräuchern von Weinfäsern, Zwischenprodukt bei der Schwefelsäureerzeugung. Schwefeltrioxid, Anhydrid der Schwefelsäure SO3 Herstellung: siehe Schwefelsäure-Herstellung (Fließbild) Verwendung: Ausgangsprodukt für die Schwefelsäureerzeugung, Herstellung von Sulfo(n)säuren. Schwefelige Säure, Schwefel(IV)säure, Sulfite, Sulfate(IV), H 2SO3, SO3 2Herstellung: Durch Lösen von Schwefeldioxid in Wasser RG: Eigenschaften: Sie ist unbeständig und zerfällt in ihre Bestandteile. Sie ist ein starkes Reduktionsmittel. Verwendung: ch_aoc.doc/14.05.16/Seite 40 Salze: Calciumhydrogensulfit Ca(HSO3)2, Magnesiumhydrogensulfit Mg(HSO3)2 werden zur Herstellung von Zellulose aus Holz verwendet (lösen Lignin und andere Verunreinigungen aus dem Holz). Schwefelsäure, Sulfate, Schwefel(VI)säure, Sulfate(VI), H2SO4, SO4 2Herstellung: siehe Schwefelsäure-Herstellung (Fließbild) Eigenschaften: Ölige, farblose Flüssigkeit, stark wasserentziehend, wirkt auf viele organische Substanzen verkohlend. Starke zweibasige Säure, wobei die sauren Eigenschaften in der verdünnten Säure überwiegen, die oxidierenden in der konzentrierten. Verwendung: Herstellung anderer anorganischer Säuren (z.B. Salzsäure, Phosphorsäure und Phosphordünger), Sulfurierung organischer Stoffe, als Nitriersäure (gemischt mit conc. Salpetersäure), Akkumulatorsäure. Thioschwefelsäure, Thiosulfat H2S2O3, S2O32Herstellung: Die freie Säure ist unbeständig, ihre Salze werden durch Einbringen von Schwefel in die entsprechende Sulfitlösung gewonnen. RG: Verwendung: Natriumthiosulfat Na2S2O3.5H2O als Fixiersalz in der Photographie und als Antichlor in der Bleicherei verwendet. ch_aoc.doc/14.05.16/Seite 41 SCHWEFELSÄUREERZEUGUNG Das heute angewandte Kontakt-(Krebs)-Verfahren läßt sich in drei wesentliche Verfahrenschritte unterteilen. 1. Herstellung eines SO2-hältigen Gases: Je nach der Art der zur Verfügung stehenden Rohstoffe können dafür nachstehende Methoden zur Anwendung kommen: a) Verbrennen von Schwefel (Elementarsynthese): RG: b) Rösten sulfidischer Erze (z.B. Pyrit) Rösten ist die Behandlung sulfidischer Erze mit überschüssigem Luft(sauerstoff) in der Hitze. Es entsteht immer SO2 und meist das höherwertige Oxid des entsprechenden Metalls. Diese Verfähren wird angewendet, weil sich sulfidische Erze nicht direkt reduzieren lassen. RG: c) Reduktion von Gips mit Koks (Müller-Kühne-Verfahren, unwirtschaftlich) RG: 2. Reinigung des Gases: Die Empfindlichkeit des Katalysators gegenüber Kontaktgiften erfordert eine gründliche Reinigung. Der dazu notwendige Arbeitsaufwand ist bei der Schwefelverbrennung gering, bei den beiden anderen Verfahren jedoch sehr aufwendig. Die gewonnenen Röstgase werden zuerst über Zyklone (1) geführt und vom Grobstaub befreit. Die Feinentstaubung erfolgt in elektrischen Gasreinigern (2), welche unter einer Spannung bis zu 70.000 Volt stehen. Hier wird der Staub von Eisenkathoden negativ aufgeladen und an positiv geladenen Drahtnetzanoden niedergeschlagen. Das Gas tritt dann in einen Waschturm (3), wo es mit SO 2-haltigem Wasser berieselt wird. Waschturm und nun folgende Anlagen sind mit Blei ausgekleidet, weil Eisen zerstört werden würde. Der Waschturm dient einerseits zur Kühlung des Gases, andererseits zur Abscheidung eventuell noch vorhandenen Staubes. Das Gas wird nun zur weiteren Abkühlung über den Gaskühler (4) geführt und im Naßelektrogasreiniger (5) vom mitgerissenen Wasser weitgehend befreit. Nach Zusatz der für die Oxidation notwendigen Luft wird in einen Trockenturm (6) durch Berieseln mit conc. Schwefelsäure (wasserentziehend) die noch vorhandene Restfeuchte entfernt. Die Wasseraufnahme der Schwefelsäure führt zu ihrer Erwärmung, sie muß daher über eine Pumpe im Kreislauf über einen Kühler (7) geführt werden. ch_aoc.doc/14.05.16/Seite 42 3. Oxidation und Absorption Die normalerweise sehr langsam ablaufende Oxidation von Schwefeldioxid zu Schwefeltrioxid mit Luftsauerstoff wird durch die Gegenwart von Katalysatoren (Divanadiumpentoxid V2O5, seltener Pt) beschleunigt. RG: Die Ausbeute dieser Gleichgewichtsreation wird durch die Sauerstoffkonzentration und die Reaktionstemperatur bestimmt. Sauerstoffüberschuß und eine möglichst geringe Reaktionstemperatur führen zu einer Ausbeutesteigerung. In der Praxis arbeitet man knapp oberhalb der Wirksamkeitsgrenze des Katalysators (ca. 450°C), wobei zur Einhaltung dieser Temperatur für eine ständige Abfuhr der Reaktionswärme gesorgt werden muß. Beim Doppelkontaktverfahren (Doppelkatalyseverfahren) wird in einem Kontaktapparat das SO2 zu 95% umgesetzt. In einem Zwischenabsorber wird das Restgas von SO 3 befreit und anschließend einem weiteren Kontaktapparat zugeführt, wo es zu SO 3 umgesetzt wird. Auf diese Weise erzielt man über 99,5% Ausbeute. Neben der Wirtschaftlichkeit spielt die Umweltfreundlichkeit diese Verfahrens eine besondere Rolle, so daß neue Anlagen nur nach dem Doppelkontaktverfahren gebaut werden. Die Reaktionsgase werden dann mit ca. 96%Iger Schwefelsäure berieselt, wodurch sich das Schwefeltrioxid mit dem Restwasser der Absorptionssäure unter Bildung der Dischwefelsäure und nachfolgendem Verdünnen mit Wasser zu Schwefelsäure umsetzt, wodurch ein Mengenzuwachs entsteht (Produktionssäure). RG: Funktionsweise der Anlage: 1. Schwefeleintrag: Der angelieferte heiße, flüssige Schwefel (135°C) wird mittels einer Pumpe (P1) zum Verbrennungsofen (C1) gebracht. 2. Verbrennungslufttrocknung: Die zur Schwefelverbrennung erforderliche Luft darf keine Feuchtigkeit enthalten. Die Feuchtigkeit wird im Lufttrockenturm (B2) durch Absorption mit conc. Schwefelsäure entfernt. 3. SO2-Herstellung: Im Verbrennungsofen (C1) sind für 1 kg Schwefel 6 m 3 Verbrennungsluft (N8) erforderlich. Das entstandene Gas enthält ca. 10 % SO 2. Die Verbrennungswärme wird durch den Abhitzekessel (W1) abgeführt. 4. SO3-Herstellung: Das Gas gelangt nun in einen Flachbettkontaktofen mit 4 Horden (C2). Die Kontaktmasse besteht aus Divanadiumpentoxid. Mit dem Sauerstoff der Luft vollzieht sich dabei die Umsetzung von SO2 zu SO3, wobei die Gasführung von Horde 1 bis Horde 3 so erfolgt, daß Wärmetauscher zur Abführung der Reaktionswärme zwischengeschaltet sind (W2,W3). Die Reaktionswärme wird zur Gasvorwärmung (W2,W3) und zur Dampferzeugung (W1) ausgenützt. An jeder Horde werden ca. 50% des noch vorhandenen SO2 umgesetzt. ch_aoc.doc/14.05.16/Seite 43 5. Zwischenabsorption von SO3: Zur Ausbeuteerhöhung wird vor Eintritt in die Horde 4 eine Absorption des gebildeten SO3 durch conc. H2SO4 in einem Zwischenabsorber (C3) vorgenommen. RG: 6. Restumsetzung von SO2: Da das Gas stark abgekühlt wurde, muß es vor Eintritt in Horde 4 im Gaserhitzer (W2,W3) auf über 400°C aufgeheizt werden. Die Reaktionswärme wird nach Horde 4 durch Wärmetauscher (W4) abgeführt und das Gas dem Endabsorber (C4) zugeleitet. 7. Kühlung der Schwefelsäure: In den Absorbertürmen wird eine der gebildeten SO 3-Menge äquivalente Menge Wasser der Absorbersäure zugesetzt, wobei ca. 98%Ige Schwefelsäure entsteht. Die dabei anfallende Reaktions- und Verdünnungswärme wird in Plattenkühlern (W5,W6) abgeführt und die Säure im Lagerbehälter (B3) gesammelt. GASREINIGUNG Fließbild SCHWEFELSÄUREERZEUGUNG - GASREINIGUNG xxx ch_aoc.doc/14.05.16/Seite 44 Fließbild SCHWEFELSÄUREERZEUGUNG xxx ch_aoc.doc/14.05.16/Seite 45 SELEN Se, TELLUR Te, POLONIUM Po Vorkommen: als Begleiter sulfidischer Erze im Verhältnis S:Se:Te = 500:100:1 Pollonium ist ein kurzlebiges Zerfallsprodukt des Uran. Verwendung: Selen im Gleichrichterbau und für Photozellen Beantworte folgende Fragen: 01. Nenne die Elemente der 6. Hauptgruppe! 02. Vorkommen von Sauerstoff 03. Herstellung von Sauerstoff aus der Luft 04. Nach welchen Prinzip erfolgt die Gasverflüssigung? 05. Eigenschaften und Verwendung von Sauerstoff 06. Herstellung von Ozon 07. Herstellung (RG) und Verwendung von Wasserstoffperoxid 08. Wie können natürliche Wässer eingeteilt werden? 09. Was versteht man unter der Anomalie des Wassers? 10. Welche Härtearten gibt es? 11. Wodurch werden sie hervorgerufen (Formel der Verbindung)? 12. In welchen Einheiten wird die Wasserhärte angegeben? 13. RG zur Enthärtung des Wassers nach dem Kalk-Soda-Verfahren? 14. RG zur Enthärtung des Wassers nach dem Phosphatverfahren? 15. Was sind Ionentauscher? 16. Welche Arten gibt es und was tauschen sie? 17. RG für die Wasserentsalzung mit Ionentauschern! 18. Wozu dient die biologische Abwasserreinigung? 19. Erkläre das Prinzip an Hand des Fließbildes! 20. Hauptvorkommen von Schwefel 21. Herstellung von Schwefel nach Claus (RG)! 22. Eigenschaften und Verwendung von Schwefel 23. Herstellung von Schwefelwasserstoff im Labor (RG) 24. Herstellung von Schwefeldioxid (RG) 25. Was ist ”Rösten”? Warum wird es gemacht? 26. Was entsteht beim Rösten sulfidischer Erze (2 Beispiele + RG)? 27. Herstellung von Schwefeltrioxid (RG) 28. Herstellung der Schwefelsäure nach dem Kontaktverfahren (RG) 29. Beschreibe die Gasreinigung an Hand des Fließbildes! 30. Beschreibe die Schwefelsäureherstellung an Hand des Fließbildes! ch_aoc.doc/14.05.16/Seite 46 METALLE METALLANREICHERUNGSVERFAHREN Einteilung: 1. Flotationsverfahren 2. Fällungsverfahren 3. Löseverfahren (Auslaugen) 4. Amalgambildung 5. Ionenaustauschverfahren 6. Fraktionierte Kristallisation 7. Dichtetrennverfahren 8. Seigern 1. FLOTATIONSVERFAHREN: Das fein gemahlene Erz wird in einer Flüssigkeit, meist Wasser, aufgeschlämmt und mit einem meist organischen Flotationsmittel, dem sogenannten "Schwimmer-Drücker-Paar" versetzt. Durch den "Schwimmer oder Sammler" wird das Erz bzw. dessen Gangart (Verunreinigungen) unbenetzbar. Durch eingeblasene Luft sammelt sich die unbenetzbaren Anteile unter Rühren als Schaum an der Flüssigkeitsoberfläche an, von wo sie abgetrennt werden. Die durch den "Drücker" benetzbar gemachten Anteile (Gangart bzw. Erz) sinken zu Boden und werden dort abgetrennt. Folgende Metalle werden damit angereichert Ausgangsproduktes siehe dort): Cu, Zn (genaue Zusammensetzung des 2. FÄLLUNGSVERFAHREN: Aus einer Lösung des Erzes in einem geeigneten Lösungsmittel werden bestimmte Ionen oder eine bestimmte Gruppe von Ionen (gewünschte Metallionen oder Ionen der Verunreinigung) durch Zugabe eines Fällungsmittels in unlösliche Verbindungen überführt, welche von der Restlösung abgetrennt werden. Auf dieser Methode beruht der Schwefelwasserstoff-Trennungsgang. Folgende Metalle werden damit angereichert (genaue Zusammensetzung des Ausgangsproduktes siehe dort): dem Prinzip nach alle Ionen der I. bis 4. Gruppe des H2S-Ganges. 3. LÖSEVERFAHREN (AUSLAUGEN): Ein Teil des Erzes wird durch geeignete Lösungsmittel selektiv gelöst und ev. durch Verdampfen des Lösungsmittels angereichert. Folgende Metalle werden damit angereichert (genaue Zusammensetzung des Ausgangsproduktes siehe dort): Co, Ni, U, Zn, Ag, Au ch_aoc.doc/14.05.16/Seite 47 4. AMALGAMBILDUNG: Das fein gemahlene Erz wird in Wasser aufgeschlämmt, mit Quecksilber versetzt und innig vermischt, wobei sich ein Metallamalgam bildet, welches abgetrennt und aus dem das Rohmetall durch Abdestillieren des Quecksilbers gewonnen wird. Folgende Metalle werden damit Ausgangsproduktes siehe dort): Au angereichert (genaue Zusammensetzung des 5. IONENAUSTAUSCHVERFAHREN: Aus einer Lösung des Erzes in einem geeigneten Lösungsmittel werden bestimmte Metallionen selektiv durch einen Ionentauscher gegen andere Kationen ersetzt. Der mit den Metallionen beladene Ionentauscher wird mittels einer konz. Fremdmetallsalzlösung bzw. Säure regeneriert, wodurch eine konz. Lösung des angereicherten Metallsalzes anfällt. Folgende Metalle werden damit angereichert Ausgangsproduktes siehe dort): III.NGr. (genaue Zusammensetzung des 6. FRAKTIONIERTE KRISTALLISATION: Aus einer Lösung des Erzes in einem geeigneten Lösungsmittel werden bestimmte Metallionen selektiv in Form eines Metallsalzes kristallisiert und somit als Feststoff angereichert. Die Trennung erfolgt aufgrund des unterschiedlichen Kristallisations- bzw. Löslichkeitsverhaltens der einzelnen Metallsalze. Folgende Metalle werden damit angereichert (genaue Ausgangsproduktes siehe dort): Nb, Ta, Ln, An, III.NGr. Zusammensetzung des 7. DICHTETRENNVERFAHREN: Das fein gemahlene Erz wird in Wasser aufgeschlämmt. Die spezifisch leichtere Komponente (Gangart) wird von strömendem Wasser weggespült und kann somit abgetrennt werden, die spezifisch schwerere Komponente setzt sich im Gefäß bzw. auf der Schüttelrinne ab. Folgende Metalle werden damit Ausgangsproduktes siehe dort): Au angereichert (genaue Zusammensetzung des 8. SEIGERN: Das Erz bzw. Metall wird knapp über den Schmelzpunkt einer Komponente (Erz bzw. Metall oder Verunreinigung) erhitzt. Man läßt nun die Schmelze auf einer leicht schräg geneigten, profilierten Platte abrinnen bzw. gießt die Schmelze aus dem Schmelztiegel ab, wodurch die nicht geschmolzenen Anteile (Verunreinigung oder Erz bzw. Metall) zurückbleiben. Folgende Metalle werden damit Ausgangsproduktes siehe dort): Sb angereichert (genaue Zusammensetzung des ch_aoc.doc/14.05.16/Seite 48 METALLHERSTELLUNGSVERFAHREN Diese Verfahren werden vor der Reduktion durchgeführt. 1. Brennen 2. Entsäuern 3. Rösten Metallcarbonat zu Metalloxid Metallsalz einer Oxosäure zu Metalloxid Metallsulfid zu Metalloxid Calcinieren: Erhitzen eines Stoffes (meist an der Luft) unter Abgabe von ev. vorhandener Feuchtigkeit und Kristallwasser und ev. Kohlendioxid (siehe Na 2CO3-Herstellung). Vor der Reduktion carbonatische Erze erst gebrannt, sulfatische Erze erst entsäuert und sulfidische Erze erst geröstet werden. 1. Brennen: Erhitzen des Metallcarbonates an der Luft unter Abgabe von Kohlendioxid. MeCO3 MeO + CO2 Folgende Metalloxide werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): CaO, MgO, ZnO Mg (Einen Spezialfall stellt das chlorierende Brennen von MgCO 3 dar, welches fälschlicherweise auch als chlorierendes Rösten bezeichnet wird.), fallweise auch zur Herstellung anderer Produkte z.B. CaO, MgO. 2. Entsäuern: Erhitzen des Metallsalzes einer Oxosäure an der Luft unter Abgabe von ev. vorhandener Feuchtigkeit und Kristallwasser und/oder dem entsprechenden Säureanhydrid (z.B. CO2 bzw. SO3, wobei man dann auch von "Brennen unter Entsäuerung" spricht). MeYOn MeO + YOn-1 Folgende Metalloxide werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): wie unter 1. 3. (Vollständiges) Rösten: Darunter versteht man das Erhitzen sulfidischer Erze unter Luftzutritt (im Überschuß). Es erfolgt eine vollständige Umsetzung zum entsprechenden Metalloxid (meist maximaler Wertigkeit) und Schwefeldioxid (welches meist zur Schwefelsäure-Erzeugung eingesetzt wird). n MeSm + (p+n.m)/2 O2 MenOp + n.m SO2 Folgende Metalloxide werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): Pb, As, Sb, Bi, Fe (CO und C sind die Reduktionsmittel), Co, Ni, Zn, Cd ch_aoc.doc/14.05.16/Seite 49 Einteilung der Metallherstellungsverfahren: REDUKTIONSMITTEL 1. Kohlenstoff 1a. Direkte Reduktion 1b. Ferrometallurgie 1c. Röstreduktionsverfahren 1d. Indirekte Reduktion durch Kohlenmonoxid 2. Reaktionsfähiges (unedles) Metall 2a. Metallothermie 2b. Zementation 3. Wasserstoff (Pulver- oder Sintermetallurgie) 4. Elektronen (Elektrolyse) 4a. Schmelzflußelektrolyse 4b. Elektrolyse in Lösung 5. Eigenmetallsulfid (Röstreaktionsverfahren) AUSGANGSSTOFF Metalloxid Metalloxid + Eisen(III)-oxid (bei carbidbildenden Metallen) Metallsulfid zu Metalloxid Eisenoxide Metallchlorid, -oxid (bei carbidbildenden Metallen) Metallsalz gelöst Metalloxid gereinigt (bei carbidbildenden Metallen) Metallchlorid, -fluorid, hydroxid Metallsalz gelöst Metalloxid 1. KOHLENSTOFF ALS REDUKTIONSMITTEL Ausgangsprodukt ist immer ein Metalloxid. 1a. Direkte Reduktion: Das Metalloxid wird unter Luftabschluß mit Kohlenstoff (Koks) erhitzt. Es erfolgt eine Umsetzung zum entsprechenden Metall und Kohlenmonoxid (fallweise auch zu Kohlendioxid). Fallweise wirkt auch das bei dieser Reaktion entstehende Kohlenmonoxid als Reduktionsmittel (siehe Eisen). (2) MemOn + n C m Me + n CO(2) Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): Si, Sn, Mg (+ Cl2), Fe (C und CO sind die Reduktionsmittel), Co, Ni, Zn, Cd 1b. Ferrometallurgie: Darunter versteht man die Umsetzung eines Metalloxides mit Eisen(III)-oxid und Kohlenstoff (Koks) unter Luftabschluß. Es erfolgt die Bildung einer Ferrolegierung (Legierung aus Eisen und dem Metall), welche als Stahlvorlegierung zur Herstellung hochlegierter Stähle bzw. als Ferromangan zur Rückkohlung (Einstellen auf einen geforderten höheren Kohlenstoff-Gehalt, da es den C sehr gut bindet) von Stählen verwendet wird. Dieses Verfahren wird meist dann angewendet, wenn eine Reduktion mit Kohlenstoff (Koks) statt zum Metall zur gänzlichen oder teilweisen Bildung eines Metallcarbides und somit zu Verlusten an Metall führt. ch_aoc.doc/14.05.16/Seite 50 MemOn + Fe2O3 + (n+3) C Fe2;Mem + (n+3) CO Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): (P), Si, B, Mn, Cr, Mo, W, V, Nb, Ta, Ti, Zr 1c. Röstreduktionsverfahren: (Vollständiges) Rösten: Darunter versteht man das Erhitzen sulfidischer Erze unter Luftzutritt (im Überschuß). Es erfolgt eine vollständige Umsetzung zum entsprechenden Metalloxid (meist maximaler Wertigkeit) und Schwefeldioxid (welches meist zur Schwefelsäure-Erzeugung eingesetzt wird). n MeSm + (p+n.m)/2 O2 MenOp + n.m SO2 Reduktion (mit Kohlenstoff): Das Metalloxid wird unter Luftabschluß mit Kohlenstoff (Koks) erhitzt. Es erfolgt eine Umsetzung zum entsprechenden Metall und Kohlenmonoxid (fallweise auch zu Kohlendioxid). Fallweise wirkt auch das bei dieser Reaktion entstehende Kohlenmonoxid als Reduktionsmittel (siehe Eisen). (2) MemOn + n C m Me + n CO(2) Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): Pb, As, Sb, Bi, Fe (CO und C sind die Reduktionsmittel), Co, Ni, Zn, Cd 1d. Indirekte Reduktion mit Kohlenmonoxid: Das Eisenoxid wird unter Luftabschluß mit Kohlenmonoxid (aus Koks mit Luft) erhitzt. Es erfolgt eine Umsetzung zum entsprechenden Metall und Kohlendioxid. FemOn + n CO m Fe + n CO2 Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): Fe 2. REAKTIONSFÄHIGES (UNEDLES) METALL ALS REDUKTIONSMITTEL 2a. Metallothermie, Metallothermische Verfahren: Darunter versteht man die Umsetzung einer Metallverbindung (meist Oxid oder Halogenid) mit einem reaktionsfähigen, elektroposiverem Metall (meist Al, Mg, Na) unter Luftabschluß. Es erfolgt eine Umsetzung zum entsprechenden Metall und dem entsprechenden Metallsalz des zugesetzten Metalles ("Anionenübertragung”, u.a. Niederschlagsarbeit). Me(1)Y + Me(2) Me(1) + Me(2)Y ch_aoc.doc/14.05.16/Seite 51 Dieses Verfahren wird meist dann angewendet, wenn eine Reduktion mit Kohlenstoff (Koks) statt zum Metall zur gänzlichen oder teilweisen Bildung eines Metallcarbides und somit zu Verlusten an Metall führt. Spezialfall: Beim Einsatz von Aluminium als reaktionsfähiges Metall wird das Verfahren auch als Aluminothermie oder Goldschmidt-Verfahren bezeichnet. Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): (As), Sb, Si, B, Be, Mg (+ Ferrosilicium), Ba, Fe, Mn, Cr, V, Nb, Ta, Ti, Zr, Hf, III.NGr. 2b. Zementation: Darunter versteht man die Umsetzung einer Lösung eines Salzes eines edleren Metalles mit einem fein verteiltem unedleren Metall (meist Fe oder Zn). Es erfolgt eine Ausfällung des edleren Metalles unter Lösung des unedleren Metalles als entsprechendes Metallsalz ("Elektronen- bzw. Anionenübertragung"). m Me(1)n + p Me(2)s m Me(1)s + p Me(2)q (m.n = p.q) Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): Cd, Ag, Au 3. WASSERSTOFF ALS REDUKTIONSMITTEL (PULVER- ODER SINTERMETALLURGIE) Darunter versteht man die Umsetzung einer Metallverbindung (meist Oxid oder Halogenid) bzw. deren Lösung mit Wasserstoff unter Luftabschluß. Es erfolgt eine Umsetzung zum entsprechenden Metall und Wasser bzw. Halogenwasserstoff. Das Metall fällt als Pulver an und wird danach im Elektroofen geschmolzen bzw. meist durch Druck kompaktiert (verfestigt), wodurch die Teilchen fest aneinander haften ("Kaltschweißen"). Danach wird der Preßling gesintert (ev. unter Druck erhitzt, wobei der Schmelzpunkt nicht erreicht wird). Me(O,X)n + n H2 Me + n H2(O,X2) [H2X2 = 2 HX] Dieses Verfahren wird meist dann angewendet, wenn eine Reduktion mit Kohlenstoff (Koks) statt zum Metall zur gänzlichen oder teilweisen Bildung eines Metallcarbides und somit zu Verlusten an Metall führt bzw. das Metall außerdem einen sehr hohen Schmelzpunkt aufweist. Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): B, Ge, Co, Ni, Tc, Re, Mo, W, U, Cu ch_aoc.doc/14.05.16/Seite 52 4. ELEKTRONEN ALS REDUKTIONSMITTEL - ELEKTROLYSEVERFAHREN Dabei handelt es sich um die Zersetzung eines Elektrolyten an 2 in den Elektrolyt tauchenden Elektroden mit Hilfe von elektrischem Gleichstrom. Elektrolyte sind Leiter 2. Klasse: Ionenverbindungen, die den elektrischen Strom nur in Schmelze oder Lösung durch Ionentransport und unter Zersetzung leiten. Dabei werden die negativ geladenen Anionen an der positiv geladenen Anode und die positiv geladenen Kationen an der negativ geladenen Kathode entladen. Kathode: m Men+ + m.n e- m Me Anode: n Ym- n Y + m.n eSumme: m Men+ + n Ym- m Me + n Y m, n = Koeffizienten bzw. Ionenladungen, Me = Metall, Y = Anion (meist Oxid, Sulfat oder Halogenid) bzw. entladenes Anion (meist Halogen oder Sauerstoff bzw. Kohlenmonoxid beim Einsatz von Söderberg-Elektroden) 4a. Schmelzflußelektrolyse Als Elektrolyt dient eine Salzschmelze, der meist ein Flußmittel zur Herabsetzung des Schmelzpunktes durch Bildung eines eutektischen Gemisches zugesetzt wird. Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): (F), B, Al, Be, Mg, Ca, Sr, Ba, Li, Na, K, Rb, Cs, Fr, Mn, Nb, Ta, III.NGr. ch_aoc.doc/14.05.16/Seite 53 4b. Elektrolyse in Lösung Als Elektrolyt dient eine wäßrige Salzlösung (fallweise mit Säurezusatz). Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): Ga, In, Tl, Mn, Zn, Cu, Cd 5. EIGENMETALLSULFID ALS REDUKTIONSMITTEL (RÖSTREAKTIONSVERFAHREN) Unvollständiges Rösten (nur zu 2/3): Darunter versteht man das Erhitzen sulfidischer Erze unter kontrolliertem Luftzutritt. Es erfolgt eine unvollständige (nur zu 2/3) Umsetzung zum entsprechenden Metalloxid (meist geringerer Wertigkeit) und Schwefeldioxid. 3 MeS + 3 O2 2 MeO + MeS + 2 SO2 Reaktion: Das Metalloxid reagiert dabei mit einer äquivalenten Menge nicht abgeröstetem Metallsulfid unter Luftabschluß. Es erfolgt eine Umsetzung zum entsprechenden Metall und Schwefeldioxid. 2 MeO + MeS 3 Me + SO2 Folgende Metalle werden damit hergestellt (genaue Formel des Ausgangsproduktes siehe dort): (S), Pb, Cu ch_aoc.doc/14.05.16/Seite 54 3. METALLREINIGUNGSVERFAHREN Einteilung: Verfahren 1. Elektrolyseverfahren Elektrolytische Metallreinigung - Elektroraffination 2. Thermische Verfahren 2a. Thermische Dissoziation 2a1. Van Arkel-de Boer-Verfahren 2a2. Mond-Verfahren (Carbonyl-Bildung/Zerfall) 2b. Destillationsverfahren 2b1. in der Hauptstufe 2b2. in der Vorstufe 2c. Schmelzverfahren 2c1. Raffinationsschmelze 2c2. Zonenschmelzen 2c3. Seigern 2c4. Oxidierendes Schmelzen (Polen) 1. ELEKTROLYSEVERFAHREN ELEKTRORAFFINATION - Ausgangsprodukt Metall Metalliodid Metall(carbonyl) Metall Metallhalogenid Metall, ev. zu Metalloxid Metall Metall Metall ELEKTROLYTISCHE METALLREINIGUNG - Das geschmolzene Rohmetall wird zu Anoden vergossen, welche in einer MetallsalzLösung (meist des selben Metalles) mit Hilfe von elektrischem Gleichstrom elektrolysiert werden. Dabei geht das Rohmetall anodisch in Lösung und wird als Reinmetall an einer Reinmetall- bzw. Fremdmetallkathode (nur wenn eine anschließende Trennung möglich ist und die Abscheidung auf Eigenmetall schlecht haftet) abgeschieden. Die edleren Metallverunreinigungen fallen als Anodenschlamm auf den Boden der Elektrolysezelle und werden meist zur Herstellung der Edelmetalle aufgearbeitet, die unedleren Verunreinigungen bleiben in Lösung. Anode: Me Men+ + n eKathode: Men+ + n e- Me Summe: Me Me n = Koeffizient bzw. Ionenladung Me = Metall Folgende Metalle werden damit gereinigt (genaue Ausgangsproduktes siehe dort): Co, Ni, Cu, Cd, Ag, Au Zusammensetzung des ch_aoc.doc/14.05.16/Seite 55 ch_aoc.doc/14.05.16/Seite 56 2. THERMISCHE VERFAHREN 2a. Thermische Dissoziation: 2a1. Van Arkel-de Boer-Verfahren: Das Rohmetall wird in einem evakuierten Gefäß bei mäßiger Wärme mit elementarem Iod zum Metalliodid umgesetzt und verdampft. Der Metalliodid-Dampf wird sodann bei höherer Temperatur thermisch zersetzt. Das Reinmetall scheidet sich an einem glühenden Tantaloder Wolframdraht ab, das dabei freiwerdende Iod wird dem Ausgangsbehälter, in dem sich die Verunreinigungen anreichern, wieder zugeführt und erneut verwendet. Vakuum Bei niedriger Temperatur: Me + n/2 I2 MeIn Metallglühdraht Bei hoher Temperatur: MeIn Me + n/2 I2 MeIn I2 Summe: Me Me Me + I2 Folgende Metalle werden damit gereinigt (genaue Ausgangsproduktes siehe dort): B, Re, W, Ti, Zr, Hf, Th Zusammensetzung des Abb. xxx 2a2. Mond-Verfahren (Carbonyl-Bildung/Zerfall) Carbonyle sind Verbindungen der nullwertigen Elemente der V.-VIII. NGr. mit Kohlenmonoxid. Das Rohmetall wird in einem Gefäß bei mäßiger Wärme mit aufsteigendem Kohlenmonoxid zum Metallcarbonyl umgesetzt und verdampft. Der Metallcarbonyl-Dampf wird sodann vom Flugstaub befreit und bei höherer Temperatur thermisch zersetzt. Das Reinmetall scheidet sich an heißen Reinmetall-Kugeln ab, das dabei freiwerdende Kohlenmonoxid wird dem Ausgangsbehälter, in dem sich die Verunreinigungen anreichern, wieder zugeführt und erneut verwendet. Bei niedriger Temperatur: Me + n CO Me(CO)n Bei hoher Temperatur: Me(CO)n Me + n CO Summe: Me Folgende Metalle werden damit Ausgangsproduktes siehe dort): Ni Me gereinigt (genaue Zusammensetzung des 2b. Destillationsverfahren Das Rohmetall (in der Hauptstufe) bzw. seine Verbindung (meist Halogenid, in der Vorstufe) wird geschmolzen und anschließend verdampft. Der Dampf wird sodann ev. vom Flugstaub befreit, abgeleitet und durch Kühlen kondensiert. Folgende Metalle werden damit gereinigt (genaue Ausgangsproduktes siehe dort): Ge, Ca, Zn, Cd, Hg Zusammensetzung des ch_aoc.doc/14.05.16/Seite 57 2c. Schmelzverfahren 2c1. Raffinationsschmelze Das Rohmetall wird unter Luftzutritt und Zusatz von Schlackenbildnern erhitzt, wodurch sich die Verunreinigungen teilweise durch Sublimation verflüchtigen bzw. als Schlacke entfernt werden können. Das Metall bzw. das Oxid des Metalles bleibt in reiner Form zurück. Me + n/2 O2 MeOn Das Metalloxid wird anschließend wieder in das Metall überführt: a. Reduktion mit Kohlenstoff: (2) MemOn + n C m Me + n CO(2) Folgende Metalle werden damit gereinigt (genaue Ausgangsproduktes siehe dort): Cu, Pb (bleibt Metall) Zusammensetzung des b. Elektrolytische Reduktion der (meist als Sulfat) vorliegenden Metallsalz-Lösung: Kathode: Anode: m Men+ + m.n e- m Me n Ym- n Y + m.n e- Summe: m Men+ + n Ym- m Me + n Y m, n = Koeffizienten bzw. Ionenladungen, Me = Metall, Y = Anion (meist Oxid, Sulfat oder Halogenid) bzw. entladenes Anion (meist Halogen oder Sauerstoff bzw. Kohlenmonoxid beim Einsatz von Söderberg-Elektroden) Folgende Metalle werden damit Ausgangsproduktes siehe dort): Pb, Cd gereinigt (genaue Zusammensetzung des 2c2. Zonenschmelzen Das kompakte Rohmetall wird durch eine Heizzone gezogen bzw. die Heizzone entlang des kompakten Rohmetalles verschoben, wodurch die niedriger schmelzenden Verunreinigungen aufgeschmolzen werden und sich in der Schmelze und zuletzt am Ende des nunmehr reinen kompakten Metalles ansammeln, von wo sie entfernt werden können. Folgende Metalle werden damit Ausgangsproduktes siehe dort): Si, Ge gereinigt (genaue Zusammensetzung des ch_aoc.doc/14.05.16/Seite 58 ch_aoc.doc/14.05.16/Seite 59 2c3. Seigern Das Rohmetall wird knapp über den Schmelzpunkt einer Komponente (Metall bzw. Verunreinigung) erhitzt. Man läßt nun die Schmelze auf einer leicht schräg geneigten, profilierten Platte abrinnen bzw. gießt die Schmelze aus dem Schmelztiegel ab, wodurch die nicht geschmolzenen Anteile (Verunreinigung oder Metall) zurückbleiben. Folgende Metalle werden damit Ausgangsproduktes siehe dort): Sn gereinigt (genaue Zusammensetzung des 2c4. Oxidierendes Schmelzen (Polen) Das Rohmetall wird aufgeschmolzen und infolge entweichender Gase durch Eintauchen frischer grüner Holzstangen kräftig durchmischt, wodurch die metallischen Verunreinigungen durch den Luftsauerstoff verschlackt werden. Folgende Metalle werden damit Ausgangsproduktes siehe dort): Sn gereinigt (genaue Zusammensetzung des METALLANWENDUNGEN 1. LEGIERUNGEN: (S), (P), As, Sb, Bi, (C), Si, Sn, Pb, B, Al, Be, Mg, Na, K, Pt, Ir, Fe, Co, Ni, Mn, Cr, Mo, W, V, Nb, Ta, Zn, Cd, Hg, Cu, Ag, Au 2. OBERFLÄCHENSCHUTZ: Rh, Co, Ni, Cr, Zn, Cd, Cu, Ag, Au Passivierung: Al 3. SCHMUCKMETALLE: Pt, Ir, Rh, Cu, Ag, Au 4. KATALYSATOREN: Pt, Pd, Rh, Co, Ni, Ag 5. RECYCLINGMETALLE: Sn, Pb, Al, Zn,Cu, Ag, Au, Pt-Metalle, Fe und Stahl ch_aoc.doc/14.05.16/Seite 60 15. Gruppe oder 5. Hauptgruppe Va (alt) - STICKSTOFFGRUPPE Name OZ N P As Sb Bi 7 15 35 51 83 Atommasse Metallcharakter Eigenschaften 14,0067 30,9738 74,9216 121,75 208,98 STICKSTOFF N Vorkommen: 1. frei in der Luft zu 78.10Vol-% 2. gebunden: Chilesalpeter NaNO3 wichtiger Bestandteil der Eiweißstoffe Herstellung: Durch fraktionierte Destillation flüssiger Luft (siehe Sauerstoff – Linde-Verfahren) Eigenschaften: Farbloses, geruchloses, geschmackloses Gas. Stickstoff ist nicht brennbar noch unterhält er die Verbrennung. Bei Zimmertemperatur ist er sehr reaktionsträge (inertes Gas) Verwendung: Als Schutzgas Salpetersäure. bei chemischen Reaktionen, Herstellung von Ammoniak und Verbindungen: Wasserstoffverbindungen: Ammoniak, Ammonium-Ion NH3, NH4+ Herstellung: siehe Ammoniak-Herstellung (Fließbild) Eigenschaften: Farbloses Gas mit charakteristischem Geruch, leichter als Luft, läßt sich leicht verflüssigen. Ammoniak reagiert mit Säuren zu Ammoniumsalzen. Die Wasserstoffe können auch durch Metalle ersetzt werden (z.B. Natriumamid). Verwendung: Als Kältemittel (hohe Verdampfungswärme), zur Herstellung von Salpetersäure, Ammonsalzen und Harnstoff. ch_aoc.doc/14.05.16/Seite 61 Ammoniumverbindungen: Diese Verbindungen gehören ihren Eigenschaften nach zu den Alkalisalzen. Herstellung: Im allgemeinen werden sie durch Einleiten von Ammoniak in die entsprechende Säure hergestellt. z.B.: RG: Ausnahmen: Ammoniumcarbonat und Ammoniumhydrogencarbonat, die durch Einleiten von Kohlendioxid in wäßrige Ammoniak-Lösung hergestellt werden. Die Reaktion verläuft über das Ammoniumcarbaminat. RG: Andere Stickstoff-Wasserstoffverbindungen: Hydrazin: NH2-NH2 Hydroxylamin NH2OH Stickstoffwasserstoffsäure (Salze: Azide): HN3 Sauerstoffverbindungen: Distickstoffoxid, Stickstoff(I)-oxid, Lachgas N2O: Herstellung: Trockenes Erhitzen von Ammoniumnitrat: RG: Eigenschaften und Verwendung: Brenngas bei der Atomabsorptionsspektroskopie, unter gleichzeitiger Sauerstoffzufuhr als Narkosegas verwendet. Stickstoffmonoxid, Stickstoff(II)-oxid NO: Herstellung: siehe Salpetersäure-Herstellung (Fließbild) Verwendung: Zwischenprodukt bei Salpetersäureproduktion.: der katalytischen Ammoniakverbrennung Stickstoffdioxid, Stickstoff(IV)-oxid NO2: Herstellung: siehe Salpetersäure-Herstellung (Fließbild) Salpetersäure, Stickstoff(V)-säure, Nitrate, Nitrate(V) HNO3, NO3- bei der ch_aoc.doc/14.05.16/Seite 62 Herstellung: siehe Salpetersäure-Herstellung (Fließbild) Eigenschaften: Die conc. Säure hat besonders starke oxidierende Eigenschaften, bei der verd. Säure überwiegen die sauren Eigenschaften. Königswasser: 1Vol-Teil conc. Salpetersäure + 3Vol-Teile conc. Salzsäure löst fast alle Metalle (Gold). Nitriersäure (organische Chemie): conc. Salpetersäure + conc. Schwefelsäure Salpetrige Säure, Stickstoff(III)-säure, Nitrite, Nitrate(III) HNO2, NO2- : Sie ist nur in Form von sehr verdünnten wäßrigen Lösungen und in Form der Salze beständig. Sie wirken je nach der Verbindung, mit der sie reagieren, als Oxidations- oder Reduktionsmittel. ch_aoc.doc/14.05.16/Seite 63 AMMONIAKSYNTHESE (SYNTHESE NACH HABER-BOSCH) Verfahrensprinzip: Die wichtigste Methode zur Herstellung von Ammoniak wurde vom Chemiker Haber und vom Techniker Bosch entwickelt. Das Verfahren beruht auf einer direkten Vereinigung von Stickstoff und Wasserstoff zu Ammoniak und arbeitet mit einer 15%igen Ausbeute. Das gesamte Verfahren läßt sich in drei Verfahrenstufen unterteilen: Synthesegasherstellung Synthesegasreinigung Ammoniaksynthese 1. Synthesegasherstellung: Als Rohstoff für die Herstellung von Stickstoff dient die Luft. Entweder wird der Stickstoff durch fraktionierte Destillation (Linde-Verfahren) gewonnen oder über Generatorgas hergestellt. Generatorgas: Luft wird über glühende Kohle geleitet. RG: Für den Wasserstoff verwendet man Erdgas oder Leichtbenzin. In diesem Fall enthalten die Ausgangsprodukte Wasserstoff, der chemisch an Kohlenstoff gebunden ist. Diese Verbindungen müssen nun unter Bildung von Wasserstoff gespalten werden Der Wasserstoff kann aber auch über den Wassergasprozeß gewonnen werden. Wassergas: Wasserdampf wird über glühende Kohle geleitet. RG: 2. Synthesegasreinigung: Bei der Reinigung des Synthesegases werden nacheinander in mehreren Verfahrensstufen alle Begleitgase (CO und CO2) aus dem Stickstoff-Wasserstoffgemisch entfernt. Letztlich soll das Gas in dem für das Verfahren benötigten Verhältnis von N 2 : H2 = 1 : 3 vorliegen. Synthesegasherstellung aus Erdgas und Synthesegasreinigung: a) Entschwefelung: Hydrierende Spaltung des organisch gebundenen Schwefels unter Bildung von Schwefelwasserstoff, der durch Zinkoxid als Zinksulfid gebunden wird. RG: b) Methanspaltung (in zwei Stufen): Primärreformer: Katalytische Spaltung Wärmezufuhr: RG: mit Wasserdampf bei 800°C unter Sekundärreformer: Katalytische Restmethanspaltung mit Luftsauerstoff (dabei wird auch der erforderliche Stickstoffmenge eingebracht: ch_aoc.doc/14.05.16/Seite 64 RG: c) Kohlenmonoxid-Konvertierung (in zwei Stufen): Katalytische Umwandlung von Kohlenmonoxid mit Wasserdampf unter Bildung von Kohlendioxid und Wasserstoff bei 400°C bezw. 200°C RG: d) Kohlendioxid-Wäsche: Entfernung des Kohlendioxids durch Absorption in heißer Kaliumcarbonat-Lösung bei 30 bar und anschließender getrennter Desorption des Kohlendioxids aus der entstandenen Kaliumhydrogencarbonat-Lösung. RG: e) Methanisierung (Feinreinigung): Katalytische Rückwandlung von restlichen Kohlenmonoxid und Kohlendioxid (Katalysatorgifte) in Methan: RG: 3. Ammoniaksynthese: Die Ammoniaksynthese stellt eine exotherme Gleichgewichtsreaktion dar, die unter Volumsabnahme verläuft (Gesetz vom kleinsten Zwang oder Prinzip von Le ChatelierBraun: Zwei Gase, die miteinander reagieren können, nehmen unter Druck immer das kleinere Volumen ein.). Durch tiefe Reaktionstemperatur und hohen Druck wäre eine Gleichgewichtsverschiebung rechts und somit eine höhere Ausbeute zu erzielen. Höhere Temperatur vermindert die Ammoniakausbeute. Höherer Druck erhöht die Ammoniakausbeute. Allerdings ist bei niedrigen Temperaturen die Reaktionsgeschwindigkeit zu gering. Zur Herabsetzung der Reaktionszeit verwendet man Katalysatoren. Diese können jedoch nur bei höheren Temperaturen (ca. 500°C) wirksam eingesetzt werden. Dadurch ist das Gleichgewicht schon weitgehend nach links verschoben. Man arbeitet daher bei einem Druck von 326 bar und 500°C in Anwesenheit eines Katalysators (Fe3O4 mit Zusätzen), wobei ca. 15 % des Synthesegases umgesetzt werden. Das nicht reagierte Gas wird erneut in den Reaktor geführt. RG: Arbeitsweise: Das gereinigte Synthesegas wird komprimiert und mit einem Druck von 326 bar in den Reaktor (C1) befördert. Es enthält außer Wasserstoff und Stickstoff noch geringe Mengen Methan und Argon (aus der Luft). Reaktor (C1): ch_aoc.doc/14.05.16/Seite 65 Beim Anfahren wird das Synthesegas im Reaktor durch elektrische Beheizung auf die nötige Reaktionstemperatur von ca. 500°C gebracht. Die Bildungsreaktion verläuft in Anwesenheit eines Katalysators (Fe3O4 mit Zusätzen) exotherm. Um im Bereich der maximalen Ammoniakbildung zu bleiben, muß nun Wärme abgeführt werden. Zu diesem Zweck wurden verschiedene Reaktortypen entwickelt: * Röhrenreaktoren (C1): Sie werden mit Hilfe des aufzuheizenden Synthesegases über die ganze Länge gekühlt. * Abschnittsreaktoren: Sie bestehen aus mehreren Katalysatorbetten, bei denen die Kühlung zwischen den Horden vorgenommen wird. Ammoniakabscheidung: Das den Reaktor (C1) verlassende Gasgemisch enthält ca. 15Vol-% Ammoniak neben nicht umgesetzten Ausgangsstoffen. Zur Ammoniakabscheidung erfolgt nun eine stufenweise Kühlung. Nach einem mit Wasser betriebenen Gaskühler (W1) gelangt der Gasstrom in einen Wärmetauscher (W2), wo die Kühlung durch rückströmendes, nicht umgesetztes Synthesegas aus den Ammoniakabscheider (F1) erfolgt. Im folgenden Tiefkühler wird durch Entspannen des flüssigen Ammoniak (V101) aus dem Entspannungsbehälter (B1) das Reaktionsgemisch auf -10°C abgekühlt. Hierbei scheidet sich der Ammoniak in flüssiger Form ab und sammelt sich im Abscheidebehälter (F1), während das kalte, nicht umgesetzte Synthesegas über den Wärmetauscher (W2) in den Reaktor zurückgeführt wird. Das flüssige Ammoniak gelangt nun unter Druckabsenkung (V102) auf 20bar in den Entspannungsbehälter (B1), wo aus der Flüssigkeit ein Abgas (Methan und Argon) entweicht (V103). Vom Entspannungsbehälter wird ein Teil des Ammoniaks abgezogen (V104) und als Flüssigkeit in Tanks gelagert, während ein anderer Teil durch sein Verdampfen im Tiefkühler (W3) die Abscheidung des neu gebildeten Ammoniaks bewirkt. Diese gasförmig anfallende Ammoniak steht ebenfalls für den Verbrauch zur Verfügung. Die Ammoniakbildung bedingt eine Volumsabnahme des Kreislaufgases. Daher ist eine stetige Zufuhr von frischem Synthesegas über das Dreiwegeventil (V105) notwendig. Der im Kreislauf entstehende Druckverlust von 10-20 bar wird durch einen Verdichter (V1) wieder ausgeglichen. Beantworte folgende Fragen: 01. 02. 03. 04. 05. 06. Bilde die Reaktionsgleichung zur Ammoniaksynthese! Welchem Reaktionstyp gehört diese Synthese an? Welche Rohstoffe dienen zur Herstellung von Stickstoff und Wasserstoff? Beschreibe den Einfluß von Druck und Temperatur auf den Verfahrensverlauf! Auf welchem Prinzip beruht die Ammoniaksynthese? Welche Verfahrensstufen werden bei der Synthesegasherstellung aus Methan und der Synthesegasreinigung durchlaufen (+RG)? 07. Beschreibe die Ammoniaksynthese an Hand des Fleißbildes! ch_aoc.doc/14.05.16/Seite 66 Fließbild Synthesegas-Herstellung xxx ch_aoc.doc/14.05.16/Seite 67 Fließbild Ammoniak-Herstellung xxx ch_aoc.doc/14.05.16/Seite 68 SALPETERSÄURE-ERZEUGUNG (OSTWALD-VERFAHREN alt) Verfahrensprinzip: Das heute angewendete Verfahren wurde von Ostwald im Jahr 1908 entwickelt. Es beruht auf der katalytischen Verbrennung von Ammoniak (12%) mit Luftüberschuß. Normalerweise verbrennt Ammoniak zu Stickstoff und Wasser. Mit Hilfe von PlatinRhodium als Katalysator läßt sich jedoch der Prozeß so steuern, daß sich Stickstoffmonoxid bildet. RG: Zur Vermeidung unerwünschter Nebenreaktionen wird bei einer Temperatur von 850°C und sehr kurzer Berührungszeit (ca. 0,001 s) zwischen Gasgemisch und Katalysator gearbeitet. Das Stickstoffmonoxid reagiert dann mit dem überschüssigen Luftsauerstoff zu Stickstoffdioxid. RG: Das Stickstoffdioxid wird anschließend in Wasser gelöst, wobei sich Salpetersäure und Stickstoffmonoxid bilden. RG: Die Oxidation und die Absorption erfolgen in mehreren Absorptionstürmen, wobei Gas und Flüssigkeit im Gegenstrom geführt werden. Durch den stets vorhandenen Luftüberschuß wird das bei der Säurebildung entstehende Stickstoffmonoxid erneut zu Stickstoffdioxid oxidiert und mit Wasser zu Salpetersäure umgesetzt. Erfolgt die Absorption unter Normaldruck (ca.1,5bar) so entsteht eine ca. 45%ige Salpetersäure, wird unter Druck absorbiert (ca. 3,5bar) erhält man eine ca. 60%ige Säure. 100%ige Säure erhält man durch Destillation in Gegenwart von conc. Schwefelsäure, die wasserentziehend wirkt. Arbeitsweise: 1. Ammoniakverbrennung: Gasförmiges Ammoniak und entstaubte Luft werden mit Hilfe einer Regeleinrichtung zu einem Gemisch aus 12 V% Ammoniak und 88V% Luft vereinigt (B1). Ein Gebläse (V1) drückt das Ammoniak-Luftgemisch über einen Wärmetauscher (W1), der von den abströmenden Verbrennungsgasen beheizt wird. Eine weitere Filtereinrichtung (F1) dient zur Entfernung sämtlicher für den Katalysator schädlichen Feststoffe. Das entstaubte und vorgewärmte Gas tritt nun mit hoher Geschwindigkeit in den Verbrennungsofen (C4). Im Verbrennungsofen befinden sich 4 engmaschige Pt/Rh-Netze, an denen bei 850 °C die Verbrennung des Ammoniak erfolgt. Die Reaktion ist exotherm und hält von selbst die erforderliche Temperatur, wenn der Ofen zu Beginn aufgeheizt Wurde. Der untere Teil des Verbrennungsofens enthält die Heizrohre eines Abhitzekessels (W2), in dem die Wärme der Verbrennungsgase zur Dampferzeugung ausgenützt wird. Das von einem Gebläse angesaugte Gas gelangt nun über einen Wärmetauscher zur weiteren Abkühlung in einen Gaskühler (W3) und wird gemeinsam mit der ebenfalls ch_aoc.doc/14.05.16/Seite 69 angesaugten Zusatzluft mit einem Druck von 1,5 bar in die Absorptionsanlage (V2) befördert. 2. Absorption: Zur Oxidation der Stickoxide und Bildung der Salpetersäure passiert das Verbrennungsgas-Luftgemisch nacheinander die Absorptionstürme (C1-C3), die mit Raschigringen gefüllt sind. Im Gegenstrom zum Gas wird dem letzten Absorptionsturm kontinuierlich Wasser aufgegeben, das laufend umgepumpt wird. Es entsteht eine verdünnte Salptersäure. Der Mengenüberschuß wird dem vorgeschalteten Turm zugeführt und dort wieder umgepumpt (P1-P3). In gleicher Weise fließt die Säure durch die anderen Türme weiter, wobei die Konzentration ständig zunimmt. Da Oxidation und Absorption exotherm verlaufen, wird der Säureumlauf der Absorptionstürme gekühlt (W4, W5). Dem Umlauf des Turmes (C1) kann eine 45%ige Salpetersäure entnommen werden. Diese stickoxidhaltige Säure wird im Ausblaseturm (K1) mit Luft ausgeblasen. Die Dabei freiwerdenden Abgase werden gemeinsam mit der Zusatzluft in den Prozeß zurückgeführt. Beantworte folgende Fragen: 01. Bilde die Reaktionsgleichung für die Ammoniakverbrennung! 02. Welcher Katalysator wird dabei eingesetzt? 03. Welche Reaktionen sind notwendig, um aus Stickstoffmonoxid Salpetersäure zu erhalten? 04. Warum muß in den Absorptiontürmen überschüssiger Luftsauerstoff vorhanden sein? 05. Beschreibe das Verfahren zur SalpetersäureHerstellung anhand des Fließbildes! ch_aoc.doc/14.05.16/Seite 70 Fließbild Salpetersäure neu Xxx Text fehlt ch_aoc.doc/14.05.16/Seite 71 KALKAMMONSALPETER (NITRAMMONCAL, STICKSTOFFDÜNGEMITTEL) Verfahrensprinzip: Durch Neutralisation von Salpetersäure mit Ammoniak wird zunächst Ammonnitrat hergestellt: RG: Die Konzentration der anfallenden Salzlösung hängt ab: * von der Konzentration der Ausgangsstoffe * vom Druck der bei der Neutralisation angewandt wird.(Druckneutralisationen werden nur bis zu einem Maximaldruck von 4 bar durchgeführt, da oberhalb dieser Grenze die Abführung der Reaktionswärme Schwierigkeiten bereitet.) Die Salzlösung wird dann in Verdampfern zu einer ca. 98%igen Salzschmelze aufkonzentriert. Da reines Ammonnitrat bei stärkeren Erhitzen zu explosionsartigem Zerfall neigt, setzt man Kalksteinmehl CaCO3 zu, wodurch die Zersetzungsgefahr herabgesetzt und überdies die Lagereigenschaften des Düngers verbessert werden. Dazu wird die Salzschmelze mit gemahlenen Kalkstein vemischt und in granulierte Handelsform gebracht. Kalkammonsalpeter enthält etwa 26% Stickstoff, entsprechend einer Zusammensetzung von 75% Ammonnitrat und 25% Kalkstein. Das Nährelement liegt dabei einerseits als langsam wirkender Nitrat-Stickstoff, andererseits als rasch wirkender Ammoniak-Stickstoff vor. Arbeitsweise: 1. Druckneutralisation: In einem Neutralisator (C1) werden Salpetersäure (60%) und Ammoniakgas unter Druck zu einer wäßrigen Ammonnitratlösung umgesetzt. Da die Reaktion stark exotherm verläuft (Zersetzungsgefahr), wird zur Kühlung ein Teil der Ammonnitratlösung, welche den Entspannungsverdampfer (F1) verläßt, in den Neutralisator zurückgeführt (Umlauflauge, P1, V101). 2. Verdampferanlage: Die heiße, wäßrige Ammonnitratlösung gelangt vom Neutralisator in einen Entspannungsverdampfer (F1), wo die Neutralisationswärme zur Aufkonzentration der Lösung genutzt wird. Auf Grund des dort herrschenden Unterdrucks verdampft Wasser, da in einem Einspritzk9ondensator (F3) niedergeschlagen wird. Ein Teil der so abgekühlten und aufkonzentrierten Lösung wird als Umlauflauge zur Kühlung in den Neutralisator gepumpt. Der verbleibende Lösungsanteil gelangt über den Wärmetauscher (W1) in einen Vakuumverdampfer (F2), in dem die Aufkonzentration bis zu einer 98%igen Salzschmelze erfolgt. Die dabei entstehenden Brüden werden im Einspritzkondensator (F4) niedergeschlagen. Die Schmelze fließt mit einer Temperatur von 140 °C in einen Sammelbehälter (B1). ch_aoc.doc/14.05.16/Seite 72 3. Granulierung: Salzschmelze, Kalksteinmehl und Rücklaufsalz werden in eine Granulierschnecke (R1) eingebracht. Infolge der heftigen Mischbewegung kommt es zur Bildung von Granalien, die in einer nachgeschalteten Granuliertrommel (B2) verfestigt werden. Das Granulat wird dann in einer Trockentrommel (W2) mit Heißluft getrocknet und zur Klassierung über ein Grobsieb (F5) und ein Feinsieb (F6) bewegt. Der grobe Anteil gelangt über ein Walzwerk (Z1), der feine Anteil dagegen unmittelbar als Rücklaufsalz über den Elevator (H1) wieder in die Granulierschnecke. Das vom Feinsieb zurückgehaltene Granulat (Korngröße 2-4 mm) wird anschließend in einer Kühltrommel (W3) mit Kaltluft gekühlt. Nach Konditionierung (Aufsprühen einer Flüssigkeit zur Vermeidung des Zusammenpackens) ist das Granulat lagerfähig. Beantworte folgende Fragen: 1. Bilde die Reaktionsgleichung zur Herstellung von Ammonnitrat! 2. Warum wird dem Düngemittel Ammonnitrat Kalksteinmehl zugesetzt? 3. Warum wird dem Druckneutralisator Umlauflauge zugefahren? 4. Beschreibe die Kalkammonsalpeterherstellung anhand des Fließbildes! ch_aoc.doc/14.05.16/Seite 73 Fließbild KALKAMMONSALPETER (NITRAMMONCAL, STICKSTOFFDÜNGEMITTEL) xxx ch_aoc.doc/14.05.16/Seite 74 PHOSPHOR P Vorkommen: gebunden als Phosphate: Phosphorit: 3Ca3(PO4)2.Ca(OH,F,Cl)2 Apatit 3Ca3(PO4)2.CaF2 Rohphosphat Ca3(PO4)2 phosphorhaltige Eisenerze wichtiger Bestandteil der Eiweißstoffe Herstellung: Durch Reduktion von Rohphosphat im Phosphor-Elektroofen (Piesteritz-Verfahren). RG: Eigenschaften: Phosphor kommt in drei Modifikationen vor. a) Weißer oder gelber Phosphor P4: Dampf und Lösungen von weißen Phosphor enthalten P 4-Moleküle, die tetraedrisch angeordnet sind. Da der Valenzwinkel anomal klein ist, ist der weiße Phosphor sehr instabil. Er ist sehr reaktionsfreudig und entzündet sich bei 60°C von selbst. Er darf nur unter Wasser aufbewahrt und geschnitten werden. Er ist stark giftig, phosphoreziert und ist in bestimmten organischen Lösungsmitteln löslich (z.B. Schwefelkohlenstoff CS 2). Nachweis von Phosphor nach Mitscherlich: Die Probe wird mit Wasser erhitzt, wodurch der Phosphor mit dem Wasserdampf übergeht. An kalten Stellen im Kühlerrohr kondensiert er. Im Dunkeln kann man einen leuchtenden Ring beobachten. b) Roter oder violetter Phosphor: Beim Übergang von weißen in roten Phosphor liegt dieser zuerst in amorpher Form vor. Durch längeres Erhitzen entsteht monoklin kristallisierender violetter Phosphor. Er ist weniger reaktionsfähig als der weiße, entzündet sich an der Luft nicht und ist in organischen Lösungsmitteln unlöslich. c) Schwarzer oder metallischer Phosphor: Er entsteht aus dem weißen Phosphor unter hohem Druck. Er hat eine hohe Dichte und leitet den elektrischen Strom. Er ist in organischen Lösungsmitteln ebenfalls unlöslich. Verwendung: Weißer Phosphor als Zwischenprodukt bei der Phosphorsäureerzeugung, der rote Phosphor zur Herstellung von Sicherheitszündern. Verbindungen: Wasserstoffverbindungen: Es sind das Phosphin PH3, das Diphosphin P2H4 und ein hochpolymeres (PH)x bekannt. ch_aoc.doc/14.05.16/Seite 75 Oxide und Sauerstoffsäuren: Tetraphosphorhexoxid, Diphosphortrioxid, Phosphor(III)-oxid, Anhydrid der Phosphorigen Säure oder Phosphor(III)-säure P2O3, P4O6: Herstellung: Durch Verbrennung von Phosphor mit gedrosselter Luftzufuhr. RG: Tetraphosphordekoxid, Diphosphorpentoxid, Phosphor(V)-oxid, Phosphorsäure oder Phosphor(V)-säure,P2O5, P4O10 Anhydrid der Herstellung: siehe Phosphorsäure-Herstellung (Fließbild) Eigenschaften: Weißes, schneeartiges, geruchloses Pulver, stark wasserentziehend. Reaktion mit Wasser: siehe Phosphorsäure-Herstellung (Fließbild). Es ist das stärkste wasserentziehende Mittel und wird daher zur Entfernung von geringsten Spuren von Wasser benutzt. Auch zur Wasserabspaltung aus chemischen Verbindungen und zur Bindung von Wasser bei chemischen Reaktionen wird es verwendet. Nach vorheriger Bestrahlung phosphoresziert es mit grünem Schein. Die Phosphoreszenz nimmt mit sinkender Temperatur zu. Phosphorsäure, Phosphate, Phosphor(V)säure, Phosphate(V), H 3PO4, PO43- : Herstellung: siehe Phosphorsäure-Herstellung (Fließbild) Eigenschaften und Verwendung: Die Orthophosphorsäure liefert als dreibasige Säure drei Reihen von Salzen. Die Dihydrogenphosphate (primären Phosphate) sind alle wasserlöslich. Die Hydrogenphosphate (sekundären Phosphate) können bei Einsatz als Dünger von den Huminsäuren des Bodens gelöst werden. Die Phosphate (tertiäre Phosphate) werden als Düngemittel eingesetzt, wobei die Rohphosphate aufgeschlossen werden müssen, da sie nicht wasserlöslich sind. Die wichtigsten Phosphor-Dünger sind: Superphosphat: Es wird aus Rohphosphat durch Aufschluß mit konz. Schwefelsäure hergestellt. RG: Doppelsuperphosphat: Carbonathaltige Rohphosphate werden mit Phosphorsäure aufgeschlossen, wodurch der Gips-Gehalt wegfällt. RG: Diammoniumhydrogenphosphat: ch_aoc.doc/14.05.16/Seite 76 Entsteht durch Einleiten von Ammoniak in Phosphorsäure. Es enthält neben dem notwendigen Phosphor auch Stickstoff. RG: ch_aoc.doc/14.05.16/Seite 77 PIESTERITZ-VERFAHREN 1. Aufbereitung der Rohstoffe: Die Rohstoffe Quarzsand, Koks und Rohphosphat werden gemahlen (1) und gesiebt (2), da sie in bestimmten Korngrößen vorliegen müssen. Der Mahlstaub des Rohphosphates wird abgetrennt (3) und zusammen mit den Abscheidungsprodukten aus der Elektroentstaubung (8) als Bindemittel vermischt, zu einem Granulat von 20 mm geformt und anschließend zu harten Pellets gesintert (4). Im Falle der Lieferung von Rohphosphaten mit unterschiedlicher Korngröße muß ebenfalls pelletiert werden (siehe oben) Im Mischbunker (5) werden die Rohstoffe im Verhältnis von 100 Teilen Rohphosphat zu 28 Teilen Quarzsand und 18 Teilen Koks homogenisiert und über das Verteilerrohr (a) in den Elektroofen eingebracht. Die Söderberg-Elektrodenmasse wird in der Mischknetmaschine (6) aus entgastem Anthrazit und Teer hergestellt und in die Elektrodenhüllen des Phosphor-Elektroofens (7) kontinuierlich eingebracht. 2. Weißer Phosphor: Im Phosphorelektroofen (7), der in Bau und Wirkungsweise einem geschlossenen Carbidofen (siehe Ca) gleicht, laufen folgende Reaktionen ab: RG: Summengleichung: Die Calciumsilikatschlacke sammelt sich am Boden des Ofens und nimmt alle Verunreinigungen der Rohstoffe außer Eisen auf und wird regelmäßig abgestochen (b). Die Schlacke läßt man in kaltes Wasser laufen, um eine Granulat zu erhalten, wodurch man sich eine spätere Zerkleinerung und Siebung erspart. Die Eisenverunreinigungen werden zu metallischen Eisen reduziert, das sich mit dem elementaren Phosphor zu Phosphoreisen oder Ferrophosphor mit bis zu 28% Phosphor legiert, wodurch Phosphorverluste entstehen. Der Ferrophosphor sammelt sich unter der Schlacke an, da er spezifisch schwerer ist, und wird ebenfalls fallweise abgestochen (c). Aus dem Ofen entweichen 400-500°C heißer dampfförmiger Phosphor und Kohlenmonoxid (d), die in Elektrofiltern (8) entstaubt und in Ströder-Wäschern (9) stufenweise abgekühlt werden, wobei sich der Phosphor verflüssigt und am Boden der Wäscher (9) sammelt und in den Sammelbehälter (10) abrinnt. Das Kohlenmonoxid entweicht (f) gasförmig aus den Wäschern (9) und wird als Heizgas verwendet oder abgefackelt. Der Vorratsbehälter (10) stellt ein Wasserbad dar, in dem der Phosphor flüssig bleibt und von der Luft abgeschlossen ist. Der geschmolzene Phosphor wird bei Bedarf abgedrückt. Die Verpackung erfolgt unter Wasser in Blechkanister als P 4-Stangen. ch_aoc.doc/14.05.16/Seite 78 3. Roter Phosphor: Zur Herstellung von rotem Phosphor wird weißer Phosphor in Chargen von 100-300 kg in einem Autoklaven im Verlauf von 24 Stunden langsam auf 250 °C erwärmt. Bei einer Temperarturerhöhung von 250 auf 300 °C beaufschlagt man den Autoklaven (11) mit Druck und erhitzt weiter auf 350°C Nach Beendigung der exothermen Reaktion wird der so hergestellte rote Phosphor gemahlen (12) und anschließend mit verdünnter Natronlauge gekocht, um ihn von Resten von weißen Phosphor zu befreien. RG: Beantworte folgende Fragen: 1. Nenne die Ausgangsprodukte für die Phosphorherstellung (mit Formel)! 2. Schreibe alle Reaktionsgleichung für die Herstellung von weißem Phosphor! 3. Wie wird roter Phosphor gewonnen? 4. Wie kann der rote Phosphor gereinigt werden (mit Reaktionsgleichung)? Beschreibe die Herstellung von weißem und rotem Phosphor anhand des Fließbildes! ch_aoc.doc/14.05.16/Seite 79 Fließbild PIESTERITZ-VERFAHREN xxx ch_aoc.doc/14.05.16/Seite 80 PHOSPHORSÄURE-ERZEUGUNG Verfahrensprinzip: Im wesentlichen kommen heute zwei Verfahren für die Herstellung von Phosphorsäure zur Anwendung: 1. Naßverfahren: Bei der nassen Herstellung wird das Rohphosphat Ca 3(PO4)2 mit Mineralsäure aufgeschlossen. Als Aufschlußsäure verwendet man meist Schwefelsäure, selten Salzsäure oder Salpetersäure. Es wird aber auch Phosphorsäure verwendet (Herstellung von Düngemitteln). RG: Die Naßsäure findet meist in der Düngemittelindustrie Verwendung. Sie ist meist trübe und gefärbt (durch Rohphosphatverunreinigungen) und fällt 30-40%ig an. Sie kann durch Extraktion mit organischen Lösungsmitteln gereinigt werden. 2. Thermisches Verfahren: ch_aoc.doc/14.05.16/Seite 81 Elementarer, weißer Phosphor P4 wird mit einem Luftüberschuß verbrannt. Das dabei entstehende Phosphorpentoxid P2O5 ist das Anhydrid der Phosphorsäure. RG: In einem Phosphorsäurekreislauf wird das Diphosphorpentoxid in Wasser eingetragen, wobei es sich über die Metaphosphorsäure und Diphosphorsäure zur Orthophosphorsäure umsetzt. Die entsprechende Säuremenge wird laufend entnommen. RG: Sowohl die Oxidation als auch die Hydrolyse sind stark exotherm. Die Reaktionswärme muß abgeführt werden. Die Kreislaufsäure dient nicht nur als Absorptionssäure für das entstehende P2O5, sondern führt auch die Reaktionswärme über Wärmetauscher ab. Die thermische Phosphorsäure fällt zum Unterschied zur Naßsäure sehr rein an. Daher ist der Einsatz der Säure und ihrer Salze in der Lebensmittel- und Waschmittelindustrie ohne kostspielige Reinigungsverfahren möglich. Die häufigsten Handelsformen sind die 75%ige (Fp= -20°C), die 80%ige (Fp= +30°C) und die 85%ige (Fp= +21°C) Phosphorsäure. Beantworte folgende Fragen: 01. Nach welchen Verfahren kann die Phosphorsäure hergestellt werden? 02. Schreibe die Reaktionsgleichung für die Herstellung von nasser Phosphorsäure! 03. Schreibe die Reaktionsgleichungen für die Herstellung von thermischer Phosphorsäure! 04. Welche Zwischenprodukte treten bei der Absorption auf? 05. Beschreibe die Herstellung von thermischer Phosphorsäure an Hand des Fließbilds! ch_aoc.doc/14.05.16/Seite 82 Fließbild PHOSPHORSÄURE-ERZEUGUNG ch_aoc.doc/14.05.16/Seite 83 ARSEN As Vorkommen: 1. gediegen (elementar): Scherbenkobalt, Fliegenstein As 2. gebunden: Arsenkies, Arsenopyrit, Giftkies FeAsS = FeS2. FeAs2 Realgar, Rauschrot, Rubinschwefel As4S4 Auripigment, Rauschgelb As2S3 Arsenik As2O3 (In den Elektrofiltern und Flugstaubkammern bei der Abröstung sulfidischer Erze zur Schwefelsäureerzeugung.) Herstellung: Durch Erhitzen von Arsenkies unter Luftabschluß, wobei das Arsen absublimiert und in den kalten Vorlagen abgeschieden wird. RG: Eigenschaften: Arsen kommt in drei Modifikationen vor. Die beständigste ist die graue, metallische. Es ist glänzend und spröde (wie Antimon und Wismut), stromleitend und hat geringe Härte. Arsen sublimiert bei 633 °C. Verwendung: Legierungsbestandteil (z.B. Bleischrot enthält 0,5% As) Verbindungen: Arsenwasserstoff, Arsin AsH3: Herstellung und Eigenschaften: Aus Arsen und Wasserstoff. Das Arsin zersetzt sich leicht und bildet einen ”Arsenspiegel” (Marsh´sche Probe in der Gerichtsmedizin). Er ist giftig. RG: Diarsentrioxid, Arsen(III)-oxid, Arsenik, Giftmehl, Arsenglas As2O3: Arsenige Säure, Arsen(III)-säure, Arsenite, Arsenate (III) H3AsO3, AsO33-: Herstellung: Entsteht durch Verbrennen von Arsen (blaue Flamme, knoblauchähnlichen Geruch) RG: Eigenschaften und Verwendung: Leicht flüchtig, weiß, giftig, in Säuren und Laugen löslich. RG: Konservierungsmittel für Felle und Häute, Schädlingsbekämpfungsmittel, Läuterungsmittel in der Glasherstellung. Diarsenpentoxid, Arsen(V)-oxid As2O5 ch_aoc.doc/14.05.16/Seite 84 Arsensäure, Arsen(V)-säure, Arsenate, Arsenate(V) H3AsO4, AsO43-: Eigenschaften und Verwendung: Giftig, kann bei den Anionennachweisen Phosphat vortäuschen (siehe Laborübungen 1, S 62), Schädlingsbekämpfungsmittel ch_aoc.doc/14.05.16/Seite 85 ANTIMON Sb Vorkommen: 1. gediegen: Allemonit Sb 2. gebunden: Grauspießglanz, Antimonglanz, Antimonit, Stibnit Sb2S3 Herstellung: Der Grauspießglanz wird durch Seigern angereichert (siehe S 50). Man erhält 92-98%iges Sb2S3. a) Niederschlagsarbeit (Metallothermisches Verfahren): Der Grauspießglanz wird in Tiegeln mit Eisenblechabfällen geschmolzen, wobei flüssiges Antimon frei wird. RG: b) Röst-Reduktions-Verfahren: Der Grauspießglanz wird im Drehrohrofen Luftüberschuß oxidiert, wobei sich das nicht flüchtige Sb2O4 bildet, das in Schmelztiegeln mit Koks reduziert wird. RG: Die Reinigung des Rohantimon erfolgt durch Sodaschmelze, Verunreinigungen oxidiert werden und in die Schlacke gehen. wobei mit die Eigenschaften: Antimon kommt in drei Modifikatioen vor, von denen die beständigste ein silberweißes, glänzendes, sprödes, ziemlich edles Metall ist. Verwendung: Als Legierungsbestandteil z.B. Hartblei, Letternmetall (Antimon härtet Blei und Zinn), Britanniametall Verbindungen: Diantimonpentsulfid, Antimon(V)-sulfid, Goldschwefel Sb2S5 Zum Vulkanisieren von Kautschuk verwendet, der dadurch eine orangerote Farbe erhält. ch_aoc.doc/14.05.16/Seite 86 BISMUT (WISMUT) Bi Vorkommen: 1. gediegen Bi 2. gebunden: Wismutglanz, Bismutin Bi2S3 Wismutocker, Bismit Bi2O3 Herstellung: Durch Röstreduktionsverfahren bei sulfidischen Erzen (siehe Antimon) und Reduktion mit Koks bei oxidischen Erzen. Die Reinigung des Rohwismut erfolgt durch oxidierendes Schmelzen. RG: Eigenschaften: Sprödes, silberweißes, leicht rötliches, leicht pulverisierbares Metall, das sich beim Erstarren (wie Wasser, Antimon, Germanium, Silicium, Gallium) ausdehnt. Verwendung: Niedrig schmelzende Legierung (elektrische Sicherungen, Sicherheitsverschlüsse, Feuermelder) wie Wood-Metall, Lipowitz-Metall, Rose-Metall und Klischeemetalle (scharfe Konturen durch die Ausdehnung beim Erstarren) Verbindungen: Wismut(III)-oxidnitrat, BiONO3.H2O Für die Brandwundenbehandlung ch_aoc.doc/14.05.16/Seite 87 Beantworte folgende Fragen: 01. Nenne die Elemente der 5. Hauptgruppe mit allgemeinen Eigenschaften, die sich aus dem PSE ableiten! 02. Nenne die wichtigsten Vorkommen von Stickstoff! 03. Wie wird Stickstoff gewonnen? 04. Was ist ein inertes Gas? 05. Wie wird Ammoniak hergestellt (+ RG)? 06. Nach welchem Prinzip funktioniert das Haber-Bosch-Verfahren? 07. Eigenschaften und Verwendung von Ammoniak? 08. Wie werden Ammoniumsalze hergestellt (3 Beispiele + RG)? 09. Wie wird Ammoniumcarbonat hergestellt (+ RG)? 10. Nenne 3 Stickstoffoxide (mit Herstellung und RG)! 11. Herstellung von Salpetersäure nach dem Ostwald-Verfahren (+RG)! 12. Nenne die wichtigsten Vorkommen von Phosphor mit chem. Formel! 13. Nenne die Phosphor-Modifikationen mit Eigenschaften! 14. Herstellung von Phosphor nach dem Piesteritz-Verfahren (+ RG)! 15. Herstellung von Diphosphortrioxid und Diphosphorpentoxid mit RG! 16. Bilde die orto-, meta-, und Diphosphorige Säure (Phosphorsäure) aus ihrem Anhydrid (+ RG)! 17. Herstellung von Superphosphat, Doppelsuperphosphat und Diammoniumhydrogenphosphat (+RG)! 18. Was versteht man unter ”gediegenen” Vorkommen? 19. Nenne die wichtigsten Vorkommen von Arsen, Antimon und Wismut mit chem. Formel! 20. Herstellung von Arsen mit RG! 21. Wie wird der Grauspießglanz angereichert? Beschreibe das Verfahren! 22. Wie kann Antimon durch die Niederschlagsarbeit gewonnen werden (+RG)? 23. Wie kann Antimon durch Röstreduktionsarbeit gewonnen werden (+RG)? 24. Wie wird Wismut aus sulfidischen Erzen gewonnen (+RG)? 25. Wie wird Wismut aus oxidischen Erzen gewonnen (+RG)? ch_aoc.doc/14.05.16/Seite 88 14. Gruppe oder 4. Hauptgruppe IVa (alt) – KOHLENSTOFFGRUPPE Name OZ Atommasse C Si Ge Sn Pb 6 14 32 50 82 12,011 28,086 72,59 118,69 207,19 Metallcharakter Eigenschaften KOHLENSTOFF C Vorkommen: 1. frei als Graphit (hexagonal), Diamant (regulär) und Kohle (amorph) 2. gebunden als anorganische Verbindungen Salze der Kohlensäure (Carbonate) z.B.: Kalk CaCO3 Magnesit MgCO3 Dolomit CaCO3.MgCO3 in der Luft als Kohlendioxid CO2 Hauptkomponente aller organischen Verbindungen Erdöl Eigenschaften: Kohlenstoff ist ein reaktionsträges Element. Er verbindet sich bei normaler Temperatur nur äußerst schwer. Er kommt in drei Modifikationen vor. Graphit: Die stabilste Form ist der hexagonal kristallisierende Graphit. Er ist tief schwarz, weich und ein guter Stromleiter. Er ist längs der Ebenen gut spaltbar. Da die natürlichen Vorkommen nicht ausreichen, wird der Graphit auch künstlich hergestellt (Retortengraphit, Ruß, Aktivkohle, Glanzkohlenstoff). Verwendung: Adsorptionsmittel (Entfernen von Verunreinigungen, Herstellung von Tiegeln und Elektroden, Schmiermittel, Farbstoff, Moderator im Kernreaktorenbau. Diamant: Er ist eine metastabile Form des Graphits und geht beim Erhitzen unter Luftabschluß in den Graphit über. Er ist sehr hart, leitet den elektrischen Strom nicht. Keine Spaltbarkeit in einer Raumrichtung. Verwendung: Schmuckstein, für technische Zwecke (Glasschneider, Poliermittel usw.). Fullerene: Es sind kugel- oder zylinderförmige Moleküle mit 60-70 C-Atomen, die in 5er- oder 6er-Ringen (ähnlich einem Fußball) angeordnet sind. ch_aoc.doc/14.05.16/Seite 89 Fulleren Diamant Graphit Natürliche Kohlen: Sie entstanden aus fossilen Pflanzen, die unter Luftabschluß und hohem Druck. Beim Erhitzen von Kohlen unter Luftabschluß entsteht der Koks. Man unterscheidet nach dem Inkohlungsgrad: Anthrazit (ca. 93% C in der Trockensubstanz) Steinkohle (70-80% C in der Trockensubstanz) Braunkohle (60-70% C in der Trockensubstanz) Torf (50- 64% C in der Trockensubstanz) Verbindungen: Wasserstoff- und Halogenverbindungen: Sie gehören in die organische Chemie und werden dort besprochen. Sauerstoffverbindungen: Kohlenmonoxid, Anhydrid der Ameisen- oder Methansäure CO Herstellung: Technisch durch den Wassergasprozeß (Wasserdampf über glühende Kohlen), Generatorgasprozeß (Luft über glühende Kohlen) oder durch Methanspaltung (siehe Ammoniak-Herstellung – Synthesegasherstellung, Fließbild). Eigenschaften: Farbloses, geruchloses, giftiges (durch Blockierung des Hämoglobins), geschmackloses Gas. Es brennt mit bläulicher Flamme und ist ein starkes Reduktionsmittel. Verwendung: Heiz- und Kraftgas, Synthesegas für organische Synthesen. Kohlendioxid, Anhydrid der Kohlensäure, Kohlensäure CO2, H2CO3 Es kommt frei in der Luft vor. Herstellung: 1. Durch Verbrennen von Koks oder Kohle mit Luftüberschuß RG: 2. Als Nebenprodukt beim Brennen carbonathaltiger Gesteine (z.B. Kalk) RG: ch_aoc.doc/14.05.16/Seite 90 Eigenschaften: Farbloses, nicht brennbares, die Verbrennung nicht unterhaltendes Gas mit leicht säuerlichem Geschmack. Es ist schwerer als Luft (Gärgase) und das Anhydrid der Kohlensäure, die frei nicht beständig ist. Verwendung: Kohlensäureschneelöscher, Solvay-Sodaprozeß ch_aoc.doc/14.05.16/Seite 91 Carbide: Sie sind Verbindungen mit Metallen und Nichtmetallen größerer Elektronegativität. Kohlenstoff ist immer der elektronegative Partner in dieser Verbindung. Man unterscheidet drei Typen: Salzartige Carbide: Metalle der 1., 2. und 3. Hauptgruppe bilden Abkömmlinge des Methans (Methanate), Acetylen (Acetylide) und Propin (Allylenide). Das bekannteste Carbid ist das Calciumcarbid CaC2 (Calciumacetylid). Kovalente Carbide: Verbindungen mit Nichtmetallen (Atombindung) z.B. :SiC und B 13C2. Sie sind sehr hart und chemisch inert. Metallische Carbide: Verbindungen mit Elementen der 4., 5. und 6. Nebengruppe. Der Kohlenstoff wird in Lücken des Metallgitters eingelagert. Sie zeichnen sich durch große Härte, hohe Schmelzpunkte und metallische Leitfähigkeit aus. ch_aoc.doc/14.05.16/Seite 92 SUPERSORBONVERFAHREN Anwendungsgebiet: Das Supersorbonverfahren wird zur Lösungsmittelrückgewinnung und Abluftreinigung eingesetzt. Es wird in der lösemittelverarbeitenden Industrie, bei Beschichtungs-, Entfettungs-, Tränkungs- und chemischen Waschanlagen eingesetzt, außerdem noch in Anlagen, wo Viskosefasern, Folien, Isolierstoffe, Gummiwaren u.ä. hergestellt werden. Durch den Einsatz werden gesundheitsschädliche oder umweltbelastende Stoffe beseitigt. Dabei ergibt sich durch die hohe Rückgewinnungsausbeute der Lösemittel.(bis 95%) ein Beitrag zur Kostensenkung. Grundlage: Grundlage ist die Anwendung von Aktivkohle Supersorbon welche eine quantitative Adsorption (physikalischer Oberflächenvorgang) organischer Dämpfe und die Regeneration der Aktivkohle mit Wasserdampf (Desorption) unter Rückgewinnung der adsorbierten Lösemittel gestattet. Die Aktivkohle wird aus organischen Rohstoffen (Holz, Torf, Braunkohle, Steinkohle, Fruchtschalen usw.) durch Aktivierung hergestellt. Diese Aktivierung (Gas- oder chemische Aktivierung) in Drehrohr-, Etagen-, Schacht- oder Wirbelschichtöfen ergibt hochporöse Kohlenstoffgerüste mit unzähligen Kapillaren. Diese Kapillaren ergeben die hohe innere Oberfläche von 1000-1500m2/g Aktivkohle. Supersorbon hat eine Korngröße von 2-4mm und wird geformt oder gebrochen eingesetzt. Pulverförmig findet sie als Entfärbungskohle Verwendung. Verfahrensbeschreibung: Beladen-Adsorption (Adsorber K1, K2) Die lösemittelhaltige Luft wird an den Verdunstungsstellen durch Gebläse abgesaugt und durch einen oder mehrere mit Aktivkohle gefüllte Adsorber von unten nach oben geführt. Dabei wird das Lösemttel von der Aktivkohle adsorbiert. Die lösemittelfreie Luft tritt oben aus. Beladen wird kontinuierlich bis zum Durchbruch, d.h. so lange, bis die Lösemittel nicht mehr quantitativ adsorbiert werden. Die Prüfung erfolgt durch ein Lösemittel-Konzentrationsmeßgerät. Jetzt wird auf ”leere” Adsorber umgeschaltet und der Beladungsvorgang geht weiter. Regenerieren-Desorption: Die Regeneration der beladenen Aktivkohle erfolgt im Gegenstrom zur Beladerichtung durch Desorption mit Wasserdampf. Dabei wird die Aktivkohle auf über 100°C erwärmt. Die Lösemittel- auch höher siedende- werden dampfförmig ausgetrieben. Das Wasser-Lösemitteldampfgemisch wird kondensiert (W1). Im Wasser unlösliche Lösemittel (Benzin, Benzol, Toluol, Schwefelkohlenstoff usw.) werden auf Grund der verschiedenen Dichte durch Abscheider getrennt (F1). Bei in Wasser ganz oder teilweise löslichen Lösemitteln bzw. Lösemittelgemischen (Alkohol, Aceton, Ether usw.) erfolgt die Trennung mit Destillations- oder Extraktionskolonnen mit Heizung und Kondensator (statt F1). Man erhält die Lösemittel in wasserfreiem, sofort wieder einsatzfähigem Zustand. Trocknen und Kühlen der Aktivkohle ist nur in besonderen Fällen notwendig. Meistens genügt der Wärmeinhalt der Beladungsgase, um die von der Aktivkohle beim Ausdämpfen aufgenommene Feuchtigkeit während der Beladung wieder auszutreiben. ch_aoc.doc/14.05.16/Seite 93 Beantworte folgende Fragen: 1. Wo wird das Supersorbonverfahren eingesetzt? 2. Wann wird das Supersorbonverfahren eingesetzt? 3. Was wissen Sie über Aktivkohlen? 4. Was ist Adsorption? 5. Was ist Desorption? 6. Was ist fraktionierte Destillation? 7. Erkläre das Verfahren anhand des Fließbildes! Beachte besonders die Ventilstellung! Fließbild Supersorbon-Verfahren xxx ch_aoc.doc/14.05.16/Seite 94 SILICIUM Si Vorkommen: 1. als Siliciumdioxid: Quarz, Quarzsand, Bergkristall, Kieselstein usw. SiO 2 2. als Salze der Kieselsäure (Silikate) von Aluminium, Erdalkalien und Alkalien Herstellung: Durch Reduktion von Quarz SiO2 mit Kohle oder Calciumcarbid CaC2 im elektrischen Ofen: RG: Eigenschaften: Silicium bildet dunkelgraue, harte, spröde Oktaeder. Es ist ein Halbleiter. Silicium verbrennt mit Sauerstoff bei hoher Temperatur zu Siliciumdioxid. Bei Zimmertemperatur wird es durch Bildung einer Oxidhaut passiviert. Mit Fluor reagiert es schon bei Zimmertemperatur zu Siliciumtetrafluorid. Verwendung: Im Gleichrichterbau, als Legierungsbestandteil für Stahl (erhöht die chemische Widerstandsfähigkeit) Verbindungen: Wasserstoffverbindungen: Sie sind analog den Kohlenwasserstoffen in der organischen Chemie aufgebaut. Ihre Beständigkeit nimmt meist steigender Kettenlänge ab. Sie sind die Bausteine der Silicone (siehe organische Chemie). Sauerstoffverbindungen: Siliciumdioxid, Anhydrid der Kieselsäure, SiO2: Vorkommen: Es kommt in der Natur sehr verbreitet in kristallisierter (z.B. Bergkristall), kristalliner (z.B. Quarzsand) und amorpher (Opal, Kieselgur) Form vor. Eigenschaften: Sehr reaktionsträge, gegen Chemikalien beständig (Ausnahmen: Alkalischmelzen und Flußsäure). Verwendung: Quarzglas (Schmelzen von Bergkristall) zur Herstellung von Tiegeln, Schalen, Destillierkolben usw. und optische Geräte (UV-durchlässig). Quarzgut (Schmelzen von Quarzsand) für chemische Großapparaturen. ch_aoc.doc/14.05.16/Seite 95 Technische Silikate: 1. Glas: Glas ist eine amorphe (nicht kristalline) Masse. Physikalisch ist es eine unterkühlte Schmelze oder Flüssigkeit mit hoher Viskosität. Chemisch ist Glas ein homogenes Doppelsilikat. Glasarten Natronkalkglas Zusammensetzung Quarz, Kalk, Soda Verwendung Flaschen, Fenster, Glaswolle Eigenschaften grünlich, chem. wenig widerstandsfähig Kalikalkglas Quarz, Kalk, Pottasche Rohre, Spiegel, Haushaltsgegen -stände weiß, härter, widerstandsfähiger, schwerer schmelzbar Bortonerdeglas Borosilikatglas Quarz, Borax, Tonerde chem. Geräte, feuerfeste Gläser temperaturbeständig, elastisch, hohe Erweichungstemperatur Kalibleiglas Quarz, Bleioxid, Pottasche opt. Geräte, Ziergegenstände hohe Lichtbrechung, schwer, leicht schmelzbar Eigenschaften: Durchscheinend, spröde, glatte Oberfläche, leicht formbar, schlechter Wärme- und Stromleiter, säurebeständig (Ausnahme Flußsäure). Es erweicht und schmilzt ohne festen Schmelzpunkt. Herstellung: Die entsprechenden Carbonate und Sand (Borsäure oder Borax und Ton) werden gemischt. Dieser ”Glassatz” wird in Schmelztiegeln aus Ton geschmolzen und geläutert. Die Schmelze wird langsam abgekühlt, um thermische Spannungen zu vermeiden. Färbung und Trübung: Die Färbung erfolgt mit verschiedenen Metalloxiden (z.B. Eisenoxide - braun, grün, Cobaltoxid - blau, kolloidales Gold – rot, analog Boraxperle). Die Trübung durch Einlagerung von Calciumphosphat Ca 3(PO4)2, Zinndioxid SnO2 oder Trinatriumhexafluoroaluminat Na3AlF6. 2. Email: Es wird als Schutz auf Metalle aufgeschmolzen. 3. Tonwaren: Sie werden durch Brennen von Aluminiumsilikaten (Kaolin, Kaolinit oder Montmorillonit) mit Magerungsmitteln (gebrannter Ton, Sand, Quarz), die das Schwinden verhindern, hergestellt. Baustoffe und Geschirr unterscheiden sich nur durch die ”Scherbenstärke”. Sie ist bei Geschirr geringer. Man unterscheidet: Tongut (wasserdurchlässig): Baustoffe (z.B. Ziegel, Schamotte) Geschirr (z.B. Blumentöpfe, Majolika, Fayence, Kacheln) Tonzeug (wasserundurchlässig): Baustoffe (z.B. Klinker, Fließen, Rohre) Geschirr (z.B. Feinterrakott, Porzellan) ch_aoc.doc/14.05.16/Seite 96 ch_aoc.doc/14.05.16/Seite 97 PORZELLAN 1. Aufbereitung der Rohstoffe: Kaolin ist ein Aluminiumsilikat, das mit Wasser angeteigt plastisch formbar ist und nach dem Brennen fest und formbeständig wird. Er muß zur Reinigung zuerst fein vermahlen und anschließend geschlämmt werden. Um eine bessere Materialgüte zu erhalten (gleichmäßige Erweichung, geringer Schwund) setzt man Magerungsmittel (z.B. Sand, Quarz, gebrannten Ton) und Flußmittel (Feldspat) zu. Feldspat (1) und Quarz (2) werden im Kollergang (4) zerkleinert und gemischt, anschließend im Trommelsieb (5) gesiebt und in der Kugelmühle (6) auf die gleiche Feinheit wie der Kaolin gebracht (12-36 Stunden unter Wasserzugabe mahlen). Kaolin (3) wird mit Wasser im Rührbottich (7) zu Kaolinmilch verrührt, in die man das FeldspatQuarz-Gemisch einrührt. Anschließend werden Klumpen durch Siebe und Eisenteile mit Magnetabscheidern aus der Mischung entfernt und die reine Milch in einem Vorratsbehälter mit Rührwerk zwischengelagert. Aus diesem entnimmt man das Gemisch nach Bedarf, filtriert es in einer Filterpresse (8) und läßt den Filterschlamm in kühlen, feuchten Lagerkellern (9) reifen (bis 1 Jahr), wodurch das Gemisch leichter formbar wird. 2. Formen: Die gereifte Masse wird vor ihrer Verarbeitung gut durchgeknetet (10), um eine homogene, luftbläschenfreie Masse zu erhalten. Je nach der Art des herzustellenden Gegenstandes wird auf der Töpferscheibe (11, für runde Gegenstände), in Pressen (12) oder Stanzen (einfache Massenartikel) weiterverarbeitet. Um schwierige Gegenstände herzustellen, wird die Masse mit Wasser und Soda zur Erhöhung der Dünnflüssigkeit im Rührgefäß (13) verrührt und in Gipsformen gegossen. Der Gips saugt das Wasser des sogenannten Schlickers auf. 3. Vorbrennen: Die Gegenstände werden nun in Trockenhorden (15) langsam und gleichmäßig an der Luft getrocknet, um Rißbildungen beim späteren Brand zu vermeiden. Anschließend werden sie in Schamottekapseln (16) (Staubschutz) verpackt und in der oberen Etage des Zwei-Etagenofens (17) 12-20 Stunden vorgebrannt oder verglüht (Glühbrand). Das so entstandene stark poröse Biskuit-Porzellan wird nun langsam von 900 - 1000°C auf Zimmertemperatur abgekühlt. 4. Fertig- oder Glattbrennen: Vor dem Fertigbrennen wird die Ware glasiert (18) und getrocknet (19), eventuell vorher noch bemalt (23, Unterglasurmalerei), wieder in Schamottekapseln verpackt und in der unteren Etage des Zwei-Etagenbrennofens (17) glattgebrannt. Die aus viel Feldspat und wenig Ton mit Wasser angeteigte Glasur, in die der Gegenstand eingetaucht wurde, schmilzt und verglast beim Abkühlen. Der vorher porige Gegenstand erhält so eine glatte glänzende Oberfläche (Temperatur 1350 -1450 °C). Die fertigen Weißwaren (ohne Malerei) werden nach Güteklassen sortiert (21) und eventuelle Unebenheiten abgeschliffen (22). Werden die glatten Waren bemalt (24, Aufglasurmalerei), ist ein dritter Brennvorgang bei 600 - 800°C im Muffelofen und eventuell ein zweiter Abschleifvorgang notwendig. ch_aoc.doc/14.05.16/Seite 98 Fließbild Porzellan-Herstellung Xxx ch_aoc.doc/14.05.16/Seite 99 GERMANIUM Ge Vorkommen: Als Begleitelement sulfidischer Erze Verwendung: Als Dioden-Material (Reinheit 99,9999%), Transistoren und Gleichrichter ZINN Sn Vorkommen: Zinnstein SnO2 Herstellung: Durch Rösten wird der Zinnstein von Verunreinigungen wie Schwefel und Arsen befreit und anschließend mit Koks in Schacht- oder Flammöfen reduziert. RG: Die Reinigung (besonders von Eisen) erfolgt durch Seigern (eine schwer schmelzbare Zinn-Eisen-Legierung bleibt zurück). Eigenschaften: Silberweißes, stark glänzendes, gut dehnbares, geschmeidiges Metall mit geringer Härte, das zu dünnen Folien ausgewalzt werden kann (Stanniol). Es kommt in zwei Modifikationen vor: -oder weißes Zinn, kristallisiert tetragonal, - oder graues Zinn, kristallisiert kubisch, ist aber meist pulverförmig. Der Übergang von - in Zinn erfolgt unter 13,2 °C (”Zinnpest”) Zinn ist gegen Luft und Wasser beständig und kommt in 2- und 4-wertiger Form vor. Verwendung: Für Kannen, Teller und Becher (Speisezinn muß bleifrei sein), als Korrosionsschutz (Eisen, Weißblech) meist durch Tauchverfahren, als Legierungsbestandteil (Weichlot Pb/Sn, Bronze Cu/Sn usw.) ch_aoc.doc/14.05.16/Seite 100 BLEI Pb Vorkommen: Bleiglanz PbS Weißbleierz PbCO3 Rotbleierz PbCrO4 Herstellung: Sie erfolgt nach zwei Verfahren: 1. Röstreduktionsverfahren: Der Bleiglanz PbS wird vollständig abgeröstet, das entstehende Bleioxid Kohlenstoff in Schachtöfen reduziert. RG: wird mit 2. Röstreaktionsverfahren: Der Bleiglanz wird unvollständig abgeröstet (zu 2/3), dann reagiert das verbliebene Bleisulfid mit dem gebildeten Bleioxid. RG: Das nach einem dieser beiden Verfahren erhaltene Werkblei enthält noch Cu, As, Sb, Sn; S und Ag. Reinigung: Das Werkblei wird unter Luftzutritt geschmolzen. Dabei bilden As, Sb, und Sn Bleisalze, die an der Oberfläche abgezogen werden. Kupfer und Blei bilden eine schwer schmelzbare Legierung, die sich abscheidet und den Schwefel zur Gänze aufnimmt. Das Verfahren zur Entsilberung wird beim Silber besprochen. Die weitere Reinigung erfolgt elektrolytisch. Eigenschaften: Blei ist ein weiches, dehnbares, walzbares, bläulich-graues Schwermetall. Es läuft an der Luft unter Bildung von Bleioxid PbO an, wodurch das darunterliegende Metall geschützt wird. Es ist gegen oxidierende Säuren und Säuren, die unlösliche Bleiverbindungen ergeben beständig. Verwendung: Bleirohre und Bleiblechherstellung, Geschosskerne, Schrot, Legierungsbestandteil (Lagerund Lettermetalle) und Akkumulatoren. Verbindungen: Einige Verbindungen als anorganische Pigmente, die gute Deckkraft und hohe Lichtechtheit haben, aber giftig sind (Bleiweiß Pb(OH)2.PbCO3, Mennige Pb3O4 usw). Der Bleiakkumulator: Er besteht aus zwei gitterförmigen Bleigerüsten, von denen eines mit Bleischwamm, das andere mit Bleidioxid PbO2 gefüllt ist. Die Akkumulatorsäure ist 20-30%ige Schwefelsäure (d=1,51 -1,22 g/ml) im geladenen Zustand. ch_aoc.doc/14.05.16/Seite 101 Eine Zelle liefert ca. 2 V Spannung. Während der Entladung sinkt die Konzentration der Schwefelsäure, so daß die Dichte der Säure ein Maß für den Ladezustand ist. Die Wiederaufladung erfolgt durch eine von außen angelegte Gleichstromspannung von über 2 V. Entladung: RG: Beantworte folgende Fragen: 01. Nenne die Elemente der 4. Hauptgruppe mit chem. Zeichen! 02. Nenne vier Vorkommen von Kohlenstoff mit chem. Formel! 03. Beschreibe die zwei Modifikationen von Kohlenstoff! ch_aoc.doc/14.05.16/Seite 102 04. Wie werden natürliche Kohlen eingeteilt? 05. Wie wird Kohlenmonoxid hergestellt (mit RG)? 06. Wie wird Kohlendioxid hergestellt (mit RG)? 07. Was sind Carbide und wie werden sie eingeteilt? 08. Wofür wird Graphit verwendet? 09. Wie kommt Silicium vor (mit chem. Formel)? 10. Wie werden technische Silicate eingeteilt? 11. Welche Glasarten gibt es? 12. Beschreibe die Herstellung von Bortonerdeglas! 13. Wie werden Tonwaren eingeteilt? 14. Nenne das Vorkommen von Zinn mit chem. Formel! 15. Wie kann Zinn gewonnen werden (mit RG)? 16. Nenne die Eigenschaften und Verwendung von Zinn! 17. Nenne das Hauptvorkommen von Blei mit chem. Formel! 18. Schreibe die RG zum Röstreduktionsverfahren zur BleiHerstellung! 19. Schreibe die RG zum Röstreaktionsverfahren zur BleiHerstellung! 20. Wie wird das Werkblei gereinigt? 21. Nenne die Eigenschaften und Verwendung von Blei! 22. Wie ist der Bleiakkumulator aufgebaut? 23. Schreibe die RG für die Entladung des Bleiakkumulators! 24. Schreibe die RG für die Ladung des Bleiakkumulators! ch_aoc.doc/14.05.16/Seite 103 13. Gruppe oder 3. Hauptgruppe IIIa (alt) - ERDMETALLE Name OZ Atommasse B Al Ga In Tl 6 13 31 49 81 10,61 16,98 69,72 114,82 204,37 Metallcharakter Eigenschaften BOR B Vorkommen: Borax Na2B4O7.10H2O Borocalcit CaB4O7.4H2O Herstellung: 1. Durch thermische Zersetzung von Bortrijodid RG: 2. Schmelzflußelektrolyse von Borsäure H3BO3 Verwendung: Als Reduktionsmittel beim Kupferguß, zur Herstellung von Ferrobor Verbindungen: Orthoborsäure, Borate H3BO3, B(OH)3, BO33Herstellung: Durch Umsetzung von Natriumtetraborat mit Salzsäure und Wasser: RG: Eigenschaften: Sehr schwache dreibasige Säure, die wasserdampfflüchtig ist. Verwendung: Desinfektionsmittel (Borwasser), zur Herstellung von Metaborsäure und Dibortrioxid durch Entwässerung; RG: ch_aoc.doc/14.05.16/Seite 104 Natriumtetraborat, Borax Na2B4O7.10H2O: Herstellung: Aus den natürlichen Vorkommen (z.B. Borocalcit durch Kochen mit Natronlauge) Verwendung: Waschmittel, Konservierungsmittel in der Gerberei, Flußmittel für Emaile und Glasuren Natriumperborat NaBO2.H2O2.2H2O: Herstellung: Durch Umsetzung von Orthoborsäure mit Natronlauge und Wasserstoffperoxid. Es enthält keine Peroxogruppe, sondern nur H2O2 statt Wasser. RG: Verwendung: Waschmittel, Bleichmittel (Wolle, Seide usw.), Zahnpulver Borcarbid B4C, Bornitrid (BN)n: Das Borcarbid ist härter als Diamant und wird als Schleifmittel verwendet. Das Bornitrid besitzt Diamantgitter, ist sehr hart und wird als Schleifmittel und für Glasschneider verwendet. ch_aoc.doc/14.05.16/Seite 105 ALUMINIUM Al Vorkommen: Bauxit Al2O3.H2O, verunreinigt mit Eisenoxid und Siliciumdioxid Ton Al2O3.SiO2.xH2O Korund Al2O3 Herstellung: siehe Aluminium-Herstellung (Fließbild) Eigenschaften: Silberweißes Leichtmetall, an der Luft beständig, da es sich mit einer Oxidschicht überzieht. Künstlich kann dies durch anodische Oxidation (Eloxierung) erreicht werden. Die Oxidschicht kann auch angefärbt werden. Verwendung: Als Reduktionsmittel, Thermit-Verfahren (Thermit: Fe3O4+Al) zum Schweißen und Verbinden von Eisenteilen. RG: Legierungen: Magnalium (Al-Mg) Hydronalium (Al-Mg, seewasserfest, Schiff- und Flugzeugbau) Duraluminium (Al-Cu-Mg) Silumin (Al-Si) Verbindungen: Aluminiumoxid Al2O3 Es ist ein amphoteres Oxid und daher in Säuren und Basen löslich (siehe BayerVerfahren). Es kommt in der Natur als Korund und Schmirgel vor. Trinatriumhexafluoroaluminat, Kryolith, Eisstein Na3AlF6: ch_aoc.doc/14.05.16/Seite 106 siehe Aluminium-Herstellung (Fließbild) Herstellung: Aluminiumoxid mit Flußsäure und Natriumcarbonat in wässriger Lösung RG: Verwendung: als Flußmittel bei der Aluminiumelekrolyse Kaliumaluminiumsulfat, Alaun KAl(SO4)2.12H2O: Alaune sind allgemein Doppelsulfate von einwertigen und dreiwertigen Metallen, die immer mit 12 Kristallwasser kristallisieren MeIMeIII(SO4)2.12H2O. Der Kalium-Aluminium-Alaun wird zur Blutstillung verwendet. ch_aoc.doc/14.05.16/Seite 107 ALUMINIUM-HERSTELLUNG Die Aluminium-Herstellung erfolgt in 2 Stufen: 1. Herstellung von reinem Aluminiumoxid Al2O3 aus Bauxit (Bayer-Verfahren): Wirtschaftlich nutzbare Bauxite haben über 50% Al 2O3, 10-30% Fe2O3, 2-3% TiO2 und unter 5% SiO2. Nach dem Bayer-Verfahren wird Bauxit mit 40%iger Natronlauge behandelt. Dabei löst sich die amphore Aluminiumkomponente als Natriumtetrahydroxoaluminat NaAl(OH)4, während unerwünschte Begleiter, wie Fe2O3, TiO2 und SiO2 ungelöst bleiben oder zu schwer lösbaren Verbindungen reagieren (z.B. Natriumaluminiumsilikat, dies bewirkt Aluminiumverluste, daher sollte der Bauxit möglichst wenig SiO2 enthalten). Der abfiltrierte Rotschlamm wird, da man ihn nicht verwenden kann, auf Halden abgelagert. RG: Aus der gereinigten Aluminatlösung wird schließlich Aluminiumhydroxid Al(OH) 3 durch Zusatz von Wasser ausgerührt. RG: Das reine Aluminiumhydroxid wird dann durch Brennen in reines Aluminiumoxid Al 2O3 umgewandelt. RG: bzw. zu Kryolith Na3AlF6 umgesetzt. RG: 2. Schmelzflußelektrolyse von Al2O3 zur Aluminium-Herstellung Da laut Spannungsreihe H+-Ionen vor den Al3+-Ionen entladen werden, darf der Elektrolyt keine H+-Ionen enthalten (er muß wasserfrei sein). Die Elektrolyse wird daher mit geschmolzenem Al2O3 durchgeführt. Reines Al2O3 schmilzt bei ca. 2000°C. Da bei dieser Temperatur die Energiekosten zu hoch wären, verwendet man Zusätze von Kryolith Na3AlF6 (80%), welches nicht elektrolytisch zersetzt wird. Dieses Gemisch schmilzt bei 970°C. Als Kathode dient eine Wanne aus Eisen, die mit Schamotte und Kohlensteinen ausgemauert ist. Von oben tauchen Graphitelektroden als Anode in die Schmelze. Bei einer Zersetzungsspannung von 5-7V werden Stromstärken bis 100.000A angewendet. Die Aluminium-Ionen wandern zur Kathode, werden dort unter Elektronenaufnahme zu Aluminium entladen, das sich am Boden des Troges absetzt. RG (Kathode): Die Sauerstoff-Ionen wandern zur Anode und werden dort unter Elektronenabgabe zu Sauerstoff entladen. Dieser reagiert mit dem Kohlenstoff der Elektroden unter Bildung von Kohlenmonoxid, wodurch ein großer Elektrodenverbrauch auftritt. RG (Anode): ch_aoc.doc/14.05.16/Seite 108 Arbeitsweise: Bauxit wird in einem Walzenbrecher (Z1) grob zerkleinert und in einer Calziniertrommel (T1) getrocknet. In einer Kugelmühle (Z2) wird er fein gemahlen, gesiebt (F1) und gelangt so in den Mischbehälter (B1), wo ihm ca. 40%Ige Natronlauge zugesetzt wird. In einem Autoklaven (B2) erfolgt die Umsetzung des Bauxit-Natronlauge-Gemisches zu Natriumtetrahydroxoaluminat (170 °C, 6-8 bar, 5 h Reaktionszeit). Nach dem Entspannen wird der Brei zur vollständigen Herauslösung des Aluminats im Verdünnungsbehälter (B3) mit Wasser versetzt und der Rückstand (Rotschlamm) abfiltriert (F2). Anschließend wird die reine Natriumaluminat-Lösung in einem Fällbehälter (B4) mit Wasser ausgerührt (2-3 Tage). Das gebildete feste Aluminiumhydroxid (nur 55% des Al) wird im Drehfilter (F3) von der Lauge befreit und durch Glühen im Drehrohrofen (T2) bei 1200 °C calciniert. Die Lauge (enthält noch 45 % des Al) wird in Verdampfern (W1) aufkonzentriert und neuerlich dem Prozeß zugeführt. Nun wird das Aluminiumoxid mit Kryolith vermengt und bei den genannten Bedingungen elektrolisiert. Das gebildete Aluminium ist schwerer als die Badflüssigkeit und sinkt zu Boden. Es wird diskontinuierlich abgelassen. Das Abgas enthält neben CO auch O2, CO2 und Fluorverbindungen. Beantworte folgende Fragen: 01. Welche Verbindungen sind im Mineral Bauxit enthalten? 02. Wie erfolgt die Abtrennung der Bauxit-Beimengungen? 03. Auf welchen Eigenschaften des Al beruht die Reinigung des Bauxits? 04. Welche Aluminiumverbindung wird bei der Elektrolyse eingesetzt? 05. Wozu dient der Kryolith bei der Elektrolyse? 06. Welches Gas entsteht an der Anode bei der Elektrolyse? 07. Beschreibe das Verfahren zur Bauxitaufbereitung und Aluminium-Herstellung an Hand des Fließbilds! ch_aoc.doc/14.05.16/Seite 109 Fließbild Aluminium-Herstellung xxx ch_aoc.doc/14.05.16/Seite 110 GALLIUM Ga, INDIUM In, THALLIUM Tl Sie kommen alle als Begleiter von Zinkblende vor. Verwendung: Ga: Als Bestandteil für Hochtemperaturquarzglasthermometer In: Als Legierungsbestandteil von Lagermetallen Tl: In Form von Thallium(I)-sulfat Tl2SO4 als Rattengift und zur Herstellung optischer Gläser (Monochromatoren) Beantworte folgende Fragen: 01. Nenne die Elemente der 3. Hauptgruppe mit chem. Zeichen und allgemeinen Eig.! 02. Nenne ein Vorkommen von Bor mit chem. Formel! 03. Wie kann Bor hergestellt werden (mit RG)? 04. Herstellung von Orthoborsäure (mit RG)! 05. Herstellung von Metaborsäure und Bortrioxid aus Orthoborsäure (mit RG)! 06. Herstellung von Natriumperborat (mit RG)! 07. Wofür wird Borcarbid und Bornitrid verwendet? 08. Nenne zwei Vorkommen von Aluminium mit chem. Formel! 09. Nach welchem Verfahren wird der Bauxit gereinigt (mit RG)? 10. Auf welchen Eigenschaften des Aluminiums beruht die Reinigung von Bauxit? 11. Was ist das Flußmittel bei der Aluminiumelektrolyse? 12. Schreibe die elektrodenbezogenen RG für die Aluminiumelektrolyse! 13. Wofür wird das Aluminium verwendet? 14. Was ist das Thermit-Verfahren (mit RG)? Wozu dient es? 15. Herstellung von Kryolith (mit RG)! 16. Was sind Alaune allgemein (mit chem Formel)? 17. Wozu wird Gallium, Indium und Thallium verwendet? ch_aoc.doc/14.05.16/Seite 111 2. Gruppe oder 2. Hauptgruppe IIa (alt) - ERDALKALIMETALLE Name OZ Atommasse Be Mg Ca Sr Ba Ra 4 12 20 38 56 88 9,012 24,305 40,08 87,62 137,34 226 Löslichkeit Carbonate Löslichkeit Sulfate BERYLLIUM Be Vorkommen: Beryll, Smaragd, Aquamarin 3BeO.Al2O3.6SiO2 Herstellung: 1. Schmelzflußelektrolyse von Natriumtrifluoroberyllat NaBeF3 2. Aus Berylliumfluorid BeF2 durch Reduktion mit Magnesium (metallo-thermisches Verfahren) RG: Verwendung: Moderator (Neutronenbremse) im Kernreaktorenbau, Fenster für Röntgenstrahlen, Kontaktfedern (hohe elektrische Leitfähigkeit), Berylliumoxid BeO für feuerfeste Steine ch_aoc.doc/14.05.16/Seite 112 MAGNESIUM Mg Vorkommen: Magnesit, Talkspat, Bitterspat MgCO3 Dolomit, Braunspat, Bitterspat CaCO3. MgCO3 Magnesiumsilikat (Asbest, Talk, Serpentin usw.) Zentralatom im Chlorophyll Herstellung: 1. Umsetzung von Magnesiumoxid MgO mit Koks im elektrischen Ofen, wobei das Magnesium abdestilliert und mit Wasserstoff (Explosionsgefahr!) gekühlt wird. Dieses Verfahren ist billiger als das nächste. RG: 2. Schmelzflußelektrolyse von künstlich hergestellten Magnesiumchlorid MgCl 2, Das in wasserfreien Zustand mit Calciumfluorid CaF2 oder Kaliumchlorid KCl als Flußmittel elektrolysiert wird. Das bei der Elektrolyse anfallende Chlor wird wieder zum Magnesiumaufschluß verwendet. RG: Eigenschaften: Silberweißes, weiches Leichtmetall, gegen Laugen beständig (Unterschied zu Aluminium), in Säuren leicht löslich. An der Luft verbrennt es mit heller Flamme zu Magnesiumoxid. RG: Es kann weder mit Wasser noch mit Kohlensäurelöschern gelöscht werden, da es den beiden Verbindungen den Sauerstoff entzieht. RG: Verwendung: Magnesiumpulver ist ein starkes Reduktionsmittel (metallothermische Verfahren), Blitzlichtpulver Legierungen, besonders mit Aluminium (z.B. Elektronmetall, Dowmetall, Magnalium, Hydronalium, Duraluminium) Synthesen in der organischen Chemie (Grignard`sche Substanzen) Verbindungen: Magnesiumoxid MgO: Herstellung: Durch Brennen von Magnesit oder Dolomit RG: Verwendung: Für Mörtelbindestoffe (Dolomitkalk), Sintermagnesia für feuerfeste Ofenauskleidungen (Magnesiastäbchen), Steinholzböden, Heraklithplatten ch_aoc.doc/14.05.16/Seite 113 Magnesiumcarbonat MgCO3: Verwendung: Für Zahnpulver, Füllstoff für Papier, Farben und Kautschuk Magnesiumsulfat, Bittersalz MgSO4.7H2O: Verwendung: Als Abführmittel, Entflammschutz für Holz und Gewebe ch_aoc.doc/14.05.16/Seite 114 CALCIUM Ca Vorkommen: Kalk CaCO3 Dolomit CaCO3. MgCO3 Gips CaSO4.2H2O Anhydrit CaSO4 Flußspat CaF2 Phosphorit Ca3(PO4)2 Herstellung: Durch Schmelzflußelektrolyse von Calciumchlorid CaCl2 (Flußmittel sind Calciumfluorid CaF2 oder Kaliumchlorid KCl) Eigenschaften: Silberweißes, an der Luft rasch anlaufendes Metall, chemisch nicht beständig, kräftiges Reduktionsmittel Verbindungen: Calciumcarbonat CaCO3: Verwendung: ch_aoc.doc/14.05.16/Seite 115 Calciumoxid, gebrannter Kalk CaO: Herstellung: Durch Brennen von Kalk in Ringöfen oder Drehrohröfen. RG: Verwendung: Zur Herstellung von Mörteln, Carbidherstellung, Ofenfutter, basischer Zuschlag bei der MetallHerstellung, Glasindustrie. Calciumhydroxid, gelöschter Kalk, Kalkmilch Ca(OH)2: Herstellung: Durch Behandeln von gebrannten Kalk mit Wasser unter Wärmeentwicklung RG: Verwendung: Zur Herstellung von Mörteln, billigste Base, zum Austreiben von Ammoniak (SolvaySoda-Verfahren), zur Bindung von Chlor (Chlorkalk), als Ätzmittel in der Gerberei. Calciumfluorid CaF2: Verwendung: Ausgangsprodukt für die Fluor- und Fluorwasserstoffherstellung, Trübungsmittel in der Emailindustrie, Flußmittel für Schmelzflußelektrolysen, Prismen für Spektrometer. Calciumchlorid CaCl2: Verwendung: Trocknungsmittel für Gase und organische Lösungsmittel, Abfallprodukt beim SolvaySoda-Verfahren ch_aoc.doc/14.05.16/Seite 116 Calciumsulfat, Gips CaSO4.2H2O: Vorkommen: Gips CaSO4.2H2O Anhydrit CaSO4 Verwendung: Dünger, Baustoffe und Mörtel. Beim Gips-Brennen entstehen folgende Gipsarten (nach steigender Temperatur): Stuck, Modell- oder Bildhauergips, Putzgips, Estrichgips, Marmorgips ch_aoc.doc/14.05.16/Seite 117 MÖRTELBINDESTOFFE Mörtel sind Baustoffe, die mit Wasser angerührt leicht formbar sind, nach einiger Zeit aber steinartig erhärten. Diese Mörtel setzen sich aus dem Bindemittel, dem Magerungsmittel (Sand, Schotter) und Wasser zusammen. Nach der Art der Verfestigung unterscheidet man Lufttrocknung (Lehme) Verfestigung an der Luft durch Wasseraufnahme (Gips) Verfestigung an der Luft durch Aufnahme von CO 2 (Kalk, Magnesiabindemittel) Verfestigung unter Wasseraufnahme (Zement) Je nach den Bedingungen, unter denen die Erhärtung erfolgt, kann zwischen Luft(werden von Wasser angegriffen) und Wassermörteln (sind wasserfest) unterschieden werden. Luftmörtel: Durch Brennen von Kalk und nachfolgendem Löschen erhält man gelöschten Kalk RG: Kalkmörtel, der bekannteste Luftmörtel, besteht aus einem Brei von gelöschten Kalk und Sand. Die Erhärtung des Breis erfolgt dadurch, daß zunächst das überschüssige Wasser verdunstet und dann das Calciumhydroxid allmählich unter Aufnahme von CO 2 aus der Luft in Calciumcarbonat übergeht. RG: Wassermörtel: Im Gegensatz zum Luftmörtel braucht der Wassermörtel zum Aushärten Wasser. Das wichtigste Bindemittel von Wassermörtel ist der Zement. Er wird normalerweise durch Brennen von Kalkstein (Calciumcarbonat), Ton-Flugasche (Aluminiumsilikat) und Sand (Siliciumdioxid) hergestellt. Das Erstarren beruht hauptsächlich auf der Bildung von unlöslichen Silikaten und Aluminaten durch Wasseraufnahme. ch_aoc.doc/14.05.16/Seite 118 ZEMENT-HERSTELLUNG Verfahrensprinzip: Ausgangsprodukte sind Kalk Ton-Flugasche Sand Beim Brennen spielen sich folgende Vorgänge ab: Aus Kalkstein entsteht Calciumoxid (siehe Kalkbrennen) Ton gibt bis 500°C Wasser (auch chemisch gebundenes) ab und reagiert dann wie eine Mischung von Anhydriden (SiO2+ Al2O3+Fe2O3) Ein Teil des CaO verbindet sich mit Al2O3 zu CaO.Al2O3 (Calciumaluminat) Ein Teil des CaO verbindet sich mit SiO2 zu 2CaO.SiO2 (Calciumsilikat) Aus Calciumaluminat entsteht mit weiterem CaO dann 3CaO.Al 2O3 (Tricalciumaluminat) Aus Calciumsilikat entsteht mit weitem CaO dann 3CaO,SiO2 (Tricalciumsilikat) Die gebildeten Tricalciumverbindungen sintern bei 1400-1500°C Zement besteht also hauptsächlich aus verschiedenen Tricalciumverbindungen. Arbeitsweise: Die Rohstoffe Kalkstein (B1) und Ton-Flugasche (B2) werden in Mühlen (Z1) gemahlen und in verschiedenen Bunkern (B3) gespeichert. Entsprechende Mengen dieser Ausgangsstoffe werden in einer Mischtrommel (R1) homogenisiert und über einen Pufferspeicher (B4) dem Drehrohrofen (C1) aufgegeben. Der Drehrohrofen kann mit Kohlenstaub oder Öl beheizt werden. Das Ofenmehl wird dem höhern Ende des Drehrohrofens bei ca. 400-500°C zugeführt, wobei die endotherme Entwässerung des Tons stattfindet. Das Ofenmehl wird mittels langsamer Drehung durch den Drehrohrofen befördert. Die Temperatur steigt dabei kontinuierlich bis 1400-1500°C an. Bei 900°C geschieht die Entsäuerung des Kalks, bei 1000-1200°C findet die eigentliche chemische Reaktion unter Wärmeentwicklung statt, bis bei ca. 1300°C eine teilweise Sinterung eintritt und die Reaktion nun rasch zu Ende geht. Die Sinterung ist bei 1400-1500°C abgeschlossen, der Zementklinker verläßt nun den Drehrohrofen und wird einige Zeit gelagert. Der Klinker, der in steinharten Granalien anfällt, wird mit Zuschlägen wie Gips (B5) und Hochofenschlacke (B6) versehen und in Mühlen (Z2) bis zu einer Korngröße von 0,001 mm vermahlen. Die Lagerung des fertigen Zements erfolgt dann in Silos bezw. In Papiersäcken. Beantworte folgende Fragen: 1. Welche Ausgangsstoffe werden zur Zementherstellung benötigt? 2. Welche Reaktionen erfolgen zwischen den Ausgangsstoffen? 3. Welche Zuschlagstoffe werden dem Zementklinker zugesetzt? 4. Beschreibe das Verfahren zur Zementherstellung anhand des Fließbilds! ch_aoc.doc/14.05.16/Seite 119 Fließbild Zement-Herstellung Xxx ch_aoc.doc/14.05.16/Seite 120 ZEMENT-HERSTELLUNG (Müller-Kühne-Verfahren) Verfahrensprinzip: Anstelle der bereits angeführten Rohstoffe werden beim Müller-Kühne-Verfahren folgende Rohstoffe eingesetzt: Anhydrit oder Gips (enthält Calcium) Flugasche (enthält Aluminium) Sand (enthält Silicium) Koks (dient als Reduktionsmittel) Bei der hohen Temperatur des Drehrohrofens (ca. 1400°C) wird zuerst Calciumsulfat durch Koks zu Calciumoxid reduziert: RG: Dieses reagiert dann mit den übrigen Ausgangsstoffen unter Bildung von Calciumsilkaten und Calciumaluminaten. Der so gebildete Zementklinker wird anschließend zur Endfertigung des Zements mit Zusätzen (Gips, Hochschlacke) fein vermahlen. Die im Drehrohrofen anfallenden Röstgase enthalten Schwefeldioxid, das nach dem Kontakt-(Krebs)-Verfahren zu Schwefelsäure verarbeitet werden kann. Arbeitsweise: Die Ausgangsstoffe Gips (Anhydrit), Flugasche, Sand und Koks werden in Mühlen (1= Löschemühle, 2= Kugelmühle) gemahlen und in verschiedenen Bunkern (3) gespeichert. Entsprechende Mengen dieser Ausgangsstoffe werden dann in einer Mischtrommel (4) homogenisiert und dem Drehrohrofen (6) aufgegeben. Ein Ofenmehlsilo (5) dient als Pufferbehälter zwischen Mischtrommel und Drehrohrofen. Das Ofenmehl wird dem höher liegenden Teil des Drehrohrofens bei ca. 400-500°C zugeführt und mittels langsamer Drehung durch den Drehrohrofen bewegt. Die Temperatur steigt dabei kontinuierlich bis ca. 1400°C an. Diese Temperatur wird dadurch erreicht, daß am tiefer liegenden Ende des Drehrohrofens Öl im Luftstrom verbrannt wird. Bei ca. 1000-1200°C findet die eigentliche Reaktion unter Wärmeentwicklung statt. Bei ca. 1300°C tritt dann teilweise Sinterung ein, wobei die Reaktion schnell zu Ende geht. Der so gebildete Zementklinker wird aus dem Drehrohrofen entfernt und einige Zeit gelagert. Der Klinker, der in steinharten Granalien anfällt, wird mit Zusätzen von Gips und Hochofenschlacke versehen und in einer Kugelmühle (7) bis zu einer Korngröße von 0,001 mm vermahlen. Die Lagerung des fertigen Zements erfolgt in Silos oder in Papiersäcken. Beantworte folgende Fragen: 1. Welche Ausgangsstoffe werden zur Zementherstellung nach dem Müller-KühneVerfahren eingesetzt? 2. Welche Reaktion erfolgt dabei zwischen Gips und Koks? 3. Wie ist der Zementklinker zusammengesetzt? 4. Welche Zuschlagstoffe werden dem Zementklinker zugesetzt? 5. Beschreibe das Verfahren anhand des Fließbilds! ch_aoc.doc/14.05.16/Seite 121 Fließbild Zement-Herstellung (Müller-Kühne-Verfahren) xxx ch_aoc.doc/14.05.16/Seite 122 CALCIUMCARBID- UND ETHIN-(ACETYLEN-)ERZEUGUNG Verfahrensprinzip: Herstellung von Calciumcarbid CaC2: Gebrannter Kalk und Koks werden in stückige Form gebracht und bei 2000-2500°C zu Calciumcarbid umgesetzt: RG: Der Umsatz findet in geschlossenen Öfen statt, denen über Kohleelektroden (Söderbergelektroden) Strom zugeführt wird. Die Einsatzstoffe wirken dem Strom gegenüber als Widerstand, wodurch die Umwandlung von elektrischer Energie in Wärmeenergie erfolgt. Die Reaktionstemperatur ist dabei so hoch, daß sowohl Ausgangsstoffe als auch das Reaktionsprodukt in geschmolzenen Zustand vorliegen. Als Nebenprodukt entweicht Kohlenmonoxid, das als Heizgas dienen kann. Das Calciumcarbid wird aus dem Ofen flüssig abgezogen und dann abgekühlt. Herstellung von Ethin (Acetylen) C2H2: Zur Ethinentwicklung wird zerkleinertes Calciumcarbid mit Wasser umgesetzt: RG: Die Reaktion verläuft stark exotherm, so daß für eine Abfuhr der freiwerdenden Reaktionswärme gesorgt werden muß. Dies kann auf verschiedene Weise erfolgen: Naßvergasung: Calciumcarbid wird mit großem Wasserüberschuß umgesetzt, wobei die Wärmeabfuhr durch Erhöhung der Wassertemperatur erfolgt. Das als Nebenprodukt gebildete Caciumhydroxid fällt in Form von Kalkschlamm an. Dieses Verfahren wird heute eher selten verwendet. Trockenvergasung: Dem Carbid wird nur soviel Wasser zugesetzt, als für die Reaktion nötig ist und zur Abführung der Reaktionswärme verdampft werden kann. Das Calciumhydroxid fällt dabei als fast trockenes Pulver an. Arbeitsweise: Carbid-Herstellung: Im Rohstoffaufarbeitungsbetrieb werden die Ausgangsmaterialien gebrannter Kalk und Koks in Brechern (1, 2) und in Siebanlagen (3, 4) auf die geeignete Körnung (Koks 6-25 mm, Kalk 6-50 mm) gebracht. Über Fördereinrichtungen (5, 6) wird der Möller im Mischbunker (7) bereitgestellt. Der Carbidofen (8) besteht aus geschweißtem Ofenblech mit feuerfester Auskleidung. Die drei Söderberg-Elektroden sind beim runden Carbidofen symmetrisch in den Ecken eines gleichseitigen Dreiecks angeordnet, um eine möglichst gleichmäßige Schmelze zu erreichen. ch_aoc.doc/14.05.16/Seite 123 Für den Ofenbetrieb ist es wichtig, daß eine möglichst gleichmäßige Beschickung erfolgt. Bei Temperaturen um 2000°C erfolgt die Umsetzung in Calciumcarbid. Die Carbidschmelze wird in bestimmten Zeitabständen abgezogen (das Abstichloch wird durch Aufbrennen mittels Lichtbogen geöffnet) und läuft zum Abkühlen in gußeiserne Tiegel (9). Das Abstichloch wird durch Hineinwerfen von ”Stopf”-Carbid wieder geschlossen. Die weitere Aufarbeitung wird begonnen, wenn die Durchschnittstemperatur des Carbidblöcke ca. 400°C beträgt, da unterhalb von 300°C Carbid mit dem Wasserdampf der Luft reagiert. Ethinerzeugung (Trockenvergasung): Die Carbidblöcke werden in Brechern (11) gebrochen. Feingemahlen wird das Carbid in Mühlen (12) unter Stickstoffatmosphäre, so daß der Verlust nur 1-2% vom Abstich bis zum Ende der Aufarbeitung beträgt. Das Carbid der Körnung 0/3 wird mit einer Transportschnecke (13) auf den obersten Teller des Vergasers (14) geführt. Über Sprühdüsen wird Entwicklerwasser zugeführt und die Ethinbildung beginnt. Während der Vergasung wird das Reaktionsgemisch (Carbid, Kalkhydrat und Wasser) mit Rührschaufeln gemischt und auf den nächst tieferen Teller befördert. Auf dem zehnten Teller ist alles Carbid vergast. Das gebildete Kalkhydrat fällt in die Kalkschleuse (15) und wird mit einer Förderschnecke (16) ausgetragen. Das erzeugte Gas (25% Ethin, 75% Wasserdampf) verläßt den Vergaser und gelangt in den Waschturm (17), wo es mit Wasser besprüht wird, um mitgerissenen Kalkstaub auszuwaschen und einen Teil des Wasserdampfes zu kondensieren. Ein Teil des im Kreislauf geführten Waschwassers wird ausgeschleust und dient im Vergaser als Entwicklerwasser. Im zweiten Waschturm (18) wird das Gas mit Frischwasser berieselt. Hierbei wird der restliche Wasserdampf kondensiert und das Gas auf ca. 20°C abgekühlt. Das erzeugte Ethin verläßt über die Tauchung (19) den Entwickler. Beantworte folgende Fragen: 1. 2. 3. 4. Aus welchen Rohstoffen wird Calciumcarbid hergestellt? Auf welche Weise wird die hohe Reaktionstemperatur erreicht? Bilde die Reaktionsgleichung zur Ethinerzeugung aus Calciumcarbid! Nach welchen Gesichtspunkten wird bei der Trockenvergasung die Reaktionswassermenge bemessen? 5. Beschreibe die Calciumcarbid- und Ethinerzeugung anhand des Fließbilds! ch_aoc.doc/14.05.16/Seite 124 Fließbild Calciumcarbid/Ethin-herstellung xxx ch_aoc.doc/14.05.16/Seite 125 STRONTIUM Sr Vorkommen: Strontianit SrCO3 Cölestin SrSO4 Allgemeines: 90Sr entsteht als Abfallprodukt bei der Kernspaltung und kann statt Ca in die Knochen eingelagert werden, wodurch es zu Störungen bei der Blutbildung kommt. Verwendung: Feuerwerkerei (rote Flammenfärbung), in der Zuckerfabrikation zum Auslaugen von Zucker aus der Melasse BARIUM Ba Vorkommen: Schwerspat, Baryt BaSO4 Witherit BaCO3 Verbindungen: Bariumsulfat BaSO4: Es wird verwendet als Kontrastmittel in der Röntgenologie (muß bariumchloridfrei sein, da lösliche Bariumverbindungen giftig sind), Schwerbeton-Herstellung (Strahlenschutzwand), Füllmittel für Kunststoffe, Papier- und Gummierzeugung, Pigment (Permanentweiß) RADIUM Ra Vorkommen: in der Uranpechblende U3O8 als Spaltprodukt des Uran Verwendung: früher zur Bestrahlung ch_aoc.doc/14.05.16/Seite 126 Beantworte folgende Fragen: 01. Nenne die Elemente der 2. Hauptgruppe mit chem. Zeichen! 02. Wie verhält sich die Löslichkeit der Carbonate und Sulfate mit steigender OZ? 03. Nenne das wichtigste Vorkommen von Beryllium mit chem. Formel! 04. Herstellung (RG) und Verwendung von Beryllium 05. Nenne drei Vorkommen von Magnesium mit chem. Formel! 06. Zwei Möglichkeiten zur Herstellung (RG) und Verwendung von Magnesium! 07. Was ist Brennen (+RG und 2 Beispiele)? 08. Herstellung von Magnesiumoxid (RG) 09. Nenne 4 Vorkommen von Calcium mit chem Formel! 10. Wie kann gebrannter und gelöschter Kalk hergestellt werden (+RG)? 11. Verwendung von Calciumhydroxid und Calciumfluorid 12. Was sind Mörtelbindestoffe? 13. Wie werden sie eingeteilt? 14. Wie können Mörtel verfestigen (mit je einem Beispiel)? 15. Je ein Vorkommen von Strontium, Barium und Radium mit chem. Formel 16. Verwendung von Strontium und Bariumsulfat ch_aoc.doc/14.05.16/Seite 127 1. Gruppe oder 1. Hauptgruppe Ia (alt) - ALKALIMETALLE Name OZ Atommasse Li Na K Rb Cs Fr 3 11 19 37 55 87 6,941 22,99 39,102 85,47 132,9055 223 Reaktionsfähigkeit allgem. Eigenschaften LITHIUM Li Vorkommen: Als Begleitelement in Phosphaten und Silikaten, Tabakasche Herstellung: Durch Schmelzflußelektrolyse von Lithiumchlorid LiCl bei 350-400°C Eigenschaften: Dem Natrium ähnlich, nur geringere Reaktionsfähigkeit, das leichteste aller festen Elemente. Verwendung: Als Hochtemperaturkühlmittel, das organischen Chemie 6Li als Neutronenfänger, für Synthesen in der ch_aoc.doc/14.05.16/Seite 128 NATRIUM Na Vorkommen: Steinsalz (siehe auch Chlor) NaCl Chilesalpeter NaNO3 Natronfeldspat Na(AlSi3O8) Herstellung: Durch Schmelzflußelektrolyse von Natriumchlorid oder Natriumhydroxid Eigenschaften: Silberweißes, weiches, sehr reaktionsfähiges Metall. Darf nur unter Petroleum aufbewahrt werden. Verwendung: Zur Herstellung von Natriumperoxid, Natriumamid (Indigosynthese), Natriumcyanid (GoldHerstellung), für organische Synthesen, Natriumdampflampen, kräftiges Reduktionsmittel Verbindungen: Natriumchlorid NaCl Vorkommen: In der Natur als Steinsalz, gelöst im Meerwasser. Aus beiden Vorkommen wird es gewonnen. Verwendung: Ausgangsprodukt für die Herstellung fast aller Natriumverbindungen, außerdem für Salzsäure und Chlor. Es wird für Speise- und Konservierungszwecke verwendet, zum Aussalzen organischer Verbindungen und gemischt mit Eis als Kältemischung (bis -21°C) Natriumhydroxid NaOH Herstellung: 1. Durch Kaustifizierung von Soda (Umsetzung von Soda mit Kalkmilch) RG: 2. Durch Chloralkalielektrolyse mit dem Diaphragma-, Amalgam- oder Membranverfahren (siehe Chlor-Herstellung): Eigenschaften: Weiß, stark hygroskopisch (wasseranziehend), stark ätzend Verwendung: In der Seifenindustrie, Farbstoffherstellung, Herstellung von Zellulose aus Holz oder Stroh, Herstellung von Kunstseide usw. Natriumsulfat (Glaubersalz) Na2SO4: ch_aoc.doc/14.05.16/Seite 129 Vorkommen: In großen Lagern (Kanada, Nevada), gelöst in Seen und als Begleitverbindung in Salzsolen. Herstellung: Aus Natriumchlorid durch Umsetzung mit Schwefelsäure RG: Natriumnitrat (Chilesalpeter) NaNO3: Kommt in der Natur vor und wird aus diesen Vorkommen gewonnen. Der Chilesalpeter hat als Düngemittel nur mehr geringe Bedeutung. Natriumcarbonat (Soda) Na2CO3: Vorkommen: In Sodaseen (Kalifornien, Ostafrika) Herstellung: Nach dem Ammoniak-Soda-Verfahren (Solvay-Verfahren): RG: Eigenschaften: Weißes, stark alkalisches Pulver Verwendung: In der Seifen-, Waschmittel- und Glasindustrie Natriumhydrogencarbonat NaHCO3: Herstellung: Durch Einleiten von Kohlendioxid in wäßrige Natriumcarbonatlösung RG: Verwendung: Backpulver, Brausepulver und zur Abstumpfung der Magensäure ch_aoc.doc/14.05.16/Seite 130 NATRONLAUGE-HERSTELLUNG (Diaphragmaverfahren) Zur Erzeugung der technisch wichtigen Natronlauge wird neben der Kaustifizierung von Soda vorwiegend die elektrolytische Zerlegung einer wäßrigen Natriumchloridlösung herangezogen. Für die Durchführung sind zwei Verfahren von Bedeutung: Diaphragmaverfahren Quecksilber-(Amalgam-)verfahren. Das Diaphragmaverfahren wird nachstehend beschrieben. Verfahrensprinzip: Eine von den Härtebildner des Wassers befreiten Natriumchloridlösung (ca. 300g/l) wird in einer Elektrolysezelle mit ca. 5V Gleichspannung zerlegt, wobei sich folgende Vorgänge abspielen: RG: Kathode (-) Anode (+) primär: sekundär: Um eine Reaktion der so gebildeten Natronlauge mit Chlor zu verhindern, sind Kathodenund Anodenraum durch ein horizontal angeordnetes Diaphragma (poröse, stromdurchlässige Scheidewand) voneinander getrennt. Eine vollständige Zerlegung des Natriumchlorids ist dabei nicht möglich, da bei einer zu starken Abnahme der Chloridionenkonzentration eine Entladung der Hydroxidionen eintreten würde. In der Praxis läßt man daher die Elektrolyse nur zur Hälfte ablaufen. Es entsteht eine ca. 12%Ige Natronlauge, die zusätzlich Natriumchlorid (ca.140g/l) gelöst enthält. Die so erhaltene Natronlauge wird in Mehrkörperverdampfern auf ca. 50% aufkonzentriert. Beim Ansteigen der Laugenkonzentration sinkt das Lösevermögen für Natriumchlorid, das sich bis auf einen Rest von ca.1% als kristalliner Niederschlag abscheidet. Nach Abtrennung und Rückführung des Natriumchlorids in den Prozeß steht die Natronlauge als 50%ige Lösung oder - nach weiteren Eindampfen - als festes Natriumhydroxid zur Verfügung. ch_aoc.doc/14.05.16/Seite 131 Arbeitsweise: 1. Elektrolyse: Aus Wasser und Natriumchlorid wird in einem Lösebehälter (1) eine gesättigte Lösung hergestellt. Durch Zugabe von Fällungsreagenzien erfolgt eine Fällung der Härtebildner des Wassers, die in einer nachgeschalteten Filtereinrichtung (2) abgetrennt werden. Die gereinigte Solelösung fließt nun kontinuierlich in den Anodenraum einer Elektrolysezelle (3), wo die Chloridionen an Graphitelektroden entladen werden und als Chlorgas aufsteigen. Der Elektrolyt tritt dann langsam durch das Diaphragma (Asbest mit Bariumsulfat beschichtet) in den Kathodenraum. Nach der Entladung der Natriumionen an den Eisenkathoden (Gitter) erfolgt sekundär die Reaktion mit dem Wasser unter Bildung von Natronlauge und Wasserstoff. Die Elektrolyseprodukte Natronlauge, Chlor und Wasserstoff werden laufend aus der Zelle abgeleitet. 2. Laugenaufbereitung: Die Natronlauge des Diaphragmaverfahrens ist wenig konzentriert (12%ig) und enthält noch viel Natriumchlorid. In einer Mehrkörperverdampferanlage (4) wird die Lauge bis ca. 50% aufkonzentriert, wobei das Natriumchlorid zum größten Teil ausfällt. Nach Abfiltration (5) des Natriumchlorids gelangt dieses über den Lösebehälter (1) in den Prozeß zurück. Die anfallende 50%ige Natronlauge geht entweder als solche in den Verkauf oder wird in einem Schmelzkessel zu festem Natriumhydroxid eingedampft. Beantworte folgende Fragen: 1. Welche Verbindung wird bei der Elektrolyse zur Herstellung von Natronlauge eingesetzt? 2. Welches Elektrolyseprodukt entsteht dabei an der Anode? 3. Welche Elektrolyseprodukte entstehen dabei an der Kathode? 4. Warum kann die Elektrolyse nicht bis zur vollständigen Zerlegung des Ausgangsprodukts fortgeführt werden? 5. Beschreibe das Diaphragmaverfahren zur Natronlauge-Herstellung anhand des Fließbilds! ch_aoc.doc/14.05.16/Seite 132 Fließbild Natronlauge-Herstellung (Diaphragma-Verfahren) xxx ch_aoc.doc/14.05.16/Seite 133 NATRONLAUGE-HERSTELLUNG (Amalgamverfahren) Verfahrensprinzip: Wäßrige Natriumchloridlösung (Sole) wird in einer Elektrolysezelle durch Gleichstrom in Natrium und Chlor zerlegt. Das Chlor scheidet sich an der Anode ab und wird als Gas abgesaugt. Das Natrium wird an der Kathode abgeschieden und bildet dort mit dem fließenden Quecksilber Natriumamalgam. Dieses verläßt die Zelle und gelangt in die Zersetzerzelle, wo unter Zugabe von Wasser in Anwesenheit eines Katalysators das Amalgam in Natronlauge, Wasserstoff und Quecksilber zerlegt wird. Das Quecksilber wird - theoretisch verlustlos - in die Elektrolysenzelle zurückgeführt. Nicht umgesetzte Sole wird mit Festsalz wieder auf die Ausgangskonzentration gebracht, mit Fällreagentien von Fremdionen befreit und erneut der Elektrolyse zugeführt. Das gasförmige Chlor wird nach Kühlung, Reinigung und Trocknung in einer Kälteanlage verflüssigt und so gelagert. Es dient hauptsächlich als Rohstoff für die Herstellung von Salzsäure, organischen Chlorverbindungen (PVC), sowie zum Bleichen und Desinfizieren. Der gasförmige Wasserstoff dient zur Herstellung von Salzsäure, als umweltfreundlicher Brennstoff und als Rohstoff bei diversen modernen technologischen Verfahren (Halbleitertechnik). Beschreibung des Verfahrens: Die aus der Elektrolyse kommende nicht umgesetzte Sole mit ca. 23% NaCl gelangt in das Puffergefäß (B6). Über die Pumpe (P1) wird sie in den Rührbehälter (B1) eingebracht, wo sie durch Zusatz von Festsalz auf ca. 26 % NaCl aufkonzentriert wird. Mittels spezieller Fällreagenzien (NaOH; Na2CO3, BaCl2, siehe Wasserenthärtung mittels Fällverfahren) werden Fremdionen ausgefällt und im Dekantationsgefäß (B2) und anschließenden Filter (F1) entfernt. Über den Kühler (W1) gelangt die Sole in die Elektrolysenzelle(n). Das gebildete Natriumamalgam fließt in die Zersetzungzelle(n), wo durch Zugabe von Wasser (in Anwesenheit von Katalysatoren) das Amalgam in Natronlauge (ca. 50%Ig) und gasförmigen Wasserstoff zerlegt wird. Die Lauge fließt über das Filter (F2) in die Lagertanks, der Wasserstoff wird vom Verdichter (V1) durch den Kühler (W2) gesaugt und in den Glocken-Gasbehälter (B4) gesaugt. Das rückgebildete Quecksilber wird von der Pumpe (P4) in die Elektrolysezelle(n) gefördert, womit der Kreislauf desselben geschlossen ist. Beantworte folgende Fragen: 1. Welche Konzentration hat die Sole vor bzw. nach der Elektrolysenzelle? 2. Welche Konzentration hat die erzeugte Natronlauge? 3. Welches Nebenprodukt entsteht bei der Elektrolyse der Sole? 4. Welches Nebenprodukt entsteht bei der Zersetzung des Amalgams? ch_aoc.doc/14.05.16/Seite 134 Fließbild NATRONLAUGE-HERSTELLUNG (Amalgamverfahren) xxx ch_aoc.doc/14.05.16/Seite 135 SODA-HERSTELLUNG (Solvay-Verfahren, Ammoniak-Soda-Verfahren) Soda wird heute ausschließlich nach dem wirtschaftlichen Solvay-Verfahren (AmmoniakSoda-Verfahren) hergestellt. Das klassische Leblanc-Verfahren besitzt keine Bedeutung mehr. Verfahrensprinzip: Durch Einleiten von gasförmigem Ammoniak und Kohlendioxid in eine gesättigte Natriumchloridlösung entsteht schwerer lösliches Natriumhydrogencarbonat neben leichtlöslichem Ammonchlorid: RG: Das ungelöste Natriumhydrogencarbonat wird durch Filtration von der Lösung abgetrennt und durch Erhitzen (Calcinieren) in Soda übergeführt: RG: Der zusätzliche Bedarf an Kohlendioxid wird durch Brennen von Kalkstein abgedeckt: RG: Das verbleibende Calciumoxid wird durch Löschen mit Wasser in Calciumhydroxid umgesetzt: RG: Dieses wird zur Rückgewinnung von Ammoniak aus dem als Nebenprodukt anfallenden Ammonchlorid eingesetzt: RG: Die große Wirtschaftlichkeit des Solvay-Verfahrens äußert sich in der Wiederverwertung der anfallenden Nebenprodukte, von denen nur Calciumchlorid für den Prozeß ungenutzt bleibt. Arbeitsweise: 1. Hauptprozeß: In einem Lösebehälter (B1) wird aus Natriumchlorid und Wasser eine kaltgesättigte Lösung hergestellt. Das zur Lösung benötigte Wasser muß frei von Härtebildnern sein, da diese im späteren Produktionsprozeß als unlösliche Carbonate ausfallen würden. Diese Salzlösung wird in einer Filterpresse (F2) von festen Verunreinigungen befreit und gelangt anschließend in den Ammoniakabsorber (C1). Dem mit Einbauten oder Füllkörpern versehenen Absorber strömen kontinuierlich gesättigte Sole und Ammoniakgas zu. Die entstehende Absorptionswärme wird über den Wärmetauscher (W2) abgeführt. Die nunmehr ammoniakalische Sole wird von oben in den Fällturm (C2) gedrückt, dem man gleichzeitig von unten her Kohlendioxid zuführt. Im Fällturm kommt es zur Bildung von schwer löslichem Natriumhydrogencarbonat und von gelöstem Ammonchlorid: RG: ch_aoc.doc/14.05.16/Seite 136 Der am Turmboden austretende Kristallbrei wird mittels Drehfilter (F3) in Feststoff und Flüssigkeit getrennt. Das abfiltrierte Natriumhydrogencarbonat gelangt dann in einen Drehrohrofen, in dem bei einer Temperatur von 180°C die Calcinierung zu wasserfreier Soda erfolgt. RG 2. Kohlendioxidkreislauf: Das zur Sodaherstellung benötigte Kohlendioxid gewinnt man durch Brennen von Kalkstein im Schachtofen bei ca. 1000°C. RG: Im Gaswäscher (F1) wird das Gas vom mitgeführten Staub befreit und gemeinsam mit dem beim Calcinieren zurückgewonnen Kohlendioxid durch den Verdichter (V1) in den Fällturm gedrückt. Das beim Kalkbrennen anfallende Calciumoxid wird in einem Lösebehälter (B2) mit Wasser zu Calciumhydroxid umgesetzt und dient zur Rückgewinnung von Ammoniak aus Ammoniumchlorid. RG: 3. Ammoniakkreislauf: Die aus dem Drehfilter (F3) ablaufende Ammoniumchloridlösung wird zunächst in einem Lagerbehälter (B3) gesammelt und gelangt von dort in den Zersetzer (C3). In dem mit Dampf beheizten Zersetzer wird durch gleichzeitige Zugabe von Calciumhydroxid aus dem Lösegefäß (B2) Ammoniakgas in Freiheit gesetzt. RG: Das entweichende Ammoniakgas wird über den Wärmetauscher (W3), in dem die Ammoniumchloridlösung vorgewärmt wird, in den Absorber (C1) und somit in den Kreislauf zurück, während eine Calciumchloridlösung in einen Lagertank abfließt. Beantworte folgende Fragen: 1. Welche Reaktionsgleichung liegt der Bildung von Natriumhydrogencarbonat nach dem Solvay-Verfahren zugrunde? 2. Auf welche Weise wird Natriumhydrogencarbonat in Soda übergeführt? 3. Woher stammt das zum Solvays-Prozeß benötige Kohlendioxid (+RG)? 4. Beschreibe den Ammoniakkreislauf (+RG)! 5. Beschreibe das Verfahren zur Sodaherstellung mit allen Nebenprozeßen anhand des Fließbilds! ch_aoc.doc/14.05.16/Seite 137 Fließbild SODA-HERSTELLUNG (Solvay-Verfahren, Ammoniak-Soda-Verfahren) xxx ch_aoc.doc/14.05.16/Seite 138 KALIUM K Vorkommen: Carnallit Mg(Cl,Br)2.K(Cl,Br).6H2O Sylvin KCl Kalifeldspat K(AlSi3O8) Herstellung: Durch Schmelzflußelektrolyse von KCl oder KOH (analog Na) Eigenschaften: Wie Natrium, nur wesentlich reaktionsfähiger, an der Luft selbstentzündlich, verbrennt zu K2O2 (Unterschied zu Na). K+ hat einen ähnlichen Ionenradius wie NH4+, gibt daher Verbindungen mit ähnlichen physikalischen und chemischen Eigenschaften. Verwendung: Alkalifotozellen, flüssige Kalium-Natrium-Legierungen, Reduktionsmittel Verbindungen: Kaliumchlorid KCl Herstellung: Aus Carnallit, der durch Flotation angereichert wird. Verwendung: Es ist das Ausgangsprodukt für fast alle Kaliumverbindungen Kaliumhydroxid, Ätzkali KOH Herstellung: Durch Elektrolyse von Kaliumchloridlösung (wie Na). Verwendung: Schmierseifenindustrie, Farbenherstellung, Kohlenmonoxid und Kohlendioxid Trocknungsmittel, Kaliumcarbonat, Pottasche (Pflanzenasche) K2CO3 Herstellung: 1. Durch Carbonisierung von Kalilauge RG: 2. Nach dem Formiat-Pottasche-Verfahren: RG: Verwendung: Schmierseifenerzeugung, Herstellung von KOH, Glaserzeugung Kaliumchlorat KClO3 Absorptionsmittel für ch_aoc.doc/14.05.16/Seite 139 Verwendung: Totalherbizid, Sprengstoffindustrie, Zündholzherstellung Kaliumnitrat KNO3 Verwendung: Feuerwerkerei, Konservierungsmittel für Fleisch, Schießpulver, für oxidative Aufschlüsse, Düngemittelzusatz Kaliumcyanid KCN Verwendung: In der Galvanik, Gold-Herstellung. ch_aoc.doc/14.05.16/Seite 140 RUBIDIUM Rb, CAESIUM Cs, FRANCIUM Fr Rubidium und Caesium kommen als Begleitelemente bei Natrium- und KaliumVorkommen vor. Das Francium ist ein radioaktives Zerfallsprodukt der Actiniumreihe. Die Schwingung des 133Cs wird für die Definition von 1 Sekunde (1s) verwendet. Beantworte folgende Fragen: 01. 02. 03. 03. 04. 05. 06. 07. 08. 09. 10. 11. 12. 13. 14. 15. Nenne die Elemente der1. Hauptgruppe mit Namen und chem. Zeichen! Wie kann Lithium gewonnen werden? Nenne 2 Vorkommen von Natrium mit chem. Formel! Verwendung von Natriumchlorid Herstellung von Natriumhydroxid durch Elektrolyse mit den elektrodenbezog. RG! Wie kann Natriumsulfat aus Natriumchlorid hergestellt werden (+RG)? Schreibe die Reaktionsgleichungen für den Solvay-Soda-Prozeß mit allen Nebenprozessen! Wie wird Natriumhydrogencarbonat hergestellt (+RG)? Verwendung von Natriumhydroxid und Natriumcarbonat! Nenne 2 Vorkommen von Kalium mit chem. Formel! Herstellung von Kaliumhydroxid mit elektrodenbezogenen Reaktionengleichungen! Verwendung von Ätzkali! Herstellung von Kaliumcarbonat durch Carbonisierung von Kaliumhydroxid (+RG) Herstellung von Kaliumcarbonat nach dem Formiat-Pottascheverfahren (+RG) Verwendung von Kaliumcarbonat Verwendung von Kaliumchlorat, Kaliumnitrat und Kaliumcyanid