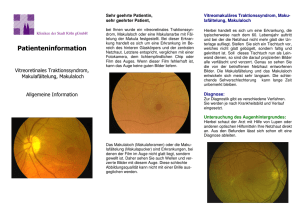
Bericht von dieser PRO RETINA
Werbung

Potsdam 2010: Persönlicher Bericht von Denise Emmerich Der nachfolgende Bericht über das PRO RETINA-Forschungskolloquium 2010 in Potsdam stammt von Denise Emmerich. Sie ist Biologin am Institut für Medizinische Genetik der Charité und die Tochter von Michael Emmerich, u.a. Leiter des Arbeitskreises für Seltene Erkrankungen in der PRO RETINA und selbst ZSD-Betroffener. Am 9. und 10. April 2010 fand in Potsdam das PRO RETINA-Research-Colloquium statt. Sicherlich wird es auch dieses Jahr wieder einen offiziellen Bericht geben, jedoch wollte ich von meinen persönlichen Eindrücken berichten, die vielleicht manchmal auch eine andere Sicht auf die Themen ermöglichen. Das letzte Drittel des Berichts befasst sich mit den vorgestellten Therapien, so dass Ungeduldige am besten gleich unten anfangen zu lesen. Zahlreiche hochrangige Augenärzte und Wissenschaftler waren angereist um Vorträge zu halten. So entdeckte ich viele bekannte Gesichter aus Augenkliniken und Humangenetischen Instituten. Es waren jedoch auch viele Nachwuchswissenschaftler angereist, die ihre Ergebnisse auf Postern präsentierten. Besonders beim Essen konnte man gute Gespräche führen und interessante Leute kennen lernen. Dies ist ein besonderer Vorteil dieses Colloquiums in relativ kleiner Runde im Vergleich zu den riesigen Kongressen, bei denen man nicht so schnell Kontakte findet. Einleitend begrüßte Franz Badura die Teilnehmer und berichtete über das „HOPE“ Projekt, ein Forschungsprojekt für erbliche Netzhauterkrankungen an der Augenklinik in Tübingen. Dieses soll durch die Ergründung der Ursachen der Erkrankungen auch zur Entwicklung von Therapien führen. Mehr dazu findet sich auch auf der PRO RETINA Webseite. Als nächstes sprach Frau Köhler, die Frau des ehemaligen Bundespräsidenten und Schirmherrin der ACHSE (Allianz Chronischer Seltener Erkrankungen). Ich hatte mich bei meiner Ankunft schon über den Bodyguard vor der Tür gewundert. Sie hielt eine sehr gute Ansprache über die Probleme von Seltenen Erkrankungen und speziell von Seltenen Netzhauterkrankungen und lobte ebenfalls das HOPE-Projekt. Als Einleitungsvortrag sprach Herr Prof. Zrenner (Tübingen) über die Verbesserung der Versorgung bei seltenen Augenerkrankungen. Da ich kürzlich auch bei der ACHSEMitgliederversammlung dabei sein durfte, konnte ich viele Parallelen zu den allgemeinen Problemen bei Seltenen Erkrankungen ziehen. So müssen beispielsweise der Weg zur Diagnose verkürzt werden, die Selbsthilfeverbände besser eingebunden werden und Referenzzentren gebildet werden. Durch die Gründung des Aktionsbündnis NAMSE des Gesundheitsministeriums könnte sich die Situation der Seltenen Erkrankungen in den nächsten Jahren verbessern. Mehr Informationen hierzu gibt es auf der ACHSE Webseite. Session 1 Das Forschungskolloquium wurde in 4 Abschnitte unterteilt, in denen es jeweils vier Vorträge gab. Der erste Abschnitt beschäftigte sich mit der Diagnosestellung. Besonders interessant fand ich hierbei die bei Ärzten so üblichen Fallbeispiele. Prof. Bart Leroy (Belgien) zeigte beispielsweise, dass Betroffene mit LCA (Lebersche Congenitale Amaurose) aufgrund von verschiedenen Genmutationen auch unterschiedliche Symptome zeigen. Er präsentierte außerdem Fälle bei denen Mutationen im gleichen Gen zu verschiedenen Erkrankungen führen konnten. Er stellte sehr interessant dar, wie der Weg zur Diagnose ist und welche Irrtümer dabei entstehen können. Im Anschluss erläuterte Herr Prof. Scholl (Baltimore) die Ergebnisse eines Projekts über die Korrelation von Funktion und Struktur der Netzhaut. Dabei wurde die Funktion der Netzhaut durch Mikroperimetrie beurteilt. Veranschaulicht wurden diese Ergebnisse durch farbige Punkte. Diese symbolisierten wie gut der Untersuchte an dieser Stelle seiner Netzhaut sehen konnte. Dann wurde eine Optische Kohärenztomographie (OCT) durchgeführt, so dass man die Netzhaut des Betroffenen wie in Scheiben geschnitten sehen konnte. Nun wurde beispielsweise an einer Stelle, an der der Untersuchte sehr schlecht gucken konnte, die Netzhautstruktur beurteilt und man konnte strukturelle Veränderungen erkennen. So etwas war für jeden Punkt der untersuchten Netzhaut möglich. Ich fand es beeindruckend wie gut das animiert war und wie sich die verschiedenen Untersuchungen zu einem Gesamtbild zusammenfügen lassen. Herr Dr. Friedburg aus Giessen berichtete danach, wie Kinder am besten untersucht werden sollten. Dabei gab er vor allem Tipps für die Ärzte und konnte auch seine Erfolge mit diesen Methoden zeigen. So ist er der Meinung, dass ein Elektroretinogramm (ERG) bereits bei Kindern ab 5 Jahren durchgeführt werden kann und zeigte Methoden zur Durchführung der Microperimetrie. Somit konnten in Giessen viele Kinder erfolgreich untersucht werden. Als letzter Redner in diesem Abschnitt stellte Herr Prof. Kellner (Siegburg) die existierenden Verfahren für Augenuntersuchungen vor, im besonderen solche, die ein Bild der Netzhaut erzeugen. Dabei erläuterte er wann sie zum Einsatz kommen sollten. Hierbei wurde besonders deutlich, dass verschiedene Untersuchungen notwendig sind, da sich sonst eine falsche Diagnose ergeben könnte. Als Beispiel nannte er die Zapfen-Stäbchen-Dystrophie (ZSD), bei der nur ca. 67 % der Betroffenen eine Veränderung des Augenhintergrundes in der Ophthalmoskopie zeigen, jedoch 92 % einen auffälligen Befund in der AutofluoreszenzUntersuchung haben. Session 2 Der zweite Abschnitt des Kolloquiums befasste sich mit den Mechanismen der Netzhautdegenerationen. Dies war für mich ein eher schwieriger Abschnitt, da jemandem, der nicht im Thema steckt nur schwer klar wird, was daran so wichtig ist, wenn das eine Protein hoch reguliert wird und das andere runter. Was nicht heißen soll, dass dies keine wichtigen Ergebnisse sind, sie waren nur einfach nicht so anschaulich für mich. So wurde erläutert was passiert, wenn beispielsweise bei einer Maus durch Lichteinstrahlung die Photorezeptoren absterben, also welche Proteine produziert werden, welche Zellen dabei aktiviert werden und welche Signalstoffe die Gruppen finden konnten. Hierbei war es interessant, dass ein Photorezeptor nicht einfach stirbt, sondern von anderen Zellen Überlebensfaktoren ausgeschüttet werden, die ihn zum „Kämpfen“ animieren. Deshalb sterben die Photorezeptoren bei den Betroffenen nicht gleich ab, auch wenn sie nicht funktionieren, sondern bleiben noch längere Zeit erhalten. Solche Überlebensfaktoren sind sehr wichtig für die Therapie und werden bereits in Studien untersucht. Das Auffinden weiterer Faktoren könnte dies noch optimieren. Session 3 Im dritten Abschnitt des Kolloquiums ging es um die Identifikation neuer Gene. Herr Prof. Cremers (Niederlande) stellte den üblichen Weg dar, wie neue Gene für Seltene Erkrankungen gefunden werden. Hierbei ist es für den Forscher vorteilhaft, wenn in der Familie eine Verwandtschaftsehe vorkommt. Dann kann man durch die Methode der Kopplungsanalyse sehr schnell den Bereich finden, in dem sich die Mutation befindet. Diese Mutation ist dann bei allen betroffenen Familienmitgliedern dieselbe und befindet sich zwischen DNA-Abschnitten, die ebenfalls bei allen Betroffenen gleich sind. Solche Bereiche werden dann Stück für Stück sequenziert, bis die Mutation gefunden werden kann. Nützlich kann auch die gleichzeitige Suche bei verschiedenen Familien sein. Ich fand es sehr interessant, dass Herr Cremers erläuterte, dass auch wenn die Familien nicht direkt verwandt sind, die Mutation trotzdem häufiger dieselbe sein kann als man theoretisch annehmen würde. So gibt es einige Mutationen in der Bevölkerung sehr oft. Dies ist auch bedingt durch den Ursprung aus derselben Population. Auch für das Next–Generation-Sequencing, die Sequenzierungs-Methode der Zukunft, stellte er ein interessantes Verfahren vor, bei dem DNA-Fragmente an kleine Kügelchen geheftet wurden, direkt an diesen kopiert und anschließend sequenziert wurden. Abschließend stellte er eine Behauptung auf, die auf dem Kongress gleich für ein Stimmengewirr sorgte: Seiner Meinung nach werden bis 2015 alle Gene für Netzhauterkrankungen gefunden sein. Wir werden ja sehen. Herr Prof. Ueffing (Tübingen) stellte dann die Bedeutung von Proteomics vor, also von der Komposition an Proteinen über die jeder Mensch in jeder Zelle verfügt. Mit dem Satz: „Zeig mir deine Freunde und ich sag dir wer du bist“, leitete er seinen Vortrag ein. Man analysiert also, mit welchen Proteinen ein untersuchtes Protein interagiert und entdeckt somit dessen Funktion. Im Anschluss daran stellte Herr Prof. Graw (München-Neuherberg) vor, wie man durch Mausmutanten neue Zielgene finden kann. Eine Möglichkeit ist es zufällige Mutationen in den Mäusen zu erzeugen und dann bei allen Tieren die Augen zu untersuchen. Außerdem präsentierte er ein Projekt bei dem alle bekannten Mausstämme mit verschiedenen Erkrankungen zusätzlich auf Augenerkrankungen untersucht werden. Dieser Programmabschnitt wurde sehr gut durch Herrn Prof. Gal (Hamburg) abgeschlossen. Er hielt einen sehr interessanten Vortrag über Genetische Modifier, also „Modifizierer“. Das Problem ist nämlich, dass eine Mutation bei verschiedenen Patienten nicht immer die gleichen Symptome zur Folge hat. Dies liegt unter anderem an solchen Modifiern, also Varianten anderer Gene, die einen Einfluss auf die Ausbildung der Erkrankung haben. Er nannte hierfür einige Beispiele wie das Usher-Syndrom oder das Bardet-Biedl-Syndrom, bei denen dies bereits beschrieben wurde. Session 4 Der letzte Abschnitt des Kolloquiums beschäftigte sich mit Therapien. Da im letzten Jahr der Schwerpunkt auf den Therapien lag, war mir bereits klar, dass es wohl nicht so viel Neues zu hören geben würde. Herr Prof. Hauswirth (Florida) stellte die Ergebnisse einer Gentherapie für LCA-Betroffene mit einer RPE65-Mutation vor. In einem Adenovirus wird dazu das intakte RPE65-Gen eingebracht. Dieses Virus wird anschließend unter die Netzhaut injiziert, wodurch das Protein vom Pigmentepithel produziert wird. An Mäusen, Ratten, Hunden und Affen wurde über mehrere Jahre die Verträglichkeit getestet. Außerdem konnte gezeigt werden, dass Mäuse und Hunde mit einem Defekt im RPE65-Gen nach der Therapie wieder sehen konnten. Danach wurde die Studie an betroffenen Menschen präsentiert. Ich fand es sehr interessant, dass es anscheinend nicht so einfach ist einzuschätzen, in welchen Bereich des Auges die injizierte Lösung fließt. Hierbei wurde bei den Betroffenen eine Stelle im Auge ausgewählt, an der das Sehen sehr schlecht war, doch in welchen Bereich genau sich die Lösung ausbreitet, war wohl schwer zu beurteilen. Nach der Therapie verbesserte sich das Gesichtsfeld der Untersuchten, da nun auch der Bereich genutzt werden konnte, der behandelt wurde. Junge RPE65-Patienten haben noch viele intakte Zapfen und Stäbchen, mit denen sie jedoch aufgrund der Mutation nicht sehen können. Durch die Therapie wurden diese wieder reaktiviert. Dies zeigt jedoch auch den Nachteil der Gentherapie: Bei Betroffenen von Netzhautdegenerationen sterben die Stäbchen und Zapfen ab, so dass auch eine Gentherapie keine Erfolge mehr erzielen kann. Es müssen also noch ausreichend Photorezeptoren vorhanden sein, deren Funktion wieder hergestellt werden kann. Die gezeigte Studie verlief über 12 Monate, wobei ab dem dritten Monat die Lichtsensitivität gleich blieb, also keine messbare Verbesserung mehr auftrat. Jedoch berichtete ein Patient erst später über eine deutliche Verbesserung der Sehschärfe, obwohl die Funktion der Netzhaut die gleiche wie vorher war. Dieser Patient fixierte jetzt mit der behandelten Stelle der Netzhaut und nicht mehr mit seiner eigentlichen Makula, da dieser Bereich nun besser funktionierte. Hierfür musste sich das Gehirn umstellen, was einige Monate benötigte. Da in dieser Studie eigentlich nicht mit solch einem großen Erfolg gerechnet wurde, wurden die Patienten hierauf nicht trainiert; dies sollte jedoch in folgenden Studien gemacht werden. Insgesamt verbesserte sich bei den Behandelten deutlich der Hell-Dunkel-Eindruck und die Farbwahrnehmung. Ein Patient konnte nun einen Hindernisparcours wesentlich besser ablaufen als vorher. Diesen Versuch kann man auch in einem Video im Internet anschauen. Abschließend nannte Herr Prof. Hauswirth noch weitere Gene, für die in den nächsten 2 bis 3 Jahren klinische Studien am Menschen zu erwarten sind: AMD (Neovascular), ABCA4, CNGB3, X-chromosomale Retinoschisis, Rho. Ich denke diese Ankündigung macht vielen Betroffenen Hoffnung auf eine baldige Therapie. Der nächste Themenschwerpunkt waren die Sehprothesen. Hierbei stellte Herr Prof. Zrenner den subretinalen Chip vor, also den, der unter die Netzhaut geschoben wird. Bei den neuen Chips befindet sich die Energiequelle unter der Haut, so dass den Patienten kein Kabel mehr hinter dem Ohr aus dem Kopf hinauskommt. Es wurden 12 Patienten behandelt, die zwischen 28 und 58 Jahre alt waren und den Chip bis zu 3 Monate im Auge trugen. Zuerst wurde der Chip elektronisch stimuliert und die Patienten sollten ihren Seheindruck beschreiben. Nachdem dies funktionierte, wurde überprüft, wie viel die Behandelten tatsächlich durch den Chip sehen konnten. Sicherlich sind den meisten von Ihnen die Videos, die es dazu gibt, bekannt. Der Vorzeigepatient konnte Apfel und Banane erkennen und konnte seinen Namen lesen, der in großen weißen Buchstaben vor ihm auf einem schwarzen Tisch lag. Auch wenn in den Videos immer ideale Lichtbedingungen zu sehen sind, so ist es, nach Aussage von Herrn Zrenner, bemerkenswert, dass der Behandelte ein ganzes Wort lesen kann, wozu dieser ja auch erkennen muss wie die Buchstaben angeordnet sind. Interessant war außerdem die Beschreibung, dass es für den Behandelten zu erst so schien als blicke er in einen Swimmingpool, auf dessen Grund etwas abgebildet war und sich mit der Zeit das Bild verbesserte. Hierbei ist es genau wie bei der Gentherapie erstaunlich, zu welchen Leistungen die vorher fast vollständig erblindeten Betroffenen nach der Therapie wieder fähig waren. Herr Zrenner betonte außerdem, dass der Chip unter der Makula platziert werden muss, da nur hier genug Nervenzellen vorhanden sind und auch die Repräsentation im Gehirn ausreicht um maximale Erfolge mit dem Chip zu erreichen. Zurzeit wird der Chip noch weiter verbessert um das nächste Model für 2 Jahre ins Auge einsetzen zu können. Herr Prof. Walter (Aachen) stellte dann die epiretinale Sehprothese vor. Hierbei zeigte er vor allem Bilder der Operationen, die mich ehrlich gesagt ein bisschen schockierten, da zur Befestigung des Chips kleine Anker in die Netzhaut gesteckt werden. Diese bleiben auch drin, wenn der Chip wieder entfernt wurde. Aber sicherlich sieht jede andere Augenoperation genauso schrecklich aus. Der Chip EPIRET 3 besteht aus 25 Elektroden und trägt eine Antenne, die sich im Auge befindet. Die Antenne sieht aus wie eine Unterlegscheibe, also rund mit einem Loch in der Mitte und wird statt der Linse eingesetzt. Das hätte ich gerne mal an einem Patienten gesehen, bis jetzt kann ich mir nämlich nicht vorstellen, wie das aussehen soll. Eine zweite Antenne befindet sich außerhalb des Auges und versorgt so den Chip mit Strom. Bisher sind mit diesem Projekt noch nicht so große Erfolge zu verzeichnen wie mit dem subretinalen Ansatz. Der Chip wurde bisher nur vier Wochen getragen und die Patienten konnten auch noch nichts wirklich sehen, jedoch erkannten sie Formen, die durch direkte Stimulation des Chips erzeugt wurden. Den letzten Vortrag hielt Herr Prof. Holz (Bonn) über die Behandlung von geographischer Atrophie. Möglicherweise lag es am Tempo des Vortrags oder einfach daran, dass ich zu müde war, aber leider konnte ich hieraus nicht so viele Informationen ziehen wie ich es mir gewünscht hätte. Er ging kurz auf verschiedene Therapieansätze ein, wie Gentherapie, Stoffe die das Absterben von Zellen verhindern sollen (Antiapoptotische Moleküle), Verminderung von oxidativem Stress, Reduzierung von Toxinen und Entzündungshemmer. Kurz schnitt er die ARED-Studie an, die die Auswirkung von Zink und Antioxidanzien auf AMD untersuchte. Er maß dieser Studie keinen Effekt zu, genaueres kann jedoch auch auf der PRO RETINAWebseite zu diesem Thema nachgelesen werden, wobei sich der WissenschaftlichMedizinische Beirat (WMB) mit diesem Thema auseinandergesetzt hat. Diesen Bericht sollte man ganz bis zum Ende lesen. Des Weiteren nannte er eine Gruppe von Medikamenten, die sogenannten „Visual Cycle Modulators“ (VCM). Einige Moleküle dieser Gruppe hemmen den Sehzyklus. Dadurch kann der Betroffene erstmal schlechter sehen, häufig einhergehend mit einem schlechteren Dämmerungssehen, aber langfristig sammelt sich weniger schädlicher Müll im Auge an. Dadurch bleiben die Zellen länger erhalten und könnten später beispielsweise durch eine Gentherapie gerettet werden. Hierzu zählen die Fenretinide, die derzeit in einer klinischen Studie getestet werden und auch ein RPE65-Hemmer. Dieser Vortrag war einfach zu kurz um all die wichtigen Informationen verarbeiten zu können. Ich hoffe ich konnte Ihnen einen Eindruck von den für mich interessantesten Punkten des Colloquiums vermitteln. Ich habe mich gefreut dabei sein zu können und werde nächstes Jahr wohl wieder teilnehmen. Liebe Grüße von Denise Emmerich