Das Konzept der „5A“ für die Intensiv
Werbung

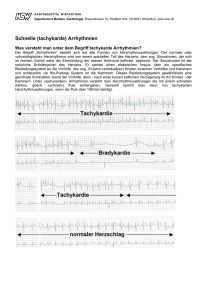
43–56 © Steinkopff Verlag 2008 H.-J. Trappe The concept of the “5A” for intensive cardiac care " Abstract Bradycardia (heart rate < 60/min) (BR) and tachycardia rhythm disturbances (heart rate > 100/min) (TR) require rapid therapeutic strategies. Supraventricular tachycardias (SVT) are sinus tachycardia, atrial tachycardia, AV-nodal reentrant tachycardia and tachycardia due to accessory pathways. All SVT are characterized by a ventricular heart rate > 100/min and small QRS complexes (QRS width < 0.12 ms) during tachycardia. It is essential to evaluate the arrhythmia history and to perform Eingegangen: 7. April 2008 Akzeptiert: 21. April 2008 Online publiziert: 4. Juni 2008 Univ.-Prof. Dr. med. Hans-Joachim Trappe ()) Medizinische Klinik II (Schwerpunkte Kardiologie und Angiologie) Ruhr-Universität Bochum Hölkeskampring 40 44625 Herne, Germany Tel.: +49-23 23 / 4 99-16 04 Fax: +49-23 23 / 4 99-3 01 E-Mail: [email protected] Das Konzept der „5A“ für die Intensiv- und Notfallmedizin a careful physical examination with exact analysis of the 12-lead electrocardiogram. An exact SVT diagnosis is then possible in > 90% of SVT patients. Ventricular tachycardia (VT) have a broad QRS complex (QRS width ≥ 0.12 s), while ventricular flutter (VFlut) and ventricular fibrillation (VF) are associated with chaotic electrophysiologic findings. For acute therapy, we will present the new “5A” concept that includes adenosine, adrenaline, ajmaline, amiodarone and atropine. Additional “B, C and D strategies” include betablocking agents, cardioversion as well as defibrillation. The “5A” concept allows a safe and effective antiarrhythmic treatment of all BR, TR, SVT, VT, VFlut, VF and asystole. " Key words bradycardia – tachycardia – “5A” concept – “B, C, D strategy” " Zusammenfassung Bradykarde (Herzfrequenz < 60/min) (BR) und tachykarde (TR) (Herzfrequenz > 100/min) Rhythmusstörungen erfordern rasche und gezielte therapeutische Maßnahmen. Supraventrikuläre Tachykardien (SVT) sind paroxysmale Tachykardien wie Sinustachykardien, atriale Tachykardien, AV-KnotenReentry-Tachykardien und Tachykardien durch akzessorische Lei- tungsbahnen. Sie führen in der Regel zu Tachykardien mit schmalen QRS-Komplexen (QRSBreite < 0,12 s). Von entscheidender Bedeutung ist die sorgfältige Erfassung der Arrhythmieanamnese, eine ordentliche klinische Untersuchung und eine exakte Analyse des 12-Kanal-Oberflächen-EKGs, das in > 90% die richtige Diagnose der vorliegenden SVT ermöglicht. Ventrikuläre Tachykardien (KT) haben in der Regel einen breiten QRS-Komplex (QRS-Breite ≥ 0,12 s), Kammerflattern (KFlat) und Kammerflimmern (KF) zeigen eine chaotische elektrische Erregung. Für die Akuttherapie wird das neue Konzept der „5A“ vorgestellt, das die Medikamente Adenosin, Adrenalin, Ajmalin, Amiodaron und Atropin zur Therapie von BR, TR und bei Asystolie umfasst. Ergänzende „B, C und D-Strategien“ sind Betablocker, Cardioversion und Defibrillation. Das Konzept der „5A“ erlaubt eine sichere und effektive Therapie von BR, TR, SVT, VT, KFlat, KF und Asystolie und mit der „B, C und D-Strategie“ zusammen lassen sich alle Notfallsituationen, die durch Arrhythmien bedingt sind, adäquat behandeln. " Schlüsselwörter Bradykardien – Tachykardien – Konzept der „5A“ – „B, C, D-Strategie“ 44 H.-J. Trappe Einleitung LA „Eine Behandlung muss einfach sein, eine mannigfaltige ist falsch und bedingt neue Störungen“ so hat sich vor vielen hundert Jahren der römische Philosoph und Literat Seneca (1–65 n. Chr.) geäußert. Dieser Satz scheint ganz besonders für die Behandlung von Patienten mit bradykarden oder tachykarden Rhythmusstörungen zu gelten, deren Behandlung durch medikamentöse Polypragmasie häufig falsch ist und zu neuen Störungen bis hin zu Proarrhythmien und/oder Herz-Kreislauf-Stillstand führt [17, 36]. In der Intensiv- und Notfallmedizin gilt die Behandlung von Patienten mit Herzrhythmusstörungen oft als schwierig, kaum durchschaubar und durch Überlegungen zu Arrhythmietyp und -mechanismus als komplex und verwirrend [45]. Diese Überlegungen sind allerdings meistens nicht zutreffend, wenn man „einfache Spielregeln“ beachtet wie sorgfältige Anamnese, klinische Untersuchung und sorgfältige Analyse des 12-Kanal-Oberflächen-Elektrokardiogramms [32]. Die Zusammenstellung dieser Befunde führt in > 90% der Fälle zur richtigen Diagnose. Die anschließende Therapie umfasst therapeutische Maßnahmen wie Antiarrhythmikagabe („A“), Betablockertherapie („B“), Cardioversion („C“) oder Defibrillation („D“), sodass die Maßnahmen der Behandlung des Rhythmuspatienten mit dem „A, B, C, D“-Konzept einfach zusammengefasst werden können. In diesem Beitrag sollen das Konzept der „5A“ für die Intensiv- und Notfallmedizin und die erweiterte „A, B, C, D-Strategie“ vorgestellt werden. Pathophysiologische Grundlagen n Bradykarde Herzrhythmusstörungen Eine Unterdrückung der dominanten Schrittmacheraktivität im Sinusknoten oder eine Beeinflussung der Weiterleitung der im Sinusknoten gebildeten Impulse führt zu Erregungsbildungs- oder Erregungsleitungsstörungen und damit zu bradykarden Arrhythmien. Die Leitung der gebildeten Impulse kann vollständig unterbrochen sein, sodass die Ventrikel von einem Schrittmacher im His-Purkinje-System aktiviert werden, oder sie ist nur partiell beeinträchtigt, sodass die Schrittmacheraktivität des Sinusknotens weiter, wenn auch in veränderter Form, führend ist (Abb. 1). n Tachykarde Herzrhythmusstörungen Tachykarde Rhythmusstörungen kommen bei zahlreichen kardialen oder extrakardialen Ursachen vor SK 1 AV-Knoten 5 3 ALB 2 6 4 RA His LV RV TawaraSchenkel rechts 7 TawaraSchenkel links 8 Abb. 1 Formen bradykarder und tachykarder supraventrikulärer und ventrikulärer Herzrhythmusstörungen. Abkürzungen: 1 = Sinusknotenfunktionsstörungen, 2 = Sinuatriale Leitungsstörungen, 3 = Vorhofleitungsstörungen, Vorhofflattern, Vorhofflimmern, 4 = AV-Knoten-Arrhythmien (Leitungsstörungen, Tachykardien), 5 = Vorhoftachykardien, 6 = Tachykardien bei akzessorischen Leitungsbahnen, 7 = Ventrikuläre Tachykardien, 8 = Kammerflattern/-flimmern Tab. 1 Ursachen bradykarder Rhythmusstörungen Ursachen Häufigkeit (%) Primär Sekundär Akutes Koronarsyndrom Pharmakologisch/toxisch Metabolisch Neurologisch Schrittmacherversagen Andere Ursachen 15 85 40 20 5 5 2 13 (Tab. 1). Als Mechanismen tachykarder Rhythmusstörungen sind die folgenden 3 elektrophysiologischen Phänomene bekannt: gesteigerte und abnorme Automatie, getriggerte Aktivität und kreisförmige Erregungen (,Reentry‘) entlang anatomischer Bahnen oder funktioneller Hindernisse [3]. Bei der gesteigerten und abnormen Automatie handelt es sich um eine Erregungsbildungsstörung, die durch Verlust eines stabilen Ruhememembranpotentials mit Veränderung transmembranärer Ionenströme entsteht. Es kommt zu einer Abnahme des Ruhemembranpotentials auf Werte um –50 mV und einer konsekutiven Inaktivierung des schnellen Natriumeinwärtsstromes. Die Depolarisation wird stattdessen durch den ,slow calcium channel‘ getragen. Abnorme Automatiezentren können in jedem beliebigen Myokardareal entstehen. Im Gegensatz zur abnormen Automatie besteht bei der getriggerten Aktivität keine Möglichkeit der spontanen Arrhythmieentwicklung, sondern die getriggerte Aktivität ist immer von der vorausgehenden Erregung abhängig [3]. Als eigentliche Auslöser der Erregungen wirken depolarisierende Nachpotenziale, die im Anschluss an ein Aktionspotenzial ent- Das Konzept der „5A“ für die Intensiv- und Notfallmedizin Abb. 2 Extremitäten-Ableitungen I, II, III, aVR, aVL und aVF bei einem Patienten mit bradykarden Rhythmusstörungen. „Durchlaufende“ P-Wellen als elektrokardiographisches Zeichen eines kompletten AV-Blocks (AV-Block III8) 45 I II III AVR AVL AVF stehen (,afterdepolarizations‘). Diese können bereits in der Repolarisationsphase eines Aktionspotenzials auftreten (,early afterdepolarizations‘) oder einem Aktionspotenzial folgen (,late afterdepolarizations‘). Frühe Nachdepolarisationen entstehen unter anderem durch eine abnorme Verlängerung der Aktionspotenzialdauer, etwa durch Medikamente oder durch Hypokaliämie. Fassbare Zeichen einer Verlängerung der Aktionspotenzialdauer ist eine Verlängerung der QT-Zeit. Späte Nachdepolarisationen schließen sich an ein Aktionspotenzial an und können, bedingt durch Erhöhung der intrazellulären Kalziumkonzentration, zu ektoper Aktivität führen, etwa bei Überdosierung von Herzglykosiden [3]. Die kreisende Erregung (,Reentry‘) ist sicher der häufigste Mechanismus tachykarder Rhythmusstörungen. Voraussetzung für einen Reentry-Mechanismus ist eine Leitungsverzögerung mit unidirektionaler Leitung und Wiedereintritt eines Impulses in das Gewebe. Für das Zustandekommen einer Tachykardie müssen beide Voraussetzungen, Verkürzung der Erregungswelle und inhomogene Erregbarkeit, erfüllt sein. Klassische Beispiele für Reentry-Mechanismen sind Tachykardien aufgrund akzessorischer Leitungsbahnen (Wolff-Parkinson-White-Syndrom) oder AV-KnotenReentry-Tachykardien. Nach heutiger Vorstellung liegen auch dem Vorhofflattern und Vorhofflimmern kreisförmige Erregungen zugrunde [36]. n Formen bradykarder Rhythmusstörungen Bradykarde Rhythmusstörungen liegen vor, wenn die Kammerfrequenz < 60/min beträgt, eine ausgeprägte Bradykardie besteht bei einer Pulsfrequenz < 40/min. Bradykardien können durch Störungen in Sinusknoten, Vorhöfen, AV-Knoten oder His-Bündel-System allein oder in Kombination hervorgerufen werden. Sinusknotendysfunktionen können als Sinusbradykardie, sinuatriale Blockierungen oder Sinusknotenstillstand imponieren. Besonders häufig finden sich diese Arrhythmien bei infero-posterioren Infarkten mit gesteigertem vagalen Tonus und sind nur in seltenen Fällen lebensbedrohlich [1]. AV-Blockierungen werden als Grad I–III klassifiziert, je nach Ausmaß der atrioventrikulären Überleitung, von einer Verlängerung der AV-Zeit (I8) bis hin zur kompletten AVDissoziation (III8) (Abb. 2). AV-Blockierungen I8 sind meistens Ausdruck einer Leitungsverzögerung im AV-Knoten. AV-Blockierungen II8 sind entweder Ausdruck eines erhöhten vagalen Tonus oder Ergebnis einer myokardialen Ischämie/Nekrose im Bereich des AV-Knotens. Sie entwickeln sich vielfach aus einem AV-Block I8 und können Zwischenstadium zum kompletten AV-Block sein, der bei 3–19% der Patienten mit akutem Infarkt beobachtet wird. AV-Blockierungen I8 und II8 treten sehr häufig < 24 Stunden nach Infarkteintritt auf und dauern gewöhnlich nicht mehr als 72 Stunden an [36]. Komplette AV-Blockierungen (Grad III) sind bei vielen Patienten mit akutem Koronarsyndrom (2/3 der Patienten mit inferoposteriorer Ischämie) ebenfalls nur vorübergehend; bei den meisten Patienten kann nach 3–7 Tagen wieder eine unauffällige atrioventrikuläre Überleitung nachgewiesen werden. Distale Leitungsstörungen des Erregungsleitungssystems sind als Schenkelblockierungen (Hemiblöcke oder komplette Blockierungen) bekannt. n Formen tachykarder Rhythmusstörungen Tachykardien sind definiert als Rhythmusstörungen mit einer Kammerfrequenz > 100/min. 46 Abb. 3 12-Kanal-Oberflächen-EKG eines Patienten mit Wolff-ParkinsonWhite-Syndrom und Vorhofflimmern. Nachweis maximaler Präexzitation mit kurzen RR-Abständen (< 250 ms) als Zeichen einer schnellen anterograden Refraktärzeit der akzessorischen Leitungsbahn (a). Klassische Zeichen eines Präexzitationssyndroms mit manifester Delta-Welle während Sinusrhythmus (b) H.-J. Trappe 95626 157 I II III avr avl avf V1 V2 V3 V4 V5 V6 a 932010 Bei supraventrikulären Tachykardien sind anatomische Strukturen oberhalb der Aufteilung des HisBündels in die Tawaraschenkel beteiligt. Zu diesen supraventrikulären Tachyarrhythmien gehören atriale Tachykardien, AV-Knoten-Reentry-Tachykardien, Tachykardien aufgrund akzessorischer Leitungsbahnen, AV-junktionale Tachykardien, Vorhofflattern und Vorhofflimmern (Abb. 3). Wenn Vorhofflimmern ausgeschlossen ist, spricht man von supraventrikulären Tachykardien (SVT). Jede dieser Tachykardien hat seine elektrokardiographisch typischen Befunde, allen SVT gemeinsam ist die Breite des QRS-Komplexes, die gewöhnlich 80–100 ms beträgt (Abb. 4). QRS-Komplex-Breiten > 120 ms werden bei SVT nur dann beobachtet, wenn ein permanenter Schenkelblock vorliegt, ein funktioneller Schenkelblock durch die Tachykardie hervorgerufen wird oder die AVÜberleitung anterograd über eine akzessorische Bahn auf die Kammern übergeleitet wird. Die Prävalenz supraventrikulärer Tachykardien liegt bei etwa 2,25/1000 Menschen, die Inzidenz bei 35/100 000 Patienten-Jahre. Tachykarde ventrikuläre Rhythmusstörungen sind mono- oder polymorphe Kammertachykardien, die in der Regel mit einer QRS-Breite > 0,12 s einhergehen, Torsade de pointes-Tachykardien, Kammerflattern und Kammerflimmern (Abb. 5 b Tab. 2 Ursachen tachykarder Rhythmusstörungen Kardiale Ursachen Koronare Herzkrankheit Akute Ischämie (Präinfarktsyndrom, stabile Angina pectoris) Chronisches Infarktstadium Kardiomyopathie (dilatativ, hypertroph-obstruktiv, restriktiv) Entzündliche Herzerkrankungen Myokarditis Perikarditis Angeborene Herzklappenfehler Erworbene Herzklappenfehler Tumoren des Herzens Hypertrophie des Herzens (arterielle Hypertonie) QT-Syndrom (angeboren oder erworben) Extrakardiale Ursachen Elektrolytstörungen Toxisch (Alkohol) Lebererkrankungen (Hämochromatose) Nierenerkrankungen Hypo-, Hyperthyreose Phäochromozytom Autoimmunerkrankungen Neuromuskuläre Erkrankungen (Friedreich-Ataxie) Neoplastische Erkrankungen Entzündliche Erkrankungen (Sarkoidose, Amyloidose) Medikamentös bedingte Ursachen Antiarrhythmika Digitalis Psychopharmaka (trizyklische Antidepressiva) 400 msec Das Konzept der „5A“ für die Intensiv- und Notfallmedizin Abb. 4 Telemetrie-EKG eines Patienten mit Tachykardien und schmalen QRS-Komplexen (QRS-Breite < 0,12 s) als Zeichen einer supraventrikulären Tachykardie S/N: Journal: Typ: Rev.: Aufnahme: Sendezeit: 039055 105782 0012/0012/000 SM100 2.10 / 1.6.1 2005-03-11 16:37:13 CET 2005-03-11 18:29:48 CET 47 Name: _________________ Vorname: Geb.: _________________ _________________ Symptome/Bemerkungen http://www.sensormobile.com/support/de/ 25mm/s 10mm/mV 0s 10s 10s 20s 20s 30s und 6). Der plötzliche Herztod (PHT) ist als schwerwiegendste Form tachykarder ventrikulärer Rhythmusstörungen aufzufassen und gehört zu den häufigsten Todesursachen in der westlichen Welt [36]. In Deutschland erliegen pro Jahr etwa 70 000–100 000 Menschen einem PHT, in den USA versterben etwa 450 000 Menschen plötzlich und unerwartet. Wegweisende klinische Befunde Die Symptome von Patienten mit Herzrhythmusstörungen reichen vom asymptomatischen Patienten bis hin zum Patienten mit Herz-Kreislauf-Stillstand als schwerwiegendster Form einer malignen Herzrhythmusstörung [45]. Bradykarde Rhythmusstörungen sind häufig asymptomatisch, können aber auch mit Phasen von Schwindel, Präsynkopen oder Synkopen einhergehen. Tachykardien werden demgegenüber in der Regel vom Patienten sofort registriert und meistens als bedrohlich empfunden [37]. Sie können paroxysmal auftreten, wenige Sekunden bis zu Stunden anhalten oder als Dauertachykardie (,unaufhörliche‘, ,incessant‘ Tachykardie) mit mehr als 50% Tachykardiezyklen pro Tag imponieren. Sie können plötzlich beginnen und plötzlich enden oder einen langsamen Anfang und ein langsames Ende haben [45]. Wichtige klinische Hinweise auf den vorliegenden Arrhythmietyp finden sich vor allem bei supraventrikulären und ventrikulären Tachykardien, während ,klassische‘, klinisch wegweisende Befunde bei bradykarden Rhythmusstörungen fehlen. Bei Patienten mit tachykarden Rhythmusstörungen sind Tachykardiefrequenz, Vorliegen eines regelmäßigen oder unregelmäßigen Pulses und charakteristische Befunde im Bereich der Halsvenen wichtig und erlauben in vielen Fällen bereits eine klinische Diagnose der vorliegenden Arrhythmieform [45]. Klinische Phänomene wie z. B. das ,Froschzeichen‘, das als ,Propfung‘ im Bereich der Halsvenen durch simultane Kontraktionen von Vorhof und Kammern beobachtet wird, sind wegweisend für die Diagnose einer AV-Knoten-Reentry- bzw. ,Circus-movement‘-Tachykardie bei Vorliegen einer akzessorischen Leitungsbahn (Tab. 3). Bei ventrikulären Tachykardien sind Zeichen einer AV-Dissoziation mit irregulären Vorhofwellen im Bereich der Halsvenen, unterschiedlichen Intensitäten des 1. Herztons und unterschiedlichen systolischen Blutdruckamplituden bei ca. 50% der Patienten nachzuweisen [36, 45]. Während supraventrikuläre Tachykardien überwiegend beim Herzgesunden vorkommen, in der Regel gut toleriert werden und meistens nicht mit schweren hämodynamischen Beeinträchtigungen einhergehen, 48 H.-J. Trappe Abb. 5 12-Kanal-Oberflächen-EKG eines Patienten mit breiter QRSKomplex-Tachykardie (QRS-Breite > 0,12 s). Klassische Zeichen einer ventrikulären Tachykardie mit einer Frequenz von 144/min, atrioventrikulärer Dissoziation, überdrehtem Rechtstyp, rechtsschenkelblockartiger Deformierung der QRS- Komplexe und R/S-Relation < 1 in Ableitung V6 I II III aVr aV1 V1 V2 V3 V4 V5 V6 sind ventrikuläre Tachykardien häufiger bei Patienten mit kardialer Grunderkrankung zu beobachten, werden oft schlecht toleriert und gehen mit Zeichen eines verminderten Herzzeitvolumens (Angst, Unruhe, Schweißausbruch, Hypotonie) einher. Tab. 3 Klinische Zeichen zur Differentialdiagnose supraventrikulärer und ventrikulärer Tachyarrhythmien (modifiziert nach Wellens [45]) Tachykardie Puls Halsvenen Blutdruck 1. HT Sinustachykardie Atriale Tachykardie VH-Flattern (2 : 1 ÜL) VH-Flattern (unreg. ÜL) Vorhofflimmern AVNRT CMT bei ALB Ventrikuläre Tachykardie regelmäßig regelmäßig regelmäßig unauffällig unauffällig Flatterwellen konstant konstant konstant konstant konstant konstant unregelmäßig unregelmäßig wechselnd wechselnd unregelmäßig regelmäßig regelmäßig regelmäßig unregelmäßig „Froschzeichen“ „Froschzeichen“ unregelmäßig wechselnd konstant konstant wechselnd wechselnd wechselnd wechselnd wechselnd ALB = akzessorische Leitungsbahn, AVNRT = AV-Knoten-Reentry-Tachykardie, CMT = „circus movement tachycardia“, VH = Vorhof, unreg.= unregelmäßige, ÜL = Überleitung Diagnostik Von entscheidender Bedeutung in der Diagnostik bradykarder und tachykarder Rhythmusstörungen ist neben einer genauen Erhebung der Anamnese sowie des körperlichen Untersuchungsbefundes (HerzLungen-Auskultation, Pulsqualitäten, Blutdruck, Herzinsuffizienzzeichen, Pulsdefizit) vor allem das 12-Kanal-Oberflächen-Elektrokardiogramm, das bei systematischer Analyse und Interpretation in > 90% zur richtigen Diagnose führt [17]. Es ist wichtig, bei tachykarden Rhythmusstörungen zwischen regelmäßigen Tachykardien mit schmalem QRS-Komplex (QRS-Breite ≤ 0,12 s) (Tab. 4) und breitem QRSKomplex (QRS-Breite ≥ 0,12 s) (Tab. 5) bzw. irregulären Tachykardien (unterschiedliche RR-Abstände während der Tachykardie) zu unterscheiden. Bei systematischer Analyse des Elektrokardiogramms („stepwise approach“) ist es einfach, zur richtigen Diagnose zu kommen. Die tägliche Praxis zeigt jedoch, dass die Differentialdiagnose von Herzrhythmusstörungen oft schwierig ist und relativ häufig Fehldiagnosen beobachtet werden, weil die Grundlagen der systematischen EKG-Analyse nicht ange- Das Konzept der „5A“ für die Intensiv- und Notfallmedizin 49 Abb. 6 12-Kanal-Oberflächen-EKG eines Patienten mit Kammerflattern/ -flimmern. Geordnete QRS-Komplexe sind nicht mehr erkennbar, klinische Zeichen des Herz-Kreislauf-Stillstandes wendet werden. Eine falsche Diagnose und eine daraufhin eingeleitete inadäquate Therapie können zu einer ernsten Gefährdung des Patienten bis hin zur Kreislaufdekompensation und Reanimationspflichtigkeit führen. Es ist daher unumgänglich, bei Patienten mit Rhythmusstörungen aus anamnestischen, klinischen und nichtinvasiven Untersuchungsbefunden ein detailliertes ,Risikoprofil‘ zu erstellen und bei speziellen Fragestellungen zusätzliche Maßnahmen wie linksventrikuläre Angiographie, Koronarangiographie und eine elektrophysiologische Untersuchung heranzuziehen. n Das Konzept der „5A“ Die Behandlung von Patienten mit Rhythmusstörungen soll einfach, effektiv und sicher sein und mit möglichst keinen oder wenigen Nebenwirkungen oder Problemen einhergehen. Aus diesen Überlegungen heraus erscheint es möglich, mit lediglich 5 Medikamenten sehr viele Rhythmusstörungen im Bereich der Intensiv- und Notfallmedizin zu behandeln. Diese Medikamente, die das neue Konzept der „5A“ in der Therapie bradykarder und tachykarder Rhythmusstörungen ausmachen, sind Adenosin, Adrenalin, Ajmalin, Amiodaron und Atropin (5-mal „A“). Adenosin Adenosin ist aufgrund seiner extrem kurzen Halbwertzeit von wenigen Sekunden ein Medikament der ersten Wahl zur Behandlung von Tachykardien mit schmalem QRS-Komplex. Es ist eine körpereigene Substanz mit kurzer Halbwertzeit, die auch in der Schwangerschaft angewendet werden kann und von 50 H.-J. Trappe Abb. 7 Algorithmus zum Konzept der „5A“ bei Patienten mit bradykarden oder tachykarden Herzrhythmusstörungen. Abkürzungen: HKS = HerzKreislauf-Stillstand, KF = Kammerflimmern, KT = Kammertachykardie, PEA = pulslose elektrische Aktivität, SVT = supraventrikuläre Tachykardien, VHF = Vorhofflimmern Das Konzept der „5A“ Arrhythmien Adenosin Adrenalin Ajmalin Amiodaron SVT Asystolie KF, PEA KT SVT KT, KF VHF Tab. 4 Differentialdiagnose von Tachykardien mit schmalem QRS-Komplex (QRS-Breite < 0,12 s) (modifiziert nach Wellens et al. [45]) 1. AV-Block 28 ________________________ nein > 250/min < 250/min VH-Flattern 2. nein 2. Breite QRS-Komplex > 0,14 s ? VT Beachte: a) SVT bei vorbestehendem SBB b) SVT mit anterograder Leitung über ALB 3. Linkstypische Achse des QRS-Komplexes ? VT Beachte: a) SVT bei vorbestehendem SBB b) SVT mit anterograder Leitung über ALB LSBB CMT bei ALB 3. Ja 4. Morphologie des QRS-Komplexes RSBB ja Relation p-Welle : QRS-Komplex ________________________________ PR > RP P in R PR < RP CMT bei ALB (schnelle L.) AVNRT CMT bei ALB (langsame L.) ALB = akzessorische Leitungsbahn, AVNRT = AV-Knoten-Reentry-Tachykardie, CMT = „circus movement“-Tachykardie, L = Leitung, VH = Vorhof, P = P-Welle, R = R-Zacke Leber- oder Nierenfunktion unbeeinflusst ist. Es konnte gezeigt werden, dass Adenosintriphosphat (6 mg i.v. als Bolus [schnelle Injektion], wenn nicht erfolgreich Steigerung der Dosis auf 9 oder 12 mg) eine Erfolgsrate von etwa 90% hat und dass der Mechanismus dieses Medikamentes in einem transien- ? VT 1. AV-Dissoziation Atriale Tachykardie Alteration des QRS-Komplexes _________________________ Bradykardie Asystolie Tab. 5 Differentialdiagnose von Tachykardien mit breitem QRS-Komplex (QRS-Breite ≥ 0,12 s) (modifiziert nach Wellens et al. [45]) ja Vorhof-Frequenz _______________ Atropin V1: mono-/biphasisch V6: R/S < 1 ? VT ? VT V1: R (Tachy) < R (Sinus) R (Tachy) > R (Sinus) V1/2: „Kerbe“ (S-Zacke) V6: qR-Konfiguration ? SVT ? VT ? VT ? VT ALB = akzessorische Leitungsbahn, AV = Atrioventrikulär, LSBB = Linksschenkelblockbild, RSBB = Rechtsschenkelblockbild, SBB = Schenkelblockbild, SVT = supraventrikuläre Tachykardie, Tachy = Tachykardie, VT = ventrikuläre Tachykardie ten AV-Block zu sehen ist, sodass Adenosin bei Tachykardien, deren Impulsausbreitung den AV-Knoten miteinbezieht, ein geeignetes Medikament zur Terminierung der Rhythmusstörung ist [39]. In den 2005 erschienenen Leitlinien zur Reanimation wird bei Tachykardien mit schmalem QRS-Komplex die Adenosingabe von 6 mg als Bolus i.v. vorgeschlagen, bei Erfolglosigkeit die erneute Gabe von 12 mg Adenosin i.v. [19]. Auch bei Patienten mit klinisch stabilen Tachykardien und breitem QRS-Komplex (≥ 0,12 s) wird unter der Diagnose einer „sicheren supraventrikulären Tachykardie“ die Gabe von 6 mg Adenosin Das Konzept der „5A“ für die Intensiv- und Notfallmedizin i.v. als Bolus, bei Erfolglosigkeit die Applikation von 12 mg als Bolus i.v. vorgeschlagen [19]. Eigene Untersuchungen haben im Jahr 2000 gezeigt, dass eine Terminierung induzierter supraventrikulärer Tachykardien durch 12 mg Adenosin i.v. bei 81% der Patienten möglich war und bei 94% durch Bolusgabe von 18 mg Adenosin i.v. (p = ns) [44]. In einer 1997 publizierten Studie konnten wir nachweisen, dass Adenosin und Ajmalin geeignete Medikamente für die Akuttherapie supraventrikulärer Tachykardien sind mit ähnlich hohen Erfolgsraten [41]. Adrenalin Die Gabe von Adrenalin ist bei Patienten mit prähospitalem Herz-Kreislauf-Stillstand und Defibrillations-refraktärem Kammerflimmern oder einer Asystolie seit Jahren etabliert [15]. Vorwiegend aufgrund seiner alpha-adrenergen Stimulation erhöht Adrenalin unter kardiopulmonaler Reanimation den kardialen und zerebralen Blutfluss [8]. An der Empfehlung für Adrenalin (1 mg fraktioniert i.v. oder über Endotrachealtubus [3fache Dosis], Wiederholung im Abstand von 2–3 min bis zur Wiedererlangung des Spontankreislaufes) hat sich auch nach den Reanimationsleitlinien 2005 nichts geändert [10, 19]. Adrenalin wird bei refraktärem Kammerflimmern nach 2 Defibrillationsversuchen, bei Asystolie und pulsloser elektrischer Aktivität so früh wie möglich eingesetzt [19]. Die zwischenzeitlich vielfach durchgeführte „Hochdosistherapie“ mit Adrenalin (0,1 mg/ kg i.v.) hat sich demgegenüber in mehreren Untersuchungen als nicht vorteilhaft erwiesen, bewirkt eine vermehrte myokardiale bzw. zerebrale Schädigung und wird deshalb nicht mehr empfohlen. Beim Vasopressin handelt es sich um ein nichtadrenerges Peptidhormon mit ausgeprägter vasokonstriktorischer Wirkung [24, 26]. Aufgrund seiner fehlenden adrenergen Wirkung führt es zu keiner myokardialen Stimulation, ist von einer Gewebeazidose unabhängig und erscheint daher im Rahmen der kardiopulmonalen Reanimation (40 IU, unabhängig von der Applikationsform) als Alternativsubstanz zum Adrenalin [20]. In einer von Wenzel und Mitarbeitern vorgelegten Studie wurden 1219 Patienten mit prähospitalem Herz-Kreislauf-Stillstand entweder mit Vasopressin oder Adrenalin behandelt. Sofern kein Wiedereinsetzen des Spontankreislaufes erfolgte, wurde das jeweilige Medikament in der gleichen Dosierung nochmals verabreicht; führte auch das nicht zum Erfolg, wurden weitere Gaben ausschließlich von Adrenalin appliziert. Die Überlebensraten bis zur Krankenhaus-Aufnahme waren für Vasopressin und Adrenalin bei Kammerflimmern (46,2 vs. 43,0%) oder pulsloser elektrischer Aktivität (33,7 vs. 51 30,5%) nicht unterschiedlich (p = ns), bei Patienten mit Asystolie war das Überleben bis zur Aufnahme (29,0 vs. 20,3%) wie auch zur Krankenhausentlassung (4,7 vs. 1,5%) unter Vasopressin signifikant besser (p = 0,04). Bei 732 Patienten, bei denen unter Studienmedikation keine Kreislaufstabilisierung zu erreichen war, führte die zusätzliche Gabe von Adrenalin in der Vasopressin-Gruppe (im Vergleich zur Adrenalin-Gruppe) zu signifikant höheren Überlebensraten bis Klinikaufnahme (25,7 vs. 16,4%) (p = 0,002) bzw. Krankenhausentlassung (6,2 vs. 1,7%) (p = 0,002) [46]. Nach den jetzt vorliegenden Leitlinien wird die Vasopressingabe bei kardio-pulmonaler Reanimation der Evidenzklasse II b zugeordnet; es bleibt abzuwarten, wie künftige Reanimationsleitlinien den definitiven Stellenwert dieses Medikamentes bewerten werden. Ajmalin Bei Patienten mit anhaltenden ventrikulären Tachykardien und stabiler Hämodynamik ist Ajmalin (50–100 mg i.v. über 5 min) ein Klasse I Antiarrhythmikum mit hoher Effektivität [39, 40]. Es hat sich seit vielen Jahren in der Akuttherapie anhaltender ventrikulärer Tachykardien bewährt und ist fester Bestandteil in der Intensiv- und Notfalltherapie [36]. Vor etwa 20 Jahren wurde bereits darauf hingewiesen, dass Ajmalin wesentlich effektiver ist als Lidocain, besonders bei Patienten mit Kammertachykardien im chronischen Infarktstadium [23, 40]. Es wurde beobachtet, dass eine Terminierung ventrikulärer Tachykardien in 76% der Fälle durch Ajmalin und nur in 36% der Fälle durch Lidocain möglich war. Demgegenüber war die Degeneration in Kammerflimmern bei Lidocain (40%) deutlich höher als unter Ajmalin (11%) [40]. Lidocain war auch aufgrund anderer Studienergebnisse als Standard bei pulsloser ventrikulärer Tachykardie als Medikament der ersten Wahl schon in den Leitlinien des Jahres 2000 durch Amiodaron ersetzt worden. In den neuen Reanimationsleitlinien wird Lidocain (1–1,5 mg/kg– max. 3 mg in der ersten Stunde) noch als Notbehelf angesehen, falls Amiodaron nicht zur Verfügung steht [19]. Trotz der eindeutig nachgewiesenen Effektivität in der Akuttherapie anhaltender ventrikulärer Tachykardien wurde Ajmalin nicht in die Empfehlungen der neuen Leitlinien zur Reanimation aufgenommen, möglicherweise, weil Ajmalin in den USA weitgehend unbekannt ist. Stattdessen wurde die Applikation von Amiodaron (300 mg i.v. in 100 ml Glucose 5%) vorgeschlagen [19]. Bei Tachykardien, deren Ursprung für den behandelnden Arzt nicht klar ist, erscheint Ajmalin ebenfalls geeignet zu sein und sollte im Zweifelsfall gegeben werden [45]. 52 Amiodaron Amiodaron ist ein Antiarrhythmikum der Klasse III nach der Vaughan-Williams-Klassifikation und wird seit etwa 25 Jahren in der klinischen Medizin eingesetzt [34]. Obgleich die Substanz [(2-n-Butyl-3(3,5-dijod-4-beta-diäthylaminoäthoxybenzoyl)-benzofuran-Hydrochlorid] primär als nichtkompetitiver aund b-Rezeptorblocker zur Behandlung der koronaren Herzkrankheit 1962 entwickelt wurde, steht seit ersten Berichten 1974 und 1976 vor allem die antiarrhythmische Wirksamkeit zur Behandlung supraventrikulärer und ventrikulärer Rhythmusstörungen im Mittelpunkt des Interesses [28, 29]. Das Klasse IIIAntiarrhythmikum Amiodaron (300 mg i.v. als Bolus) ist zur Zeit die einzige antiarrhythmische Substanz, für die ein Effektivitätsnachweis bei Schockrefraktärem Kammerflimmern nachgewiesen werden konnte und nimmt in den neusten Empfehlungen eine zentrale Rolle ein [4, 19, 22]. In der ALIVE-Studie (Amiodarone Versus Lidocaine In Prehospital Ventricular Fibrillation Evaluation) wurde Amiodaron (179 Patienten) und Lidocain (165 Patienten) bei Patienten mit 5 erfolglosen Schockabgaben bei Kammerflimmern miteinander verglichen [11]. Die Überlebensrate bis zur Krankenhausaufnahme war bei Amiodaron (22,7%) signifikant höher als bei Lidocain (10,9%) (p < 0,005). In der ARREST-Studie (Amiodarone in Resuscitation of REfractory Sustained Ventricular Tachyarrhythmias) [21] wurde schließlich an 504 Patienten mit Defibrillationsrefraktärem Kammerflimmern (3 erfolglose Schocks) nachgewiesen, dass unter Amiodaron im Vergleich zu Plazebo die Überlebensraten bis Krankenhausaufnahme signifikant höher waren (43,9 vs. 34,1%) (p = 0,03), dass sich aber hinsichtlich des Überlebens bis zur Entlassung kein signifikanter Unterschied (13,4 vs. 13,2%) (p = ns) ergab. Für die medikamentöse Konversion von Vorhofflimmern zum Sinusrhythmus sind bei der Applikation von Amiodaron Konversionsraten bis zu 80% beschrieben worden, besonders bei der intravenösen Gabe von 300 mg Amiodaron i.v. über 30 min, sodass auch Amiodaron für die medikamentöse Konversion von Vorhofflimmern angewendet werden kann, insbesondere bei älteren und strukturell herzkranken Patienten, da die negativ inotrope Wirkung gering ist und proarrhythmische Effekte mit < 1% wenig ausgeprägt sind [20, 25, 35]. Atropin Atropin erhöht als Parasympatholytikum die Autonomie des Sinusknotens und die AV-Überleitung über die direkte vagolytische Wirkung. Atropin sollte bei vagal bedingten Sinusbradykardien, AV-Blockie- H.-J. Trappe rungen im Bereich des AV-Knotens und vagal bedingten Asystolien gegeben werden, wenngleich bei akuter Asystolie natürlich eine sofortige Reanimation erforderlich ist [43]. Bei Asystolie sollte Atropin in einer Dosierung von 1 mg i.v. alle 3–5 min injiziert werden, bei bradykarden Rhythmusstörungen 0–5 mg i.v. bis zu einer Maximaldosis von 0,04 mg/ kg (3 mg) [19]. Bei dieser Maximaldosis ist beim Menschen die volle Wirkung erreicht. Vorsicht mit der Atropingabe ist beim akuten Myokardinfarkt gegeben, da ein Anstieg der Herzfrequenz die Ischämie verstärken kann. Bei Verdacht einer Bradykardie durch infranodalen AV-Block II8 (Typ Mobitz) und bei komplettem AV-Block (AV-Block III8) sollte Atropin nicht angewendet werden, da es zu einer paradoxen Bradykardisierung kommen kann [43]. In den neuen Reanimationsleitlinien ist allerdings klar beschrieben, dass es „unwahrscheinlich sei, dass Atropin bei Asystolie schädlich sei“ [19]. Nach den 2005 publizierten Leitlinien ist bei Asystolie ein einmaliger Bolus von 3 mg möglich, Wirksamkeitsbeweise von Atropin bei der Reanimation fehlen tatsächlich bisher [19]. n Das erweiterte „5A“-Konzept: „A, B, C, D“-Strategie Neben dem neuen „5A“-Konzept spielen in der Rhythmologie auch weiterhin andere, „erweiterte“ therapeutische Maßnahmen eine Rolle, die ebenfalls in dieser Arbeit diskutiert werden sollen, und die neben dem „5A“-Konzept als „B, C und D“-Strategie als „ergänzende“ Maßnahmen bezeichnet werden sollen: Betablocker, Cardioversion und Defibrillation. B – Betablocker Betablocker haben einen Stellenwert in der Intensivund Notfalltherapie, besonders bei Patienten mit tachykardem Vorhofflimmern, bei denen das Vorhofflimmern unvermeidbarer Endzustand einer Vorhofpathologie ist [30]. Die am häufigsten verwendeten Medikamente zur Frequenzkontrolle bei tachykardem Vorhofflimmern sind Betablocker wie Metoprolol oder Bisoprolol. Auch das Esmolol hat sich als kurz wirksamer b-Blocker bei diesen Patienten bewährt [33]. Esmolol ist ultrakurz wirksam, hat eine Halbwertzeit von 9 min und führt zu einer selektiven Blockierung der b1-Rezeptoren. Esmolol hat keine intrinsische Aktivität und keine membranstabilisierende Wirkung. Im Gegensatz zu anderen Betablockern, die oft schwierig zu steuern sind, liegt der Vorteil von Esmolol in seiner Wirksamkeit, Sicherheit und guten Steuerbarkeit, da nach Abstellen einer Infusion die Wirksamkeit des Medikamentes Das Konzept der „5A“ für die Intensiv- und Notfallmedizin nach circa 20 min abgeklungen ist. Die antiarrhythmische Wirkung von Esmolol manifestiert sich am Sinusknoten, Vorhof und AV-Knoten, währenddessen His-Bündel und Ventrikel nicht wesentlich beeinflusst werden. Esmolol ist nur parenteral verfügbar, hat ein Verteilungsvolumen von 2 l/kg und eine Plasmaproteinbindung von 55%. Esmolol wird durch Hydroxylierung in den Erythrozyten metabolisiert und in Form inaktiver Metaboliten renal eliminiert. Esmolol ist für die Behandlung supraventrikulärer Tachykardien zugelassen und ist darüber hinaus vor allem bei schnellem Vorhofflimmern und Vorhofflattern gut belegt [6, 33]. Betablocker erscheinen als bevorzugte Medikamente zur Frequenzkontrolle bei tachykardem Vorhofflimmern, da sie die Herzfrequenz in Ruhe und unter Belastung effektiv senken [30]. C – Cardioversion Bei der elektrischen Cardioversion wird ein Elektroschock EKG-synchron mono- oder biphasisch abgegeben. Die Cardioversion kommt bei allen Rhythmusstörungen in Betracht, bei denen kein Kammerflimmern vorliegt, und bei denen zur Wiederherstellung eines Sinusrhythmus ein DC-Schock indiziert ist [2, 16]. Die EKG-Synchronisation (Abgabe des DC-Schocks in oder unmittelbar nach der R-Zacke des EKG) ist erforderlich, da durch die Schockabgabe außerhalb der Refraktärität durch abrupte Depolarisation des Herzmuskels Kammerflimmern ausgelöst werden könnte. Indikationen zur Cardioversion sind hämodynamische instabile ventrikuläre oder supraventrikuläre Tachykardien, Vorhofflimmern oder Vorhofflattern [36]. Die Überlegungen zum Vorgehen der Cardioversion entsprechen den vorliegenden Ergebnissen zur DC-Defibrillation und werden im folgenden Abschnitt ausführlich besprochen. D – Defibrillation Unter einer Defibrillation versteht man die Wiederherstellung des Sinusrhythmus eines Herzens durch Abgabe einer extern oder intern applizierten elektrischen Energiemenge bei Patienten, bei denen zum Zeitpunkt der Defibrillation Kammerflimmern vorliegt [38]. Beim Kammerflimmern ist die geordnete, normale Erregungsbildung und Erregungsleitung des Herzens verloren gegangen und es liegt „elektrisches Chaos“ vor. Folge dieser „elektrischen Entgleisung“ ist die fehlende Kontraktion des Herzmuskels; stattdessen findet man unkoordinierte Zuckungen einzelner Muskelareale mit völligem Verlust der myokardialen Kontraktilität, verbunden mit Bewusstseinsverlust und einem plötzlichen Herz-Kreislauf-Stillstand [12]. Im 53 Oberflächen-Elektrokardiogramm oder Monitor-EKG findet sich beim Kammerflimmern eine „chaotische“ Erregung des Herzens, bei der regelrechte elektrische Impulse fehlen und man lediglich irreguläre Undulationen der elektrokardiographischen Signale sieht. Bei der Defibrillation wird elektrische Energie durch Kondensatoren des Defibrillator-Generators aufgebaut und über Elektrodenplatten („Flächenelektroden“ oder „Patche“) entweder im Bereich des Brustkorbes („externe Defibrillation“) oder direkt auf myokardiale Strukturen („interne Defibrillation“ [automatischer Defibrillator, Energieabgabe über rechtsventrikulär platzierten Elektrodenkatheter]) abgegeben [42]. Die Flächenelektroden, die zur Reduktion des Übergangswiderstandes und zur Vermeidung von Hautreizungen mit Elektrolytgel beschichtet sein sollten, werden idealerweise im Bereich des rechten Sternalrandes unterhalb der Klavikula und im Bereich der Herzspitze in der mittleren Axillarlinie links positioniert. Zur Defibrillation wird die Herzmuskulatur von einem Gleichstromimpuls mit einer Dauer von etwa 10 ms durchströmt und führt somit zum „Reset“ der elektrischen Aktivität. Der exakte Mechanismus, der der Effektivität einer Defibrillation zugrunde liegt, ist bisher nicht in allen Einzelheiten geklärt, es ist aber bekannt, dass die Defibrillation zu einer Änderung der an den Zellmembranen existierenden elektrischen Potenzialen in der gesamten Herzmuskulatur oder zumindest in einem überwiegenden Teil der kardialen Muskulatur durch den Elektroschock führt [9]. Die dabei auf das Herz einwirkende Energie ist von Impedanz, Spannung und Stromstärke der Strukturen abhängig, die zwischen den Elektroden liegen. Seit der ersten Defibrillation 1947 durch Beck bei einem 14-jährigen Jungen und den ersten systematischen Arbeiten von Lown sind viele Untersuchungen durchgeführt worden, um die Frage der optimalen Schockform („biologische Wirksamkeit“) für die Defibrillation zu klären [7]. Die monophasische Schockform ist eine relativ einfache Impulskonfiguration, bei der Energieabgaben simultan (Dauer in der Regel 3,9–6,3 ms) oder sequentiell (zwei gleich lange und gleich große Impulse zu je 3,9 ms) erfolgen, ohne dass die Polarität des Impulses in irgendeiner Weise umgekehrt wird. Die biphasische Impulsform besteht aus zwei Phasen, einem positiven Anteil, der nach der Hälfte oder 2/3 der Impulsdauer endet und einem negativen Anteil, währenddessen die dann noch verbleibende Restenergie abgegeben wird. Tierexperimentelle Untersuchungen ergaben, dass der biphasische Schock mit höherer Ausgangsspannung und längerer Dauer der ersten Impulsabgabe günstiger war als biphasische Defibrillationsimpulse mit längerer und hochamplitudiger zweiter Phase [5, 14, 18, 25, 31]. Bei Patienten mit Kammerflimmern ist die einzige effektive Form der Behandlung die schnellstmögliche 54 Tab. 6 Klinische Studien zur externen Defibrillation bei Kammerflimmern H.-J. Trappe Autor Jahr Greene [21] Mittal [40] Higgins [23] Schneider [46] Bain [6] 1995 1999 2000 2000 2001 # Pt 171 184 115 115 118 Monophasisch Biphasisch Energie Erfolgsrate Energie Erfolgsrate 215 200 200 200 215 100% 93% 90% 67% 97% 171 120 200 150 171 100% 99% 100% 98% 100% J J J J J J J J J J J = Joule, Pt = Patienten, # = Anzahl Defibrillation, um das Leben dieser Patienten zu retten und die Erfolgsrate ist bei mono- und biphasischen Schockformen hoch (Tab. 6). In Ergänzung zu tierexperimentellen Befunden bei Kammerflimmern liegen klinische Beobachtungen bei Patienten mit Herz-Kreislauf-Stillstand vor, die auch zu Fragen der Wiederherstellung einer spontanen Zirkulation Stellung nahmen, und die eine deutlich höhere Rate erfolgreicher Defibrillationen bei 150 Joule biphasischer Schockabgabe zeigten als bei konventionellen monophasischen Impulsformen [13, 27, 47]. In einer von Schneider und Mitarbeitern [31] vorgestellten randomisierten, klinischen Untersuchung war die erfolgreiche Defibrillation bei Herz-Kreislauf-Stillstand mit 98% signifikant besser als bei monophasischer Impulsform, bei der die Erfolgsrate lediglich 67% betrug (p < 0,0001). Dieses ging einher mit einer deutlich höheren Wiederherstellung spontaner Zirkulation nach biphasischer Defibrillation (76%) im Vergleich zur monophasischen Schockabgabe (55%, p < 0,02) [31]. Man hat sich auch in den neuen Leitlinien zur Reanimation entschlossen, als orientierende Vorgabe einen biphasischen Schock von 200 Joule zu empfehlen [19]. Für den monophasischen Schock werden in Anbetracht der Unterlegenheit von Beginn an 360 Joule für jeden Schock vorgeschlagen. Schlussfolgerungen Die Behandlung bradykarder oder tachykarder Herzrhythmusstörungen muss in der Intensiv- und Not- fallmedizin schnell, zielgerichtet und sicher sein. Eine zögerliche, falsche oder unüberlegte Strategie kann zur Gefährdung, zu Nebenwirkungen oder zum Tod eines Patienten führen. Für die richtige Behandlung des Arrhythmiepatienten sind nur wenige Befunde notwendig, die in mehr als 90% zur richtigen Diagnose führen: eine sorgfältige klinische Untersuchung, die exakte Erhebung der hämodynamischen Situation und die systematische Interpretation des Oberflächen-Elektrokardiogramms. Es ist relativ einfach zu entscheiden, ob der Patient hämodynamisch stabil oder instabil ist, ob eine Brady- oder Tachykardie vorliegt, eine Tachykardie regelmäßig oder unregelmäßig ist, mit schmalen (QRS-Breite < 0,12 s) oder breiten (QRS-Breite ≥ 0,12 s) QRSKomplexen einhergeht oder ein Herz-Kreislauf-Stillstand durch Asystolie, pulsloser elektrischer Aktivität oder Kammerflimmern vorliegt. Das neue Konzept der „5A“ soll die notfallmäßige Arrhythmietherapie auf 5 Medikamente beschränken, die alle mit dem Anfangsbuchstaben „A“ beginnen und zur Behandlung aller Arrhythmien und bei Herz-KreislaufStillstand erfolgreich sind. Es handelt sich um Adenosin, Adrenalin, Ajmalin, Amiodaron und Atropin. Andere Maßnahmen, die als „ergänzende B, C und D-Strategie“ vorgestellt werden, können additiv verwendet werden. Es handelt sich um Betablocker, elektrische Cardioversion oder Defibrillation. Zahlreiche Studien zu den „5A“ sind in den vergangenen 20 Jahren publiziert worden und gewähren eine große therapeutische Sicherheit dieses neuen Behandlungskonzeptes. Literatur 1. Alpert JS (1997) Conduction disturbances: temporary and permanent pacing in patients with acute myocardial infarction. In: Gersh BJ, Rahimtoola SH (eds) Acute myocardial infarction. Chapman & Hall, New York, pp 354–367 2. Alt E, Ammer R, Schmitt C (1998) Ein Vergleich der Behandlung von Vorhofflimmern mit niedrig-energetischer intrakardialer Kardioversion und konventioneller externer Kardioversion. In: Bach R, Spitzer S (Hrsg) Aktuelle Trends in der invasiven Kardiologie. Akademische Verlagsgesellschaft AKA, Berlin, S 197–207 3. Antoni H, Weirich J (1996) Ursachen tachykarder Herzrhythmusstörungen. Internist 37:3–11 4. Arntz HR, Andresen D, Trappe HJ (2006) Pocket-Leitlinien Kardiopulmonale Reanimation. www.dgk.org Das Konzept der „5A“ für die Intensiv- und Notfallmedizin 5. Bain AC, Swerdlow CD, Love CJ, Ellenbogen KA, Deering TF, Bewer JE, Augostini RS, Tchou PJ (2001) Multicenter study of principles-based waveforms for external defibrillation. Ann Emerg Med 37:5–12 6. Balser JR, Martinez EA, Winters BD, Perdue PW, Clarke AW, Huang W, Tomaselli GF, Dorman T, Campbell K, Lipsett P, Breslow MJ, Rosenfeld BA (1998) Beta-adrenergic blockade accelerates conversion of postoperative supraventricular tachyarrhythmias. Anesthesiology 89:1052–1059 7. Beck CS, Pritchard WH, Feil HS (1947) Ventricular fibrillation of long duration abolished by electric shock. J Am Med Assoc 135:985–986 8. Behringer W, Kittler H, Sterz F et al (1998) Cumulative epinephrine dose during cardiopulmonary resuscitation and neurologic outcome. Ann Intern Med 129:450–456 9. Blanchard SM, Knisley SB, Walcott GP, Ideker RE (1994) Defibrillation waveforms. In: Singer I (eds) Implantable cardioverter defibrillator. Futura Publishing, New York, pp 153–178 10. Dick WF (2002) Die neuen internationalen Leitlinien zur kardiopulmonalen Reanimation in autorisierter Form des German Resuscitation Councils. Notfall & Rettungsmedizin 1:7–13 11. Dorian P, Cass D, Schwartz B et al (2002) Amiodarone as compared to Lidocaine for shock-resistant ventricular fibrillation. N Engl J Med 346: 884–890 12. Ewy GA (1998) Defibrillation and cardioversion. In: Brown DL (eds) Cardiac intensive care. WB Saunders Company, Philadelphia, pp 795–808 13. Gliner BE, Jorgenson DB, Poole JE (1998) Treatment of out-of-hospital cardiac arrest with a low-energy impedance-compensating biphasic waveform automatic external defibrillator. IEEE Biomed Intrum Technol 32:631– 644 14. Greene H, DiMarco J, Kudenchuk P, Scheinman M, Tang A, Reiter M, Echt D, Chapman P, Jazayeri M, Chapman F (1995) Comparison of monophasic and biphasic defibrillating pulse waveforms for transthoracic cardioversion. Am J Cardiol 75:1135–1139 15. Gueugniaud PY, Mols P, Goldstein P et al (1998) A comparison of repeated high doses and repeated standard doses of epinephrine for cardiac arrest outside age hospital. European Epinephrine Study Group. N Engl J Med 339:1595–1601 16. Heisel A, Jung J, Neuzner J, Michel U, Pitschner H (1997) Low-energy transvenous cardioversion of atrial fibrillation using a single lead atrial lead system. J Cardiovasc Electrophysiol 8:607–614 17. Herff H, Danninger T, Wenzel V, Lindner KH (2007) Kardiopulmonale Reanimation. In: Burchardi H, Larsen R, Kuhlen R, Jauch KW, Schölmerich J (Hrsg) Die Intensivmedizin, 10. überarb. u. erw. Aufl. Springer, Berlin Heidelberg New York, S 374–383 18. Higgins SL, Herre JM, Epstein AE, Greer GS, Friedmann PL, Gleva ML, Porterfield JG, Chapman FW, Finkel ES, Schmitt PW, Nova RC, Greene HK (2000) A comparison of biphasic and monophasic shocks for external defibrillation. Prehospital Emergency Care 4:305–313 19. International Liasion Committee on Resuscitation, ILCOR (2005) International consensus cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation 67: 157–337 20. Klingenheben T, Zeiher AM, Fichtlscherer S (2005) Reanimation nach prähospitalem Herz-Kreislauf-Stillstand. Internist 46:248–255 21. Kudenchuk PJ, Cobb LA, Copass MK et al (1999) Amiodarone for resuscitation after out-of-hospital cardiac arrest due to ventricular fibrillation. N Engl J Med 341:871–887 22. Kudenchuk P (2002) Advanced cardiac life support antiarrhythmic drugs. In: Kern KB (ed) Cardiology clinics – emergency cardiovascular care. WB Saunders, Philadelphia, pp 79–87 23. Manz M, Lüderitz B (1988) Vergleichende Untersuchung von Ajmalin und Lidocain bei ventrikulären Tachyarrhythmien. In: Lüderitz B, Antoni H (Hrsg) Perspektiven der Arrhythmiebehandlung. Springer, Berlin Heidelberg, S 88–96 24. Mayr V, Wenzel VD, Voelckel WG et al (2001) Randomised comparison of epinephrine and vasopressin in patients with out-of-hospital ventricular fibrillation. Lancet 349:535–537 25. Mittal S, Ayati S, Stein KM, Knight B, Morady F, Schwartman D, Cavlovich D, Platia E, Calkins H, Tcou P, Miller J, Wharton J, Sung R, Slotwiner D, Markowitz S, Lerman B (1999) Comparison of a novel rectilinear biphasic waveform with a damped sine wave monophasic waveform for transthoracic ventricular defibrillation. ZOLL investigators. J Am Coll Cardiol 34:1595–1601 55 26. Paradis NA, Wenzel V, Southall J (2002) Pressor drugs in the treatment of cardiac arrest. In: Kern KB (ed) Cardiology clinics – emergency cardiovascular care. WB Saunders, Philadelphia, pp 61–78 27. Poole JE, White RD, Kanz KG (1997) Low-energy impedance compensating biphasic waveforms terminate ventricular fibrillation at high rates in victims of out-of-hospital cardiac arrest. J Cardiovasc Electrophysiol 8: 1373–1385 28. Rosenbaum MB, Chiale PA, Ryba D, Elizari MV (1974) Control of tachyarrhythmias associated with Wolff-Parkinson-White syndrome by amiodarone hydrochloride. Am J Cardiol 34: 215–223 29. Rosenbaum MB, Chiale PA, Halpern MS, Nau GJ, Przybylski J, Levi RJ, Lazzari JO, Elizari MV (1976) Clinical efficacy as an antiarrhythmic agent. Am J Cardiol 38:934–944 30. Schauerte P, Näbauer M, Steinbeck G – aus dem Kompetenznetz Vorhofflimmern (2008) Einstellung der Kammerfrequenz bei persistierendem und permanentem Vorhofflimmern. Frequenzkontrolle. Klinikarzt 37:81–86 31. Schneider T, Martens PR, Paschen H, Kuisma M, Wolcke B, Gliner BE, Russell JK, Weaver D, Bossaert L, Chamberlain D (2000) Multicenter, randomized, controlled trial of 150-J biphasic compared with 200- to 360-J monophasic shocks in the resuscitation of out-of-hospital cardiac arrest victims. Circulation 102:1780–1787 32. Schuster HP, Trappe HJ (2005) EKGKurs für Isabel, 4. Aufl. Thieme, Stuttgart, S 236–276 33. Sievers B, Weismüller P, Trappe HJ (2002) Sind supraventrikuläre Reentrytachykardien durch den selektiven b-Blocker Esmolol (Breviblock) terminierbar? Intensivmed 39:529–536 34. Singh BN, Vaughan Williams EM (1970) The effect of amiodaron, a new anti-anginal drug, on cardiac muscle. Br J Pharmacol 39:657–667 35. Steven D, Lutomsky B, Rostock T, Willems S (2006) Moderne Pharmakotherapie bei supraventrikulären und ventrikulären Herzrhythmusstörungen. Ein update zur konventionellen Therapie. Internist 47:1013–1023 36. Trappe HJ (2007) Herzrhythmusstörungen. In: Burchardi H, Larsen R, Kuhlen R, Jauch KW, Schölmerich J (Hrsg) Die Intensivmedizin, 10. überarb. u. erw. Aufl. Springer, Berlin Heidelberg New York, S 430–443 37. Trappe HJ (2007) Elektrotherapie bei bradykarden oder tachykarden Rhythmusstörungen und akutem Koronarsyndrom. Intensivmed (im Druck) 56 38. Trappe HJ, Klein H, Lichtlen PR (1992) Ursachen des akuten Herz-KreislaufStillstandes. Internist 33:289–294 39. Trappe HJ (1997) Akuttherapie supraventrikulärer Tachykardien: Adenosin oder Ajmalin? Intensivmed 34:452– 461 40. Trappe HJ, Klein H, Lichtlen PR (1988) Akutbehandlung der stabilen Kammertachykardie: Ajmalin oder andere spezifische Antiarrhythmika? In: Antoni H, Meinertz T (Hrsg) Aspekte der medikamentösen Behandlung von Herzrhythmusstörungen. Springer, Berlin Heidelberg, S 2–9 41. Trappe HJ (1997) Akuttherapie supraventrikulärer Tachykardien: Adenosin oder Ajmalin? Intensivmed 34: 452–461 H.-J. Trappe: Das Konzept der „5A“ für die Intensiv- und Notfallmedizin 42. Walcott GP, Rollins DL, Smith WM, Ideker R (1996) Effect of changing capacitors between phases of a biphasic defibrillation shock. Pace 19: 945–954 43. Weismüller P, Heinroth KM, Werdan K, Trappe HJ (2001) Die Notfalltherapie bradykarder Herzrhythmusstörungen. In: Trappe HJ, Schuster HP (Hrsg) Die Notfalltherapie bei akuten Herzrhythmusstörungen. Steinkopff, Darmstadt, S 40–50 44. Weismüller P, Kattenbeck K, Heinroth KM, Ranke C, Trappe HJ (2000) Terminierung supraventrikulärer Tachykardien durch Adenosin – Vergleich der Wirkung von 12 und 18 mg. Dtsch Med WSchr 125:961–969 45. Wellens HJJ, Conover B (2006) The ECG in emergency decision making. 2nd ed. WB Saunders, Philadelphia, pp 1–281 46. Wenzel V, Krismer AC, Arntz HR et al (2004) European Resuscitation Council Vasopressor during Cardiopulmonary Resuscitation Study Group. A comparison of vasopressin and epinephrine for out-of-hospital cardiopulmonary resuscitation. N Engl J Med 350:105–113 47. White RD (1997) Early out-of-hospital experience with an impedance compensating low-energy biphasic waveform automatic external defibrillator. J Intervent Card Electrophysiol 1:203–208