Anorganisch-chemische Versuche
Werbung
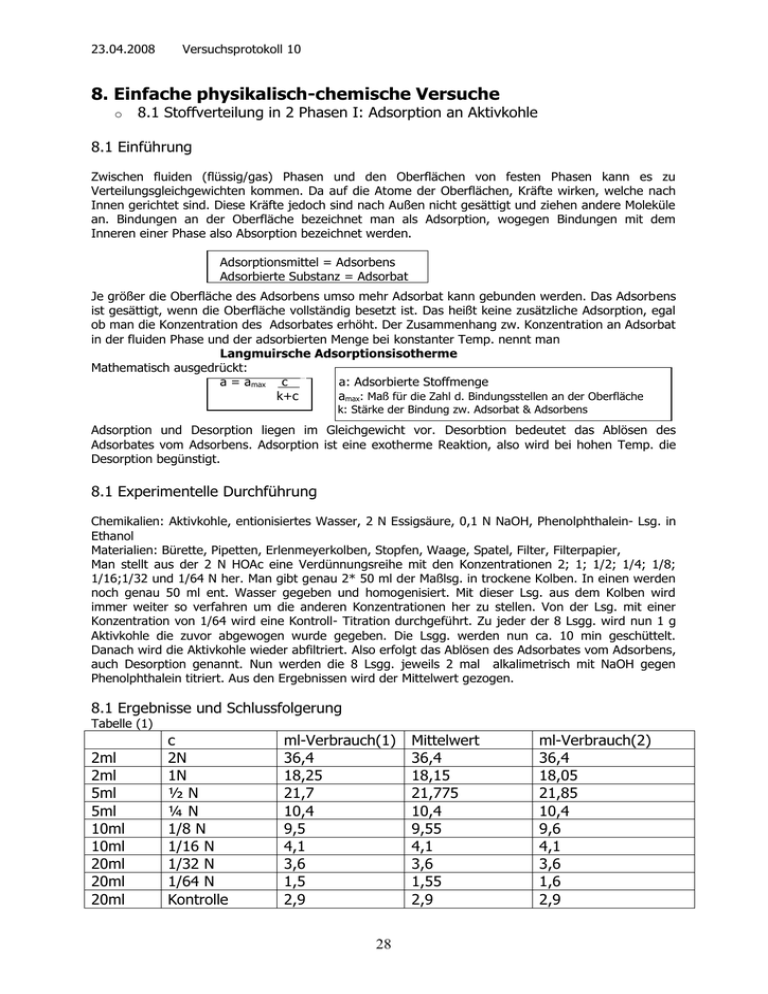
23.04.2008 Versuchsprotokoll 10 8. Einfache physikalisch-chemische Versuche o 8.1 Stoffverteilung in 2 Phasen I: Adsorption an Aktivkohle 8.1 Einführung Zwischen fluiden (flüssig/gas) Phasen und den Oberflächen von festen Phasen kann es zu Verteilungsgleichgewichten kommen. Da auf die Atome der Oberflächen, Kräfte wirken, welche nach Innen gerichtet sind. Diese Kräfte jedoch sind nach Außen nicht gesättigt und ziehen andere Moleküle an. Bindungen an der Oberfläche bezeichnet man als Adsorption, wogegen Bindungen mit dem Inneren einer Phase also Absorption bezeichnet werden. Adsorptionsmittel = Adsorbens Adsorbierte Substanz = Adsorbat Je größer die Oberfläche des Adsorbens umso mehr Adsorbat kann gebunden werden. Das Adsorbens ist gesättigt, wenn die Oberfläche vollständig besetzt ist. Das heißt keine zusätzliche Adsorption, egal ob man die Konzentration des Adsorbates erhöht. Der Zusammenhang zw. Konzentration an Adsorbat in der fluiden Phase und der adsorbierten Menge bei konstanter Temp. nennt man Langmuirsche Adsorptionsisotherme Mathematisch ausgedrückt: a = amax c 7 a: Adsorbierte Stoffmenge k+c amax: Maß für die Zahl d. Bindungsstellen an der Oberfläche k: Stärke der Bindung zw. Adsorbat & Adsorbens Adsorption und Desorption liegen im Gleichgewicht vor. Desorbtion bedeutet das Ablösen des Adsorbates vom Adsorbens. Adsorption ist eine exotherme Reaktion, also wird bei hohen Temp. die Desorption begünstigt. 8.1 Experimentelle Durchführung Chemikalien: Aktivkohle, entionisiertes Wasser, 2 N Essigsäure, 0,1 N NaOH, Phenolphthalein- Lsg. in Ethanol Materialien: Bürette, Pipetten, Erlenmeyerkolben, Stopfen, Waage, Spatel, Filter, Filterpapier, Man stellt aus der 2 N HOAc eine Verdünnungsreihe mit den Konzentrationen 2; 1; 1/2; 1/4; 1/8; 1/16;1/32 und 1/64 N her. Man gibt genau 2* 50 ml der Maßlsg. in trockene Kolben. In einen werden noch genau 50 ml ent. Wasser gegeben und homogenisiert. Mit dieser Lsg. aus dem Kolben wird immer weiter so verfahren um die anderen Konzentrationen her zu stellen. Von der Lsg. mit einer Konzentration von 1/64 wird eine Kontroll- Titration durchgeführt. Zu jeder der 8 Lsgg. wird nun 1 g Aktivkohle die zuvor abgewogen wurde gegeben. Die Lsgg. werden nun ca. 10 min geschüttelt. Danach wird die Aktivkohle wieder abfiltriert. Also erfolgt das Ablösen des Adsorbates vom Adsorbens, auch Desorption genannt. Nun werden die 8 Lsgg. jeweils 2 mal alkalimetrisch mit NaOH gegen Phenolphthalein titriert. Aus den Ergebnissen wird der Mittelwert gezogen. 8.1 Ergebnisse und Schlussfolgerung Tabelle (1) 2ml 2ml 5ml 5ml 10ml 10ml 20ml 20ml 20ml c 2N 1N ½N ¼N 1/8 N 1/16 N 1/32 N 1/64 N Kontrolle ml-Verbrauch(1) 36,4 18,25 21,7 10,4 9,5 4,1 3,6 1,5 2,9 28 Mittelwert 36,4 18,15 21,775 10,4 9,55 4,1 3,6 1,55 2,9 ml-Verbrauch(2) 36,4 18,05 21,85 10,4 9,6 4,1 3,6 1,6 2,9 23.04.2008 Versuchsprotokoll 10 Tabelle (2) c( HOAc)0 2,0 mol/l 1,0 mol/l 0,5 mol/l 0,25 mol/l 0,125 mol/l 0,0625 mol/l 0,03125 mol/l 0,015625 mol/l Kontrollle: 1/64 mol/l n(HOAc)0 100 mmol 50mmol 25mmol 12,5 mmol 6,25 mmol 3,125 mmol 1,5625 mmol 0,78125 mmol 0,78125 mmol n(HOAc)Gl.gew. 91 mmol 45,375 mmol 21,775 mmol 10,4 mmol 4,775 mmol 2,05 mmol 0,9 mmol 0,3875 mmol 0,725 mmol n(HOAc)ads. 9 mmol 4,625 mmol 3,225 mmol 2,1 mmol 1,475 mmol 1,075 mmol 0,6625 mmol 0,39375 mmol c(HOAc)Gl.gew. 1,82 mol/l 0,9075 mol/l 0,4355 mol/l 0,208 mol/l 0,0955 mol/l 0,041 mol/l 0,018 mol/l 0,00775 mol/l Diagramm (1) Langmuirsche Adsorptionsisotherme n(HOAc)ads. 10 9 8 7 6 5 4 3 2 1 0 0 0,25 0,5 0,75 1 1,25 1,5 1,75 2 c(HOAc)Gl. gew. Da unsere Kurve keiner Sättigungskurve entspricht ist es nicht möglich den Wert a max abzulesen und somit auch k zu bestimmen. Das unsere Kurve so ungenau ist, liegt vermutlich an der selbst erstellen Verdünnungsreihe oder an der Menge der Aktivkohle die hinzu gegeben wurde. Oder auch durch ungenaues arbeiten beim Titrieren. Literatur: H.Fleischer Praktikum Chemie für Biologen: Anorganische, Organische und Physikalische Chemie, Mainz, 2004 29











