Antragsformular - Landesärztekammer Rheinland
Werbung

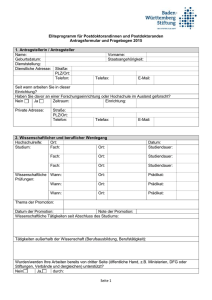
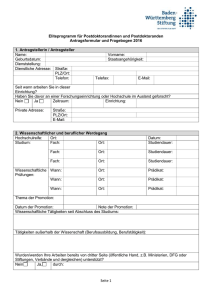
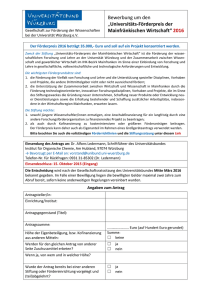
Zusammenfassung des wissenschaftlichen Studienprotokolls I. Allgemeine Angaben 1. Datum der Antragstellung 2. Titel des Forschungsvorhabens 3. Verantwortlicher Studienleiter / Ansprechpartner 4. Verantwortlicher Sponsor 5. Handelt es sich um eine multizentrische Studie? NEIN □ JA □ Ort der Durchführung des Forschungsvorhaben Sonstige Teilnehmer mit Orts- und Berufsangabe (lokale Studienärzte mit Angabe der Berufsbezeichnung und beruflicher Stellung) 6. Finanzierung a) Kostenträger des Forschungsvorhabens b) 7. Höhe des Probanden-Honorars, sofern ein solches gezahlt wird Wurde das Forschungsvorhaben bereits einer anderen Ethik-Kommission vorgelegt und, wenn ja, mit welchem Ergebnis ? (Votum beifügen) ja □ nein □ II. Allgemeine Planung 1. Geplanter Beginn und voraussichtliche Dauer des Forschungsvorhabens 2. Untersuchung an gesunden Probanden ja □ nein □ Anzahl stationär ja □ ambulant ja □ Dauer des Prüfvorhabens für den Einzelnen Untersuchung an Patienten ja □ nein □ Anzahl stationär ja □ ambulant ja □ Dauer des Prüfvorhabens für den Einzelnen 3. 4. 5. Handelt es sich um eine: diagnostische Prüfung ja □ nein □ therapeutische Prüfung ja □ nein □ Verträglichkeitsprüfung ja □ nein □ pharmakokinetische Prüfung ja □ nein □ Wirksamkeitsprüfung ja □ nein □ sonstige Prüfung (Grundlagenforschung, Aufklärung zur Pathogenese oder zur Prognose von Krankheiten, Ermittlung von Normalwerten) Darstellung des Studiendesigns (z.B. verblindet? randomisiert? plazebokontrolliert?) 1 6. Bei Forschungsvorhaben, bei denen Arzneimittel eingesetzt werden, angeben, ob die Arzneimittel zugelassen, aber neue Indikation ja □ nein □ zugelassen, aber neue Dosierung ja □ nein □ zugelassen, aber neue Applikationsform ja □ nein □ 7. Bei Prüfungen, in denen Medizinprodukte eingesetzt werden, angeben, ob eine CE-Kennzeichnung für den geplanten Einsatz vorliegt ja □ nein □ 8. Hat eine biostatistische Beratung stattgefunden? ja □ nein □ III. Auswahl der Probanden/Patienten 1. Nehmen nur Männer (ja □), nur Frauen (ja □), Männer und Frauen (ja □) an der Studie teil? 2. Geben Sie den Altersbereich der Studienteilnehmer an: von bis Jahre 3. Werden Minderjährige an der Studie teilnehmen (Altersbereich angeben)? ja □ nein □ von bis Monate/Jahre (Unzutreffendes streichen) 4. Werden Patienten eingeschlossen, bei denen Zweifel an der Einsichtsfähigkeit bestehen bzw. die Einsichtsfähigkeit nicht vorliegt ? ja □ nein □ 5. Werden Patienten mit fehlender Einwilligungsfähigkeit in das Forschungsvorhaben aufgenommen? ja □ nein □ Liegt eine gesetzliche Betreuung vor? ja □ nein □ IV. Ablauf 1. Auflistung der Maßnahmen, die ausschließlich aus Studiengründen durchgeführt werden 2. Erfolgt während der Studie eine Strahlenanwendung (siehe Anlage)? ja □ nein □ 3. Wie werden die Daten erhoben und gespeichert? Anonym (d.h. ohne Personenbezug) Pseudonymisiert (d.h. codiert, personenbeziehbar) Wenn ja: Erfolgt eine Weitergabe an Dritte? ja □ nein □ ja □ nein □ ja □ nein □ Werden Namen und/oder Kontaktdaten erfasst? Wenn ja: Erfolgt eine Weitergabe an Dritte? ja □ nein □ ja □ nein □ 4. Liegt eine Stellungnahme des/der Datenschutzbeauftragten vor? 2 ja □ nein □ 5. Wird im Rahmen der Studie Biomaterial gewonnen? ja □ nein □ Wird Biomaterial an Dritte weitergegeben? ja □ nein □ pseudonymisiert? anonymisiert oder doppelt kodiert? ja □ nein □ ja □ nein □ 3 V. Ethisch-rechtliche Aspekte 1) Dient das Forschungsvorhaben unmittelbar dem Interesse der Patienten? ja □ nein □ einem rein wissenschaftlichen Ziel? ja □ nein □ der künftigen Entwicklung von diagnostischen und therapeutischen Verfahren? ja □ nein □ der Gewinnung von Erkenntnissen über Pathogenese und Prognose von Krankheiten? ja □ nein □ der Gewinnung von Erkenntnissen über sozialmedizinische Probleme? ja □ nein □ ausschließlich der lokalen Qualitätssicherung? ja □ nein □ (Wenn JA ist kein Antrag bei der Ethik-Kommission zu stellen, da diese nur für wissenschaftsgetriebene Forschungsvorhaben zuständig ist der Versorgungsforschung? ja □ nein □ 2. Bestehen Risiken/Belastungen für die Probanden/Patienten? Welche? ja □ nein □ 3. Ergeben sich Vorteile für die Studienteilnehmer? Welche? ja □ nein □ 4. Besteht neben der Haftpflichtversicherung der Einrichtung und des durchführenden Arztes/Ärztin ein zusätzlicher Versicherungsschutz ? ja □ nein □ 5. Wurden ähnliche Forschungsvorhaben oder vergleichbare Untersuchungen mit der Prüfsubstanz bereits durchgeführt? ja □ nein □ Wenn ja, mit welchem Ergebnis ? 6. Wird ein Proband-/Patientenausweis ausgestellt? 7. Wird der weiterbehandelnde Arzt (in der Regel der Hausarzt) über die Teilnahme seines Patienten an dem Forschungsvorhaben informiert? ja □ nein □ ja □ nein □ ……………………………….. Ort, Datum ………………………………………………. Unterschrift (Antragsteller) ……………………………….. Ort, Datum ………………………………………………. Unterschrift (Leiter der Einrichtung) 4