31P-2D-CSI Untersuchung des Herzstoffwechsels an Patienten mit
Werbung

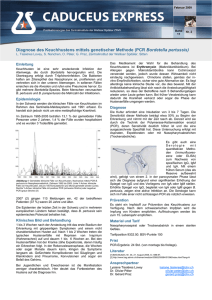
31P-2D-CSI Untersuchung des Herzstoffwechsels an Patienten mit verschiedenen Herzerkrankungen Rzanny1 R, Hansch2 A, Heyne2 J-P, Leder3 U, Kaiser2 WA, Reichenbach1 JR 1 AG Medizinische Physik, Institut für Diagnostische und Interventionelle Radiologie, 2 Institut für Diagnostische und Interventionelle Radiologie, 3Klinik für Innere Medizin, Universitätsklinikum der Friedrich-Schiller-Universität Jena EINLEITUNG Die 31P-MRS (Magnet-Resonanz-Spektroskopie) ist eine Methode, mit der Konzentrationsänderungen der Hochenergiephosphate (HEP) und somit Störungen des Energiestoffwechsels nichtinvasiv erfasst werden können. Da Phosphokreatin (PCr) im Rahmen des Energiestoffwechsels sowohl wichtige Speicher- als auch Transportfunktionen erfüllt, führen Störungen des Energiestoffwechsels meist auch zu Änderungen der PCr-Konzentration. In verschiedenen Studien zur Untersuchung von Herzerkrankungen mit der 31PMRS wurden daher ebenfalls Änderungen der PCr-Konzentration beobachtet [1-3]. Die 31P-MRS kann somit wichtige Zusatzinformationen für die Beurteilung der Schwere von Herzerkrankungen liefern. Nachteile, wie eine geringe räumliche Auflösung und ein geringes SNR konnten durch neue Techniken wie die SLOOP-Technik (Spatial Localization with Optimal Pointspread Function) oder durch Protonenentkopplung (Overhausereffekt) verringert werden [3, 4]. Diese Techniken sind jedoch noch nicht sehr verbreitet und erfordern besondere Hard- und Softwarevoraussetzungen. Ziel dieser Studie ist es daher, mit konventioneller 31P-CSI-Technik (Chemical Shift Imaging) zu untersuchen, ob bei Patienten mit verschiedenen Herzerkrankungen der PCr/ATP Quotient verringert ist und ob sich hieraus Aussagen über die Schwere der Erkrankung ableiten lassen. Es sollte weiterhin untersucht werden, ob die ermittelten Quotienten mit der linksventrikulären Ejektionsfraktion (LVEF) korrelieren. MATERIAL UND METHODE Insgesamt wurden 67 Patienten und 20 gesunde Probanden (mittleres Alter: 35 ± 11 Jahre) mit einer 31P-CSISequenz (8x8 Matrix, NEX=8, TR/TE/=600 ms/250 ms/90°) an einem 1,5 T MRT (Magnetom Vision, Siemens) untersucht. Bei 20 Patienten wurde eine dilatative Kardiomyopathie (DCM) diagnostiziert (Alter: 51±12 Jahre), 35 Patienten litten an einer hypertonen Herzerkrankung (HHD; Alter: 64±10 Jahre), 7 Patienten an einer ischämischen Kardiomyopathie (iCMP, Alter: 62±16 Jahre) und 4 Patienten hatten eine Myokarditis (MyoC, Alter: 27±13 Jahre). Die Diagnose erfolgte auf Basis der Krankengeschichte, physikalischer Untersuchungen sowie einer Echokardiographie und einer Herzkatheder-Untersuchung. Die Positionierung des spektroskopisch erfassten Volumens erfolgte an zuvor akquirierten T1-gewichteten Schnittbildern. Bildgebung und Spektroskopie wurden mit einer doppelt abgestimmte 1H/31P-Herz/Leber-Oberflächenspule der Firma Siemens durchgeführt. Bei der räumlichen Rekonstruktion erfolgte eine Interpolation der mit der CSI gemessenen Voxelgröße von 40x40x100 mm3 auf 20x20x100 mm3. Die Auswertung der Spektren erfolgte mit der implementierten Scanner-Software (Luise VB33A). Hierbei wurde die Messwertanzahl des FID-Signals (free induction decay) durch Anfügen von Nullen (zero filling) auf das Zweifache erweitert (2048). Zur Verbesserung des SNR wurde das FID mit einer exponentiellen Apodisationsfunktion multipliziert (I=I0exp(-t/a), mit a=120 ms). Vor der Quantifizierung durch Anpassung von Lorentzprofilen an das Originalspektrum erfolgte eine polynomische Basislinienkorrektur. Für die statistische Datenanalyse wurde die SPSS-Software (SPSS Inc. Chicago; Vers. 10.0.5) verwendet. Tab.1 Vergleich der Quotienten für PCr/-ATP, PDE/-ATP, 2,3 und 2,3-DPG/-ATP sowie der LVEF Werte zwischen gesunden Kontrollpersonen (e) und Patienten mit DCM (a), HHD (b), iCMP (c) sowie mit MyoC (d). Die Standardabweichungen sind hinter den Mittelwerten in Klammern angegeben. Die letzten vier Spalten enthalten die Ergebnisse der Signifikanzprüfung der Gruppenunterschiede zwischen Patienten und Kontrollen mit dem Mann-Whitney-U-Test. DCM (a) (N=20) HHD (b) (N=35) iCMP (c) (N=7) MyoK (d) (N=4) Ko (e) (N=20) PCr/-ATP 1,45 (0,42) 1,57 (0,25) 2,47 (0,47) 1,70 (0,60) PDE/-ATP 1,19 (0,71) 0,75 (0,57) 0,61 (0,32) 2,3-DPG/ -ATP 1,28 (0,83) 1,10 (0,61) 31 (11) 51 (18) LVEF p (Mann-Whitney-Test) a-e b-e c-e d-e 2,05 (0,18) <0,000 <0,000 0,019 0,135 0,87 (0,30) 1,11 (0,42) 0,640 0,048 0,002 0,273 1,67 (1,03) 0,93 (0,43) 1,02 (0,39) 0,738 0,536 0,176 0,737 39 (17) 47 (12) ERGEBNISSE Ein Vergleich der in Tab. 1 aufgelisteten mittleren PCr/-ATP Quotienten zwischen Patienten und gesunden Kontrollpersonen zeigt eine signifikante Verringerung bei Patienten mit DCM und HHD. Während bei Patienten mit MyoC die Verringerung schwächer ausgeprägt und der Unterschied auf Grund der geringeren Patientenzahl nicht signifikant ist (p>0,05), liegt der Wert bei Patienten mit iCMP sogar etwas über dem Mittelwert gesunder Kontrollpersonen. Ein Vergleich zwischen PCr/-ATP Quotienten und LVEF Werten ergab für DCM Patienten bei abnehmender LVEF auch eine Verringerung der PCr/-ATP Quotienten (Abb. 1a). Bei anderen Patienten wurde dagegen keine (iCMP, MyoC) oder nur eine schwache (HHD) Korrelation festgestellt (Abb. 1b). Neben Änderungen der PCr/-ATP Quotienten wurden auch Abweichungen der PDE/-ATP Quotienten von Patienten gegenüber Referenzwerten von gesunden Kontrollpersonen gefunden. Signifikant verringerte mittlere PDE/ATP Quotienten wurden bei Patienten mit HHD und iCMP gefunden. Bei Patienten mit MyoC war die Verringerung schwächer und nichtsignifikant und bei DCM Patienten lagen die Werte geringfügig höher. Wie in Abb. 1d dargestellt, zeigten die PDE/-ATP Quotienten bei HHD Patienten mit abnehmenden LVEF Werten ebenfalls eine Verringerung, während bei Patienten mit iCMP und MyoC wiederum keine Änderung beobachtet wurde. Bei DCM Patienten nehmen die PDE/-ATP Quotienten dagegen bei abnehmenden LVEF Werten zu. 3,5 Abb. 1. mDCM Modell-Reg R2=0.47; Co PCr / -ATP - HHD HHK HHKd Modell-Reg Co 3,0 p=0.01 2,5 R2=0.05; p=0.24 2,5 PCr/-ATP PCr/-ATP Korrelation der PCr/-ATP (a) und PDE/-ATP Quotienten (b) mit den LVEF Werten bei Patienten mit DCM und HHD (c, d) mit eingezeichneter Regressionsgrade. 3,5 PCr / -ATP - DCM sDCM 3,0 2,0 1,5 1,0 2,0 1,5 1,0 0,5 0,5 a) 0,0 0 c) 0,0 10 20 30 40 50 60 70 80 0 10 20 30 40 LVEF 3,5 3,0 60 70 80 PDE / -ATP - HHD HHK-SD HHK-D Modell-Reg Co 3,0 R2=0.16; p=0.08 R2=0.11; p=0.07 2,5 PDE/ -ATP 2,5 PDE/ -ATP 50 LVEF 3,5 PDE / -ATP - DCM sDCM mDCM Modell-Reg 2,0 1,5 1,0 2,0 1,5 1,0 0,5 0,5 b) 0,0 d) 0,0 0 10 20 30 40 50 60 70 80 LVEF 0 10 20 30 40 50 60 70 80 LVEF DISKUSSION Die bei DCM Patienten am stärksten ausgeprägte Verringerung der PCr/-ATP Quotienten sowie die Korrelation mit den LVEF Werten sprechen für eine starke Schädigung des Herzmuskelgewebes durch Fibrose und Destruktion der Myozyten. Mit zunehmender Schwere der Erkrankung, ausgedrückt durch funktionelle Defizite in Form verringerter LVEF Werte, verringern sich auch die PCr/-ATP Quotienten. Die Erhöhung der PDE/ATP Quotienten mit abnehmenden LVEF Werten kann mit einer steigendem Konzentration der Membranabbauprodukten bei Zunahme degenerativer Prozesse erklärt werden. Die Verringerung der PCr/-ATP Quotienten ist bei HHD Patienten zwar ebenfalls signifikant, aber schwächer ausgeprägt und zeigt keine Korrelation mit den LVEF Werten. Die höheren PCr/-ATP Quotienten und die schwache Korrelation mit den LVEF Werten sprechen für eine geringere Bedeutung degenerativer Prozesse bei HHD Patienten. Die Interpretation der PDE Werte ist schwierig, da diese einerseits als Membranabbauprodukte degenerative Prozesse anzeigen, andererseits aber auch eine Hemmung dieser Prozesse bewirken [5]. Verringerte PDE Konzentrationen könnten daher ein Hinweis auf eine Verlangsamung der Membranumbauprozesse („turnover“) sein. Wegen des größeren Altersunterschiedes zu den Kontrollpersonen und altersbedingten Stoffwechselveränderungen ist bei HHD Patienten allerdings keine eindeutige Aussage möglich [6]. Bei Patienten mit MyoC wurde wie bei HHD Patienten eine Verringerung der PCr/-ATP und PDE/-ATP Quotienten gefunden, die aber geringer ausfiel Patienten mit HHD. Die höheren PCr/-ATP Quotienten bei iCMP könnten dadurch erklärt werden, dass bei schwacher Minderperfusion oder kurzer Dauer der ischämischen Störung durch Verringerung des Energieverbrauchs die Homeostase und damit die Konzentrationen der HEP kurzfristig wiederhergestellt werden kann. Bei wiederholten schwächeren ischämischen Störungen ist sogar ein Anstieg der PCr-Konzentration über den Normalwert möglich (PCr overshoot) [7]. LITERATUR [1] Masuda Y et al. 1992 Jpn Circ J. 1992 Jun;56(6):620-6. [2] Neubauer S et al. 1997 Circulation 96:2190−2196 [3] Beer M 2004 Eur Radiol 14(6):1034–1047 [4] Jung WI et al. 1998 Circulation 97:2536–2542 [5] Burt CT et al. Comp Biochem Physiol Biochem Mol Biol 108(1):11−20 [6] Schunk K et al. Invest Radiol 34(2):116−125 [7] Kaplan LJ et al. Biochimie (1995) 77, 245-248