Löslichkeit von Salz in Wasser
Werbung

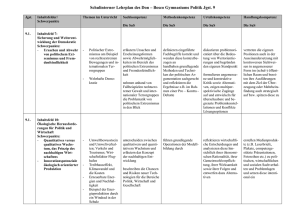
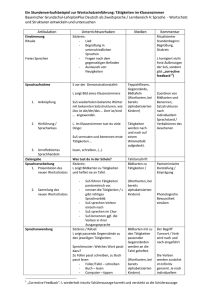
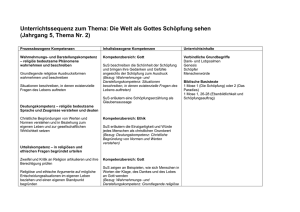
Löslichkeit von Salz in Wasser Einführung in die quantitative Betrachtung der Löslichkeit am Beispiel von Natriumchlorid und Natriumnitrat Stundenziele: Die Schüler und Schülerinnen (SuS) sollen erkennen, dass man die Löslichkeit eines Feststoffes nicht nur qualitativ, sondern auch quantitativ beschreiben kann, einen experimentellen Ansatz beschreiben können, mit dem die Löslichkeit eines Feststoffes ungefähr ermittelt werden kann, diesen experimentelle Ansatz durchführen können, erkennen, dass ein Stoff über seine Löslichkeit charakterisiert werden kann. Stellung der Stunde in der Reihe Die SuS haben in Rahmen der Reihe Stoffe und Stoffeigenschaften bisher die Stoffeigenschaften Farbe, Geruch, Härte, elektrische Leitfähigkeit, Verhalten gegenüber Magneten, Verhalten beim Erhitzen und auf qualitativer Ebene die Löslichkeit kennengelernt. Die Charakterisierung in löslich und nichtlöslich wurde eingeführt bei der Untersuchung des Verhaltens verschiedener Stoffe bei der Zugabe von Wasser. In den vorangegangenen Stunden haben die SuS für verschiedene Stoffe steckbriefartig die verschiedenen Eigenschaften zusammengestellt und erkannt, dass man einzelne Stoffe aufgrund verschiedener Eigenschaften voneinander unterscheiden kann. Sie wissen aber auch, dass sich einige Stoffe, wie z.B. Natriumchlorid und Natriumnitrat so ähneln, dass sie nicht aufgrund der den SuS bekannten Eigenschaften zu unterscheiden sind. Mit der quantitativen Betachtung der Löslichkeit lernen die SuS in der heutigen Stunde eine weitere Stoffeigenschaft kennen, die ihnen eine zusätzliche Möglichkeit liefert, Stoffe zu charakterisieren. Im Rahmen der Reihe schließen sich noch Schmelz- und Siedetemperaturen (in Verbindungen mit den Aggregatzustände) und die Dichte an, die allesamt weitere spezifische Stoffeigenschaften darstellen und den SuS Charakterisierungsmerkmale für Stoffe liefern. Didaktische Überlegungen Die quantitative Betrachtung der Löslichkeit bietet Anknüpfungspunkte für weitere Lerninhalte, wie der Bewertung des Sauerstoffgetränks Active O2, mit denen die SuS im Verlauf des späteren Chemieunterrichts konfrontiert werden. Zum einen kann nach der Erarbeitung der quantitativen Angabe der Löslichkeit auch die Massenkonzentration von Lösungen eingeführt werden, die in der Erfahrungswelt der SuS eine Rolle spielt, z.B. auf Lebensmittelpackungen. Desweiteren wird der Grundstein gelegt für die Prinzipien des Auskristallisierens und des Eindampfens, da beide Vorgänge durch eine Überschreitung der Sättigungskonzentration ausgelöst werden. Um den Begriff der Löslichkeit nicht zu unübersichtlich werden zu lassen, beschränken sich die in der letzten und der heutigen Stunde angestellten Überlegungen nur auf Feststoffe. Das Löslichkeitsverhalten von Gasen und Flüssigkeiten kann an anderer Stelle thematisiert werden. Für die SuS sind Feststoffe im Lösungsmittel Wasser bisher nur löslich oder nichtlöslich. Um zu einer quantitativen Betrachtung der Löslichkeit zu kommen und diese als spezifische Stoffeigenschaft zu erkennen, müssen die SuS folgende gedankliche Schritte durchlaufen: Sie müssen erkennen, dass die Löslichkeit von bisher als wasserlöslich charakterisierten Stoffen nicht unbegrenzt ist. sie müssen erkennen, dass sich diese Begrenztheit quantitativ fassen läßt. abschließend müssen sie erkennen, dass die Löslichkeitsgrenze für verschiedene Stoffe unterschiedlich ist und somit eine Stoffeigenschaft darstellt, die zur Unterscheidung von Stoffen genutzt werden kann. Beim ersten gedanklichen Schritt geht es bei den meisten SuS darum, eine ihnen im Prinzip bekannte Tatsache bewußt zu machen und mit dem im Unterricht erworbenen Wissen zu verknüpfen. Vermutlich kennen viele bereits die Tatsache, dass sich beispielsweise Zucker nicht unbegrenzt in Kaffee löst und haben die Begrenztheit eines als wasserlöslich bekannten Stoffes schon erfahren. Ein Weg, ihnen diese Begrenztheit im Unterricht vor Augen zu führen, stellt die Konfrontation mit einer gesättigten Lösung eines ihnen als wasserlöslich bekannten Stoffes dar. Eine solche Lösung bildet einen formalen Widerspruch zu der bisher im Unterricht gemachten Erfahrung und regt die SuS zum Nachdenken an. Allerdings sollte es für die SuS aufgrund ihrer Alltagserfahrung möglich sein, diesen scheinbaren Widerspruch zu erklären. Die quantitative Beschreibung der Löslichkeit läßt sich am Anschaulichsten über ein Experiment erkennen, welches die SuS selbst durchführen können. Dabei wird einer bestimmten Menge Wasser portionsweise der entsprechende Feststoff zugefügt, bis er sich nicht mehr löst. Damit aus dem Experiment quantitative Schlüsse zu ziehen sind, werden die Massen des Feststoffes und des Wassers erfasst. Wenn die SuS über dies hinaus noch erkennen sollen, dass die Löslichkeit für verschiedene Feststoffe unterschiedlich ist, müssen zwangsläufig verschiedene Feststoffe untersucht werden. Dabei reichen zwei Feststoffe aus, die als Beispiel herangezogen werden können. Diese Feststoffe müssen folgende Kriterien erfüllen: Sie müssen für Schülerexperimente hinsichtlich ihrer Gefährlichkeit zugelassen sein Die Löslichkeit der beiden Stoffe muß derart differieren, dass auch bei ungenauem Arbeiten noch eindeutige Ergebnisse ermittelt werden. Die Stoffe sollten schon von den SuS untersucht und als wasserlöslich charakterisiert sein. Die Stoffe sollten ähnliche Dichten aufweisen. Dies ist notwendig, da den SuS der Begriff der Dichte noch nicht bekannt ist. Es wäre für sie eventuell verwirrend, wenn gleiche Massen von verschiedenen Stoffen deutlich unterschiedliche Volumina einnehmen. Aufgrund dieser Anforderungen habe ich mich für die beiden Stoffe Natriumchlorid und Natriumnitrat entschieden. Ersteres weist eine Wasserlöslichkeit von 360g/l (20°C) und eine Dichte von 2,16g/cm³ auf, letzteres hat eine Wasserlöslichkeit von 880g/l (20°C) und eine Dichte von 2,26 g/cm³. Beide sind für den Schülerversuch in der SI zugelassen. Um den letzten gedanklichen Schritt vollziehen zu können, müssen die SuS die ermittelten Löslichkeitsgrenzen als Stoffeigenschaft erkennen. Dabei könnte es ihnen hilfreich sein, wenn sie mit einer ihnen bekannten Tabelle konfrontiert werden, in der sie selbst Stoffe als löslich/unlöslich klassifiziert haben. Damit ist einzusehen, dass die Stoffe anhand der Menge, die sich von ihnen in Wasser löst, genauer klassifiziert werden können. Wenn die SuS diese Einsicht erhalten, wird ihnen auch der Zusammenhang der Stunde mit den bisherigen Stunden zu Stoffen und Stoffeigenschaften klar. Um die Erfahrungswelt der SuS mit einzubeziehen und somit den Chemieunterricht mit den Alltagserfahrungen der SuS zu verknüpfen, wird als Beispiel für eine gesättigte Kochsalzlösung das Tote Meer angesprochen. Allerdings muß dabei dann im Sinne einer Elementarisierung vernachlässigt werden, dass im Wasser des Toten Meeres noch andere Salze gelöst sind. Die Sättigung läßt sich recht eindrucksvoll anhand geeigneter Fotos demonstrieren. Es wäre natürlich wünschenswert, die von den SuS experimentell ermittelten Werte mit den tatsächlichen Werten zu vergleichen und den SuS so zu einem Erfolgserlebnis zu verhelfen. Dies erscheint mir bei genauerem Hinsehen aber nicht als sinnvoll, da im Toten Meer neben Natriumchlorid noch große Mengen Magnesiumchlorid und Calciumchlorid gelöst sind. Aufgrund der somit zusätzlich vorhandenen Chloridionen ergibt sich eine deutlich niedrigere Sättigungskonzentration für Natriumchlorid als die von den SuS ermittelte - ein Vergleich sollte entfallen. Methodische Analyse Die Stunde beginnt mit einer Folie vom Toten Meer, auf der man große Mengen ungelösten Salzes erkennt. Die SuS erhalten zunächst die Möglichkeit, sich zu der Folie zu äußern. Möglicherweise wissen einige SuS, dass es sich bei den Ablagerungen um Salz handelt, ansonsten wird diese Information von der Lehrerseite eingebracht. Anschließend wird im Unterrichtsgespräch thematisiert, warum sich das Salz, welches bisher als wasserlöslich bekannt ist, trotz der großen Mengen Wasser nicht löst. In dieser Phase soll die Begrenztheit der Löslichkeit herausgearbeitet werden. Diese Begrenztheit kann dann auf andere Stoffe, die den SuS als wasserlöslich bekannt sind, übertragen werden. An dieser Stelle besteht allerdings zugleich die Gefahr, dass die SuS den roten Faden der Stunde aus den Augen verlieren. Deshalb wird eine Folie aus der letzten Stunde verwendet, auf der das Verhalten von Stoffen gegenüber Wasser beschrieben wird. Die SuS können anhand der Folie erkennen, dass es nicht allein ausreicht, Stoffe als löslich/nichtlöslich zu klassifizieren. Auch für die anderen wasserlöslichen Stoffe können sie die Begrenztheit der Löslichkeit postulieren. Auf diese Weise soll die zentrale Frage der Stunde herausgearbeitet werden: Welche Mengen der jeweiligen Stoffe (hier Salze) lassen sich in Wasser lösen. In der anschließenden Phase sollen sie Überlegungen experimentell überprüft werden. Dazu sollen die SuS Ansätze entwickeln, mit denen die Löslichkeit von Feststoffen überprüft werden kann. Im Prinzip sollten diese Ansätze darauf hinaus laufen, dass von einem Feststoff immer mehr in eine konstante Menge Wasser gegeben wird, bis sich nichts mehr löst. Sollten die SuS nicht erkennen, dass die Menge an Wasser in jedem Versuch gleich sein muß, kann dies von Lehrerseite provoziert werden, in dem z.B. den SuS sehr verschieden große wassergefüllte Gefäße für den Versuch angeboten werden. Die anschließende experimentelle Untersuchung der Löslichkeit von Natriumchlorid und Natriumnitrat wird als Schülergruppenexperiment durchgeführt, um eine möglichst große Schüleraktivität zu erhalten. Der Unerfahrenheit der SuS des Anfangsunterrichtes wird dabei Rechnung getragen, in dem der Versuch auf einem Arbeitsblatt kleinschrittig beschrieben ist. Zudem sind die erforderlichen Mengen an Wasser in Spritzen bereitgestellt sowie die Stoffportionen der Salze schon abgewogen und werden den SuS gebrauchsfertig zur Verfügung gestellt. Die SuS sollen in einem Reagenzglas Grammportionen der Salze sukzessive in jeweils 5 Gramm Wasser lösen. Dies ist im Vergleich zum Versuch in einem Becherglas mit mehr Wasser material- und zeitsparend. Die Ergebnisse werden auf Folie festgehalten. Die SuS sollen versuchen, den Begriff der Löslichkeit genauer zu fassen und er wird in Form eines Merksatzes festgehalten. Am Ende der Stunde kann noch einmal die Folie mit dem toten Meer aufgelegt werden, um den SuS den Zusammenhang der Unterrichtsthematik mit der Welt außerhalb des Chemiesaals vor Augen zu führen. Dabei können die SuS schnell zu der Überlegung gelangen, dass aufgrund des hohen Salzgehaltes im Toten Meer kein Leben möglich ist. Skizze des geplanten Unterrichtsverlaufs: Einführung in die quantitative Betrachtung der Löslichkeit Phase Einstieg Hypothesenbildung Vertiefung Erarbeitung Inhalt Präsentation eines Fotos vom Toten Meer Mögliche Impulse: Was sieht man im Hintergrund? Das Foto ist aus einem Bildband aus Israel Infos über die Größe des toten Meeres und die große Menge an vorhandenem Wasser. Natriumchlorid ist nur begrenzt löslich. Mögliche Impulse: Was habt ihr in der letzten Stunde über Natriumchlorid herausgefunden? Warum löst sich (als wasserlöslich bekanntes) Natriumchlorid nicht auf? Verallgemeinerung - könnte das auch für andere Stoffe gelten? Wieviel eines Feststoffes ist löslich? Medium/Methode 1. OHP- Folie Lehr-/Lernorg. Unterrichtsgespräch Ein Alltagsbezug soll hergestellt werden erwartete Lernschwierigkeiten Falls die SuS nicht wissen, dass es sich bei den Ablagerungen um Natriumchlorid handelt, muß diese Information vom Lehrer gegeben werden 2. OHP Folie Unterrichtsgespräch Tafel 1 [Thema der Stunde und erste Feststellung] Scheinbarer Widerspruch wird formuliert. Die SuS erkennen, dass sich nur eine begrenzte Menge Natriumchlorid in Wasser löst. 2. OHP-Folie Tafel 2 [Fragestellung] Problemfrage wird formuliert: Den SuS könnte eventuell der Welche Menge eines Feststof- Sinn der Verallgemeinerung nicht klar werden, dann muß fes löst sich in Wasser ? noch mal zusammengefaßt werden, was wir bisher über die Löslichkeit von Stoffen wissen und was wir nun erfahren wollen. Wenn den SuS nicht klar ist, dass man die Wassermenge konstant hält, können provozierend sehr unterschiedlich große Mengen Wasser angeboten werden, die offensichtDie einzelnen Arbeitsschritte lich einen Vergleich der Verund die Sicherheitsaspekte Experimentellen Ansatz entwickeln, mit Die SuS üben sich dem man herausfindet, welche Menge darin, Versuche zu eines Feststoffes sich in Wasser löst planen. Unterrichtsgespräch Unterrichtsgespräch Arbeitsblatt verteilen und besprechen. Die Löslichkeiten von Natriumchlorid Kommentar Schülergruppenexpe- Skizze des geplanten Unterrichtsverlaufs: Einführung in die quantitative Betrachtung der Löslichkeit Phase Inhalt Medium/Methode und Natriumnitrat werden im Experiment bestimmt Sicherung Vertiefung Ergebnisse werden auf Folie festgehalten und ausgewertet. Löslichkeit wird weiter definiert als bisher. Die Löslichkeit gibt nicht nur an, ob ein Stoff sich in Wasser löst, sondern wieviel davon sich lösen Verknüpfung der Ergebnisse mit der Reihe. Löslichkeit ist eine Stoffeigenschaft - was haben wir davon, diese Stoffeigenschaft zu kennen Schlußzusammenfassung Warum heißt das Meer Totes Meer? Lehr-/Lernorg. riment Folie Tafel 3 Kommentar werden thematisiert. Unterrichtsgespräch Unterrichtsgespräch SuS erkennen Löslichkeit als Stoffeigenschaft. Die SuS reflektieren Ergebnis der Stunde und setzen es in Zusammenhang mit ihren Erfahrungen. erwartete Lernschwierigkeiten suche nicht zulassen. Damit die Vorgehensweise allen klar ist, wird sie zusammengefaßt Klasse 7_ Name _____________ Chemie Datum __________ Wie viel Gramm Natriumchlorid lösen sich in 5mL Wasser? Geräte: Reagenzglasständer, Reagenzglas, Stopfen, fünf Gefäße mit jeweils 1g Kochsalz gefüllt, Spritze Chemikalien: 5mL Wasser, 5g Kochsalz (in fünf Portionen) Sicherheitshinweis: Während des gesamten Versuchs Schutzbrillen tragen! Durchführung: 1. Füllt mit der Spritze genau 5mL Wasser in ein Reagenzglas. 2. Gebt 1g Kochsalz hinein (also nur die Menge aus einem kleinen Gefäß!). 3. Verschließt das Reagenzglas mit einem Stopfen und dreht es mehrfach auf den Kopf und zurück (Stopfen gut festhalten!). 4. Wenn sich das Kochsalz ganz auflöst (also keine Kristalle mehr im Wasser schwimmen), dann gebt das nächste Gramm Kochsalz hinein (also zurück zu 1.). Beobachtung: Notiert zunächst, wie viele Gefäße ihr ganz leeren konntet (das letzte zählt also nicht!): Von den fünf Gefäßen konnten wir ___ im Wasser leeren, ohne das ein Rückstand blieb. Auswertung: Es haben sich ___ g Kochsalz in 5mL Wasser vollständig gelöst. Reagenzglas mit Wasser Behälter mit je 1g Kochsalz