1 Beschreibung des Themas und zugehörige Lernziele
Werbung

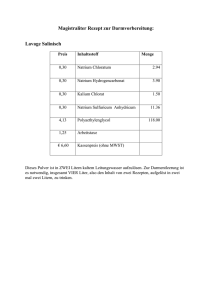
Schulversuchspraktikum Name: Jennifer Ahrens Semester: Sommersemester 2012 Klassenstufen 9 & 10 Alkalimetalle Auf einen Blick: In dieser Unterrichtseinheit werden Versuche zu den Alkalimetallen der ersten Hauptgruppe vorgestellt, die für die 9. und 10. Klasse konzipiert sind. Es werden 2 Lehrerversuche und 2 Schülerversuche vorgestellt. Die Schülerinnen und Schüler erfahren durch die Versuche, dass Alkalimetalle den elektrischen Strom leiten und bei Verbrennungen jeweils charakteristische Flammenfärbungen besitzen. Diese charakteristischen Flammenfärbungen kann man sich zu Nutze machen, um auch in Alltagsgegenständen, wie Backpulver, Waschmittel oder Brausepulver, Natrium nachzuweisen. In einem weiteren Versuch lernen sie, die molare Masse von Alkalimetallen (hier: Lithium) zu bestimmen. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele ...............................................................................1 2 Lehrerversuche .........................................................................................................................................................1 3 4 5 2.1 V 1 – Leitfähigkeit von Alkalimetallen ...................................................................................................1 2.2 V 2 – Bestimmung der molaren Masse von Lithium .......................................................................3 Schülerversuche........................................................................................................................................................5 3.1 V 3 – Verbrennen von Alkalimetallsalzen.............................................................................................5 3.2 V 4 – Natrium im Alltag ................................................................................................................................6 Reflexion des Arbeitsblattes ............................................................................................................................. 10 4.1 Erwartungshorizont (Kerncurriculum).............................................................................................. 10 4.2 Erwartungshorizont (Inhaltlich) ........................................................................................................... 10 Literaturverzeichnis ............................................................................................................................................. 11 Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 1 1 Beschreibung des Themas und zugehörige Lernziele Die Versuche thematisieren die Alkalimetalle für die 9. und 10. Klassenstufe, die den Basiskonzept Stoff-Teilchen angehören. Die zentralen Aspekte dieser Versuche sind, dass sich die Alkalimetalle durch ihre unterschiedliche Flammenfärbung bei Verbrennungen differenzieren lassen (V3). Lithium verbrennt mit einer rötlich-pinken, Natrium mit einer gelb-orangen und Kalium mit einer violetten Flamme. Dieses Wissen sollen die Schülerinnen und Schüler in einem weiteren Versuch nutzen, um Natrium in Alltagsgegenständen, wie Waschpulver, Backpulver und Brausepulver nachzuweisen (V4). Zudem sollen die Schülerinnen und Schüler durch den Versuch V1 benennen können, dass elementare Alkalimetalle leicht zu schneiden sind, einen silbrig-metallischen Glanz besitzen und den elektrischen Strom leiten. In einem weiteren Versuch sollen die Schülerinnen und Schüler erfahren, wie man experimentell die molare Masse der Alkalimetalle bestimmen kann (V2). Die Schülerinnen und Schüler vergleichen die Elemente innerhalb einer Familie und stellen Gemeinsamkeiten und Unterschiede fest. Sie erkennen in Experimenten zu Elementen Trends, erklären diese und ziehen Schlussfolgerungen. Außerdem wenden sie Sicherheitsaspekte beim Experimentieren an. (KC: Stoff-Teilchen, S. 55) Die Schülerinnen und Schüler führen Nachweisreaktionen durch, um das Vorhandensein von bestimmten Teilchen nachzuweisen (KC: Soff-Teilchen, S. 56). Dazu führen sie qualitative Nachweisreaktionen durch (KC: Stoff-Teilchen, S. 56). Des Weiteren werten sie vorgegebene quantitative Dateien aus (KC: Stoff-Teilchen, S. 56). 2 Lehrerversuche 2.1 V 1 – Leitfähigkeit von Alkalimetallen Alkalimetalle leiten den elektrischen Strom, wodurch ihre metallischen Eigenschaften zum Vorschein kommen. Die Schülerinnen und Schüler erfahren durch diesen Versuch, dass Lithium, Natrium und Kalium den elektrischen Strom leiten. Zudem sollen sie nennen können, dass Alkalimetalle leicht zu schneiden sind und eine metallisch glänzende Oberfläche besitzen, wenn sie entrindet sind. Gefahrenstoffe Lithium H: 260-314 P: 223-231+232-280305+351+338-370+378-422 H: 260-314 P: 280-301+330+331- Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 2 Natrium Kalium Materialien: 305+351+338309-310-370+378-422 H: 260-314 P: 223-231+232-280305+351+338-370+378-422 Netzgerät, Voltmeter, Kabel, 4 Krokodilklemmen, Glühbirne mit Fassung, Pinzette, Messer, Filterpapier, 2 Eisennägel. Chemikalien: Wasser, Lithium, Natrium, Kalium. Durchführung: Der Versuchsaufbau wird nach Abbildung 1 aufgebaut, dabei wird das jeweilige Alkalimetall erst ganz am Ende aus dem Gefäß entnommen. Das Alkalimetall sollte hierbei groß genug sein, dass 2 Eisennägel hineingedrückt werden können (ca. 2cm). Die Eisennägel werden anschließend mit 2 Krokodilklemmen verkabelt (Pinzette benutzen! Alkalimetall nicht mit der Hand berühren!) und das Netzgerät (Wechselstrom) auf ca. 3-4 V eingestellt. Beobachtung: Die Glühbirne beginnt nach kurzer Zeit zu leuchten. Abb. 1 - Skizze des Versuchsaufbaus. Deutung: Alkalimetalle leiten den elektrischen Strom. Entsorgung: Das Alkalimetall wird in den Vorratsbehälter zurückgelegt und die Eisennägel für die nächsten Alkalimetalle mit Wasser vorsichtig gereinigt und getrocknet. Literatur: (Glöckner 1996) Anmerkungen: Falls die Glühbirne nicht leuchtet, kann dies an den oftmals verrosteten Krokodilklemmen liegen. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 3 2.2 V 2 – Bestimmung der molaren Masse von Lithium In diesem Versuch wird experimentell die molare Masse von Lithium mittels Kalium bestimmt. Die Schülerinnen und Schüler sollen mittels der Formel n=m/M quantitativ die molare Masse des Lithiums auf Grundlage der molaren Masse des Kaliums berechnen. Die Schülerinnen und Schüler sollten bereits aus dem Fach Physik das Verhalten idealer Gase mit den Gesetzen von Boyle-Mariotte und Gay-Lussac (ebenfalls Klasse 9 & 10) kennen. Je nach Kenntnisstand der Klasse kann in diesem Versuch darauf aufbauend der Satz von Avogado hergeleitet, oder auf ihn zurückgegriffen werden. Gefahrenstoffe Lithium H: 260-314 P: 223-231+232-280305+351+338-370+378-422 Kalium H: 260-314 P: 223-231+232-280305+351+338-370+378-422 Petroleum H: 350+340+304 P: - Ethanol H: 225 P: 210 Butan-1-ol H: 226-302-318315-335-336 P: 280-302+352305+351+338-313 Materialien: Reagenzglas mit seitlichem Ansatz, 100ml Kolbenprober mit Hahn, Gummistopfen, Schlauchstück, 50ml Becherglas, Analysewaage, Messer, Pipette, Filterpapier, Stativmaterial. Chemikalien: Lithium, Kalium, Petroleum, Ethanol, Butan-1-ol Durchführung: Der Versuch wird nach Abbildung 2 aufgebaut. Für Kalium wird 6 mL Butanol in das Reagenzglas gegeben. Für das Wiegen mittels Analysewaage wird ein 50 mL Becherglas mit ca. 6 mL Petroleum gefüllt. Das Becherglas wird mit Petroleum gewogen. Anschließend wird Kalium (m ≤ 0,05 g) entrindet und in das Becherglas mit Petroleum gegeben und ebenfalls gewogen. Dann wird das Kalium mittels Pinzette in das Reagenzglas gegeben und das Reagenzglas mit dem Gummistopfen wieder verschlossen. Während der Reaktion wird der Kolben ab und an gedreht um ein Verkanten zu vermeiden. Bei Lithium wird in gleicher Weise vorgegangen Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 4 nur das statt Butanol, eine Lösung aus 2 mL Wasser mit 4 mL Ethanol in das Reagenzglas gegeben wird. Beobachtung: Bei einer eingewogenen Masse des Lithiums von 0,0058 g entsteht 19 mL zusätzliches Gas im Kolben. Bei einer eingewogenen Masse des Kaliums von 0,0226 g entsteht 12 mL zusätzliches Gas im Kolben. Abb. 2 - Skizze des Versuchsaufbaus. Deutung: Alle Alkalimetalle reagieren in gleicher Weise: M(s) + H2O(l) M+(aq) + OH-(aq) + ½ H2(g) Das bedeutet: 1 mol Alkalimetall setzt ½ Wasserstoff frei oder gleich schwere Stoffportionen der Alkalimetalle setzen unterschiedliche Wasserstoffvolumina frei, da sie unterschiedliche Dichten besitzen: V=m/ρ Bei gleicher Temperatur und gleichem Druck nehmen nach dem Gesetz von Avogadro gleich viele Teilchen (n) einen nahezu gleichen Raum (V) ein. Somit folgt: Gesetz von Avogadro: Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 5 Entsorgung: Bei kleineren Mengen kann über den Abguss entsorgt werden, bei größeren Mengen über den Säure-Base Behälter. Das Petroleum wird zu den flüssigen organischen Abfällen gegeben. Literatur: (Glöckner 1996) Anmerkungen: Es kann zusätzlich auch noch die molare Masse von Natrium bestimmt werden. Dann sollte jedoch nur eine Masse von m ≤ 0,1 g benutzt werden. Für die Reaktion im Reagenzglas wird eine Lösung aus 6 mL Propan-1-ol und 0,5 mL Wasser verwendet. 3 Schülerversuche 3.1 V 3 – Verbrennen von Alkalimetallsalzen In diesem Versuch wird gezeigt, dass die Alkalimetalle bzw. Salz der Alkalimetalle unterschiedliche Flammenfärbungen aufweisen und sich die Methode somit als Nachweisreaktion geeignet. In diesem Versuch werden Lithium, Natrium und Kalium nachgewiesen. Gefahrenstoffe LiCl H: 302-315-319 P: 302+352-305+351+338 Materialien: Tiegelzange, 3 Magnesiastäbchen, Bunsenbrenner Chemikalien: NaCl, LiCl, KCl Durchführung: Die Enden der Magnesiastäbchen werden so lange über der Bunsenbrennerflamme erhitzt bis keine gelb-orange Flamme mehr zu erkennen ist. Dann werden sie in 20%ige Salzsäure gehalten und abermals so lange erhitzt bis keine gelb-orange Flamme mehr sichtbar ist. Anschließend wird jeweils eine Spatelspitze der zu untersuchenden Substanzen (NaCl, LiCl, KCl) auf eine ausgeglühte Stelle des Magnesiastäbchens gegeben und in die Flamme des Bunsenbrenners gehalten. Beobachtung: Die Salze des Lithiums verbrennen rötlich-pink, die des Natriums gelborange und die des Kaliums violett. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 6 Abb. 6 - links: Lithium, mitte: Natrium, rechts: Kalium. Deutung: Die unterschiedlichen Alkalimetalle verbrennen mit einer charakteristischen Flammenfärbung. Die Verbrennung eignet sich somit für eine Nachweisreaktion der Alkalimetalle. Literatur: (Nordholz 2010) Anmerkungen: Das Ausglühen der Magnesiastäbchen sollte die Lehrkraft vorbereiten, da mit konzentrierter Salzsäure gearbeitet wird. Man könnte jedoch auch eine geringere Konzentration verwendet, dann sollte man das Magnesiastäbchen jedoch mehrmals ausglühen. 3.2 V 4 – Natrium im Alltag In diesem Versuch wird gezeigt, dass man mittels Flammenfärbung auch Natrium in Alltagsgegenständen, wie Backpulver, Waschmittel und Brausepulver nachweisen kann. Die Schülerinnen und Schüler sollten für diesen Versuch bereits Salze der Alkalimetalle verbrannt haben, wodurch sie wissen sollten, dass Natrium mit gelb-oranger Flamme verbrennt. Gefahrenstoffe Salzsäure Materialien: P: 260-301+330+331303+361+353 305+351+338-405-501 H: 314-335 Tiegelzange, 3 Magnesiastäbchen, Waschpulver, Brausepulver. Bunsenbrenner, Backpulver, Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 7 Chemikalien: Wasser, Salzsäure (20%ig). Durchführung: Die Enden der Magnesiastäbchen werden so lange über der Bunsenbrennerflamme erhitzt bis keine gelb-orange Flamme mehr zu erkennen ist. Dann werden sie in 20%ige Salzsäure gehalten und abermals so lange erhitzt bis keine gelb-orange Flamme mehr sichtbar ist. Anschließend wird jeweils eine Spatelspitze der zu untersuchenden Substanzen (Waschpulver, Backpulver und Brausepulver) auf eine ausgeglühte Stelle des Magnesiastäbchens gegeben und in die Flamme des Bunsenbrenners gehalten. Beobachtung: Backpulver, Waschpulver und Brausepulver verbrennen mit gelb-oranger Flamme. Abb. 3 - links: Waschpulver, mitte: Backpulver, rechts: Brausepulver Deutung: In Backpulver befindet sich Natriumhydrogencarbonat, im Waschmitel (hier: Persil Universal) befinden sich Sodium Sulfate, Sodium Carbonate, Sodium Carbonat Peroxide und Natriumsalze. Im Brausepulver (hier: AhojBrause) befinden sich Natriumhydrogencarbonate, Natriumcyclamate und Saccharin-Natrium. Diese Natrium-Verbindungen werden durch die gelborange Flamme nachgewiesen. Literatur: (Unbekannt) Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 8 Anmerkungen: Das Ausglühen der Magnesiastäbchen sollte die Lehrkraft vorbereiten, da mit konzentrierter Salzsäure gearbeitet wird. Man könnte jedoch auch eine geringere Konzentration verwendet, dann sollte man das Magnesiastäbchen jedoch mehrmals ausglühen. Wo ist Natrium drin? In diesem Versuch sollst du herausfinden, ob im Waschpulver, im Backpulver und in Brausepulver Natrium enthalten ist. Stelle zuerst Vermutungen an, dann überprüfe diese mit der dir bereits bekannten Nachweismethode: der Flammenfärbung. Materialien: Tiegelzange, 3 Magnesiastäbchen, Bunsenbrenner, Backpulver, Waschpulver, Brausepulver. Chemikalien: Salzsäure (5%ig) Durchführung: Ein Ende der Magnesiastäbchen musst du solange über der Flamme des Bunsenbrenners erhitzen bis keine gelb-orange Flamme mehr zu erkennen ist. Dann halte die ausgeglühte Seite in 5%ige Salzsäure und erhitze sie abermals so lange bis keine gelb-orange Flamme mehr sichtbar ist. Den Vorgang solltest du 2-3 mal wiederholen. Anschließend gebe eine Spatelspitze der zu untersuchenden Substanz (Waschpulver, Backpulver oder Brausepulver) auf die ausgeglühte Stelle des jeweiligen Magnesiastäbchens und halte es in die Flamme des Bunsenbrenners. Auswertung: Backpulver Waschmittel Brausepulver Flammenfarbe 1.) Erkläre, was dir die jeweiligen Flammenfarben über das Vorhandensein von Natrium sagen. 2.) Recherchiere in den Pulvern, die eine positive Flammenfärbung auf Natrium zeigten, welche natriumhaltigen Substanzen in den Pulvern jeweils enthalten sind. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 10 4 Reflexion des Arbeitsblattes Das Arbeitsblatt beschäftigt sich mit dem Thema Alkalimetalle. Es ordnet sich dem Basiskonzept Stoff-Teilchen ein. Die Schülerinnen und Schüler sollten bereits wissen, dass Natrium mit gelboranger Flamme verbrennt. Die qualitative Nachweisreaktion sollen sie nun nutzen, um auch in Alltagsgegenständen Natrium nachzuweisen. 4.1 Erwartungshorizont (Kerncurriculum) Fachwissen: Die Schülerinnen und Schüler führen Nachweisreaktionen auf das Vorhandensein von bestimmten Teilchen (Natrium) zurück. (Aufgabe 1) Die Schülerinnen und Schüler recherchieren welche natriumhaltigen Substanzen in den verbrannten Substanzen enthalten waren. (Aufgabe 2) Erkenntnisgewinnung: Die Schülerinnen und Schüler führen qualitative Nachweisreaktionen durch. Bewerten: 4.2 - Erwartungshorizont (Inhaltlich) Flammenfarbe Backpulver Waschmittel Brausepulver gelb-orange gelb-orange gelb-orange 1.) Eine gelb-orange Verbrennungsflamme ist ein Nachweis für Natrium, der somit in allen drei Substanzen enthalten war. 2.) Waschpulver (hier: Persil Universal): Sodium Sulfate, Sodium Carbonate, Sodium Carbonate Peroxide, Natriumsalze. Backpulver: Natriumhydrogencarbonat Brausepulver (hier: Ahoj-Brause): Natriumhydrogencarbonat, Natriumcycla mat, Saccharin-Natrium Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 11 5 Literaturverzeichnis Glöckner, W. (1996). Handbuch der Experimentellen Chemie. Sekundarbereich II. Band 2: Alkaliund Erdalkalimetalle, Halogene. Köln: Aulis Verlag Deubner & Co KG. Nordholz, M., & Herbst-Irmer, R. (2010). Allgemeine und Anorganische Chemie. Göttingen: GeorgAugust-Universität. Unbekannt. (kein Datum). http://www.kappenberg.com/experiments/info/pdf/v11.pdf. (Zuletzt abgerufen am 07..10.2012 um 10:37).