BWB-2_2012-Loesungen Experiment
Werbung

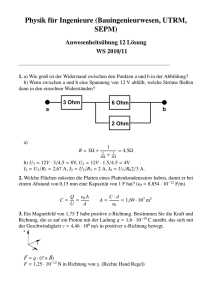
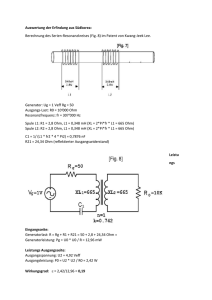
31. ÖSTERREICHISCHE PHYSIK-OLYMPIADE-2012 Bundeswettbewerb - 2. Teil Eisenstadt, 29.Mai – 13.Juni 2012 Experimentelle Aufgabe aus ELEKTRIZITÄT Heimo HERGAN BORG 8020 Graz Dreierschützengasse 15 Lösungsvorschläge Feldverteilung und galvanische Elemente 2 1 1 1. Feldverteilungen a. Die Elektroden werden laut Bild montiert, Wasser eingefüllt (wirkt dann wie ein Potentiometer), die Elektroden mit der Batterie kontaktiert. Das Voltmeter lässt sich direkt als Indikator für die Äquipotentiallinien verwenden (ein Anschluss an der Elektrode, einer im Wasser zur Suche des Punktes mit der entsprechenden gesuchten Potentialdifferenz. Die Punkte gleichen Potentials lassen sich verbinden und bilden so die Äquipotentiallinien. Senkrecht dazu – ausgehend und endend bei den Elektroden – kann man die Feldlinien einzeichen. (Da die Gesamtspannung ca. 4,6V beträgt, sind die Potentialdifferenzen zwischen benachbarten Äquipotentiallinien laut Messvorgabe in Volt 1-1-1,6-1-1). Die erste Potentiallinie liegt jeweils erstaunlich knapp neben der jeweiligen Elektrode und verläuft in der Nähe einer Elektrodenspitze deutlich dichter an der nächsten. Die Feldstärke lässt sich zunächst über die Feldlinienlage und -dichte abschätzen und U E numerisch ermitteln. Dazu misst man den Abstand zwischen 2 über x benachbarten Äquipotentiallinien entlang der dazu senkrecht eingezeichneten Feldlinien x und liest die Potentialdifferenz U aus der Messskizze ab. Die gemessenen Feldstärken liegen zwischen weniger als 100 V/m und mehreren 100 V/m. U dQ ergibt den Widerstand, mit I und Q n e erhält man die Zahl der I dt bewegten Ladungen, über die Wertigkeit der Ionen deren Zahl. Bei 4,6V Spannung und wenigen mA Stromstärke liegt der Widerstand bei 1 bis 2 k - je nach Anordnung. A c. R aus b) und R ergibt den spezifischen Widerstand des verwendeten l Leitungswassers, weil die Elektroden viel besser leiten. Mit rund 15 cm 2 Fläche und mS 10cm Abstand ergibt das eine spezifische Leitfähigkeit von 30 bis 50 . m b. R 1 31. ÖSTERREICHISCHE PHYSIK-OLYMPIADE-2012 Bundeswettbewerb - 2. Teil Eisenstadt, 29.Mai – 13.Juni 2012 Experimentelle Aufgabe aus ELEKTRIZITÄT Heimo HERGAN BORG 8020 Graz Dreierschützengasse 15 Lösungsvorschläge 3 2. Spannungsreihe, galvanische Elemente a. Die Metalle müssen zunächst in einem Elektrolyten paarweise miteinander verglichen werden. Dabei ist darauf zu achten, dass die Polung des Messgeräts immer gleich bleibt. Cu 2cm Abstand 1cm breit +\- mV Cu Me Pb Fe zn Fe/Zn Niro Al Cu 0 61 379 392 808 784 -76 430 Me -38 0 313 138 754 666 -80 290 Pb -389 -355 0 -280 270 280 -430 80 Fe -380 -365 -118 0 216 203 -470 -90 Zn -812 -810 -565 -720 0 -235 -902 -480 Fe/Zn -770 -744 -490 -667 -139 0 -816 -440 Niro 70 100 360 160 686 626 0 420 Al -360 -306 -33 -220 272 230 -311 0 Platz Cu Me Pb Fe Zn Fe/Zn Niro Al Zahl 1 2 3 4 5 6 7 8 Niro Cu Me Pb Fe Al Fe/Zn Zn Niro Cu Me Fe Al Pb Fe/Zn Zn Niro Cu Me Fe Pb Al Zn Fe/Zn Niro Cu Me Pb Fe Al Fe/Zn Zn Niro Cu Me Fe Pb Al Fe/Zn Zn Niro Cu Me Fe Pb Al Zn Fe/Zn Niro Cu Me Fe Pb Al Fe/Zn Zn Cu Niro Me Fe Pb Al Fe/Zn Zn 7/1 7/1 8 6/2 5/2/1 7/1 6/2 6/2 Erdapfel, d 2 cm , b 2 cm anschließend sortiert man die Messwerte absteigend und erhält eine – in einigen Bereichen nicht übereinstimmende – Reihung mit entsprechender Häufigkeit. Gegebenenfalls muss mit anderen Elektrolyten eine Gegenprobe erfolgen. Im Wesentlichen wird aber die Reihung bestätigt. 2 31. ÖSTERREICHISCHE PHYSIK-OLYMPIADE-2012 Bundeswettbewerb - 2. Teil Eisenstadt, 29.Mai – 13.Juni 2012 Experimentelle Aufgabe aus ELEKTRIZITÄT Heimo HERGAN BORG 8020 Graz Dreierschützengasse 15 Lösungsvorschläge 3 b. Aus den in den Tabellen dargestellten Messwerten sieht man, dass Nirosta (und darüber hinaus der Kohlenstoff in Form einer Graphitmine) in der „Spannungsreihe“ ganz links (ganz oben) liegen, dicht gefolgt vom Kupfer. Ganz rechts (ganz unter) ist Zink. Chemisch gesehen wäre Kohlenstoff am edelsten und Zink am unedelsten. Niro/Zn U_0 (mV) U_Kl (mV) Erdapfel I_K (µA) R_i (Ohm) rho (Ohm.m) U_0 (mV) U_Kl (mV) Apfel I_K (µA) R_i (Ohm) rho (Ohm.m) U_0 (mV) U_Kl (mV) Zitrone I_K (µA) R_i (Ohm) rho (Ohm.m) 2qcm 4qcm 972 960 40 60 360 550 2589 1636 51,8 65,5 1080 1020 22 30 200 260 5290 3808 106 152 1049 1048 102 210 314 500 3016 1676 60,3 67 Cu/Zn 2qcm 4qcm U_0 (mV) 940 960 U_Kl (mV) 50 60 Erdapfel I_K (µA) 380 618 R_i (Ohm) 2342 1456 rho (Ohm.m) 93,7 58,3 U_0 (mV) 960 960 U_Kl (mV) 26 32 Apfel I_K (µA) 238 284 R_i (Ohm) 3924 3268 rho (Ohm.m) 157 131 U_0 (mV) 907 U_Kl (mV) 40 Zitrone I_K (µA) 350 R_i (Ohm) 2477 rho (Ohm.m) 99,1 Man sieht, dass der Elektrolyt auf die Spannung wenig Einfluss hat, wohl aber auf den Kurzschlussstrom, ebenso wie die Elektrodenfläche. So lassen sich auch die sehr kleinen Kurzschlussströme bei den verschiedenen Graphitminen erklären. Während die Innenwiderstände von Abstand und Fläche erwartungsgemäß abhängen, zeigt der spezifische Widerstand ebenso erwartungsgemäß wenig Unterschied beim gleichen Elektrolyten, wohl aber bei verschiedenen. So zeigt Apfel (grüner Niro U_0 U_Kl I_K Golden Delicious) in beiden Fällen einen größeren Erdapfel C/B -240 -1 -2 Innenwiderstand als Zitrone oder Kartoffel. Bei der C/HB -400 -1 -5 Zitrone dürfte die Säure dafür sorgen, bei der Kartoffel die sehr gleichmäßige Zellstruktur und der leicht saure pH-Wert. C/B Zn Erdapfel Cu Niro Zn Apfel Cu Niro Zn Zitrone Cu Niro U_0 U_Kl I_K 1000 0 1 206 0 2 240 1 2 960 6 44 170 0 1 270 0 2 870 10 72 70 0 1 112 0 2 3