Arbeitsblatt – Die Löslichkeit von Alkoholen
Werbung

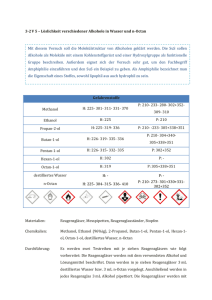
Schulversuchspraktikum Sommersemester 2014 Klassenstufen 9 & 10 Alkohole und deren Eigenschaften Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 1 Auf einen Blick: Diese Unterrichtseinheit für die 9. und 10. Klassenstufe beinhaltet drei Lehrerdemonstrationsversuche und vier Schülerversuche zum Thema „Alkohole und deren Eigenschaften“. Die Lehrerversuche V 1 „Brennbarkeit von Alkoholen“ und V 2 „Das feuerfeste Taschentuch“ beschäftigen sich mit der Brennbarkeit von Alkoholen, wobei V 2 „Das feuerfeste Taschentuch“ gut als Showversuch zum Stundeneinstieg verwendet werden kann. Dagegen sollte der dritte Lehrerversuch V 3 „Oxidierbarkeit von primären, sekundären und tertiären Alkoholen“ erst am Ende der Unterrichtssequenz Alkohole durchgeführt werden, wenn bereits primäre, sekundäre und tertiäre Alkohole thematisiert wurden, da er als Überleitung in die nächste Stoffeklasse Aldehyde und Ketone gedacht ist. Die Schülerversuch V 5 „Löslichkeit verschiedener Alkohole in Wasser und Oktan“, V 6 „Siedepunkt homologer Alkohole“ und V 7 „Mit Alkohol wird es kalt“ thematisieren die anderen Eigenschaften der Alkohole: deren Löslichkeit, Siedetemperatur und Flüchtigkeit. V 4 „Brennende Wasser-Ethanol-Gemische“ dagegen stellt eine Alternative zum Showversuch V 2 „Das feuerfeste Taschentuch“ dar, da auch hier die Brennbarkeit verschiedener Alkohol-Wasserlösungen im Fokus steht. Das Arbeitsblatt „Die Löslichkeit von Alkoholen“ soll zur Erarbeitung und Ergebnissicherung von Versuch V 5 ausgeteilt werden. Inhalt 1 Beschreibung des Themas und zugehörige Lernziele ..............................................................................2 2 Lehrerversuche .........................................................................................................................................................3 3 4 2.1 V 1 – Brennbarkeit von Alkoholen...........................................................................................................3 2.2 V 2 – Das feuerfeste Taschentuch ............................................................................................................5 2.3 V 3 – Oxidierbarkeit von primären, sekundären und tertiären Alkoholen .............................8 Schülerversuche..................................................................................................................................................... 12 3.1 V 4 – Brennende Ethanol-Wasser-Gemische .................................................................................... 12 3.2 V 5 – Löslichkeit verschiedener Alkohole in Wasser und n-Octan.......................................... 14 3.3 V 6 – Siedepunkt der homologen Alkohole ....................................................................................... 16 3.4 V 7 – Mit Alkohol wird es kalt ................................................................................................................. 18 Reflexion des Arbeitsblattes ............................................................................................................................. 21 4.1 Erwartungshorizont (Kerncurriculum).............................................................................................. 21 4.2 Erwartungshorizont (Inhaltlich) ........................................................................................................... 22 Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 2 1 Beschreibung des Themas und zugehörige Lernziele Die nachfolgende Unterrichtseinheit zum Thema „Alkohole und deren Eigenschaften“ ist für die 9. und 10. Klasse konzipiert und wird im Kerncurriculum indirekt unter den Basiskonzepten Struktur und Eigenschaft sowie Stoff-Teilchen aufgeführt. Die Schülerinnen und Schüler (SuS) sollen die Molekülstruktur von Alkanen und Alkoholen voneinander differenzieren könne. Aus diesem Grund sollte diese Unterrichtseinheit erst nach Alkanen behandelt werden, um deren Eigenschaften als Vorwissen voraussetzten zu können. Alkohole sind für SuS durch ihren hohen Alltagsbezug besonders relevant. So kommen die SuS fast täglich mehr oder weniger direkt mit Alkoholen in Kontakt: Sei es durch die Verwendung eines Parfüms oder durch die Fahrt mit dem elterlichen Auto, welches mit dem Treibstoff E10 getankt wurde. Aber auch industrielle und medizinische Aspekte sowie Alkohole als Genussmittel bei Familienfeiern dürften einigen SuS bereits bekannt sein. Nach dieser Unterrichtssequenz beschreiben die SuS die homologe Reihe der Alkohole und deren chemische und physikalische Eigenschaften. Als Vorwissen werden für die Erklärung der physikalischen Eigenschaften intermolekulare Wechselwirkungen (van-der-Waals- Wechselwirkungen und Wasserstoffbrückenbindungen) vorausgesetzt. In V 5 „Löslichkeit verschiedener Alkohole in Wasser und Oktan“ erklären die SuS die Löslichkeit von Alkoholen in polaren und unpolaren Lösungsmitteln mit Hilfe der Molekülstruktur unter Zuhilfenahme des Arbeitsblattes. In V 6 „Siedepunkte homologer Alkohole“ ermitteln die SuS die Siedetemperatur der Alkohole. Die SuS erklären die Zunahme der Siedetemperatur innerhalb der homologen Reihe der Alkohole durch die Zunahme der van-der-Waals-Wechselwirkungen bedingt durch das Wachstum der Alkylkette. In den Versuchen V 1 „Brennbarkeit von Alkoholen“, V 2 „Das feuerfeste Taschentuch“ und V 4 „Brennende Ethanol-Wasser-Gemische“ untersuchen die SuS die Brennbarkeit der Alkohole als Eigenschaft der Alkohole und bauen Vorwissen für V 7 „Mit Alkohol wird es kalt“ auf. In V 7 „Mit Alkohol wird es kalt“ wird der Kühlungseffekt von Methanol und Ethanol thematisiert. Als Überleitung zu den nächsten Stoffklassen, Aldehyde und Ketone, bietet sich Versuch V 3 „Oxidierbarkeit von primären, sekundären und tertiären Alkoholen“ an, der auf die unterschiedliche Oxidationsfähigkeit der primären, sekundären und tertiären Alkohole eingeht und somit eine chemische Eigenschaft der Alkohole in die Unterrichtssequenz integriert. Für diesen Versuch ist es wichtig, dass im Unterricht zuvor die Einteilung der Alkohole in primäre, sekundäre und tertiäre Alkohole erfolgt ist. In dieser Unterrichtseinheit werden somit die Grundlagen für die weitere Themenbereiche der organischen Chemie gelegt, die erst während der Oberstufenzeit auf einige SuS zukommen. Eine didaktische Reduktion erfolgt in der Hinsicht, dass als weitere Reaktion von Alkoholen die Veresterung ausgeklammert wird, da Ester als Stoffklasse erst in der Sekundarstufe II thematisiert werden. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 3 2 Lehrerversuche 2.1 V 1 – Brennbarkeit von Alkoholen In diesem Versuch soll die Brennbarkeit verschiedener Alkohole untersucht werden. Die SuS kennen aus ihrem Alltag das Flammbieren von Lebensmitteln wie dem Zuckerhut der Feuerzangenbowle aus der Weihnachtszeit durch das Übergießen mit Alkohol. Der Versuch soll zum einen zeigen, dass Alkohole Brennstoffe und somit Energieträger sind. Zum anderen sollen die SuS Unterschiede in der Flammenfarbe bei unterschiedlich langen Alkylketten der Alkohole ausmachen: Je länger die Alkylkette, desto gelber wirkt die Flamme. Gefahrenstoffe Methanol H: 225- 301- 311- 331- 370 P: 210- 233- 280- 302+352309- 310 Ethanol (96%ig) H: 225 P: 210 1-Propanol H: 225- 318- 336 Butan-1-ol H: 226- 302- 315- 318- 335336 P: 210- 233- 305+351+338313- 280 P: 280- 302+352305+351+338- 309+313 Materialien: 4 Porzellanschalen, Tiegelzange, Streichhölzer, Pipetten Chemikalien: Methanol, Ethanol, 1-Propanol, Butan-1-ol Durchführung: Der Versuch wird unter dem Abzug auf einer feuerfesten Unterlage durchgeführt. Es werden jeweils 4 mL eines Alkohols in die Porzellanschalen gegeben und mit einem Streichholz wird die Flüssigkeit angezündet. Beobachtung: Alle Alkohole sind brennbar. Butan-1-ol lässt sich schwerer entzünden als die kürzerkettigen Alkohole wie Methanol und Ethanol. Methanol verbrennt mit einer fast nicht sichtbaren bläulichen Flamme. Die anderen Alkohole brennen mit einer deutlichen gelben hellen Flamme. Die Flamme von Butan-1-ol brennt am längsten, die von Methanol am kürzesten. In den Porzellanschalen von 1-Propanol und Butan-1-ol sind im Gegensatz zu den Porzellanschalen von Methanol und Ethanol Rückstände nach dem Erlöschen der Flammen sichtbar. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 4 Abb. 1 – Flammenfarbe von angezündetem Methanol (links) und Ethanol (rechts). Abb. 2 – Flammenfarbe von angezündetem 1-Propanol (links) und Butan-1-ol (rechts) Deutung: Alle Alkohole sind brennbar. Je länger die Kohlenstoffkettenlänge des Alkohols, desto heller brennt er und desto mehr Rußbildung ist zu beobachten. Es brennt der Alkohol, der sich in der Gasphase befindet. Aufgrund der hohen Flüchtigkeit treten viele Alkoholmoleküle in die Gasphase. Außerdem gilt: Je länger die Alkylkette des Alkohols, desto beständiger ist er und desto schwerer lässt er sich entzünden. Aufgrund der Anziehungskräfte (van-der-Waals-Kräfte) zwischen den Molekülen mit zunehmender Kettenlänge benötigt man immer mehr Energie, um sie voneinander zu trennen und in einen anderen Aggregatzustand zu überführen. Methanol + Sauerstoff → Kohlenstoffdioxid + Wasser 2 CH3 OH (g) + 3 O2 (g) → 2 CO2 (g) +4 H2 O(g) Ethanol + Sauerstoff →Kohlenstoffdioxid + Wasser 𝐶2 𝐻5 OH(𝑔) + 3 𝑂2 (𝑔) → 2 𝐶𝑂2 (𝑔) + 3 𝐻2 𝑂(𝑔) Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 5 1- Propanol + Sauerstoff → Kohlenstoffdioxid + Wasser 2 C3 H7 OH(g) + 9 O2 (g) → 6 CO2 (g) + 8 H2 O(g) Butan-1-ol + Sauerstoff → Kohlenstoffdioxid + Wasser 2 C4 H9 OH(g) + 12 O2 (g) → 8 CO2 (g) + 10 H2 O(g) Entsorgung: Die Alkohole können im flüssigen organischen Abfall entsorgt werden. Literatur: H. Scheve, CONATEX-DIDACTIC Lehrmittel GmbH, http://www.contax.com/mediapool/versuchsanleitungen/VAD_Chemie_Al kohole.pdf, zuletzt aufgerufen am 14.08.2014 um 15:55 Uhr. Bei dem Versuch „Brennbarkeit von Alkoholen“ handelt es sich um einen Lehrerdemonstrationsversuch der nach V 2 „Das brennende Taschentuch“ vorgeführt werden sollte. Er ist nicht als Schülerversuch geeignet, da das Verbrennen von Alkoholen aus Sicherheitsgründen besser unter dem Abzug durchgeführt werden sollte, was vor allem den Flammen zuzuschreiben ist. 2.2 V 2 – Das feuerfeste Taschentuch Der Versuch veranschaulicht die unterschiedlichen Siedetemperaturen von Ethanol und Wasser. Als Vorwissen werden Kenntnisse über Wasserstoffbrückenbindungen vorausgesetzt, um die Unterschiede zwischen den Siedetemperaturen auf Teilchenebene erklären zu können. Gefahrenstoffe Ethanol H: 225 P: 210 Destilliertes Wasser H: - P: - Materialien: Tiegelzange, 3 Bechergläser (250 mL), 4 Papiertaschentücher, feuerfeste Unterlage, Feuerzeug Chemikalien: Ethanol (96%ig), destilliertes Wasser Durchführung: Vier Taschentücher werden in nachfolgende Lösungen getaucht und anschließend wird versucht, das jeweilige Taschentuch über einer feuerfesten Unterlage mit einem Feuerzeug anzuzünden. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 6 Wasser Ethanol 1. Taschentuch - - 2 .Taschentuch - 20 ml 3. Taschentuch 20 ml - 4. Taschentuch 10 ml 10 ml Beobachtung: Das Taschentuch… 1. Taschentuch verbrennt. 2 .Taschentuch verbrennt. 3. Taschentuch verbrennt nicht. 4. Taschentuch Es ist eine Flamme erkennbar, aber das Taschentuch ist nach dem Erlischen der Flamme unversehrt. Abb. 3 – Verbrennung der trockenen Taschentuchs (links) und des in Ethanol getauchten Taschentuchs. Abb. 4 – Brennendes Taschentuch, das in Wasser-Ethanol-Lösung getaucht wurde. Links während der Verbrennung. Rechts das unversehrte Taschentuch nach dem Erlöschen der Flamme. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 7 Deutung: Das trockene Papier verbrennt unter Sauerstoffverbrauch zu Kohlenstoffdioxid und Wasser. Beim zweiten Taschentuch verbrennt zum einen das Ethanol und zum anderen das reine Papier. Anzumerken ist, dass generell der verdampfte Ethanol verbrennt und nicht die Flüssigkeit, da aufgrund der hohen Flüchtigkeit viele Ethanolmoleküle in die Gasphase übertreten. Bei beiden Reaktionen entstehen Kohlenstoffdioxid und Wasser. Das dritte Papier kann nicht zum Brennen gebracht werden, da das Wasser das Papier kühlt, so dass das Feuer nicht auf das Papier übergreifen kann. Die Entzündungstemperatur des Papiers und die Siedetemperatur des Wassers werden nicht überwunden. Beim vierten Taschentuch verbrennt der Ethanol zu Kohlenstoffdioxid und Wasser unter Sauerstoffverbrauch. Es verbrennt zuerst der Ethanoldampf, der eine niedrigere Siedetemperatur und einen niedrigeren Flammpunkt (ΔT=12°C) besitzt als Wasser. Die bei der EthanolVerbrennung freiwerdende Energie erwärmt das vom Taschentuch aufgenommene Wasser, kann es jedoch nicht zum Sieden bringen, so dass das Taschentuch selbst kein Feuer fangen kann, weil es durch das Wasser gekühlt und feucht gehalten wird. Ethanol + Sauerstoff →Kohlenstoffdioxid + Wasser 𝐶2 𝐻5 OH(𝑔) + 3 𝑂2 (𝑔) → 2 𝐶𝑂2 (𝑔) + 3 𝐻2 𝑂(𝑔) Entsorgung: Das Wasser-Ethanol-Gemisch kann für die Wiederholung des Versuchs in einer Kunststoffflasche aufbewahrt werden. Die benutzten Taschentücher können im Hausmüll entsorgt werden. Literatur: H. Schmidkunz, W. Rentzsch, Chemische Freihand Versuche. Band 2, Aulis Verlag, Auflage 2011, Seite 307 Der Versuch „Das brennende Taschentuch“ eignet sich als Showversuch und somit als Einstieg in die Unterrichtstunde, in der die Brennbarkeit als Eigenschaft der homologen Alkohole thematisiert wird. Alternativ bzw. zusätzlich kann der Schülerversuch V 4 „Das brennende Wasser“ durchgeführt werden, der ebenfalls die Brennbarkeit von WasserEthanol-Gemischen behandelt. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 8 2.3 V 3 – Oxidierbarkeit von primären, sekundären und tertiären Alkoholen Der Versuch zeigt die Unterschiede von primären, sekundären und tertiären Alkoholen hinsichtlich ihrer Oxidierbarkeit. Primäre Alkohole können in zwei Schritten oxidiert werden: Zunächst zu Aldehyden, abschließend zu Carbonsäuren. Dagegen können sekundäre Alkohole lediglich einmal zu Ketonen oxidiert werden. Im Gegensatz dazu können tertiäre Alkohole nicht auf diese Weise oxidiert werden, da sich keine Carbonylgruppe ohne Spaltung einer C-CBindung bilden kann. Gefahrenstoffe Ethanol H: 225 P: 210 Isopropannol (2-Propanol) H: 225- 319- 336 P: 210- 233- 305+338+351 tert-Butanol (2-Methyl-2-Propanol) H: 225- 319- 332-335 Natronlauge H: 290- 314 Kaliumpermanganat H: 272- 302- 410 P: 210- 305+338+351403+233 P: 280- 301+330+331305+351+338 P: 210- 273 Materialien: 3 Petrischalen, Messpipetten, Peleusball, 2 Bechergläser Chemikalien: Ethanol (96%iger), Isopropanol, tert-Butatanol, 1 M Natronlauge, Kaliumpermanganat-Lösung (c = 0,006 mol/L) Durchführung: Es wird aus 14 mg Kaliumpermangant und 15 mL destilliertem Wasser eine 0,006 molare Kaliumpermangant-Lösung angesetzt. Zu dieser Lösung werden 15 mL 1M-Natronlauge hinzugefügt. Die Lösung wird dann auf drei Petrischalen aufgeteilt. In jede Petrischale werden dann 2 mL eines Alkohols gegeben. Beobachtung: Die Lösung, zu der Ethanol pipettitert wurde, färbt sich von lila über grün zu gelb-braun. In der Lösung, in die Isopropanol hinzugefügt wurde, kommt es zu einem Farbumschlag von lila nach grün. Die Lösung mit tert-Butanol bleibt farblich unverändert. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 9 Abb. 5 – Oxiderung von Isopropanol mit Permanganat. Abb. 6 – Oxidierbarkeit von Ethanol, Isopropanol und tert-Butanol mit Permanganat. Deutung: Der Versuch zeigt die unterschiedliche Oxidierbarkeit von primären (Ethanol), sekundären (Isopropanol) und tertiären (tert-Butanol) Alkoholen. Als Oxidationsmittel wirkt das Kaliumpermanganat, das die Alkohole bis zu unterschiedlichen Oxidationsstufen oxidiert. Die Unterteilung in primäre, sekundäre und tertiäre Alkohole erfolgt anhand der Position der Hydroxylgruppe im Molekül, d.h. man unterscheidet die Alkohole nach der Anzahl der Nichtwasserstoffnachbarn des Kohlenstoffatoms, an welchem sich die Hydroxylgruppe befindet. So trägt bei primären Alkoholen das C-Atom mit der Hydroxylgruppe noch zwei Wasserstoffatome, bei sekundären trägt das C-Atom mit der Hydroxylgruppe noch ein Wasserstoffatom und bei tertiären Alkoholen weist das C-Atom mit der Hydroxylgruppe kein weiteres Wasserstoffatom auf. Primäre Alkohole wir Ethanol werden durch Permanganat-Ionen zu Aldehyden und Carbonsäuren reduziert. Dabei verläuft die Oxidation des Ethanols in zwei Schritten unter Protonenverbrauch. Im ersten Schritt entstehen aus Ethanol entsteht Ethanal. Dabei werden die Mangan-Ionen auf die Oxidationsstufe +6 reduziert, was an der Grünfärbung der Lösung deutlich wird. In weiteren Schritt werden die Aldehyde zu Carbonsäuren, im Falle des Ethanols zu Ethansäure, oxidiert und die Mangan-Ionen auf Oxidations- Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 10 stufe +4 reduziert. Man erhält Braunstein, was an der gelblich-braunen Färbung der Lösung auszumachen ist. Oxidation: Ethanol →Ethanal +2𝑒 − → Ethansäure + 2𝑒 − C2 H5 OH(l) → 𝐶𝐻3 𝐶𝐻𝑂(𝑙) + 2 𝐻 + (𝑎𝑞) + 2𝑒 − + 𝑂𝐻 − (𝑎𝑞) 𝐶𝐻3 𝐶𝐻𝑂(𝑙) → CH3 COOH(l) + 2𝑒 − + 𝐻 + Reduktion: Permanganat+ e- + Protonen → Mangantrioxid + Wasser MnO4 - (aq) + e- + 2 H+ (aq) → MnO3 (aq) (grün)+ H2 O(l) Mangantrioxid+e- + Protonen →Braunstein + Wasser MnO3 (aq) + 2e-+2 H+ (aq) → MnO2 (aq) (braun)+H2 O(l) Gesamtgleichung: Ethanol + Permanganat + Protonen → Ethansäure + Braunstein + Wasser 3 C2 H5 OH(l) + 4 MnO4 - (aq) +4 H + (aq) →3 CH3 COOH(aq) + MnO2 (aq) + H2 O(l) Sekundäre Alkohole wie das Isopropanol werden von Kaliumpermangant nur bis zum Keton oxidiert. Die Permanganat-Ionen werden nur zur Oxidationsstufe +6 reduziert, was an der grünen Farbe der Lösung zu erkennen ist. Oxidation: 2-Propanol→ Propanon+ 2e- +Protonen C3 H7 OH(l) →CH3 COCH3 (l) +2e- +2 H + (aq) Reduktion: Permanganat+ e- + Protonen → Mangantrioxid+ Wasser MnO4 - (aq) (violett)+ e- + 2 H+ (aq) → MnO3 (aq) (grün)+ H2 O(l) Tertiäre Alkohole wie das tert-Butanol (2-Methyl-Propan-2-ol) können von Kaliumpermanganat nicht oxidiert werden, da ohne Spaltung einer C-CBindung keine Carbonylgruppe ausgebildet werden kann. Dies ist an der konstanten violetten Färbung der Lösung auszumachen. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 11 CH 3 OH H3C OH H3C H 3C CH3 OH CH 3 Abb. – Strukturformeln primärer, sekundärer und tertiärer Alkohole: Etan-1-ol, Isopropanol (Propan-2-ol), tert-Butanol (2-Metyhl-Propan-2-ol) Entsorgung: Die Lösungen werden mit Natriumthiosulfat behandelt und im Schwermetallabfall entsorgt. Literatur: CHIDS. Philipps-Universität-Marburg. http://chids.online.uni-marburg.de /dachs/experimente/005oxidierbarkeit _prim_sek_ter_alkohole.xml (zuletzt aufgerufen am 15.08.2014 um 10:57 Uhr). Der Versuch „Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole“ ist als Überleitung zu den Stoffklassen Aldehyden und Ketonen am Ende der Unterrichtseinheit geeignet. Er kann auch als Schülersuch durchgeführt werden. Dann sollten anstelle von Petrischalen Reagenzgläser verwendet werden, da so weniger Chemikalien verbraucht werden. Als Lehrerversuch kann der Versuch auf dem OHP durchgeführt werden, damit der Farbwechsel besser für alle SuS sichtbar ist und die Anschaulichkeit zu erhöhen wird. Außerdem ist dieser Versuch ein Alternativversuch für die Veresterung eines Alkohols mit Borsäure. Obwohl diese Veresterung aufgrund der grünen Flammenfärbung der Alkohole sehr effektstark ist, eignet er sich nicht für den schulischen Einsatz, da für die Borsäure ein generelles Tätigkeitsverbot für die SuS und ein eingeschränkte Tätigkeitserlaubnis für Lehrkräfte gilt. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 12 3 Schülerversuche 3.1 V 4 – Brennende Ethanol-Wasser-Gemische Bei der Verbrennung von Alkoholen verbrennen nicht die Moleküle in der flüssigen Phase, sondern es werden die Moleküle, die aufgrund der hohen Flüchtigkeit in die Gasphase getreten sind, entflammt. Der Alkoholdampf verbrennt mit einer bläulichen Flamme. Je mehr Kohlenstoffatome ein Alkohol enthält, desto gelber erscheint die Flamme. Gefahrenstoffe Ethanol H: 225 P: 210 Destilliertes Wasser H: - P: - Materialien: 4 Porzellanschalen, Messpipetten, Peleusball, Streichhölzer Chemikalien: destilliertes Wasser, Ethanol Durchführung: Es werden folgende Lösungen angesetzt, die dann einzeln in eine Porzellanschale vorgelegt und unter dem Abzug mit dem Streichholz angezündet werden: Ethanol Wasser Verhältnis Ethanol :Wasser 1. Gemisch 4 mL 6 mL 2:3 2. Gemisch 5 mL 5 mL 1 :1 3. Gemisch 6 mL 4 mL 3:2 4. Gemisch 7 mL 3 mL 7:3 Beobachtung: Das 1. Gemisch ist nicht entflammbar. Die Gemische 2-4 sind entflammbar. Die Flamme in Gemisch 2 erlischt nach wenigen Sekunden. Dagegen brennen die Flammen in Gemisch 3 und 4 länger. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 13 Abb. 6 – Verbrennung von Wasser-Alkohol-Gemischen (Ethanol:Wasser). Deutung: Wasser-Ethanol-Gemische in einem Verhältnis ab einem Mischungsverhältnis von 1:1 sind entflammbar. Dies entspricht einem Alkoholgehalt von 50%. Beträgt der Alkoholgehalt exakt 50%, brennt das Gemisch kurzeitig, da der Alkoholanteil schnell zu Kohlenstoffdioxid und Wasser verbrannt wird und nur noch Wasser in der Porzellanschale vorliegt. Es verbrennt jedoch nicht das flüssige Ethanol, sondern das Ethanol in der Gasphase, da aufgrund der hohen Flüchtigkeit viele Ethanolmoleküle in die Gasphase übertreten. Liegt bei der Wasser-Ethanol-Mischung der Alkoholanteil unter 50%, kann die Mischung nur zum Brennen gebracht werden, wenn das Gemisch mit dem Bunsenbrenner erhitzt wird. In diesem Fall würde das Ethanol aufgrund seiner Siedetemperatur von 78,4°C vor Wasser in die Dampfphase übergehen und der Ethanoldampf kann mit einem Streichholz entzündet werden. Ethanol + Sauerstoff → Kohlenstoffdioxid + Wasser 𝐶2 𝐻5 OH(𝑔) + 3 𝑂2 (𝑔) → 2 𝐶𝑂2 (𝑔) + 3 𝐻2 𝑂(𝑔) Entsorgung: Die Reste der Mischungen können im Abfluss entsorgt werden. Literatur: H. Schmidkunz, W. Rentzsch, Chemische Freihand Versuche. Band 2, Aulis Verlag, Auflage 2011, Seite 306 Der Versuch „Das brennende Wasser“ stellt eine Alternative zum Lehrerdemonstrationsversuch „Das brennende Taschentuch“ dar oder kann zur Wiederholung eingesetzt werden. Um ihn als Schülerversuch durchführen zu können, müssen genügend Plätze unter dem Abzug zu Verfügung stehen. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 14 3.2 V 5 – Löslichkeit verschiedener Alkohole in Wasser und n-Octan Mit diesem Versuch soll die Molekülstruktur von Alkoholen geklärt werden. Die SuS sollen Alkohole als Moleküle mit einem Kohlenstoffgerüst und einer Hydroxylgruppe als funktionelle Gruppe beschreiben. Außerdem eignet sich der Versuch sehr gut, um den Fachbegriff Amphiphilie einzuführen und den SuS ein Beispiel zu geben. Als Amphiphilie bezeichnet man die Eigenschaft eines Stoffes, sowohl lipophil aus auch hydrophil zu sein. Gefahrenstoffe P: 210- 233- 280- 302+352- Methanol H: 225- 301- 311- 331- 370 Ethanol H: 225 P: 210 Propan-2-ol H: 225- 319- 336 P: 210- -233- 305+338+351 Butan-1-ol H: 226- 319- 335- 336 Pentan-1-ol H: 226- 315- 332- 335 P: 302+352 Hexan-1-ol H: 302 P: - Octan-1-ol H: 319 P: 305+338+351 destilliertes Wasser H: - P: - n-Octan H: 225- 304- 315- 336- 410 P: 210- 273- 301+330+331302+352 309- 310 P: 210- 304+340305+338+351 Materialien: Reagenzgläser, Messpipetten, Reagenzglasständer, Stopfen Chemikalien: Methanol, Ethanol (96%ig), 2-Propanol, Butan-1-ol, Pentan-1-ol, Hexan-1ol, Octan-1-ol, destilliertes Wasser, n-Octan Durchführung: Es werden zwei Testreihen mit je sieben Reagenzgläsern wie folgt vorbereitet: Die Reagenzgläser werden mit dem verwendeten Alkohol und Lösungsmittel beschriftet. Dann werden in je sieben Reagenzgläser 3 mL destilliertes Wasser bzw. 3 mL n-Octan vorgelegt. Anschließend werden in jedes Reagenzglas 3 mL Alkohol pipettiert. Die Reagenzgläser werden mit einem Stopfen verschlossen und geschüttelt. Sobald sich die Lösungen abgesetzt haben, werden die Beobachtungen notiert. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 15 Beobachtung: Methanol, Ethanol und Propan-2-ol mischen sich vollständig in Wasser. Butan-1-ol, Pentan-1-ol, Hexan-1-ol und Octan-1-ol mischen sich nicht vollständig in Wasser. Es ist sind zwei Phasen sichtbar. Methanol mischt sich nicht vollständig mit n-Octan, sondern bildet zwei Phasen. Dagegen lösen sich die übrigen Alkohole Ethanol, Propan-2ol, Butan-1-ol, Pentan-1-ol, Hexan-1-ol und Octan-1-ol vollständig in n-Octan. Abb Löslichkeit verschiedener Alkoholen in Wasser : 1) Methanol, 2) Ethanol 3) Propan-2-ol, 4) Butan-1-ol, 5) Pentan1-ol, 6) Hexan-1-ol, 7) Octan-1-ol Abb. – Löslichkeit verschiedener Alkohole in n-Octan: 1) Methanol, 2) Ethanol 3) Propan-2-ol, 4) Butan-1-ol, 5) Pentan-1-ol, 6) Hexan-1-ol, 7) Octan-1-ol Deutung: Mit zunehmender Länge der Kohlenstoffketten nimmt die Löslichkeit der Alkohole in polaren Lösungsmitteln wie Wasser ab und in unpolaren Lösungsmitteln wie n-Octan zu. Die Löslichkeit in polaren Lösungsmitteln nimmt mit zunehmender Kohlenstoffkettenlänge ab, da der Anteil der unpolaren Alkylkette überwiegt und somit der Anteil an van-der-WaalsWechselwirkungen größer ist als der Anteil der polaren Hydroxylgruppen und der ausgebildeten Wasserstoffbrückenbindungen zwischen Wassermolekülen und den Hydroxylgruppen der Alkohole. Ab Butanol reicht die Polarität für das Lösen in polaren Lösungsmitteln nicht mehr aus. Bei Methanol ist es beim Lösen in unpolaren Lösungsmitteln umgekehrt: Die kurze Alkylkette kann nicht genügend van-der-Waals- Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 16 Wechselwirkungen mit n-Octan-Molekülen eingehen, so dass zwei Phasen im Reagenzglas zu erkennen sind. Entsorgung: Lösungen in organische Lösungsmittelabfälle geben. Literatur: nach Haupt, Möllencamp, http://www.chemieexperimente.de/alkohole /15_6.htm, 05.12.2005 (zuletzt abgerufen am 15.08.2014 um 14:41 Uhr). Der Versuch „Löslichkeit verschiedener Alkohole in Wasser und n-Heptan“ sollte in einer der ersten Unterrichtsstunden durchgeführt werden, um die Molekülstruktur der Alkohole von den SuS erarbeiten zu lassen. Wichtig ist es, den SuS nach der Durchführung die Strukturformeln vorzugeben, damit sie anhand ihrer Vorkenntnisse die Lipohilie und/oder Hydrophilie erklären. Um die Effektstärke des Versuchs zu erhöhen, sollten die Lösungsmittel Wasser und n-Heptan angefärbt werden, damit die Phasentrennung deutlicher hervortritt. Für Wasser kann Methylenblau und für n-Octan kann Sudanrot verwendet werden. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 16 3.3 V 6 – Siedepunkt der homologen Alkohole Bei diesem Versuch sollen die SuS die Siedepunkte der ersten fünf homologen Alkohole quantitativ ermitteln. Dabei soll die Zunahme der Siedetemperatur auf die zunehmende Länge der Alkylkette und die damit korrelierenden zwischenmolekularen Wechselwirkungen (van-derWaals-Kräfte) zurückgeführt werden. Aus diesem Grund sollten die zwischenmolekularen Wechselwirkungen als bekannt vorausgesetzt werden. Gefahrenstoffe Methanol H: 225- 301- 311- 331- 370 Ethanol H: 225 1-Propanol H: 225- 318- 336 P: 210- 233- 280- 302+352309- 310 P: 210 P: 210- 233- 305+351+338313- 280 H: 226- 302- 315- 318- 335- P: 280- 302+352- 336 305+351+338- 309+313 Pentan-1-ol H: 226- 332- 335- 315 P: 302+352 destilliertes Wasser H: - P: - Butan-1-ol Materialien: Heizplatte, Stativ mit Klemme und Muffe, Ölbad, Reagenzgläser, Hochtemperaturthermometer bis 200°C, Siedesteinchen, Rührfisch Chemikalien: Methanol, Ethanol (96%iger), 1-Propanol, Butan-1-ol, Pentan-1-ol, destilliertes Wasser Durchführung: Der Versuch wird wie in der Skizze gezeigt aufgebaut. Das Ölbad wird auf der Heizplatte erhitzt. Die Alkohole werden in die Reagenzgläser gefüllt und nacheinander im Ölbad zum Sieden gebracht. Es wird die jeweilige Temperatur am Thermometer abgelesen und notiert. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 17 Abb. 7 – Versuchsaufbau zur Siedepunktermittlung der verschiedenen Alkohole. Beobachtung: Deutung: Die Alkohole sieden bei folgenden Temperaturen: Experimenteller Wert Literaturwert Methanol 63,5°C 64,7°C Ethanol 78°C 78,3°C 1-Propanol 95°C 97,2°C Butan-1-ol 113,5°c 117,3°C Pentan-1-ol 136°C 138°C Je länger die Alkylkette, desto höher liegt der Siedepunkt des Alkohols. Mit zunehmender Kettenlänge nehmen die van-der-Waals-Anziehungskräfte zwischen den Molekülen zu. Da sich die Moleküle beim Phasenübergang von flüssig zu gasförmig weit voneinander entfernen müssen, sieden längerkettige Alkohole erst bei hohen Temperaturen. Entsorgung: Die Alkoholreste werden im flüssigen organischen Abfall entsorgt. Literatur: H. Scheve. CONATEX-DIDACTIC Lehrmittel GmbH http://www.contax.com/mediapool/versuchsanleitungen/VAD_Chemie_Al kohole.pdf, zuletzt aufgerufen am 15.08.2014 um 09:20 Uhr. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 18 Um den Versuch „Siedepunkte der homologen Alkohole“ als Schülerversuch durchführen zu können, sollten genügend Abzüge im Unterrichtsraum zur Verfügung stehen, da die Ermittlung der Siedetemperatur von Methanol aufgrund der Toxizität der Methanoldämpfe besser unter dem Abzug durchgeführt werden sollte. Alternativ könnte auf Methanol verzichtet werden. Auch aufgrund der hohen Kaskade an Gefahrensymbolen sollte der Versuch nur mit einer kleinen Klasse als Schülerversuch ausgeführt werden, um eine Gefährdung der SuS zu vermeiden. Dennoch sollte dieser Versuch durchgeführt werden, damit die SuS einen Vergleich zwischen den Siedetemperaturen von Wasser, Alkanen und Alkenen erstelle und somit zum einen ihr Wissen über verschiedene Stoffklassen verknüpfen können und zum anderen ihre Beobachtungen mit der Stärke von Wasserstoffbrückenbindungen und van-der-Waals-Kräften erklären versuchen. von Van-der-Waals Kräften diskutieren. 3.4 V 7 – Mit Alkohol wird es kalt Der Versuch demonstriert den Verdunstungsvorgang. Als Verdunstung versteht man den Vorgang, bei dem Teilchen aus der flüssigen oder festen Phase unterhalb ihres Siedepunkts in die Gasphase übertreten. Dabei wird der Umgebung Wärme entzogen. Die SuS haben den Verdunstungsvorgang bereits in ihrem Alltag in Form des Kühlungseffekts von Erfrischungstüchern und Deodorants kennengelernt. Die Flüchtigkeit der Alkohole sollte als Vorwissen aus den vorhergehenden Versuchen vorausgesetzt werden können, damit die SuS möglichst eigenständig eine Erklärung für ihre Beobachtungen finden können. Gefahrenstoffe Methanol H: 225- 301- 311- 331- 370 Ethanol H: 225 P: 210- 233- 280- 302+352- Materialien: Thermometer, Filterpapier, Pipetten, Filterpapier Chemikalien: Methanol, Ethanol (96%iger) 309- 310 P: 210 Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 19 Durchführung: Der Versuch wird zweimal durchgeführt: Zuerst mit Methanol, dann mit Ethanol. Ein Filterpapier wird einige Male um das Vorratsgefäß der Thermometerflüssigkeit gewickelt und die Temperatur wird notiert. Anschließend wird 1 mL Alkohol mit einer Pipette auf das Filterpapier gegeben. Die Temperatur wird über einige Minuten gemessen. Beobachtung: Die Temperatur sinkt sowohl nach dem Auftragen des Methanols als auch beim Ethanol, wobei das Methanol das Temperatur stärker abkühlen lässt. Temperatur [°C] Zeit [Min] Methanol Ethanol 0 24°C 26°C 1 18°C 19°C 2 14°C 16,5°C 3 8°C 15,2°C 5 7°C 14 Abb. 9 – Mit Filterpapier umwickeltes Thermometer Deutung: Alkohole wie Methanol und Ethanol verdunsten sehr schnell bei Zimmertemperatur, d.h. weit unterhalb ihres Siedepunktes (Methanol siedet bei 64,7°C und Ethanol bei 78,4°C). Für die Verdunstung wird Wärme benötigt, die der Umgebung entzogen wird. Mit dem Thermometer kann der Entzug der Wärmeenergie beobachtet werden: Die Temperatur sinkt. 𝑉𝑒𝑟𝑑𝑢𝑛𝑠𝑡𝑢𝑛𝑔 𝐶2 𝐻5 OH(𝑙) → Entsorgung: 𝐶2 𝐻5 OH(𝑔) Das Filterpapier kann im Hausmüll entsorgt werden. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 20 Literatur: H. Schmidkunz, W. Rentzsch, Chemische Freihand Versuche. Band 2, Aulis Verlag, Auflage 2011, Seite 311 Für den Versuch „Mit Alkohol wird es kalt“ kann zur Verdeutlichung des Verdunstungseffekts des Alkohols Wasser statt Methanol verwendet werden. Der Versuch kann am Ende der Unterrichtseinheit durchgeführt werden. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 21 4 Reflexion des Arbeitsblattes Das Arbeitsblatt „Löslichkeit von Alkoholen“ soll vor der Durchführung von Versuch V 4 „Löslichkeit verschiedener Alkohole in Wasser und n-Heptan“ ausgeteilt werden und dient zur Erarbeitung und Ergebnissicherung. Gleichzeitig dient es zur Verknüpfung von Wissen zwischen verschiedenen Stoffklassen, in diesem Fall der Alkane und Alkohole hinsichtlich ihrer Molekülstruktur. Das Ziel ist es, mit Hilfe der Molekülstruktur von Methanol, Ethanol und Hexan-1-ol die unterschiedlich gute Löslichkeit in polaren und unpolaren Lösungsmittel und dabei die hydrophilen und lipophilen Eigenschaften zu erklären. Des Weiteren soll ein Vergleich zwischen Alkanen und Alkoholen hinsichtlich ihrer Löslichkeit in Wasser angestellt werden. 4.1 Erwartungshorizont (Kerncurriculum) Das Thema Alkohole und deren Eigenschaften wird im Kerncurriculum nicht explizit in einem der Basiskonzepte beschreiben. Sie können jedoch unter den Basiskonzepten StrukturEigenschaft sowie Stoff-Teilchen eingeordnet werden: Fachwissen: Die Schülerinnen und Schüler differenzieren zwischen der Molekülstruktur der Alkane und Alkohole (Aufgabe 3). Die Schülerinnen und Schüler erklären die unterschiedlichen Eigenschaften der Stoffe anhand geeigneter Bindungsmodelle (Auf gabe 2+3). Die Schülerinnen und Schüler differenzieren zwischen polaren und unpolaren Atombindungen/Elektronenpaarbindungen (Auf gabe 2+3). Erkenntnisgewinnung: Die Schülerinnen und Schüler wenden Sicherheitsaspekte beim Experimentieren an (Aufgabe 1). Kommunikation: Die Schülerinnen und Schüler argumentieren fachlich korrekt und folgerichtig (Aufgabe 2+3). Die Aufgaben auf dem Arbeitsblatt „Die Löslichkeit von Alkoholen“ sind nach aufsteigendem Anforderungsniveau gegliedert. In Aufgabe 1 wird das Anforderungsniveau 1 bedient, in dem die SuS anhand einer Versuchsanleitung die Löslichkeit verschiedener Alkohole in Wasser und nHeptan testen. In Aufgabe 2 wird das Anforderungsniveau 2 aufgegriffen. Die SuS sollen ihre Beobachtungen anhand der Molekülstrukturformeln von Methanol, Ethanol und Hexan-1-ol erklären und dabei die hydrophilen und lipophilen Eigenschaften der Alkohole erklären. In Aufga- Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 22 be 3 wird das Anforderungsniveau 3 bedient, indem die SuS die Eigenschaft von Alkoholen, sich in Wasser zu lösen, auf die Löslichkeit von Alkanen übertragen und dabei ebenfalls zwischenmolekulare Wechselwirkungen miteinbeziehen. 4.2 Erwartungshorizont (Inhaltlich) Aufgabe 1: Die Schülerinnen und Schüler notieren ihre Beobachtungen über die Löslichkeit der Alkohole in Wasser und n-Heptan in die nachfolgende Tabelle: Alkohol Löslichkeit in Wasser Löslichkeit in n-Heptan Methanol Gut, keine Phasengrenze 2 Phasen mit Phasengrenze Ethanol Gut, keine Phasengrenze Gut, keine Phasengrenze 1-Propanol Gut, keine Phasengrenze Gut, keine Phasengrenze Butan-1-ol 2 Phasen mit Phasengrenze Gut, keine Phasengrenze Hexan-1-ol 2 Phasen mit Phasengrenze Gut, keine Phasengrenze Octan-1-ol 2 Phasen mit Phasengrenze Gut, keine Phasengrenze Aufgabe 2: Methanol und Ethanol lösen sich im Gegensatz zu Hexan-1-ol vollständig in Wasser. Bei Hexan1-ol ist der Anteil der hydrphoben Alkylkette größer als die hydrophile funktionelle Hydroxylgruppe. Die Wasserstoffbrückenbindungen zwischen der Hydroxylgruppe des Metahnols und Ethanols sind stärker als die schwachen van-der-Waals-Wechselwirkungen zwischen den Alkoholmolekülen. Bei Hexan-1-ol dagegen ist der Anteil der hydrophoben Alkylkette größer, so dass die van-der-Waals-Kräfte überwiegen und sich Hexan-1-ol nicht in Wasser lösen lässt. Ethanol und Hexan-1-ol lassen sich besser als Methanol in unpolaren Lösungsmitteln wie nHeptan lösen, da ihr Anteil an lipophilen Alkylketten größer ist als der der Hydroxylgruppe, so dass van-der-Waals-Wechselwirkungen zwischen dem Lösungsmittel und den Alkoholmolekülen stark ausgeprägt sind. Methanol löst sich nicht in n-Heptan, da der Anteil der Alkylkette nicht größer ist als die Hydroxylgruppe. Die kurze Alkylkette kann nicht genügend van-der-WaalsWechselwirkungen mit n-Heptan-Molekülen eingehen, so dass zwei Phasen im Reagenzglas zu erkennen sind. Aufgabe 3: Ethan löst sich im Gegensatz zu Ethanol schlecht in Wasser, da Ethan wie alle Alkane nicht über eine positive funktionelle Gruppe verfügt, sondern lediglich unpolare C-C und C-H-Bindungen aufweist, so dass keine Wasserstoffbrückenbindungen mit den Wassermolekülen ausgebildet werden können. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. Error! Use the Home tab to apply Überschrift 1 to the text that you want to appear here. 23 Arbeitsblatt – Die Löslichkeit von Alkoholen Aufgabe 1: Führe Versuch V 4 „Löslichkeit verschiedener Alkohole in Wasser und n-Heptan“ durch. Beschreibe deine Beobachtungen. Alkohol Löslichkeit in Wasser Löslichkeit in n-Heptan Methanol Ethanol 1-Propanol Butan-1-ol Hexan-1-ol Octan-1-ol Aufgabe 2: Erkläre die unterschiedlich gute Löslichkeit von Methanol, Ethanol und Hexan-1-ol in Wasser und n-Heptan. Verwende dazu die nachfolgenden Strukturformeln. Methanol Ethanol Hexan-1-ol _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ ______________________________________________________________________________________________________ Aufgabe 3: Erkläre am Beispiel von Ethanol und Ethan, warum sich Alkohole besser als Alkane in Wasser lösen lassen. _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ _______________________________________________________________________________________________________________ ___________________________________________________________________________________________________________