docx - ChidS
Werbung

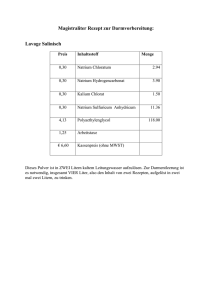
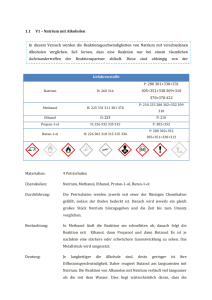
Chlorgas trifft auf elementares Natrium Protokoll A06 Reaktionsgleichungen ∆ 𝑁𝑎(𝑠) → 𝑁𝑎(𝑙) 𝑁𝑎(𝑙) + 𝐶𝑙(𝑔) → 𝑁𝑎𝐶𝑙(𝑠) Zeitbedarf Vorbereitung: 60 min. Durchführung: 3 min. Nachbereitung: 30 min. Chemikalienliste Edukte Chemikalien Summenformel R-Sätze S-Sätze Natrium Chlorgas Wasser Natriumhydrogencarbonat Schwefelsäure (konz., w = 96 %) Natriumthiosulfat Na(s) Cl(g) H2O(l) 14/15-34 23-36/37/38-50 - 5-8-43.7-45 9-45-61 - Gefahrensymbole F, C T, N - NaHCO3 (s) - 22-24/25 - S1 H2SO4 (l) 35 26-30-45 C S1 Na2S2O3 (s) - - - S1 Chemikalien Summenformel R-Sätze S-Sätze Natriumchlorid NaCl(s) - - Schuleinsatz S1 S1 S1 Produkte Gefahrensymbole - Schuleinsatz S1 Gefahrensymbole Materialien und Geräte Filterpapier, Pinzette, Messer, Stativmaterial (2 Platten, 4 Stangen, 6 Doppelmuffen, 6 Hakenmuffen), 1 Stativring, 9 Schlauchschellen, 3 Keckklemmen, 3 Gaswaschflaschen, 1 langes Glasrohr (ø = 1,5 cm, l = 25 cm), 2 durchbohrte Stopfen für das lange Glasrohr, 2 kurze Glasrohre, 3 kurze PVC-Schläuche (l = 3 cm), 2 lange PVC-Schläuche (l = 50-60 cm) Chlorgas trifft auf elementares Natrium Protokoll A06 Versuchsaufbau Abb. 1: Versuchsaufbau (Chlorgaszuleitung von links) Durchführung Augenschutz benutzen Schutzhandschuhe benutzen Schutzkleidung benutzen Der Versuch muss unbedingt in einem gut funktionierenden Abzug durchgeführt werden! Als erstes wird eine gesättigte Natriumthiosulfat-Lösung in Griffweite gestellt. Anschließend wird der Versuch gemäß Abbildung 1 aufgebaut. Dabei werden die zweite Gaswaschflasche von links mit konzentrierter Schwefelsäure und die rechte Gaswaschflasche mit gesättigter Natriumhydrogencarbonat-Lösung gefüllt. Dann wird ein etwa erbsengroßes Stück Natrium zurechtgeschnitten und im Reaktionsrohr platziert. Nun wird der Hahn der Chlorgasbombe geöffnet und das Chlorgas durch die Apparatur geleitet. Mithilfe des Bunsenbrenners wird dann das Natrium erhitzt, bis es zu glühen beginnt. Sobald dies erreicht ist, wird der Bunsenbrenner entfernt und die Reaktion beobachtet. Beobachtungen Bei Einleiten des Chlorgases entstehen in der Schwefelsäure und in der NatriumhydrogencarbonatLösung Gasblasen. Das Natrium schmilzt während des Erhitzens und bildet eine silbrig glänzende Kugel, welche sich kurz darauf mit einer schwarzen Schicht überzieht. Sie beginnt stark zu glühen und zu rauchen. Auch eine intensiv gelbe Flamme ist zu sehen. Währenddessen färbt sich der Gasraum in der ersten und zweiten Gaswaschflasche grün. In der dritten Gaswaschflasche bildet sich ein weißer Nebel/Rauch. Chlorgas trifft auf elementares Natrium Protokoll A06 Abb. 2: Ablaufende Reaktion Nachdem die Reaktion beendet ist, ist ein weißer Rückstand im Reaktionsrohr zu sehen (Abb. 3). Abb. 3: Reaktionsprodukt Entsorgung Zunächst lässt man die Apparatur, insbesondere die Gaswaschflaschen, im Abzug ausgasen. Anschließend wird die Schwefelsäure neutralisiert (z.B. mit Natriumhydroxid) und in den Ausguss entsorgt. Die Natriumhydrogencarbonat-Lösung wird mit der äquivalenten Menge an Natriumthiosulfat-Lösung versetzt und anschließend in den Ausguss gegeben. 4 𝐶𝑙2 (𝑔) + 10 𝑁𝑎𝐻𝐶𝑂3 (𝑎𝑞) + 𝑁𝑎2 𝑆2 𝑂3 (𝑎𝑞) → 2 𝑁𝑎2 𝑆𝑂4 (𝑎𝑞) + 8 𝑁𝑎𝐶𝑙(𝑎𝑞) + 10 𝐶𝑂2 (𝑔) + 5 𝐻2 𝑂(𝑙) Alle Teile der Apparatur, die wiederverwendet werden sollen (z.B. die Gaswaschflaschen), werden mit Natriumthiosulfat-Lösung durchgespült. Die restlichen Teile (wie Schlauchstücke) werden in den Feststoffabfall entsorgt. Das Reaktionsrohr kann für Versuch „A07 Nachweis der Kochsalzbestandteile“ aufgehoben oder ebenfalls in den Feststoffabfall entsorgt werden. Fachliche Analyse Unter den Metallen reagieren die Alkalimetalle (z.B. Natrium) am heftigsten mit Chlor. Dabei werden große Energiemengen frei, welche hier vor allem in Form von Licht abgegeben werden: 2 𝑁𝑎(𝑠) + 𝐶𝑙2 (𝑔) → 2 𝑁𝑎𝐶𝑙(𝑠) + 822,56 𝑘𝐽 Im Versuch werden zwei Elemente aus verschiedenen Bereichen des Periodensystems (PSE) kombiniert. Natrium aus der 1. Gruppe (links im PSE) und Chlor aus der 17. Gruppe (rechts im PSE). Bei den chemischen Reaktionen zwischen den Atomen sind nur die Valenzelektronen beteiligt, davon Chlorgas trifft auf elementares Natrium Protokoll A06 besitzt Natrium nur eines und Chlor sieben. Alle Atome sind aber bestrebt, eine abgeschlossene Außenschale, d.h. acht Valenzelektronen zu besitzen. Dazu gibt Natrium bereitwillig ein Elektron ab und Chlor nimmt dieses auf. Nun besitzen beide Atome ein sog. Elektronenoktett, d.h. acht Valenzelektronen. Da Natrium nun aber noch immer 11 positiv geladene Protonen im Kern enthält, ihm aber ein negativ geladenes Elektron „fehlt“, ergibt sich für das Natrium die Ladung +1 und es wird nun als Ion (Kation) bezeichnet. Ähnliches gilt für das Chloratom: Es besitzt noch immer 17 Protonen im Kern, hat aber nun 18 Elektronen, wodurch sich eine Ladung von -1 für das Chlorid-Ion (ein Anion) ergibt. In einer Reaktionsgleichung werden die Valenzelektronen meist als Punkte dargestellt: Na+ + Cl - Na + Cl In der Darstellung nach dem Bohrschen Schalenmodell sieht es wie folgt aus: Aufgrund der unterschiedlichen Ladungen werden die Ionen zusammengehalten. Die Anziehungskraft wird als elektrostatische Anziehung und die auf diesem Wege gebildete Bindung als Ionenbindung bezeichnet. Das durch die Ladung induzierte elektrische Feld eines Ions ist in der Regel nicht gerichtet, d.h. es zielt nicht nur auf ein Ion der entgegengesetzten Ladung, sondern in alle Richtungen auf benachbarte Ionen in gleichem Maße. Daher lagern sich Stoffe, welche durch Ionenbindungen zusammengehalten werden, wie z.B. das hier gebildete Natriumchlorid, in Form von Ionenkristallen zusammen. Darin liegen die Anionen (z.B. Cl-) und die Kationen (z.B. Na+) abwechselnd nebeneinander. Solche Stoffe werden Salze genannt. Chlorgas trifft auf elementares Natrium Protokoll A06 Abb. 4: 3D-Modell der Natriumchloridstruktur (Chlor = grün, Natrium = blau)[1b] Die Ionenbindungen treten vor allem bei Verbindungen auf, bei denen die Elektronegativitäten (EN) der Reaktionspartner eine Differenz von > 2 aufweisen. Eine Differenz von 2 entspricht in etwa einem 50 %igen ionischen Charakter. Bei geringeren Differenzen liegen überwiegend kovalente, bei größeren Differenzen überwiegend ionische Bindungen vor. Stoffe die aus einem Halogenatom und einem Metallatom bestehen, werden auch als Halogenide bezeichnet. Bei ihrer Benennung wird zuerst das Metall und dann das Halogen genannt. Der entstehende Name wird dann um die Endung -id ergänzt: Natrium + Chlor = Natriumchlorid Natriumchlorid (NaCl, „Steinsalz“) ist den meisten als Kochsalz bekannt. Es ist in großen Salzlagerstätten in der norddeutschen Tiefebene, in Galizien oder im Salzkammergut in Österreich zu finden. Darüber hinaus sind riesige Mengen (3,6 · 1016 t) an Natriumchlorid im Meerwasser gelöst und 1015 t liegen als festes Steinsalz darin vor. Gewonnen wird es entweder durch bergmännischen Abbau, durch Aussolung (Eindampfen wässriger Lösungen) oder durch Einleiten des Meerwassers in sog. Salzgärten warmer Länder (die Sonne lässt das Wasser verdunsten und das Salz bleibt zurück). Verwendung findet es als Speisesalz zum Würzen und zum Konservieren von Lebensmitteln (Pökelsalz). In der chemischen Industrie dient es zum Aussalzen organischer Verbindungen sowie zur Darstellung fast aller Natriumverbindungen wie Soda (Natriumcarbonat, Na2CO3), Ätznatron (Natriumhydroxid, NaOH) oder Glaubersalz (Natriumsulfat, Na2SO4). Die Schwefelsäure in der ersten Gaswaschflasche hat nur die Funktion, durch ihre stark hygroskopische Wirkung die im Chlorgas eventuell vorhandene Feuchtigkeit zu binden, damit das Gas möglichst trocken und rein zum Natrium gelangt. Die Natriumhydrogencarbonat-Lösung nimmt einen eventuellen Überschuss an Chlorgas auf, damit dieses möglichst nicht aus der Apparatur ausströmt. Anschließend werden die gelösten Stoffe mit Natriumthiosulfat-Lösung in ungefährliche Produkte überführt. Chlorgas trifft auf elementares Natrium Protokoll A06 Methodisch didaktische Analyse Einordnung Nach dem hessischen Lehrplan G8 ist der Versuch in die Stufe 8G.2 im Thema „Ordnung in der Vielfalt, Atombau und Periodensystem“ und in das Unterthema „2.4 Alkalimetalle“ einzuordnen. Dabei sollen chemische Reaktionen gezeigt werden, wobei dieser einen ausgezeichneten Alltagsbezug herstellt, da jeder Schüler Kochsalz als Speisesalz, aber meist nicht als chemische Verbindung kennt. Darüber hinaus kann hier gut auf die Gruppen der Salze und Halogenide übergeleitet werden. Daher kann der Versuch auch unter Punkt „2.5 Halogene“ in der gleichen Jahrgangsstufe eingesetzt werden. Die Schüler sollten dazu mit dem Schalenmodell zum Aufbau von Atomen vertraut sein. Als Nachfolgeversuch bietet sich „A07 Nachweis der Kochsalzbestandteile“ an, in welchem das Produkt aus dem vorliegenden Versuch analysiert wird. Aufwand Die Vor- und Nachbereitung sind sehr aufwendig, vor allem der Aufbau nimmt sehr viel Zeit in Anspruch. Die Kosten halten sich in Grenzen, nur die Schläuche müssen jedes Mal ausgetauscht werden, da sie durch das stark ätzende Chlorgas angegriffen werden. Der Geräteaufwand ist auch relativ groß, aber die Materialien sollten alle in der Sammlung vorhanden sein. Bei Chlorgas könnte dem nicht so sein. Durchführung Der Versuch funktioniert sehr gut, wenn das Chlorgas zu Beginn durch die Apparatur strömt. Stellt man den Gasstrom erst an, wenn das Natrium zu glühen beginnt (wie in der Vorschrift angegeben), so verglüht ein Großteil zu einem schwarzen Rückstand, bevor das Gas das Natrium erreicht und reagiert nicht zu Natriumchlorid. Der Versuch sollte aufgrund des giftigen Chlorgases nur vom Lehrer in einem gut funktionierenden Abzug durchgeführt werden. Aufgrund des hohen Aufwands wird aber empfohlen, das vorliegende Video zu zeigen. Zunächst wurde überlegt, das Chlor in einer angeschlossenen Apparatur selbst zu entwickeln, anstatt eine Chlorbombe einzusetzen. Allerdings zeigte sich beim Probedurchlauf ein unzureichender, weil unregelmäßiger Gasstrom, welcher nicht genug Chlor lieferte, um die gewünschten Effekte zu erzielen. Fazit Ein sehr effektvoller, anschaulicher Versuch zur exothermen Reaktion zwischen Alkalimetallen und Halogenen, wobei Salze (hier das aus dem Alltag bekannte Kochsalz) gebildet werden. Nur der Aufbau ist unter Umständen relativ zeitaufwendig. Chlorgas trifft auf elementares Natrium Protokoll A06 Literaturangaben Versuchsquelle Boeck, H.: Chemische Schulexperimente Band 3, Seite 381ff (V 504 d). Frankfurt/M.: Verlag Harri Deutsch. 1978. Sekundärliteratur [1a] FIZ CHEMIE (Fachinformationszentrum Chemie GmbH): Encyclopedia - ChemgaPedia. Zu finden unter URL: http://www.chemgapedia.de. Letzter Zugriff am 09.04.2010. [1b] ] FIZ CHEMIE (Fachinformationszentrum Chemie GmbH): Encyclopedia - ChemgaPedia. Zu finden unter URL: http://www.chemgapedia.de/vsengine/popup/vsc/de/glossar/n/na/natriumchlorid_00045gitter.glos .html. Letzter Zugriff am 11.04.2010. [2] Hessisches Kultusministerium: Lehrplan Chemie Gymnasialer Bildungsgang Jahrgangsstufen 7G bis 12G. 2008. Zu finden unter URL: http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2. Letzter Zugriff am 09.04.2010. [3] Hollemann, A. F.; Wiberg, E.; Wiberg, N.: Lehrbuch der Anorganischen Chemie. Seiten 120f, 146f, 437, 1281f. 102., stark umgearbeitete und verbesserte Auflage. Berlin, New York: de Gruyter. 2008. [4] Mortimer, C. E.: Chemie – Das Basiswissen der Chemie. Seiten 96-98. 7., korrigierte Auflage. Stuttgart, New York: Georg Thieme Verlag. 2001. [5] Unfallkasse Hessen; Hessisches Kultusministerium: Hessisches Gefahrstoffinformationssystem Schule - HessGISS. Version 13. 2008/2009.