Deletionen und Punktmutationen im LRRC50-Gen führen zu
Werbung
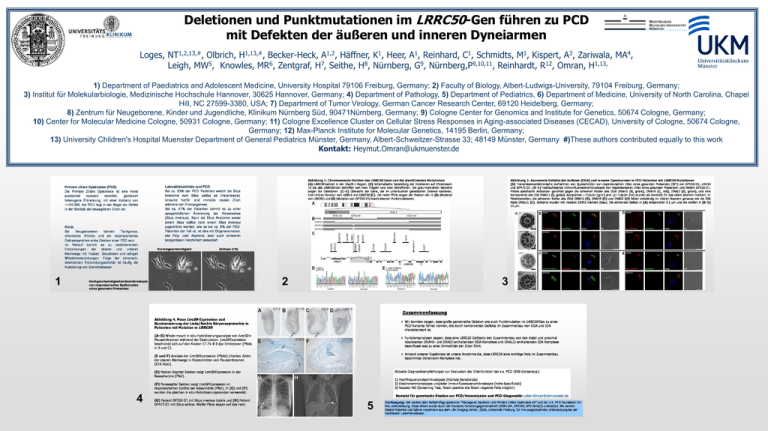
Deletionen und Punktmutationen im LRRC50-Gen führen zu PCD mit Defekten der äußeren und inneren Dyneiarmen Loges, NT1,2,13,#, Olbrich, H1,13,#, Becker-Heck, A1,2, Häffner, K1, Heer, A1, Reinhard, C1, Schmidts, M1, Kispert, A3, Zariwala, MA4, Leigh, MW5, Knowles, MR6, Zentgraf, H7, Seithe, H8, Nürnberg, G9, Nürnberg,P9,10,11, Reinhardt, R12, Omran, H1,13, 1) Department of Paediatrics and Adolescent Medicine, University Hospital 79106 Freiburg, Germany; 2) Faculty of Biology, Albert-Ludwigs-University, 79104 Freiburg, Germany; 3) Institut für Molekularbiologie, Medizinische Hochschule Hannover, 30625 Hannover, Germany; 4) Department of Pathology, 5) Department of Pediatrics, 6) Department of Medicine, University of North Carolina, Chapel Hill, NC 27599-3380, USA; 7) Department of Tumor Virology, German Cancer Research Center, 69120 Heidelberg, Germany; 8) Zentrum für Neugeborene, Kinder und Jugendliche, Klinikum Nürnberg Süd, 90471Nürnberg, Germany; 9) Cologne Center for Genomics and Institute for Genetics, 50674 Cologne, Germany; 10) Center for Molecular Medicine Cologne, 50931 Cologne, Germany; 11) Cologne Excellence Cluster on Cellular Stress Responses in Aging-associated Diseases (CECAD), University of Cologne, 50674 Cologne, Germany; 12) Max-Planck Institute for Molecular Genetics, 14195 Berlin, Germany; 13) University Children's Hospital Muenster Department of General Pediatrics Münster, Germany, Albert-Schweitzer-Strasse 33; 48149 Münster, Germany #)These authors contributed equally to this work Kontakt: [email protected] 1 2 4 3 5 Primäre ziliäre Dyskinesie (PCD) Die Primäre Ziliäre Dyskinesie ist eine meist autosomal rezessiv vererbte, genetisch heterogene Erkrankung, mit einer Inzidenz von ~1/20.000. Bei PCD liegt in der Regel ein Defekt in der Motilität der beweglichen Zilien vor. Klinik Bei Neugeborenen können Tachypnoe, chronische Rhinitis und ein respiratorisches Distresssyndrom erste Zeichen einer PCD sein. Im Verlauf kommt es zu rezidivierenden Entzündungen der oberen und unteren Atemwege mit Husten, Sinusitiden und eitrigen Mittelohrentzündungen. Folge der chronischdestruktiven Entzündungsaktivität ist häufig die Ausbildung von Bronchiektasen. Hochgeschwindigkeitsvideomikroskopie von respiratorischen Epithelzellen eines gesunden Probanden Lateralitätsdefekte und PCD Bei ca. 53% der PCD Patienten weicht die Situs Anatomie vom Situs solitus ab (Heterotaxie). Ursache hierfür sind immotile nodale Zilien während der Embryogenese. Bei ca. 47% der Patienten kommt es zu einer spiegelbildlichen Anordnung der Körperachse (Situs inversus). Kann die Situs Anatomie weder einem Situs solitus noch einem Situs inversus zugeordnet werden, wie es bei ca. 6% der PCDPatienten der Fall ist, ist dies mit Organanomalien, wie Poly- oder Asplenie, aber auch schweren kongenitalen Herzfehlern assoziiert. Normalgeschwindigkeit Zeitlupe (1/8) Abbildung 1: Chromosomale Position des LRRC50-Gens und die identifizierten Mutationen (A) LRRC50 kartiert in der 16q24.1-Region. (B) Schematische Darstellung der Deletionen auf Chromosom 16 die das LRRC50-Gen betreffen von zwei Trägern und zwei Betroffenen. Die grau-markierten Bereiche zeigen die Deletionen. (C–E) Übersicht der Gene, die im untersuchten genetischen Interval kartieren; Exon-Intron-Struktur von HSDL1 und LRRC50 (C). Die roten Pfeile zeigen die Position der in (D) (Mutation von UNC65) und (E) (Mutation von OP250-II1) beschriebenen Punktmutationen. Abbildung 3. Axonemale Defekte der äußeren (ODA) und inneren Dyneinarmen in PCD Patienten mit LRRC50 Mutationen (A) Transmissionselektronische Aufnahmen von Querschnitten von respiratorischen Zilien eines gesunden Probanden (WT) von OP250-II1, UNC65 und OP473-II1. (B–E) Hochauflösende Immunfluoreszenzmikroskopie von respiratorischen Zilien eines gesunden Probanden und Patient OP250-II1. Mittels spezifische Antikörper gerichtet gegen die schweren Ketten des ODA DNAH5 (B, grün), DNAH9 (C, rot), DNAI2 (D, grün), und eine Komponente des IDA DNALI1 (E, grün). Acetyliertes a-Tubulin (grün) and a/b-Tubulin (rot) wurden als Kontrolle für das ziliäre Axonem markiert. In Patientenzellen, die schweren Ketten des ODA DNAH5 (B), DNAH9 (C) und DNAI2 (D) fehlen vollständig im ziliären Axonem genauso wie die IDA Kette DNALI1 (E). Zellkerne wurden mit Hoechst 33342 markiert (blau). Die schwarzen Balken in (A) entsprechen 0.1 µm und die weißen in (B–E) 10 µm. Abbildung 4. Maus Lrrc50-Expression und Randomisierung der Links/Rechts Körperasymmetrie in Patienten mit Mutation in LRRC50 (A–D) Whole-mount in situ-Hybridisierungsanalyse von Lrrc50 in Mausembryonen während der Gastrulation. Lrrc50-Expression beschränkt sich auf den Knoten E7.75–8.0 dpc Embryonen (Pfeile in B und C). (E und F) Analyse der Lrrc50-Expression (Pfeile) ziliierten Zellen der oberen Atemwege in Kryoschnitten von Mausembryonen (E16.5dpc). (E) Median-Sagittal Sektion zeigt Lrrc50-Expression in der Nasopharynx (Pfeil). (F) Parasagittal Sektion zeigt Lrrc50-Expression im respiratorischen Epithel der Nasenhöhle (Pfeil). In (E) und (F) wurden die gleichen in situ-Hybridisierungssonden verwendet. (G) Patient OP250-II1 mit Situs inversus totalis und (H) Patient OP473-II1 mit Situs solitus. Weiße Pfeile zeigen auf das Herz. Zusammenfassung • Wir konnten zeigen, dass große genomische Deletion wie auch Punktmutation im LRRC50-Gen zu einer PCD-Variante führen können, die durch kombinierten Defekte im Zusammenbau von ODA und IDA charakterisiert ist. • Funktionsanalysen zeigen, dass eine LRRC50 Defizienz den Zusammenbau von den distal und proximal lokalisierten DNAH5- und DNAI2-enthaltenden ODA-Komplexe und DNALI1-enthaltenden IDA-Komplexe beeinflusst was zu einer Immotilität der Zilien führt. • Anhand unserer Ergebnisse ist unsere Annahme die, dass LRRC50 eine wichtige Role im Zusammenbau bestimmter Dyneinarm-Komplexe hat. Aktuelle Diagnostikempfehlungen zur Evaluation der Zilienfunktion bei v.a. PCD (ERS-Consensus): 1) Hochfrequenzvideomikroskopie (höchste Sensitivität) 2) Elektronenmikroskopie und/oder Immunfluoreszenzmikroskopie (hohe Spezifizität) 3) Nasalen NO (Screening-Test, falsch positive wie falsch negative Fälle möglich) Kontakt für genetische Studien zur PCD/Heterotaxien und PCD-Diagnostik: [email protected] Danksagung: Wir danken dem Selbsthilfegruppeverein „Kartagener Syndrom und Primäre Ciliäre Dyskinesie eV” und die „U.S. PCD Foundation“ für ihre Unterstützung. Diese Arbeit wurde durch die Deutsche Forschungsgemeinschaft (GRK1104, SFB592, DFG Om6/2) unterstützt. Wir danken Roland Nitschke und Sabine Haxelmans aus dem Life Imaging Center, ZBSA, Universität Freiburg, für ihre ausgezeichnete Unterstützung bei der Konfokalen Lasermikroskopie .