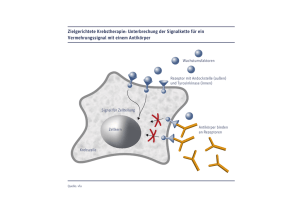
PowerPoint-Präsentation - Heidelberger Life
Werbung

PD Dr. med. Ansgar Schulz: Antikörper in der Krebsbehandlung Klinik für Kinder- und Jugendmedizin der Universität Ulm: Tagesklinik der Onkologie, Immunologie und Knochenmarktransplantation Maus Antikörper (IgG) Antigen H-Kette VH CH1 Fab Fc VL L-Kette CL CH2 CH3 Therapie in vivo - > Rasche Entwicklung von HAMAs (Human Anti Mice Antibodies) „Chimärer“ Maus - Mensch Antikörper VH CH1 VL CL CH2 CH3 z.B. Rituximab (Anti-CD20) Maus-Anteile Mensch-Anteile „Humanisierter“ Antikörper VH CH1 VL CL CH2 CH3 z.B. Campath-1H (Anti-CD52) Maus-Anteile Mensch-Anteile „Humaner“ Antikörper VH CH1 VL CL CH2 CH3 Mensch-Anteile Antikörper in der Medizin: Die „CD“-Nomenklatur CD=Cluster of Differentiation CD antigen CD30 Activated B and T cells Ki-1 CD31 monocytes, platelets, granulocytes, B cells, endothelial cells PECAM-1 CDw32 Monocytes, granulocytes, B cells eosinophils FcgRII T11-3 CD33 myeloid progenitor cells, monocytes T3 CD34 hematopoietic precursors, capillary endothelium Cellular expression Other names CD1a CD1b CD1c CD1d Cortical thymocytes, Langerhans cells, Dendritic cells, B cells (CD1c), Intestinal epithelium (CD1d) CD2 T cells, thymocytes, NK cells T11, LFA-2 CD2R Activated T cells CD3 Thymocytes, T cells CD4 Thymocyte subsets, helper and inflammatory T cells (about T4, L3T4 two thirds of peripheral T cells), monocytes, macrophages CD35 Erythrocytes, B cells, monocytes, neutrophils, eosinophils, CR1 FDC CD5 Thymocytes, T cells, subset of B cells T1, Ly1 CD36 platelets, monocytes CD6 Thymocytes, T cells, B cell CLL T12 CD37 mature B cells, mature T cells, myeloid cells CD7 Pluripotential hematopoietic cells, thymocytes, T cells CD38 CD8 Thymocyte subsets, cytotoxic T cells early B and T cells, activated T cells, germinal centre B cells, plasma cells CD9 Pre-B cells, eosinophils, basophils, platelets CD10 B and T cell precursors, bone marrow stromal cells CD11a CD3 – T-Lymphozyten T8, Lyt2,3 CD20 – B-Lymphozyten lymphocytes, granulocytes, monocytes and macrophages CD11b myeloid and natural killer cells CD11c myeloid cells CDw12 monocytes, granulocytes, platelets CD13 myelomonocytic cells CD14 myelomonocytic cells CD15 & CD15S neutrophils, eosinophils, monocytes CD15u sulphated CD15 CD16 a & b neutrophils, NK cells, macrophages CDw17 neutrophils, monocytes, platelets CD18 Leukocytes CD19 B cells CD20 B cells CD21 mature B cells, FDC CD22 mature B cells CD23 Neutral endopeptidase, Common Acute Lymphocytic Leukemia Antigen (CALLA) LFA-1 Mac-1 CD39 activated B cells, activated NK cells, macrophages, dendritic cells CD40 B cells, monocytes, dendritic cells CD40L (CD154) activated CD4 T cells CD41 platelets, megakaryocytes CD42a, b, c, d platelets, megakaryocytes a: GPIX b: GPIba c: GPIbb d: GPV CD43 leukocytes, except resting B cells leukosialin, sialophorin CD44 leukocytes, erythrocytes Hermes antigen, Pgp-1 CD45 leukocytes Leukocyte common antigen (LCA), T200, B220 CD45RO T cell subsets, B cell subsets, monocytes, macrophages CR4, p150, 95 aminopeptidase N Lewsi-x (Lex) FcgRIII CD34 – hämatologische Vorläuferzellen, Endothelzellen CD45RA B cells, T cell subsets (naive T cells) monocytes CD45RB T cell subsets, B cells, monocytes, macrophages, granulocytes CD45RC Restricted T200 CD46 hematopoietic and non-hematopoietic nucleated cells BL-CAM CD47 all cells mature B cells, activated macrophages, eosinophils, follicular dendritic cells, platelets FceRII CD47R previously CDw149 leukocytes CD24 B cells, granulocytes possible human homologue of mouse Heat Stable Antigen (HSA) or J11d. CD48 CD25 activated T cells, B cells, monocytes CD26 Activated B and T cells, macrophages CD28 CD29 T-BAM CD33 – myeloische Vorläuferzellen, Monozyten CR2 CD27 platelet GPIV CD66 – Granulozyten T200 MCP Blast-1 CD49a activated T cells, monocytes VLA-1 Tac CD49b B cells, monocyte, platelets VLA-2 Dipeptidyl peptidase IV CD49c B cells VLA-3 Medullary thymocytes, T cells CD49d B cells, thymocytes VLA-4 T cell subsets, activated B cells CD49e memory T cells, monocytes, platelets VLA-5 CD49f memory T cells, thymocytes, monocytes VLA-6 Leukocytes Tp44 Antikörper in der Medizin: 1 – Diagnostische Anwendung Identifizierung und Differenzierung bestimmter Zelltypen Problem: Wie unterscheide ich die „normale“ von der „bösartigen“ Körperzelle? Lösung: Die „bösartige“ (z.B. Leukämie-) Zelle hat andere Proteine an der Zelloberfläche als die normale Zelle -> anderes „CD-Profil“ Patient A.S.; Akute Lymphatische Leukämie „FACS“-Analyse der Knochenmarkzellen: Leukämiezelle ist CD20+ CD34+ TdT+ CD20: Marker der B-Lymphozyten und –Vorläufer CD34: Marker der Stammzelle und Leukämiezelle TdT: Leukämiezell-Marker CD20+ CD34+ TdT+ CD34+ Anwendung: Charakterisierung von Leukämien (bestimmte Subtypen und Risikogruppen) Identifikation von restliche Leukämiezellen unter vielen „normalen“ Zellen („Minimal Residual Disease“) -> Therapiesteuerung Antikörper in der Medizin: 2 – „Pharmazeutische“ Anwendung Präparation „reiner“ Zelltypen Problem: Wie bekomme ich eine saubere Zellpopulation (z.B. „Stammzellen“)? Lösung: Kopplung der Antikörper an Metall-“Beads“ und Präparation über eine magnetische Säule Serum Beispiel: Aufreinigung hämatopoetischer Stammzellen zur Transplantation 1 – Apheresat 2 - Serum (GvHD-Prophylaxe bei HLA-nichtidentischer Transplantation) Transplantat CD34-Antikörper, gekoppelt an magnetische „Beads“ CD34-positive hämatopoietische Stamzelle T- und B-Lymphozyten, Monozyten Anwendung: Mit aufgereinigten Stammzellen ist eine Transplantation auch von nicht passenden Spendern möglich (z.B. von HLA-haploidentischen Eltern) -> jeder Mensch hat einen Stammzellspender Antikörper in der Medizin: 3 – Therapeutische Anwendung Gezielte Behandlung bestimmter Zellen „Targeting“ Problem: Wie behandle ich „selektiv“ eine z.B. bösartige Zellpopulation? Lösung: „Immunologische Wirksamkeit“ der AK Kopplung der Antikörper an pharmakologisch wirksame Substanzen („Immunkonjugate“) Antikörper in klinischer Anwendung (Auswahl) Antikörper (Handelsname) Antigen (Zielzelle) Klinische Zulassung Andere Anwendungen INFLIXIMAB (Remicade) Tumor Necrosis Factor-alpha Rheumatoide Arthritis, Ankylosierende Spondilitis, M. Crohn GvHD-Therapie nach StammzellTransplantation BASILIXIMAB (Simulect) Interleukin-2 Abstoßung nach Organtransplantation (Niere) GvHD-Prophylaxe bei StammzellTransplantation MUROMONAB (Orthoclone Okt-3) CD3 (T-Zellen) Abstoßung nach Organtransplantation (Niere, Herz, Leber) Abstoßung, GvHD nach StammzellTransplantation TRASTUZUMAB (Herceptin) HER2 (Mamma-Ca) Mammakarzinom (HER2-Überexpression) ALEMTUZUMAB (MabCampath) CD52 (Lymphozyten) CLL (refraktär) Leukämien und Lymphome; GvHD RITUXIMAB (Mabthera) CD20 (B-Zellen) Follikuläres Lymphom (refraktär); B-Zell-NHL (+ CHOP) Andere Lymphome und Leukämien, CLL, LPS Patient A.S.; Akute Lymphatische Leukämie CD20+ CD34+ TdT+ CD34+ 12 Stunden nach Mabthera-Therapie (Anti-CD20): Voraussetzungen für den therpeutischen Einsatz: 1 – Spezifität Monoklonale Antikörper 2 –Verträglichkeit Humanisierte Antikörper 3 – Wirksamkeit Immunkonjugate Zellgift-gekoppelte monoklonale Antikörper GEMTUZUMAB OZOGAMYCIN (GO; Mylotarg) • Antikörper: humanisiert, monoklonal, Anti-CD33 • Zielantigen: CD33 (positiv auf 80-90% de novo AML) • Konjugat: N-acetyl-gamma-calicheamicin dimethylhydrazine (zytotoxische Substanz aus der Enedyne-Familie der DNA-schneidenden Antibiotika) Immuntherapie mit Mylotarg Klinische Studien mit Monotherapie (Auswahl) Phase Patienten Diagnosen Ansprechen 20% BlastenReduktion Nebenwirkungen (Grad III-IV) Lit. 20% Transaminitis Sievers, Blood 1999 23% Cholestase, 17% Transaminitis, Allerg. Reaktionen Sievers, J Clin Oncol 2001 I N=40 (> 18 J.) Refraktäre AML II N=142 (22-84 J., med. 61) AML-Rezidiv 29% (16% CR, 13% CRp) II N=128 je Arm AML-Rezidiv CR + CRp A- Mylotarg A- 38% B- HD-AraC B- 41% Leopold, Clin Adv Hematol Oncol 2003 I/II N=15 < 18J. refraktäre AMLRezidive Zwaan, Blood 2003 8/18 Blasten- 3/15 Leber-Tox. Reduktion 1/15 VOD 5/15 CRp -> wirksam, relativ gut verträglich Aber: keine Dauerremissionen durch Monotherapie Konzepte der selektiven Immuntherapie (Beispiel Leukämie) a) Klassisches Konzept Leukämiezelle b) Radioimmuntherapie Gesunde Knochenmarkzelle Knochenmark „Cross Fire“ Antigen auf der Zielzelle -> „Leukämie-spezifisch“ (z.B. Mylotarg, Mabthera) Antigen der Hämatopoiese „Knochenmark-selektiv“ (Radioimmunkonjugate) „RADIOIMMUNTHERAPIE“ = „RIT“ Re Re Re Re Re Re Re Prinzip der Radioimmuntherapie GEZIELTE Bestrahlung des Knochenmarks zur Zerstörung des Knochenmarks vor Knochenmarktransplantation VORTEILE gegenüber Ganzkörperbestrahlung (= ungezielte Bestrahlung „von außen“) • Weniger Nebenwirkungen zu erwarten (da gezielt) • Höhere Wirksamkeit möglich (da höhere Dosen) Radioimmuntherapie (RIT) mit Radioisotop-gekoppelten monoklonalen Antikörpern Nuklid Rhenium (R-188) Yttrium (Y-90) Halbwertzeit Eigenschaft 17 Stunden Hoher gamma-, geringer betaEmitter 2,7 Tage Sehr hochenergetischer beta-Emitter Antigen Zielzelle CD45 Mononukleäre Zellen, LeukämieZellen CD66 Granulozyten und GranulozytenVorläufer Selektive interne Radiotherapie Nuklide Zielstruktur • α – Strahler ( 213 Bi, 225 Ac) Einzelzelle • β - Strahler (131 I,188Re,90Y) Zellcluster • Auger – Elektronen (125 I) Zellkern Re-188 anti-CD66-mAb 20 hrs. p.i.; AML PR1 Der Crossfire - Effekt Normale Granulopoese Anti – CD 66 Antikörper Leukämische Blasten ß - Strahlen Prinzip der Radioimmuntherapie GEZIELTE Bestrahlung des Knochenmarks zur Zerstörung des Knochenmarks vor Knochenmarktransplantation VORTEILE gegenüber Ganzkörperbestrahlung (= ungezielte Bestrahlung „von außen“) • Weniger Nebenwirkungen zu erwarten (da gezielt) • Höhere Wirksamkeit möglich (da höhere Dosen) Konzepte der Radioimmuntherapie Vor Stammzell-Transplantation I) INTENSIVIERTE Konditionierung Ziel: weniger Rezidive nach Transplantation Methode: Radioimmuntherapie + „normale“ Konditionierung (Ganzkörperbestrahlung +/- Hochdosis-Chemotherapie Anwendung: Höchstrisiko-Leukämien II) REDUZIERTE Konditionierung Ziel: weniger Nebenwirkungen der Konditionierung Methode: Radioimmuntherapie + „reduced Intensity Conditioning“ = RIT+RIC Anwendung: vorbelastete „kranke“ Patienten Radioimmuntherapie und Stammzell-Transplantation Klinische Studien in Ulm (Phase I/II) Studie Patienten Diagnosen Design Antikörper Intensivierte Re-188/ Konditionierung anti-CD66 Zeit A > 18 Jahre AML (high risk) ALL (high risk) CML (> 1. C.P) B 55-65 Jahre C > 18 Jahre AML (high risk) ALL (high risk) CML (> 1. C.P.) Intensivierte Y-90 / Konditionierung Anti-CD66 Läuft D > 18 Jahre Refraktäre AML Intensivierte Y-90 / Konditionierung Anti-CD45 Läuft E 1-18 Jahre HochrisikoLeukämien Intensivierte Re-188 Konditionierung oder Y-90 / anti-CD66 Läuft F 3-90 Jahre Nicht maligne KMKrankheiten Reduzierte Y-90 / Konditionierung Anti-CD66 Läuft AML, ALL, MDS, Reduzierte Re-188 CML, M.Myelom Konditionierung oder Y-90 / anti-CD66 1999 2002 1999 – 2002 Radioimmuntherapie und Stammzell-Transplantation Universität Ulm (Innere Medizin III und Pädiatrie) Patienten: • Gesamtzahl der Patienten: • Internistische Patienten: • Pädiatrische Patienten: Univ.-Kinderklinik Ulm Univ.-Kinderklinik Frankfurt Univ.-Kinderklinik Tübingen N ~ 300 N ~ 250 N = 33 N = 26 N=5 N=2 Antikörper und Nuklide (Kinder): • Anti – CD 66 • Anti – CD 45 • Re – 188 • Y – 90 N = 31 N=2 N = 14 N = 19 CD20+ CD34+ Study schedule Konzept I: Intensiviert Outpatient Dosimetry day - 21 TdT+ CD34+ Inpatient Konditionierung RIT -> CD66-Y90 Hochdosis-Chemoth. day - 14 day - 10 Tx day 0 Patient A.S.; ALL nach Mabthera (Anti-CD20): nach RIT (Y-90, Anti-CD66): Studie – A: > 18 Jahre, AML, Radioimmuntherapie mit Re-188 / Anti-CD66 Percent DFS Überleben in Abhängigkeit vom Remissionsstatus 100 90 80 70 60 50 40 30 20 10 0 < 15% blasts > 15% blasts 57% N = 41 p = 0,0003 8% N = 13 0 500 1000 1500 time in days 2000 2500 Nach: Bunjes, Blood 2001 E - Pädiatrische Studie I – INTENSIVIERT / Leukämien Nuklid N= TRM Rückfall Überleben 188Re 14 8* 4 90Y 11 2* 2 Total 25 10 6 * Infection / GvHD HUS due to RIT in 2 (14%) 48 / 65 mo. 7 (63%) 0 – 37 mo. 9 (36%) n= 8 188Re n= 2 Zwischenergebnis Konzept I Bei Erwachsenen mit Hochrisiko-Leukämien (z.B. nicht in Remission vor Transplantation = therapierefraktär) kann eine Heilung durch Transplantation erreicht werden Bei Kindern ist das Konzept auch durchführbar und kann in Hochrisiko-Situationen angewendet werden CD20+ CD34+ Study schedule Konzept II: Reduziert Outpatient Dosimetry day - 21 Inpatient RIT -> CD66-Y90 RIC -> Tx Flu(+Mel)+ATG day - 14 day - 7 day 0 F - Pädiatrische Studie II – REDUZIERT / RIT+RIC Nicht bösartig N Rezidivfreies TRM Rückfall = Überleben 4 (80%) 5 0 1 0 – 19 mo. 7 (88%) 8 0 1* 0 – 14 mo. Total 13 Erkrankung Leukämien 0 2 11 (85%) Zwischenergebnis Konzept II Die Nebenwirkungen von RIC+RIT sind deutlich geringer als bei normaler Konditionierung Das Konzept kann erfolgreich bei malignen und nicht-malignen Erkrankungen eingesetzt werden -> auch Patienten mit schweren vorbestehenden Organschäden (Leberszirrhose, Lungenpilzinfektion) können durch Knochenmarktransplantation geheilt werden! Zusammenfassung Spezifische Antikörper in der Onkologie • „Ideale“ onkologische Therapie: The current time can be compared with the onset 1 – Spezifität zu erzielen durch Antikörper of antibiotic development thatmonoklonale transformed the 2 – Verträglichkeit durch humanisierte Antikörper treatment of many bacterial infectious diseases. 3 – Effektivität steigerbar durch Immunkonjugate Houshmand and Zlotnik, Current Opinion in Cell Biology, 2003 Vielen Dank! Klinik für Kinder- und Jugendmedizin der Universität Ulm: Tagesklinik der Onkologie, Immunologie und Knochenmarktransplantation