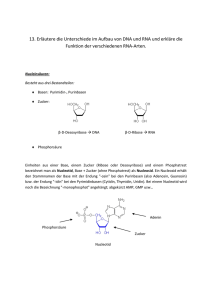
AtGRP7 - Universität Bielefeld
Werbung

Universität Bielefeld SFB 613 Untersuchung des molekularen Mechanismus eines circadianen „slave“ Oszillators mittels Einzelmolekülfluoreszenzspektroskopie und -Imaging M. Lummer1, F. Humpert2, K. Voss1, S. Doose2, M. Schüttpelz2, D. Staiger1, und M. Sauer2 1 Lehrstuhl für Molekulare Zellphysiologie, Fakultät für Biologie 2 Angewandte Laserphysik und Laserspektroskopie, Fakultät für Physik Ziele Arbeitsplan Das Projekt beschäftigt sich mit der Aufklärung des Bindungsmechanismus des circadian regulierten RNA-Bindeproteins AtGRP7 (Arabidopsis thaliana glycine-rich RNA-binding protein) an seine mRNA, das in vivo zu alternativem Splicing führt. Durch die Bindung des Proteins wird eine Strukturänderung der RNA induziert, die durch den Einsatz verschiedener einzelmolekülempfindlicher fluoreszenzspektroskopischer Verfahren aufgeklärt werden soll. Ferner soll geklärt werden, ob eine unterschiedliche subzelluläre Verteilung von AtGRP7 im Tagesverlauf Teil des negativen Rückkopplungskreises ist. Zur Untersuchung des Transports des RNABindeproteins zwischen Cytoplasma und Kern bzw. subnukleären Territorien sollen Mehrfarben-Fluoreszenzimaging-Experimente an Wurzelzellen mit verschiedenen fluoreszierenden AtGRP7-Fusionsproteinen durchgeführt werden. • Untersuchung des Bindungsmechanismus von AtGRP7 und AtGRP8 • Etablierung von PET-FRET-FCS zum Nachweis von Strukturänderungen des Proteins AtGRP7 und der RNA targets • quantitativer Vergleich der Bindungsstärken der reziproken Interaktion von AtGRP7 und AtGRP8 mittels FCS Resultate Es wurden Techniken zur Untersuchung von RNA-Protein-Interaktionen auf Einzelmolekülebene entwickelt: Mittels der Fluoreszenzkorrelationsspektroskopie (FCS) wurde ein minimales Bindemotiv für die Interaktion des RNA-Bindeproteins AtGRP7 mit der 3’ UTR seines eigenen Transkripts definiert. Untersuchungen zur Konformationsdynamik mittels PET-FCS ergaben, dass AtGRP7 im Gegensatz zu vielen bekannten Proteinen mit einem RNA Recognition Motif (RRM) RNA targets ohne ausgeprägte Sekundärstruktur bevorzugt bindet und diese in einer ausgestreckten Struktur arretiert („induced fit“). Erste FRAPExperimente mittels konfokaler Laserrastermikroskopie zeigen, dass der Transport in den Zellkern zu zwei unterschiedlichen Tageszeiten unterschiedlich ist. • Ein- / Zwei-Photonen-Mehrfarben-Mikroskopie der Dynamik von AtGRP7 im Cytoplasma, Nukleus und in subnukleären Kompartimenten • Aufklärung und Quantifizierung der stationären Verteilung von optisch schaltbaren AtGRP7 Fusionsproteinen zwischen Zellkern und Cytoplasma zu verschiedenen Tageszeiten • Aufklärung der Transportpfade und -raten des AtGRP7 Fusionsproteins zwischen Cytoplasma und Zellkern („shutting“) mittels FRAP • Mobilität des AtGRP7-Fusionsproteins innerhalb der verschiedenen Kompartimente Untersuchungen zur Bindung und Konformationsdynamik Mittels FCS konnte gezeigt werden, dass AtGRP7 einzelsträngige RNA und DNA, nicht aber doppelsträngige DNA oder DNA-RNA-Hybride, als Substrat akzeptiert. FRAP-Experimente: Kernimport Es wurden Wurzelzellen transgener Arabidopsis thalianaPflanzen mit einem AtGRP7-GFP-Fusionsprotein mittels konfokaler Fluoreszenzmikroskopie in vivo untersucht. In FRAP-Experimenten wurde ein definierter Bereich des Zellkerns gebleicht und die Rückkehr der Fluoreszenz in diesen Bereich gemessen. Unsere Ergebnisse deuten darauf hin, dass das Protein in Abhängigkeit von der Tageszeit unterschiedlich schnell in den Kern transportiert wird. Zeit Durch den Einsatz von PET-FCS wurde die Rolle der Sekundärstruktur und die Konformationsdynamik der RNA bei der Erkennung und Bindung durch AtGRP7 charakterisiert. Dazu wurde ein für die Bindung minimal notwendiges RNA-Motiv (5´UUCUGG3´) in verschiedenem strukturellen Kontext, d.h. als native Sequenz oder als Hairpin mit unterschiedlicher Länge und Stabilität des Stems, angeboten. Unsere Ergebnisse zeigen, dass AtGRP7 selektiv die ausgestreckte Form des Hairpins bindet und diese arretiert („induced fit“). ZT = „Zeitgeber time“, Stunden nach Lichtbeginn Publikationen [1] M. Schüttpelz, J.C. Schöning, S. Doose, H. Neuweiler, E. Peters, D. Staiger, M. Sauer: Changes in conformational dynamics of mRNA upon AtGRP7 binding studied by fluorescence correlation spectroscopy. Journal of the American Chemical Society, 130(29):9507-9513 (2008) [2] J. Kim, S. Doose, H. Neuweiler, M. Sauer: The initial step of DNA hairpin folding: a kinetic analysis using fluorescence correlation spectroscopy. Nucleic Acids Research, 34:2516-2527 (2006) [3] J.C. Schöning, C. Streitner, D. Page, S. Hennig, K. Uchida, E. Wolf, M. Furuya, D. Staiger: Autoregulation of the circadian slave oscillator component AtGRP7 and regulation of its target genes is impaired by an RRM point mutation. Plant Journal, 52: 1119-1130 (2007) [4] J.C. Schöning, D. Staiger: RNA-protein interaction in the circadian system. In: Methods in Molecular Biology, 479. Editor: Th. Pfannschmidt, Humana Press, in press (2008) [5] M. Schüttpelz, M. Lummer, M. Sauer, D. Staiger: RNA-Protein-Interaktion im Laserfokus. BIOforum, in press (2008) [6] A. Fuhrmann, J.C. Schöning, D. Anselmetti, D. Staiger, R. Ros: Quantitative analysis of single molecule RNA-protein interaction. Biophysical Journal, submitted Universität Bielefeld SFB 613 Zusatzinformation Geplante Weiterführung des Teilprojekts Studium der Konformationsänderung in Protein und RNA mittels FRET und PET bzw. PET-FRET Zur weiteren Charakterisierung des Bindungsmechanismus eines Single RRM-Proteins an sein RNA Substrat soll die Strukturänderung des Proteins bei Bindung an die RNA untersucht werden. Hierzu soll zusätzlich zu dem etablierten Löschmechanismus durch PET der FRET eingesetzt werden, um unter Ausnutzung der unterschiedlichen Abstandsabhängigkeiten der beiden Löschmechanismen den Bindungsprozess mit hoher zeitlicher und räumlicher (struktureller) Auflösung aufzuklären. Es ist geplant, AtGRP7 mit einem Donorfarbstoff und die RNA mit einem Akzeptorfarbstoff so zu modifizieren, dass die bei der Bindung an die RNA auftretenden Strukturänderungen fluoreszenzmikroskopisch verfolgt werden können, um somit gleichzeig die korrelierten Strukturänderungen im Protein und in der RNA in Echtzeit zu verfolgen. Subzelluläre Verteilung von AtGRP7 mit Mehrfarben-Fluoreszenz-Imaging Es soll ein Ein- und Zwei-Photonen-Mikroskopsystem etabliert werden, das die Langzeitbeobachtung von AtGRP7-GFP in lebenden Pflanzenzellen mit Hilfe des hochempfindlichen Mehrfarben-Fluoreszenz-Imagings erlaubt (Live Cell Imaging). Zur Optimierung der Systeme sollen verschiedene Referenzlinien mit spektral unterschiedlich fluoreszierenden Fusionsproteinen hergestellt werden, in denen verschiedene Zellorganellen markiert sind. Interessanterweise wurde AtGRP7-GFP im Gegensatz zu GFP allein im Nukleolus gefunden. Die Charakterisierung des Transports in den Nukleolus sowie eine Kolokalisation mit anderen nukleolären Proteinen soll Ziel weiterer Arbeiten sein. Photoaktivierung: Kernexport Der Export des Proteins AtGRP7 aus dem Zellkern soll durch Photoaktivierung analysiert werden. Erste Experimente mit einem GFP-Derivat erlauben die Studie von Transportprozessen in der Zelle. Eine Quantifizierung dieser Proteinmobilität soll eine Unterscheidung zwischen Diffusion oder aktivem Transport ermöglichen. Bei der Photoaktivierung wird die Fluoreszenz in der gesamten Zelle durch Laserlicht der Wellenlänge 488 nm deaktiviert. Danach wird ein kleiner Bereich im Zellkern mit Licht der Wellenlänge 405 nm aktiviert und der Transport dieser kleinen Population an Fusionsprotein detektiert. Das Auftreten von Fluoreszenz im Cytoplasma gibt den Transport von AtGRP7 durch die Kernpore ins Cytoplasma in Echtzeit wieder. Zum ersten Mal konnte der Kernexport dieses Proteins experimentell gezeigt werden. Die Exportrate soll nun mit optisch-schaltbarem GFP unter Einsatz dieser Technik zu verschiedenen Tageszeiten untersucht werden. 1 min Zelle 2 min AtGRP7 AtGRP7 ? mRNA Exon 4 min Int ron Exon 3‘ 5 min mRNA AtGRP7 mRNA ATGRP7 3 min AtGRP7 0 min AtGRP7 vorher Nukleus Stop Stop RRM Die M9-Domäne im Glycin-reichen Bereich von AtGRP7 ist für den Kernimport verantwortlich. Eine gezielte Punktmutation in dieser Domäne soll die Rolle der M9-Domäne im Kerntransport aufdecken. Posttranskriptionelle Autoregulation von AtGRP7: Eine erhöhte AtGRP7Proteinkonzentration führt zu der Produktion einer alternativ gespleissten instabilen RNA. Das alternative Spleissen wird durch Bindung des Proteins an seine eigene RNA ausgelöst, was zu Konformationsänderungen und / oder veränderter Protein-Protein-Interaktion zwischen Spleissfaktoren führen könnte. Vernetzung mit anderen Teilprojekten / Beantragte Finanzierung Hochempfindliches zeitaufgelöstes 3D-Imaging und der Aufbau der Mehrfarben-Imaging Apparatur mit EMCCD-Kamera ist mit den Projekten A5 und K8 vernetzt. Kraftspektroskopische Experimente werden zukünftig in enger Kollaboration mit K2 und K5 durchgeführt. Weitere methodische Verknüpfungen bestehen mit den Projekten D11 (Expression und Reinigung rekombinanter Proteine), D12 (Proteintranslokation durch nukleäre Pore) und A8 (FCS mit Fluoreszenzlöschung). Beantragte Finanzierung: 1 Doktorandenstelle je Projektpartner jährlich, 9.000 EUR Zubehör für Äkta (TP D11)