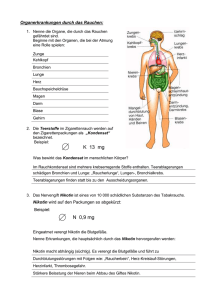
Computergestützte Diagnose von Lungenerkrankungen/ Exploration
Werbung
Computergestützte Diagnose von Lungenerkrankungen/ Exploration von CT-Thoraxdaten Tobias Mönch, Matthias Keil, CV 8. Sem Gliederung 1. 2. Einleitung Bildgebung 3. Computer Tomographie Maximum Intensity Projection Volumerendering Oberflächendistanzbilder Anatomische Reformatierung Einteilung der Lunge in Segmente 2 Bildfilterung Subtraktion Fortgeschrittene Visualisierungsmethoden 5. • • Einfache Visualisierungsmethoden 4. Digitales Roentgen Fissuren Bronchien Blutgefäße & Bronchien Einleitung Anatomie der Lunge 3 Einleitung Digitale Bildgebung der Lunge: – Erkennung pulmonaler Erkrankungen (Veränderungen) • Globale Berechnung der Stärke der Erkrankung • Einteilung in Segmente • Periphere und Homogene Veränderungen • Struktur und Funktion 4 Einleitung – Lokalisation und Prozessdiagnose (Tumore) • Röntgen: Überlagerung von Strukturen • CT: 3 dimensionale Sicht – Verlaufskontrolle (Behandlung) • Auflösung sehr wichtig • Berechnung von Volumen 5 Einleitung – Präoperative Behandlungsplanung • Lokalisation und Nachbarschaft • Volumenbestimmung 6 Einleitung – Berechnung von Lungenparametern (Segmentabhängig) • Globale Berechnung ungenau • Mittlere Lungendichte • Emphysem Index 7 Digitales Röntgen (CR) • Elektronische Photoplatte / Speicherfolie – – – – Seit 1981 (Fuji) Hohe Empfindlichkeit (1/10 der Dosis) Bis 10 Aufnahmen je Sekunde Hohe Auflösung • 10 Linienpaare / mm – Digitale Verarbeitung 8 CR- Bildfilterung • Bildverbesserung – Unsharp Matching • Highpass-Filterung • Resultierendes Bild gewichtet auf Original addiert • Kleine Strukturen und Kanten werden verstärkt – z.B. Pulmonalarterien • Rauschanfällig 9 CR- Bildfilterung • Kontrastanhebung – Wavelettransformation • • • • • Multiscale Repräsentation Gradienten verstärken Senkrecht zu Kanten Inverse Transformation Regionen werden mit Kanten verstärkt • Rauschunterdrückung 10 CR- Subtraktion • Verlaufskontrolle – Tumorwachstum / Ansprechen auf Behandlung • Besser als „Side by Side“ Vergleiche • Registrierung (Überlappung) – Anatomische Landmarken – Geometrische Verformung • Volumenänderung im Subtraktionsbild 11 Computertomographie (CT) • Schichtbildverfahren • Fächerförmige Strahlen – In parallele Geometrie umrechnen • Projektionen messen • 1-D Fouriertransformation – Frequenzraumrepräsentation • 2-D Rücktransformation – Ortsraumrepräsentation http://www.iap.uni-bonn.de/P2K/tomography/auto_rib_cage.html 12 Computertomographie (CT) • Spiral CT: – – – – – Kontinuierliche Abtastung Schnelle Aufnahme Geringe Artefakte Umrechnung der Messdaten in Ebenenprojektion Interpolation • Hounsfield Einheiten: – H = 1000 (m - mw)/(mw - ma) • Artefakte: – Bewegung – Metall – Partialvolumeneffekt 13 SARSSevere Acute Respiratory Syndrome • In Röntgenaufnahmen schlecht diagnostizierbar • HRCT als Lösung http://www.droid.cuhk.edu.hk/web/atypical_pneumonia/atypical_pneumonia.htm 14 Einfache Visualisierungsmethoden • Bereits Standardverfahren – In Visualisierungssoftware integriert – Vom Arzt ausgeführt • Maximum Intensity Projection • Distance MIP Lokalisation und Prozessdiagnose • Volume Rendering Präoperative Behandlungsplanung 15 Maximum Intensity Projection • Lunge vorsegmentieren – Schwellwertverfahren – Keine hellen Strukturen außerhalb der Lunge • z.B. Rippenknochen, Mediastinale Strukturen • Projektion des 3D Datensatzes – Nur hellste Voxel dargestellt • In Echtzeit möglich – Interaktive Rotation 16 Distance MIP • Darstellung des Abstands des hellsten Voxels zur Oberfläche des Lungenvolumens in Projektionsrichtung • Farbkodiert • Nur Voxelintensitäten über bestimmtem Schwellwert 17 Volume Rendering • Direkte Darstellung des 3D-Datensatzes • Ohne Graphik Primitive • Ablauf: – Datenverbesserung – Voxelshading (Phong) parallel – Berechnung der Durchsichtigkeit (Klassifikation) • Anhand der Grauwerte und der Gradienten – Raycasting und undurchsichtiger Hintergrund Pixelwert 18 Volume Rendering • Echtzeitfähig • Slab Technik: – Datensatz durch Clip-Ebenen einschränken 19 Volume Rendering 20 Fortgeschrittene Visualisierungsmethoden • Vorgestellt von MeVis • Befundung von – Rundherden (im Inneren der Lunge) – Pleuraständigen Tumoren (linsenförmig, rund) • Erscheinen als Verdickung des Rippenfells • Projektionsansichten der segmentierten Lunge – Region Growing und Wasserscheiden • Oberflächendistanzbilder • Anatomische Reformatierung 21 Oberflächendistanzbilder • Veränderungen der segmentierten Lungenoberfläche • Projektion des Abstandes Distanzbild • GradientenfilterungVeränderungen verstärkt 22 Anatomische Reformatierung • Verschieben der Zeilen des Datensatzes • Oberfläche der Lunge in einer Schicht • Voxel darunter werden entsprechend mit verschoben • Bei Tumoren ist Oberfläche nicht gleichmäßig • Unnatürliche Verschiebung der inneren Strukturen 23 Anatomische Reformatierung 24 Einteilung der Lunge in Segmente über Fissuren • Fissuren: – Trennung zwischen Lungenlappen – Ca. 1 mm dicke Bindegewebsstrukturen – Unvollständig oder gar nicht sichtbar 25 Fissuren • Erstellen der Lungenmaske – Segmentierung der Luftwege – Trennung der Lungenteile • Gefäßsegmentierung – Region Growing mit automatischem Startpunkt 26 Fissuren • Distanztransformation – Entfernung jedes Voxels zum nächsten Blutgefäß • Berücksichtigen von Fissuren – Gewichtete Addition von Distanzbild und Original – Anpassung an hoch- und niedrigaufgelöste Daten 27 Fissuren • Lungenlappensegmentierung durch interaktive Wasserscheidentransformation – Finden von 3D-Bereichen, die durch lokale Maxima getrennt werden – Hierarchische, markerbasierte WST – Schnelle Anzeige der Segmentierungsergebnisse nach jedem Marker 28 Fissuren • Fazit: – Robustes Verfahren – Geringer Interaktionsaufwand – Volumen stimmt zu >99% überein 29 Einteilung der Lunge in Segmente über den Bronchialbaum • Segmentierung des Lungenparenchyms durch Region Growing • Sigma-Filter – Rauschen unterdrücken – Kanten erhalten • Verfolgung des Bronchialbaumes 30 Bronchialbaum • Skelettierung der Struktur • Interpretation als Graph – Knoten = Verzweigungspunkte – Kanten = Mittelachsen der Gefäße zwischen den Verzweigungen 31 Bronchialbaum • Segment alle Voxel, die näher am entsprechenden Teilbaum liegen • Genauigkeit >70 % • Ursprünglich zur Segmentierung der Leber gedacht 32 Einteilung der Lunge in Segmente über Blutgefäße & Bronchien • Finden der Hauptäste durch 3D-Region-Growing • Vorverarbeitung – – – – – 33 Vergrößern der Schichten (2x) 13x13 Mexican Hat Filter Luftwege dunkel Blutgefäße hell Kantenerhaltendes Region Growing Blutgefäße & Bronchien • Nutzung von anatomischem Wissen – Luftwege und kleinere Blutgefäße verlaufen parallel – Erst Blutgefäße finden, dann in der Umgebung nach Luftwegen suchen • Vergeben von Vertrauenslevels – Blutgefäße (0.5 und 1.0) – Luftwege (0.4, 0.6, 0.8 und 1.0) 34 Blutgefäße & Bronchien • Einstufung der… – Blutgefäße nach… • Größe • Grauwert (auch relativ zur Umgebung) – Luftwege nach… • Grauwert • Nachbarschaft zu Blutgefäßen, deren Größe und Vertrauenslevel • Vorhandensein einer Gefäßwand • Relativer Grauwert zu umgebenden Regionen 35 Blutgefäße & Bronchien 36 Blutgefäße & Bronchien • Aufbau des Bronchialbaums – A-Baum = Primärbaum – B-Baum = A-Baum und alle größeren gefundenen Luftwege – C-Baum = alle Luftwege aus den CT-Schichten • Nachbearbeitung des Baumes – Skelettierung – Füllen von Löchern – Löschen von geometrisch unmöglichen Formen 37 Blutgefäße & Bronchien • Weiterer Ansatz Fuzzy-Logic: – Repräsentation durch Sprachausdrücke • HELLIGKEIT ist NIEDRIG • ADJAZENZ ist HOCH • VORHANDENSEIN_VON_WÄNDEN ist HOCH Vorhandensein von Wänden Helligkeit 38 Niedrig Mittel Hoch Dunkel Mittel Hoch Sehr Hoch Mittel Niedrig Mittel Hoch Hell Sehr Niedrig Niedrig Mittel Blutgefäße & Bronchien • Wahrscheinlichkeitsermittlung über Fuzzy-Logic • Ergebnis: Einstufung von 0 bis 3 • C-Baum besteht aus den mit 2-3 bewerteten Luftwegen 39 Blutgefäße & Bronchien • Fazit: – Getestet an Datensätzen von Hunde-Lungen – Gute bis sehr gute Übereinstimmungen 40 Literatur (1) • • • • • • 41 • S. Krass, D. Selle, D. Boehm, H.-H. Jend, A. Kriete, W. Rau, H.-O. Peitgen, „A method for the determination of bronchopulmonary segments based on HRCT data“ M. Sonka, G. Sundaramoorthy, E. A. Hoffman, „Knowledge-Based Segmentation of Intrathoracic Airways from Multidimensional High Resolution CT Images“ M. Sonka, W. Park, E. A. Hoffman, „Rule-Based Detection of Intrathoracic Airway Trees“ W. Park, E. A. Hoffman, M. Sonka, „Fuzzy Logic Approach to Extraction of Intrathoracic Airway Trees from Three-Dimensional CT Images“ J.-M. Kuhnigk, H. K. Hahn, M. Hindennach, V. Dicken, S. Krass, H.-O. Peitgen, „Lung lobe segmentation by anatomy-guided 3D watershed transform“ J.-M. Kuhnigk, H. K. Hahn, M. Hindennach, V. Dicken, S. Kraß, H.-O. Peitgen, „3D-Lungenlappen-Segmentierung durch Kombination von Region Growing, Distanz- und WasserscheidenTransformation“ http://www.mevis.de/projects/thorax/segments/segments.html (16.05.04) Literatur (2) • • • • • • • • 42 http://www.mevis.de/projects/thorax/radiography/chest.html (16.05.04) http://www.droid.cuhk.edu.hk/web/atypical_pneumonia/atypical_pneum onia.htm (16.05.04) http://www.iap.uni-bonn.de/P2K/tomography (16.05.04) http://dpi.radiology.uiowa.edu/spie/sonka/lung.html (16.05.04) J. Lu, D. M. Healy Jr. and J. B. Weaver, „Contrast Enhancement of Medical Images Using Multiscale Edge Representation“, SPIE vol. 2242 Wavelet Applications, pp. 711-719, 1994 A. Polesel, G. Ramponi and V.J. Mathews, „Adaptive Unsharp Masking for Contrast Enhancement“, Proc. Fourth IEEE Intern. Conf. on Image Processing, ICIP-97, S.Barbara, CA, Oct.26-29, 1997 Marc Levoy, „Display of Surfaces from Volume Data“, IEEE Computer Graphics and Applications, Vol. 8, No. 3, May, 1988, pp. 29-37 S. Krass, D. Selle, A. Bödicker, W. Spindler, H. Seyffarth, H.-H. Jend, „Computergestützte Radiologie des Thorax“