Bohrsches Atommodell
Werbung

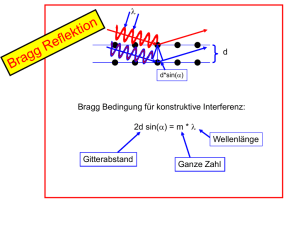
Kernstruktur des Atoms Wie ist Ladung und Masse im Atom verteilt? Positive Ladung und Masse lokalisiert oder delokalisiert? Kernstruktur des Atoms Betrachte die STREUUNG geladener Teilchen “Streuwinkel” “Stoßparameter” b Kernstruktur des Atoms “Streuwinkel” “Stoßparameter” b Z1Z2 e2 b= mv2 tan(/2) für Coulomb Abstoßung zwischen Punktteilchen Kernstruktur des Atoms “Streuwinkel” “Stoßparameter” b Kann nicht “Zielen” d.h. kenne b nicht ist die einzige Messgröße “Schrotgewehr” Z1Z2 e2 b= mv2 tan(/2) d.h .für reine Coulombstreuung an Punktteilchen erwartet man eine Wahrscheinlichkeitsverteilung der Streuwinkel 1/sin4(/2) Fläche =2 b db Ringzone = Raumwinkel dR für Streuung zwischen Θ und Θ+dΘ dR 2 sin d d j 2 b db j dR j sei Stromdichte der einfallenden Teilchen d 2 d b db Z Z e 1 2 mit b a cot und a 2 m v2 d sin d a2 d a cos / 2 1 a 4 sin 2 sin / 2 2 cos / 2 sin / 2 2 sin / 2 4 2 d Energie fest, detektiere Streuwinkel Setzt reine Coulombstreuung voraus. d.h. wenn Kernberührung -> Abweichungen! Z1 Z 2 e 2 1 rm 1 R1 R2 3 fm sin 2 mv 2 rm “Coulomb Schwelle” (einige MeV/u) Winkel fest, variiere Energie Setzt reine Coulombstreuung voraus. d.h. wenn Kernberührung -> Abweichungen! Rutherfords Erklärung Weil einige der positiv geladenen Alpha Teilchen beträchtlich abgelenkt wurden, schloss Rutherford daraus, dass sich im Innern des Atoms ein dichtes, positiv geladenes Objekt befindet, an dem Alpha Teilchen zurückprallen können: der Atomkern. Spektralanalyse Wasserstoff-Spektrallinien Absorbtionsspektren Wasserstoff Gas Wasserstoff Absorbtionsspektrum Helium Spektrallinien Emissionsspektren Helium Wasserstoff Emissionsspektrum Wellenlänge nm H Spektralanalyse Kirchhoff und Bunsen: Jedes Element hat charakteristische Emissionsbanden Rydbergkonstante 109678 cm-1 infrarot sichtbar ganze Zahlen ultaviolett Lyman n1=1 Balmer n1=2 Paschen n1=3 Die Bohrschen Postulate Wie Rutherford Elektronen auf Kreisbahnen Coulomb Anziehung Z=1, e- Zentrifugalkraft: mer2 Widerspruch zur klassichen Mechanik & Maxwellgleichungen: •Bewegte Ladung strahlt Energie ab, Elektron stürzt in Kern! •Strahlung ist nicht quantisiert keine diskreten Linien! Widerspruch zur klassichen Mechanik & Maxwellgleichungen: •Bewegte Ladung strahlt Energie ab, Elektron stürzt in Kern! •Strahlung ist nicht quantisiert keine diskreten Linien! Bohrsche Postulate (Niels Bohr 1913) •Elektronen bewegen sich auf Kreisbahnen •Die Bewegung ist strahlungsfrei rn •Der Drehimpuls der Bahnen ist quantisiert L=m v r=n ħ n (Historisch nicht korrekt) e2 v2 m 2 4 0 r r 1 • erlaubte Kreisbahnen L mv r n 2 n2 rn 4 0 m e2 e2 vn 4 0 n 1 Bohrsche Atomradius 2 2 rn 4 0 2 n me (n=1, 2, 3, …) Grundzustand des H-Atoms (n=1): a0=0,529*10-10 m n=1 K-Schale max. 2 Elektronen n=2 L-Schale max. 8 Elektronen n=3 M-Schale 2*n2 Elektronen Gesamtenergie des Elektrons auf der Bahn: Eges = Ekin + Epot E ges 1 e2 2 mv 2 4 0 r 0 Energie Epot r negativ Energie die frei wird wenn Elektron von unendlich zum Radius r gebracht wird. Gesamtenergie des Elektrons auf der Bahn: Eges = Ekin + Epot E ges 1 e2 2 mv 2 4 0 r m v2 e2 r 4 0 r 2 Eges e2 e2 8 0 r 4 0 r Eges e2 m e4 1 2 2 2 8 0 r 80 h n Einige Zahlenwerte: Radius des Wasserstoffatoms rn=1= 0.59 10-10m Ionisierungsenergie des Wasserstoffatoms En=1= 13.59 eV Z2 !! dh. Uran 115 keV Heisenbergsche Unschärfe x px ħ Elektronische Übergänge: Die bei einem Bahnwechsel erforderliche bzw. freiwerdende Energiedifferenz kann in Form von elektromagnetischer Strahlung aufgenommen bzw. abgegeben werden. E E2 E1 h mit h 2 0,41 10 14 eV Hz m e4 1 1 1 18 1 E 2 , 18 10 2 2 2 2 2 8 0 h n1 n2 n1 n2 E h hc 1 1 1,097 10 m 2 2 n1 n2 1 7 Rydberg Konstante Korrektur durch endliche Kernmasse Folge: Isotope haben verschiedenen Spektrallinien Korrektur: Wasserstoff Energie 0.0545 % mdeuteron / mproton = 2 Sommerfelds Korrekturen zum Bohr Modell Ha ist aufgespalten Sommerfelds Korrekturen zum Bohr Modell Keplerellipsen statt Kreisbahnen Nebenquantenzahl k (zu n) beschreibt kleine Halbachse relativistische Bewegung in Kernnähe -> E hängt auch von Elliptizität ab Sommerfeldsche Feinstukturkonstante a Geschwindigkeit auf n=1 Bahn = 1/137 c