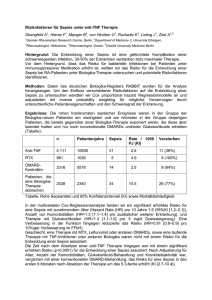
Document
Werbung

Ernährung in der Chirurgie R.Stocker Abteilung Chirurgische Intensivmedizin Universitätsspital Zürich Geschichte • Zusammenhang zwischen “Essen” und “Wohlfühlen” seit Jahrtausenden bekannt • Schon primitive Kulturen suchten nach und verabreichten Nahrungsmittel an Schwache und Kranke, denen sie magische und heilende Eigenschaften zusprachen Geschichte • Erkenntnisse über zentrale Rolle des Darmes bei der Entstehung post-chirurgischer Komplikationen führte nach einer Phase konsequenten Fastens über den Umweg der parenteralen Ernährung zum Konzept der frühenteralen Ernährung, welches heute eine der wenigen “evidence based” Therapien in der Intensivmedizin darstellt Stoffwechsel I • Ernährungstechnisch 3 Kompartimente – Fettfreies Gewebe: Skelettmuskulatur: labiler Protein-Pool für Körper und Leber, Glykogenspeicher – Körperfett: Hauptenergiespeicher, wenig metabolische Aktivität, wenig strukturelle Funktionen – extrazelluläres Wasser: Hauptzuordnungsort der Glukose; quantitativ wenig, qualitativ sehr wichtig. Pool stellt Substrat für Muskulatur zur Verfügung stellt Abtransport "metabolischer Abfälle" sicher. Stoffwechsel II • Antwort auf Fasten und Verletzung / Infektion Netto-Katabolie von Körpersubstanz zur Energie- und Substratgewinnung unter Präservation der vitalen Organe (Hirn, Herz, Leber, Niere..) auf Kosten von Muskulatur und Bindegewebe Stoffwechsel III • Fasten – Angepasst an cyklische bzw. saisonale Nahrungszufuhr: • In Überschusszeit: Hauptenergielieferant=Kohlehydrate. Überschusszufuhr wird in der dichtesten Form als Fett gespeichert Stoffwechsel IV • Fasten – Bei Mangelzufuhr: Energiegewinnung aus Fettspeicher, Reduktion des Energieverbrauches. • 1. Glykogenolyse (72 h) • 2. Glukoneogenese: Glukosegewinnung aus glukoplastischen AS (u.a. Glutamin) und Glyzerol für obligate Glukoseverbraucher (Ec,RES, Makrophagen, Hirn) • 3. Lipolyse: Energie aus Fettspeicher Stoffwechsel V • Kritisch Kranke, Verletzung, Infektion – Akutphasenantwort (TNF, IL-1....) mit Ziel, Leber- und Immunsystemvolumen zu vergrössern um Infektabwehr zu verbessern und Wundreparation zu initiieren => Energieintensiv (v.a. Glukoneogenese und Proteinsynthese) – erhöhter Energieverbrauch – Katabolie von Speichern Stoffwechsel VI • Kritisch Kranke, Verletzung, Infektion – Katabolie durch gegenregulatorische Hormone (antiinsulinär, Stresshormone) • Katabolie nur reduzierbar aber nicht umkehrbar solange Trigger weiterbesteht – Insulinresistenz peripherer Gewebe Nur bei gutem Ernährungszustand und unkompliziertem Verlauf gilt "5-TageRegel" für Ernährungsbeginn Stoffwechsel VII Charakteristik Fasten (Marasmus) Energieverbrauch Primärer Energielieferant Insulin Ketonkörper Gegenregulationshormone (ACTH, STH, Katecholamine, Kortisol, Glukagon) Totales Körperwasser Proteolyse Glycogenolyse Lipolyse erniedrigt Fett (RQ 0.75) Metabolische Antwort auf Verletzung erhöht gemischt (RQ 0.85) erniedrigt vorhanden basal erhöht (Resistenz!!) fehlend erhöht erniedrigt erniedrigt erhöht erhöht erhöht beschleunigt beschleunigt erhöht Stoffwechsel VIII Charakteristik Körperspeicher Muskulatur Fett Viszerale Proteine „Refeeding“-Antwort Gewichtsverlust Typisches Vorkommen Fasten (Marasmus) Metabolische Antwort auf Verletzung reduziert reduziert erhalten Anabolismus graduell chronische Krankheiten reduziert reduziert erhöht(Leber, Immunsystem) reduz. Katabolie beschleunigt Spital, ICU Stoffwechsel IX Stoffwechselveränderungen nach Verletzung, Trauma und Sepsis – Aggressionsstoffwechsel (ebb phase) • unmittelbar nach Trauma für Stunden bis 1-2 Tage • Metabolische Paralyse • Energieverbrauch tief • initiale der Insulinsekretion • starke der katabolen (gegenregulatorischen) Hormone • Energiebereitstellung, Glukose- und Fettoxidation • Entleerung der Energiespeicher – verminderte Eiweissynthese Stoffwechsel X Stoffwechselveränderungen nach Verletzung, Trauma und Sepsis – Postagressionsstoffwechsel (flow phase) • ab h bis 1-2 d, bei unkompl. Verlauf ca. 10 Tage • Stressstoffwechsel: toxin-/zytokinbed. Überwiegen antiinsulinärer Faktoren • Katabolie, Hypermetabolismus • Insulinresistenz (Glukoseverwertungsstörung trotz hoher Insulin-sekretion) • EN-Gewinn aus Lipolyse, Glukoneogen.aus(körpereig.) Proteinen • Katecholamin-/Glukagon-/Insulin-/Kortisolanstieg • Umstellung auf Fastenstoffwechsel nicht möglich Stoffwechsel XI Stoffwechselveränderungen nach Verletzung, Trauma und Sepsis – Septikämiestoffwechsel • Wie Postaggressionsstoffwechsel mit zusätzlicher partieller Lipid- und Ketonkörperverwertungsstörung bei maximalem Energiebedarf • Maximale Proteolyse für Glukoneogenese unter Energieaufwand (septischer Autokannibalismus) mit beschleunigter Muskelproteolyse und AS-Freisetzung trotz Verwertungsstörung Stoffwechsel XII Stoffwechselveränderungen nach Verletzung, Trauma und Sepsis • Rekonvaleszenzstoffwechsel – anabol, insulinbetont – bessere Glukoseverwertung, Eiweissresynthese – Wiederauffüllen der Reserven Stoffwechsel XIII • Patienten brauchen in der Postaggressionsphase – mehr Kalorien (1500-2500 kcal/die); CAVE Überernährung – mehr Proteine: 80-150 kcal/g Stickstoff – initial weniger Kohlehydrate – initial mehr Lipide – mehr Vitamine und Spurenelemente Physiologie • Oberer GI-Trakt (Magen, Dünndarm) normalerweise steril • Kolon, Rektum: Oekologisches Gleichgewicht verschiedenster (apathogener und potentiell pathogener) Mikroorganismen • Intakte Darmwand (Mukus,Epithel,Zelldesquamation, IG-A-Opsonierung) verhindert normalerweise Translokation • Bei vereinzelter Translokation: Vorsorgliche systemische IG-Produktion Pathophysiologie Physiologie • Bakterielle Flora – von neutralen Mucinen und Sulfomucinen, von Sialomucinen im Dünndarm – von neutralen Mucinen und Sulfomucinen, Sialomucinen in Zoekum und Kolon • Ausdruck der bakteriellen mukolytischen Aktivität und der Effekte von bakteriellen Metaboliten auf die Mukosa Meslin et. al. Comp Biochem Physiol A Mol Integr Physiol 1999 123:235 Physiologie • Bakterielle Flora –Degradation von Substraten • Lösliche Nahrungsfasern werden zu SCFA abgebaut; stellen Hauptnährsubstrat der Kolonozyten dar Physiologie • Die Gegenwart einer normalen intestinalen Flora verbessert die Heilung von intestinalen Anastomosen Okada et. al. 1999 Br J Surg 86:961 Physiologie • 50% der Nährstoffe des Dünndarmepithels und > 80% der Nährstoffe des Dickdarmepithels kommen aus dem Darmlumen Pathophysiologie • Kritisch Kranke: empfindlich gegenüber Schädigung der intestinalen Mukosa, Veränderungen der mukosalen Permeabilität, und Versagen der intestinalen Abwehrmechanismen Pathophysiologie • Translokation von Bakterien und Endotoxin => SIRS, Sepsis => MOF (Yao et al. Resuscitation 1995) Pathophysiologie Bakterielle Translokation: • Für Sepsis verantwortliche Organismen Organismen, die in mesenterialen Lymphknoten gefunden werden können. Unterstützt “gut origin hypothesis” der Sepsis beim Menschen. (OBoyle et al. GUT 1998) Protektion gegen bakterielle Invasion • Selective Digestive Decontamination (SDD)??? – Selektion von mehrfach-resistenten G+ Kokken. Kein Effekt auf Mortalität. Deutliche finanzielle Belastung Quino et. al. 1996. Chest 109:765 Pathophysiologie • Antibiotika selektionieren pathogene Darmkeime und können zu Resistenzbildung führen (z.B. Cl difficile, extended-spectrumbeta-lactamase-producing Klebsiella pneumoniae, Enterokokkus faecalis) Decre et. al. 1998 Clin Inf Dis 27:834 Protektion gegen bakterielle Invasion • Erhalt der Darmflora • Erhalt der Darmmukosa – endoluminale Substratzufuhr – Optimierung der intestinalen Hämodynamik – Substratangebot für schnell replizierende Zellen (z.B. Glutamin) • Aufrechterhaltung der Peristaltik Ziele der Ernährung • Sicherstellung einer adäquaten Substratzufuhr zur Aufrechterhaltung der morphologischen und funktionellen Organintegrität sowie zur Adaptation an Akutphasenreaktion nach Trauma/ Operation.... • Erhalt der funktionellen und morphologischen Integrität des Gastro-Intestinaltraktes Folgen der Malnutrition • Beschleunigte Katabolie (u.A. Skelett-/Atemmuskulatur) • Störung der Wundheilung • Störung der Immunabwehr • Störung der Organfunktionen u.A. auch des Darmes => Risiko für MOV • Verzögerte Rehabilitation Ernährungsplanung • Ernährungszustand? – normal – Malnutrition • Aktueller Kalorien-/Substratbedarf • Monitoring • Ernährungsroute Ernährungszustand • Body Mass Index (BMI): Gewicht (kg)/Grösse (m2) – – – – BMI 20 18-19 15-17 <15 Punkte 0 1 2 3 • Nicht beabsichtigter Gewichtsverlust in den letzten 3 Monaten Gewichtsverlust – keiner – 0-3 kg – 3-6 kg – >6 kg Punkte 0 1 2 3 Ernährungszustand • Appetit Punkte – gut; 3 Malzeiten/Tag – schlecht (weniger alsdie Hälfte/ kleine Portionen – kein (isst nichts oder kaum) • Fähigkeit zu essen – problemlos, selbständig keine – Kauschwierigkeiten, Nausea Diarrhoe/Erbrechen Erbrechen, Durchfall (bis 2 x/die) 0 2 3 Punkte 0 1 – Kauprobleme, Schluckprobleme braucht pür./fl. Kost, Hilfe b. Essen, Erbrechen/Diarrhoe 3-5x/die 2 – orale Ernährung unmöglich schweres Erbrechen u/o massive Diarrhoe > 5x/die 3 Ernährungszustand • Metabol. Stressfaktor – kein – gering – mässig konsum. Grunderkr. Infekt leichter Infekt,minor Surgery grösserer Infekt,Dekubitus,Frakturen, Verbrennung < 20%,major Surgery, aktive chron.entzündl.K’heiten Punkte 0 1 2 – gross Polytrauma,mult.Fx. Verbrennung >20%, mult. Dekubiti, Sepsis,fortgeschr. Malignome, Leberinsuffizienz, AIDS 3 • Beurteilung Punkte Risiko Massnahmen 0-3 4-6 7-15 gering erhöht hoch Überwachung Monitoring,Ergänzungsnahrung prä-/postoperative Ernährungstherapie Ernährungszustand • Zusatzparameter – Oberarmumfang – Hautfaltendicke – Wadenumfang Kalorienbedarf Grundumsatz || Harris Benedict – 21 kcal/kg KG/die || 66.5+(13.7xkg)+(5xL)-(4.7xAlter) – 24 kcal/kg KG/die || 655+(9.6xkg)+(1.8xL)-(6.8xAlter) + Aktivitätsfaktor – liegender Spital-Patient + 20% GU – mobilis. Spital-Patinent + 30-40% GU – Ambulant + 50% (Büro)- +70%(Maurer) + Krankheitsfaktor – Fieber +10-20% GU/°Fieber, Sepsis +10-40% GU – Verbrennung +40-50% GU, Polytrauma +40-100% GU – ......... Monitoring I • Indirekte Kalorimetrie (z.B. Deltatrac) = Referenzmethode (Jolliet et al. Enteral nutrition in intensive care patients: a practical approach. Intensive Care med 1998) Monitoring II • Albumin (HWZ 2-3 h bis 20 Tage; viele Einflüsse) • Transferrin (HWZ 8-10 Tage; prognostischer Wert, reagiert besser auf nutritive Repletion als Albumin) • Präalbumin (HWZ 2 Tage; Prädiktiv für Stickstoffstatus und nutritive Repletion) • Retinol-bindendes Protein (HWZ 12 h; transportiert durch Präalbumin; reagiert sehr schnell auf nutritive Repletion) • Cholinesterase (HWZ 5-12 Tage; Mass für funktionelle Leberzellmasse; Synthese an Albuminsynthese gekoppelt) Monitoring III • Fettstoffwechsel – Cholesterin – Triglyceride • Stickstoffbilanz: Harnstoff (24h Urin)[mmol / l ] 24h 0.451.2g N /Tag 16.6 • Lymphozytenzahl Monitoring IV • Körpergewicht (unbrauchbar bei Capillary Leak) • Antropometrie (unbrauchbar bei Capillary Leak) • indirekte Kalorimetrie • Bioimpedanzanalyse (unbrauchbar bei Capillary Leak) Ernährungsroute Total/Partielle Parenterale Ernährung Zentral Peripher Enterale Ernährung Gastral Postpylorisch duodenal Jejunal Parenterale Ernährung TPN Indikationen – Unmöglichkeit der oralen/enteralen Ernährung innerhalb der ersten 5-7 Tage bei normalem Ernährungszustand – Ergänzung unzureichender enteraler Kalorienzufuhr – Prä-/postoperativ bei schwerer Malnutrition und Unmöglichkeit einer oralen/enteralen Ernährung – Speicherschutz perioperativ (peripher-venös) Parenterale Ernährung TPN Substrate Glukose Fette Aminosäuren, Proteine Vitamine, Spurenelemente (Zn, Cu, Se) Parenterale Ernährung TPN – Glukose: Minimale Glucosezufuhr insulinunabh., endogenen Glucoseverbrauch von Gehirn, Ec, Makroph, RES (ca. 150-200 g/die); Glucoseutilisation, der Glucosezufuhr. CAVE: CO2-Produktion – Insulin in nicht-Diabetikern ???(Lebersteatose, intrahepatische Cholestase) – Fette: Stresstoffwechsel, Sepsis: initiale Hauptenergiequelle: Fett (CAVE: gestörte Fettclearance) – Aminosäuren: Nicht-Proteinkalorien:Stickstoff = 80-150:1 (entspricht 70-150 g/die bzw. 0.8-1,5 g/kg KG) Spezielle Substrate I • Arginin – Stickstoffbilanz – Wundheilung (Kollagensynthese und -deponierung) – thymusabhängige und T-Zell-abhängige Immunfunktion • Glutamin CAVE: Glutamat bei Schädel-Hirn-Trauma – Energiesubstrat für schnell replizierende Zellen wie Immunzellen und Enterozyten – Makrophagenfunktion – Schützt Glutathionspeicher in Leber, oxidativen Stress, posttraumatischen/septischen Leberschaden – Stickstoffbilanz – Trophische Effekte auf Darmmukosa=> Translokation Spezielle Substrate II • Omega-3-Fettsäuren – Bildung und Metabolismus von proinflammatorischen Prostanoiden (Arachidonsäure, Leukotriene, Thromboxane) und Zytokinen v.a. im Zusammenhang mit Endotoxin, Sepsis, Reperfusion • Medium-Chain-Triglyceride (MCT) – nicht als Überschussfett gespeichert =>instantane Oxidation – Trsp ohne Chylomikronen=>schnellere Verfügbarkeit und Clearance – Carnitin-Carrier-unabhängiger Transport in Mitochondrien => bessere Clearance, schnellere Verfügbarkeit für Oxidation – kleinere Aufnahme in RES=>kleinere Beeinträchtigung der RES-Funktion – CAVE: intrazelluläre Fettüberladung Spezielle Substrate III • Fasern Gemisch aus unlöslichen und/oder löslichen, unverdaulichen pflanzlichen Zellwandpolysacchariden – Lösliche Fasern: Degradation zu SCFA => Primäres Substrat für Kolonmukosa: Translokation, MOV – Unlösliche Fasern (Regulation intestinaler Transit, Reduktion von Diarrhoe) – günstige Einflüsse auf gastrointestinale Anastomosen – Verbesserter Erhalt der Kolonintegrität. Verbesserte Wundheilung – Verbesserte Stoffwechseladaptation nach Chirurgie, Trauma – Verzögerte Kohlehydratresorbtion – Reduzierte Absorbtion bis zu Nettoverlust von Eisen, Kupfer Spezielle Substrate IV • Verzweigtkettige Aminosäuren – Einflüsse auf Proteindegradation und Synthese im Skelettmuskel – Hauptmetabolisierung in Peripherie (und nicht in Leber) – passieren Bluthirnschranke; Competitieren mit aromatischen AS (Vorläufer von MonoaminNeurotransmittern) =>Vorteile bei Leberinsuffizienz (Enzephalopathie) =>potentielle Vorteile beim septischen Autokannibalismus Enterale Ernährung Indikation • Grundsätzlich alle Intensivpatienten die nicht ausreichend peroral ernährt werden können • Auch bei – fehlenden Darmgeräuschen – retroperitonealen Hämatomen – Post-Laparotomie – ................ Positive Effekte der enteralen Ernährung • Verbesserte Darm Hämodynamik sichert Splanchnikusintegrität (Purcell et al. Am J Surg 1993 ). • Splanchnische hämodynamische Parameter: während EndotoxinSchock,EN alle Parameter (Kazamis et al. World J Surg 1998) Positive Effekte der enteralen Ernährung • EN septische Morbidität verglichen mit Fasten und TPN . Schlüsselmechanismus: Erhalt mukosalen Barrierenfunktion (VA study JPEN 1992) • Früher Beginn mit EN: signifikant günstiger Effekt auf septische Komplikationen (Minard G et al. New Horiz 1994) Wie früh ist früh? • Beginn der EN innerhalb der ersten 6 Stunden nach Trauma: – intestinale Permeabilität – MOF Score • verglichen mit einem Beginn später als 6 Stunden (Kompan et. al Intensive Care Med 1999) Problem: Gastrische Kolonisierung Kontinuierliche gastrale Ernährung erhöht gastralen pH. Cutoff point für bei pH 4 für Kolonisation mit G-Bakterien. (Dive et al. Gastic acidity and duodenogastric reflux during nasojejunal tube feeding in mechanical ventilated patients 1999 Intensive Care Med) Problem: Gastrische Kolonisierung Massnahmen: • Nächtliche Pause • Jejunale Ernährung (nur kleiner Reflux mit mittl. pH-Werten von 2,7 => Bakterizidie bleibt erhalten) (Dive et al. Gastic acidity and duodenogastric reflux during nasojejunal tube feeding in mechanical ventilated patients 1999 Intensive Care Med) “How to do” • Start innerhalb 2 Stunden nach Eintritt mit 20 ml Sondennahrung/h via Magensonde (Triggerung, Blutfluss-Redirektion, Ulkusprophylaxe; nicht Kalorienzufuhr) • Wenn perorale Nahrungsaufnahme möglich: Trinken/Essen sobald gut wach und Bedürfnis vorhanden “How to do” • Steigerung innerhalb 48-72 h bis kalorische Bedürfnisse gedeckt • Prokinetika falls erforderlich • Nächtliche Pause wenn möglich “How to do” • Kalorien-/Proteinbedarf – 20*-25, 25*-30 non-protein kcal/Tag – 1.0*-1.2-(1.5) g/kg KG Proteine/Tag (*Alter) – Erhöht bei Fieber,Infekt, Sepsis “How to do” • Zusätzliche/Spezifische Substrate – Unlösliche Fasern (Regulation intestinaler Transit, Reduktion von Diarrhoe) – Lösliche Fasern: Degradation zu SCFA => Primäres Substrat für Kolonmukosa – Vitamine, Spurenelemente – Glutamin (Energiesubstrat für schnell replizierende Zellen wie Immunzellen und Enterozyten) – -3 Fettsäuren, Arginin, Nucleotide: Immunonutrition Kontraindikationen • Grundsätzlich keine • Patienten mit ausreichender peroraler Nahrungsaufnahme • etablierter Ileus • Relativ – Subileus – proximale Darmanastomosen – “Abdomineller Hochdruck” Problem: Gastraler Transport, Gastroparese • Häufig • Ursachen:z.B. ICP ,Zytokine, Corticotropin-Releasing Factor, Opiate, Dopamin (Tarling MM et. al. A model of gastric emptying using paracetamol absorption in intensive care patients Intensive-Care-Med. 1997 De Deyne C et. al. Early enteral feeding in cranial trauma. Ann-Fr-Anesth Reanim. 1998) • Magenaspirat > 150 ml ODER > 2 x stündliche Zufuhrrate Problem: Gastraler Transport, Gastroparese 1. Opioide, Sedation, 2.Metoclopramide 10 mg 3 x/Tag 3.Cisapride 10 mg - 20 mg /Tag 4.(Erythromycin) 5.Naso-Jejunal-Sonde(Spitze distal Treitz) mit gastr.Dekompression 6.ggf. Reduktion der Zufuhrrate Problem: Diarrhoe Ursachen: 1. Verzögerter Beginn/vorgängiger Unterbruch der enteralen Zufuhr 2. Malnutrition/Hypalbuminämie 3. Fieber/Hypothermie 4. Vorliegen eines Infektfokus 5. Antibiotika (Bleichner et.al. 1997. Saccharomyces boulardii prevents diarrhea in critically ill tube-fed patients. Intensive Care Med) Problem: Diarrhoe Massnahmen: 1. oder stop von Antibiotika 3. Auschluss einer AB-induzierten Kolitis (Cl.difficile) 2. Saccharomyces boulardii* 4. Zusammensetzung, Intoleranz, Fasern, Osmolarität (*Bleichner et.al. 1997. Saccharomyces boulardii prevents diarrhea in critically ill tube-fed patients. Intensive Care Med) Schlussfolgerung • Die frühe enterale Ernährung dient nebst der Kalorienzufuhr der spezifisch Behandlung des Darmes und des Splanchnikusgebietes und ist deshalb ein essentieller Teil der Intensivtherapie Schlussfolgerung • Gastrische Stase, Fehlen von Darmgeräuschen, und kürzlich durchgeführte Abdominalchirurgie sind keine Hindernisse für die frühe enterale Ernährung. • Mit motivierten Mitarbeitern, der Verwendung von Prokinetika und jejunalen Ernährungssonden kann eine früh-enterale Ernährung bei praktisch allen Patienten erfolgreich durchgeführt werden Schlussfolgerung • Trotz hohem Morbiditätspotential ist die natürliche intestinale Flora entscheidend für eine intakte Darmphysiologie • Ziel ist nicht die Keimelimination sondern die Integritätserhaltung der mukosalen Barriere gegenüber der Translokation von Toxinen und Mikroorganismen sowie der Erhalt eines physiologischen Darmmilieus Schlussfolgerung • Die Enterale Ernährung dient nebst der Kalorienzufuhr der spezifisch Behandlung des Darmes und des Splanchnikusgebietes und ist deshalb ein essentieller Teil der Intensivtherapie