Zeitauflösung
Werbung

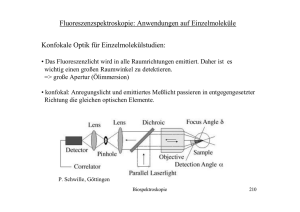
trFTIR Atomar aufgelöste Beobachtung von Proteinen in Aktion Nutzung von trFTIR in der Bioanalytik NMR und XRD: Struktur eines Proteins im Grundzustand, statisch trFTIR gibt Informationen über die Proteindynamik auf atomarer Ebene in μs bis ns Zeitauflösung unter physiologischen Bedingungen! ? Informationen: - Ladungsverteilung - H-Brücken - Protonierungszustände - Kinetik Differenzspektren Identifizierung und Beobachtung von reaktiven Gruppen I1 (v) E log I ( v ) 2 Apparatur Hohe Anforderungen, da Hintergrundintensität viel stärker ist, als die Intensitätsänderungen (3-5 Größenordnungen) • Michelson Interferometer (Multiplexvorteil) • Gleiche Bedingungen bei jeder Messung! • Wiederholungsmessungen zur Verbessung des Signal/Rausch Verhältnisses (~ n ) Apparatur L M Z Michelson Interferometer D Zeitauflösung Reaktionsinitiierung a) Direkt über ns - Laserblitz nur bei photobiologisch aktiven Proteinen z.B. Bacteriorhodopsin b) Photolabile Trigger-Substanzen z.B. Caged ATP ATP NO2 c) Mischzellen max. µs - Auflösung hv ATP + N O O O N O + ATP Zeitauflösung Rapid Scan Step Scan • Spektrenaufnahme mit schneller Spiegelbewegung schnelle aufeinanderfolgende Aufnahme vollständiger Interferogramme - It(x) • Bei fixierter Spiegelposition wird Zeitabhängigkeit des Signals gemessen - Ix(t). Wiederholung der Messung bei jeder Spiegelposition • ms - Auflösung • ns - Auflösung (Detektionsbegrenzung) • auf alle Reaktionen anwendbar • nur zyklische Reaktionen (z.B. Bacteriorhodopsin), andernfalls besondere Technik notwendig Zeitauflösung Step Scan Technik Häufige Reaktionswiederholung (oft > 1000x) genau gleiche Bedingungen! Techniken für azyklische Reaktionen: • Flow cells Austausch der Substanz - hoher Substanzbedarf - kleine Extinktionsänderungen nicht messbar (grosse Zelldimensionen) • Fokussierung des Laser/IR Strahls Messung von einzelnen Probensegmenten - 4 μm Film zwischen CaF2-Fenstern (Filmdicke ± 10%) - Aufheizung der Probe - Beeinflussung von Segmenten durch Streulicht Bandenzuordnung Austausch von Aminosäuren Eine bestimmte Extinktionsänderung entfällt (neue Aminosäure ist unreaktiv) Problem: invasive Mutation Isotopenmarkierung Verschiebung der Wellenzahl der Extinktionsänderung (Isotopeneffekt) Beispiel für ein Step Scan trFTIR Gerät • Kommerzielles FTIR Spektrometer mit Globar, Beamsplitter, Spiegel • Farbstofflaser (Laserblitz ca. 20 ns) • Individuelle Anfertigung von Messzelle und Signalverstärker • Kommerzieller stickstoffgekühlter MCT-Detektor (Mercury/Cadmium/Tellur) mit einer Zeitauflösung von ca. 20 ns • Schnelle Photodiode, die durch Laserreflex aktiviert wird und Aufnahme der Daten auslöst • 3 mbar Vakuum im Geräteraum, um Vibration des Spiegels durch Geräusche zu minimieren • Isolationstisch und Temperaturkontrolle Zusammenfassung und Ausblick Vorteile der trFTIR - physiologische Bedingungen - Informationen über H-Atome und Ladungsverteilungen - Instabile Intermediate sind messbar - Kinetische Informationen Nachteil Noch keine Standardprozedur zur Vermessung verschiedener Proben verfügbar. Aufwändige, auf das Problem zugeschnittene, technische Modifikationen Ausblick - Standardisierung und Validation der Methoden - fs - Zeitauflösung - Theoretische Berechnung kompletter IR-Spektren und Vergleich mit dem Experiment Struktur und Ladungsverteilung im Reaktionsverlauf! Anwendung • Fehlfunktion von Proteinen Auslöser vieler Krankheiten • Untersuchung molekularer Reaktionsmechanismen Verständnis Struktur, Funktion und Interaktion von Proteinen Voraussetzung Entwicklung gezielter wirkender pharmakologische Substanzen mit weniger Nebenwirkungen Lichtgetriebene Protonenpumpe Bakteriorhodopsin • Aufklärung katalytische Schritte • Mechanismus stimmt mit 10 Jahre später über Röntgenstrukturanalyse ermittelter Kristallstruktur überein Bakteriorhodopsin [2] Lichtgetriebene Protonenpumpe Bakteriorhodopsin •Retinal über Schiffsche Base Gebunden •Wird durch Licht angeregt Isomerisierung (pk-Änderung) H-Brücke W402 aufgespalten Freie OH-Gruppe W401 kann negative Ladung des Asp 85 nicht mehr stabilisieren Protonentransfer von Schiffscher Base auf Asp 85 Arg 82 bewegt sich Protonierter Wasserkomplex nahe der Oberfläche destabilisiert Gibt Proton ab Wasser aktiv beteiligt Protonentransfer im Bakteriorhodopsin mit Hilfe von Wasser [1] Wie Proteine Protonen pumpen •1190 cm-1 Deprotonierung Zentrale Protonenbindestelle •1762 cm-1 Protonierung Asp-85 Differenzspektrum Protonentransfer Bakteriorhodopsin [1] Schaltmechanismus von GTPasen • • • RAS kontrolliert Wachstumssignal Mutationen unkontrolliertes Zellwachstum GAP hydrolysiert nicht mehr Verfolgt RAS-GTP-Hydrolyse Struktur vom Intermediat (H2PO42- ) [1] Schaltmechanismus von GTPasen •Ras(*Ras)Gap: Intermediat (1143 cm-1) •Katalyse durch positive geladene Lys, Arg und Mg2+ Mutation Arg zu ungeladenem Gln -> Verlangsamung GTP-Hydrolyse [1] Differenzspektrum GTP-Hydrolyse [2] Pharmascreening • Nahezu alle Moleküle IR-aktiv (keine Fluoreszenzmarkierung) Kann direkt Einfluss Pharmaka auf Protein bestimmen z.B. Reaktivierung RAS • Studieren potentieller Pharmaka • Identifizierung aktivierender Pharmaka • Substanzen in natürlicher Umgebung studieren (RAS über Lipidanker an Membranmodelle binden die auf ATR-Oberfläche aufgetragen sind) Ausblick – Entwicklung verbesserter Biokatalysatoren – Herstellung gezielter wirkender Pharmaka mit weniger Nebenwirkungen – Untersuchung Protein mit unbekannter Raumstruktur – Charakterisierung G-Proteingekoppelter Rezeptoren Literatur 1. Proteinreaktionen: aufgelöst mit trFTIR, Nachrichten aus der Chemie, 5 2. http://www.innovationspreisruhr.de/Entwicklungsbeschreibung_17%2002%2006.pdf 3. K. Gerwert, Ber. Bunsen-Ges. Phys. Chem., 1988, 92, 978 4. W. Uhrmann , A. Becker, C. Taran, F. Siebert, Appl. Spectrosc., 1991, 45, 390 5. R. Rammelsberg, B. Hessling, H. Chorongiewski, K. Gerwert, Appl. Spectrosc., 1997, 51, 558 6. R. Rammelsberg, S. Boulas, H. Chorongiewski, K. Gerwert, Vib. Spectrosc., 1999, 19, 143