Die Entstehung der Elemente - Lehrstuhl für Anorganische Chemie
Werbung

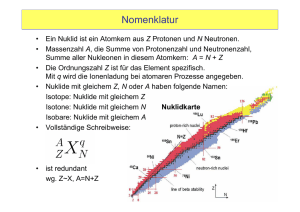
Anorganische Chemie in Prinzipien und Methoden der Chemie Die wissenschaftliche Methodik I. Beobachtung II. Theorie (Erklärung der Beobachtung) III. Experimentelle Überprüfung (Planung, Durchführung, Auswertung) Erkennen fehlerhafter Theorien: a) Reproduzierbarkeit des Experiments b) statistische Überprüfung If it disagrees with experiment, it is wrong ! (R. Feynman) Die Entstehung der Elemente - Urknalltheorie Die Entstehung der Elemente - Urknalltheorie Die Entstehung der Elemente – Sterne als Wiege der Elemente Häufigkeitsverteilung der Elemente H: 90 %; He: ca. 10 %; große Häufigkeit, da Produkt des He-Brennens (Proton-Proton-Prozess, Bethe-Weizsäcker-Zyklus) Exponentieller Abfall bis A=50: Coulomb-Barierre. Li, B, Be sehr selten: Zerstörung durch Kernreaktionen schon bei geringen Temperaturen möglich Maximum bei Eisen-56: Stabilstes Element. Bei hohen Temperaturen überleben bevorzugt Elemente mit der höchsten Bindungsenergie pro Nukleon. Die Bindung im Kern Der Kern enthält Protonen (11p) und Neutronen (01n). Problem: Positive Ladungen stoßen sich ab! H. Yukawa: Kernbindung durch Austausch von p-Mesonen Bindungsenergie und Massendefekt: Einsteinsches Gesetz der Äquivalenz von Masse und Energie E = m • c2; E [J], m [kg], c = 3•108 ms-1 Die Masse eines Nuklids ist stets kleiner als die Summe der Massen seiner Bausteine; die Massendifferenz ("Massendefekt") wird in Kernbindungsenergie umgewandelt. z. B. m(2•p + 2•n) = 4.029108 u; aber : m(24He) = 4.00260 u Dm = 0.026508 u = = 28.3 MeV = 2.73•109 kJmol-1 (1 u = 931 MeV = 8.98•1010 kJmol-1) Sonne: H-Verbrennung: 6•1011 kgs-1 Dm = 4•109 kgs-1 DE = 3.6•1023 kJs-1 Nuklide 112 Elemente ca. 1900 Nuklide ( = unterschiedliche Atomkerne) davon: 340 natürliche 270 stabil Die meisten Elemente sind Mischelemente! Indizierung Massenzahl Kernladung Ladungszahl(Ionen) E lementsymbol 20 Reinelemente (alle außer Beryllium besitzen ungerade Ordnungszahlen): Be, F, Na, Al, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi Einteilung von Nukliden: Protonenzahl (p) Neutronenzahl (n) Nukleonenzahl (m = p+n) Bezeichnung gleich verschieden verschieden Isotope gleich gleich gleich Isomere verschieden verschieden gleich Isobare verschieden gleich verschieden Isotone Isotopie-Effekte a) physikalische Gravitationswirkung auf höhere Masse, z. B. H2 0 D2O Fp. 0.00 °C 3.82 °C Kp. 100.0 °C 101.42 °C Anteil leichterer Nuklide (1H; 16O) im Dampf größer als im flüssigen Wasser Mit grösserer geograph. Breite/Distanz zum Meer sind Niederschläge verarmt an schweren Isotopen. b) chemische Masse bestimmt harmonische Schwingungsfrequenz f 2p k m leichtere Nuklide eines Elements zeigen höhere Reaktionsfähigkeit Geochemisches Beispiel: Schwefellagerstätten in Texas, besitzen überdurchschnittlich hohes 32S/34S - Verhältnis. Grund: bakteriell reduziertes Sulfatsediment. Generell Variation der Isotopenmasse bei Mischelementen: natürlich: künstlich: O, S, Ar, Cu, Pb H, Li, B, C, N, Ne, Kr, Xe, U Isotopentrennung Wichtige Isotope: 1 1 H1; 21H( D) 10-4 ; 31H= T 1018 12 6 C1; 136 C102 ; 146 C 235 92 U1; 238 92 U7 103 Anreicherung eines bestimmten Isotops für spezielle Anwendungen (Tracer-Technik, NMR-Experimente, Kernspaltung, Kernfusion) fraktionierte Destillation (H2O/D2O) Elektrolyse (H2/D2) Diffusion (Uran als UF6) Druckdiffusion " Trennsäule " Gaszentrifuge " Im allgemeinen jeweils mehrere Trenngänge notwending! Einzig komplette Trennung: Massenspektrometrie!