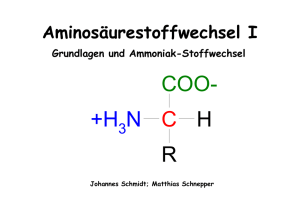
COO
Werbung

Stoffwechsel von Aminogruppen Katja Arndt, 30.10.2006 Aminosäure-Metabolismus Nahrungsproteine Aminosäure-Pool andere N-haltige Substanzen Proteine, Enzyme Kohlenstoff-Skelett Acteyl-CoA NH4+ Pyruvat, Intermediate des Citrat-Cyclus ATP-Produktion oder Harnstoff Glukose K. Arndt, 10/2006 Stoffwechsel der Aminogruppen periphere Organe Glutamin Leber Umbau Niere Abbau Harnstoff K. Arndt, 10/2006 Warum Aminostoffwechsel ? • Aminosäuren wichtig für Protein-Biosynthese. • Zellen können Amino-Gruppe nicht vollständig zu N2 oxidieren. • Primäres Abbauprodukt ist Ammoniak (= NH3) – toxisch! • Umwandlung in nicht-toxisches, gut wasserlösliches Molekül: Harnstoff K. Arndt, 10/2006 Entsorgung des Stickstoffs • Transaminierung: Übertragung der Amino-Gruppe auf anderes Molekül. • Desaminierung: Abspaltung der Amino-Gruppe, Bildung von Ammoniak, Umbau zu Harnstoff. • Decarboxylierung: Abspaltung der Carboxyl-Gruppe resultiert in Biogenen Aminen, z.B. Histamin, GABA (mengenmäßig unbedeutend). Coenzym: Pyridoxalphosphat (PLP, PALP) (aus Vit. B6: Pyridoxal) K. Arndt, 10/2006 Die wichtigsten Moleküle beim Aminostoffwechsel COO− | H3N+ — Cα — H | R1 α-Aminosäure COO− | O = Cα | R1 α-Ketosäure COO− | H3N+ — Cα — H | CH3 Alanin COO− | O = Cα | CH3 Pyruvat α-Ketopropionsäure Brenztraubensäure COO− | H3N+ — Cα — H | CH2 | COO− Aspartat COO− | H3N+ — Cα — H | CH2 | CH2 | COO− Glutamat COO− | O = Cα | CH2 | COO− Oxalacetat COO− | O = Cα | CH2 | CH2 | COO− α-Ketoglutarat α-Ketobernsteinsäure COO− | H3N+ — Cα — H | CH2 | CH2 | H2N — C = O Glutamin K. Arndt, 10/2006 Transaminierung: Überblick COO− | H3N+ — Cα — H | R1 COO− | O = Cα | R2 α-Aminosäure 1 α-Ketosäure 2 Transaminase (PALP) COO− | O = Cα | R1 α-Ketosäure 1 COO− | H3N+ — Cα — H | R2 α-Aminosäure 2 K. Arndt, 10/2006 Transaminierung: Überblick COO− | H3N+ — Cα — H | R1 α-Aminosäure 1 COO− | O = Cα | CH2 | CH2 | COO− Transaminase (PALP) α-Ketoglutarat COO− | O = Cα | R1 α-Ketosäure 1 COO− | H3N+ — Cα — H | CH2 | CH2 | COO− Glutamat COO− | O = Cα | CH2 | COO− Oxalacetat COO− | H3N+ — Cα — H | CH2 | COO− Aspartat K. Arndt, 10/2006 Mechanismus der Transaminierung – Teil 1 Schiffsche Base (Aldimin, C=N) aus PALP und Aminosäure Einlagerung Aminosäure PALP (Pyridoxalphosphat) Abspaltung α-Ketosäure PAMP (Pyridoxaminphosphat) K. Arndt, 10/2006 Mechanismus der Transaminierung – Teil 2 PALP (Pyridoxalphosphat) PAMP (Pyridoxaminphosphat) Abspaltung Aminosäure Schiffsche Base (Aldimin, C=N) aus PALP und Aminosäure Einlagerung α-Ketosäure K. Arndt, 10/2006 Für die Klinik wichtige Aminotransferasen • Aspartat-Aminotransferase (AST, ASAT) Aspartat/Glutamat-Aminotransferase alter Name: Glutamat-Oxalacetat-Transaminase (GOT, SGOT) COO− | H3N+ — Cα — H | CH2 | COO− COO− | O = Cα | CH2 | CH2 | COO− Aspartat Aspartat-Aminotransferase COO− | O = Cα | CH2 | COO− Oxalacetat α-Ketoglutarat COO− | + H3N — Cα — H | CH2 | CH2 | COO− Glutamat Enzym der Leber (Mitochondrien), gelangt bei Leberschädigung in Blutplasma. K. Arndt, 10/2006 Für die Klinik wichtige Aminotransferasen • Alanin-Aminotransferase (ALT, ALAT) Alanin/Glutamat-Aminotransferase alter Name: Glutamat-Pyruvat-Transaminase (GPT, SGPT) COO− | O = Cα | CH2 | CH2 | COO− COO− H3N+ | — Cα — H | CH3 Alanin Alanin-Aminotransferase COO− | O = Cα | CH3 Pyruvat α-Ketoglutarat COO− | + H3N — Cα — H | CH2 | CH2 | COO− Glutamat Enzym der Leber (Zytoplasma), gelangt bei Leberschädigung in Blutplasma. K. Arndt, 10/2006 Bedeutung in der Diagnostik K. Arndt, 10/2006 Bedeutung in der Diagnostik K. Arndt, 10/2006 Glukose-Alanin-Zyklus • Energieversorgung des Muskels. • Abtransport von NH4+ aus dem Muskel zur Leber. K. Arndt, 10/2006 Desaminierung • Entfernung der Aminogruppe, Bildung von Ammoniak. • Bis auf GLDH sind alle Desaminierungen irreversibel. • Oxidative Desaminierung – Aminogruppe oxidiert, dann hydrolysiert zu α-Ketosäure – Elektronen auf NAD+ oder NADP+ übertragen • Hydrolytisch Desaminierung – Abspaltung der Säureamidgruppe (Gln, Asn) • Eliminierende Desaminierung – Eliminierung von NH3 und Ausbildung einer Doppelbindung – seltene Reaktion K. Arndt, 10/2006 Oxidative Desaminierung COO− | H3N+ — Cα — H | CH2 | CH2 | COO− NAD(P)+ NAD(P)H + H+ Glutamat GlutamatDehydrogenase (GlDH) COO− | O = Cα | CH2 | CH2 | COO− α-Ketoglutarat COO− | H2N+ = Cα | CH2 | CH2 | COO− α-Iminoglutarat (Schiffsche Base) H2O NH4+ Trans-Deaminierung: Combination von Transaminase mit Glutamat-Dehydrogenase Enzym der Leber (nur Mitochondrien), gelangt bei Leberschädigung in Blutplasma. K. Arndt, 10/2006 Hydrolytische Desaminierung COO− | — Cα — H | CH2 | CH2 | H2N — C = O H3N+ N für Purin- und Pyrimidinbiosynthese Niere: NH4+ zur Kontrolle des Urin pH Nerven: Inaktivierung des Neurotransmitters Glutamat Muskel: Substrat für Gluconeogenese in Leber H2O Glutamin Glutaminase (aktiviert durch Pi) COO− | H2N — Cα — H | CH2 | CH2 | − O — C = O Glutamat GlutaminSynthetase ATP → ADP + Pi NH4+ Leber: Harnstoffsynthese Niere: Sekretion Glutamin → Glutamat Asparagin → Aspartat K. Arndt, 10/2006 Decarboxylierung • Entstehung biogener Amine. • Pyridoxalphosphat (PALP) als Coenzym. • fast alle Aminosäuren CO2 COO− | + H3N — Cα — H | R AminosäureDecarboxylase (PALP) α-Aminosäure H | + H3N — Cα — H | R biogenes Amin z.B.... • Histidin → Histamin (Mastzellen) • Glutamat → GABA (Glutamat γ-Aminobutyrat) (Rückenmark) • Phenylalanin, Tyrosin → → → Dopamin, Noradrenalin, Adrenalin • Tryptophan → → Serotonin (Gewebehormon, ZNS) → Melatonin (Epiphyse) • Cystein → → Taurin (Leber, Gallensäure) • Serin → Ethanolamin (Membranbaustein) → Cholin → Acetylcholin (NS) • Lysin → Kadaverin K. Arndt, 10/2006 Stoffwechsel der Aminogruppen Peripherie NH3 versch. AS Glutamat Glutamin Leber Glutamin NH3 Niere COO− | H3N+ — Cα — H | CH2 | CH2 | H2N — C = O Glutamin Glutamat α-Ketoglutarat NH3 Harnstoff Harnstoff K. Arndt, 10/2006 Mitochondrium HCO3− CarbamoylphosphatSynthetase O || H2N—C~ P CarbamoylPhosphat Cytosol α-Ketoglutarat, 2[H] NH4+ Glutamat 2 ATP 2 ADP+Pi OrnithinCarbamoylTransferase P NH2 | C=O | CH2—NH | CH2 | CH2 | H—C—NH3+ | COO− Citrullin CH2—NH3+ | CH2 | CH2 | H—C—NH3+ | COO− Ornithin Arginase H2N—C—NH2 || O Harnstoff Glutamat ATP AMP+PPi COO− | H3N+—Cα—H | CH2 | COO− Aspartat ArginiosuccinatSynthase NH2+ COO− || | C—HN—CH | | CH2—NH CH2 | | CH2 COO− | CH2 | H—C—NH3+ | COO− NH2+ Argininosuccinat || C—NH2 | CH2—NH Arginiosuccinat| Lyase CH2 | CH2 H—C—COO− | || H—C—NH3+ − H—C—COO | COO− Fumarat Arginin K. Arndt, 10/2006 Mitochondrium HCO3− CarbamoylphosphatSynthetase O || H2N—C~ P CarbamoylPhosphat Cytosol α-Ketoglutarat, 2[H] NH4+ Glutamat Glutamat 2 ATP 2 ADP+Pi OrnithinCarbamoylTransferase P NH2 | C=O | CH2—NH | CH2 | CH2 | H—C—NH3+ | COO− ATP AMP+PPi Harnstoffcyclus Ornithin Arginase Song: OE Kabarett, Charité H2N—C—NH2 || O Harnstoff Aspartat ArginiosuccinatSynthase Citrullin CH2—NH3+ | CH2 | CH2 | H—C—NH3+ | COO− COO− | H3N+—Cα—H | CH2 | COO− NH2+ COO− || | C—HN—CH | | CH2—NH CH2 | | CH2 COO− | CH2 | H—C—NH3+ | COO− NH2+ Argininosuccinat || C—NH2 | CH2—NH Arginiosuccinat| Lyase CH2 | CH2 H—C—COO− | || H—C—NH3+ − H—C—COO | COO− Fumarat Arginin K. Arndt, 10/2006 Literatur Bücher: • Löffler, Petrides: Biochemie & Pathobiochemie, Springer Verlag, 7. Auflage, 2003. • Horn, et al.: Biochemie des Menschen, Thieme Verlag, 3. Auflage, 2005. • Doenecke, Koolman, Fuchs, Gerok: Karlsons Biochemie und Pathobiochemie, Thieme Verlag, 15. Auflage, 2005. • Berg, Tymoczko, Stryer: Biochemistry, W.H.Freeman & Co bzw. Spektrum Verlag, 5. Auflage, 2002/2003. (http://www.ncbi.nlm.nih.gov/books oder http://bcs.whfreeman.com/biochem5/ ). www.molbiotech.uni-freiburg.de/ka/lehre/dat/Stoffwechsel_Aminogruppen.ppt K. Arndt, 10/2006