Aminosäurestoffwechsel 1
Werbung
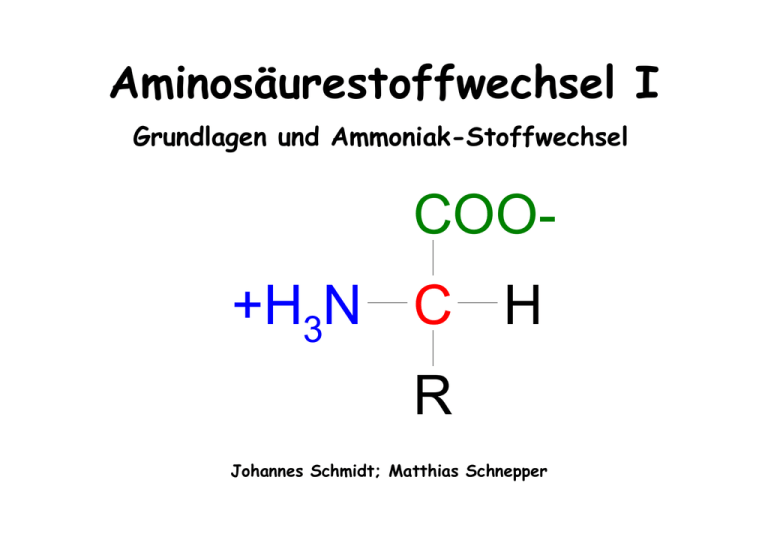
Aminosäurestoffwechsel I Grundlagen und Ammoniak-Stoffwechsel COO+H3N C H R Johannes Schmidt; Matthias Schnepper Gliederung: • • • • • Einführung Struktur und Einteilung der Aminosäuren Grundzüge des Aminosäurestoffwechsels Ammoniakstoffwechsel Stoffwechsel der Aminogruppen der Aminosäuren Einführung: Die Aminosäuren besitzen 4 Funktionen im Stoffwechsel der Zellen: 1. als Bausteine für die Biosynthese der Proteine 2. als Aminogruppen- bzw. Stickstoffdonatoren bei der Biosynthese von stickstoffhaltigen Verbindungen 3. als Substrat für die Gluconeogenese („Glucosehomöostase“) 4. als exzitatorische (anregende) und inhibitorische Neurotransmitter Struktur der Aminosäuren: Aminosäuren mit apolaren Seitenketten: COO- COOH C H NH3+ COO- CH COO- 3 H C CH3 H C CH H C CH2 NH3+ NH3+ CH3 NH3+ Glycin Gly; G Alanin Ala; A Valin Val; V COO- Leucin Leu; L Isoleucin Ile; I COO- H C CH2 CH2 S CH3 NH3+ Methionin Met; M COO- CH CH3 3 H C CH CH2 CH3 CH CH3 NH3+ COOH C CH2 NH3+ Phenylalanin Phe; F HC N H Prolin Pro; P COOH C CH2 NH3+ N Tryptophan H Trp; W Struktur der Aminosäuren: Aminosäuren mit ungeladenen polaren Seitenketten: H C CH2 COO- H C CH2 CH2 CH CH3 H C CH2 C NH2 NH3+ NH3+ NH3+ OH COOH C CH2 Asparagin Asn; N Threonin Thr; T Serin Ser; S Cystein Cys; C O OH H C NH3+ NH3+ COO- COO- COO- COOSH H C CH2 O C NH2 Glutamin Gln; Q COOSeH NH3+ Selenocystein Sec H C CH2 NH3+ Tyrosin Tyr; Y OH Struktur der Aminosäuren: Aminosäuren mit geladenen polaren Seitenketten: COO- O H C CH2 C NH3+ Aspartat Asp; D COO- COO- O H C CH2 CH2 O NH3+ COO- NH+ H C CH2 C O NH3+ N H Histidin His; H Glutamat Glu; E COO- NH2 H C CH2 CH2 CH2 CH2 NH3+ H C CH2 CH2 CH2 NH C NH3+ NH3+ Lysin Lys; K Arginin Arg; R NH2+ Einteilung der Aminosäuren: • nach Struktur und funktionellen Gruppen • in proteinogene und nichtproteinogene Aminosäuren: nicht proteinogen sind z. B. Ornithin (Harnstoffzyklus) Citrullin (Harnstoffzyklus) 5-Hydroxytryptophan (Vorstufe von Serotonin) ß-Alanin (Teil von Coenzym A) … insgesamt sind 21 Aminosäuren proteinogen, mehr als 100 sind nicht proteinogen Einteilung der Aminosäuren: • in essentielle und nichtessentielle Aminosäuren: essentiell sind Histidin; Isoleucin; Leucin; Lysin; Methionin; Phenylalanin; Threonin; Tryptophan; Valin nichtessentiell sind Alanin; Arginin; Asparagin; Tyrosin; Glutamat; Glutamin; Glycin; Prolin bedingt essentiell sind Serin; Cystein • nach Biosyntheseweg Grundzüge des Aminosäurestoffwechsels: Tagesumsatz der Aminosäuren: Werte für eine 70 kg schwere Person Stickstoffgleichgewicht bei täglicher Zufuhr von 32 g hochwertigem Protein Zentrale Stellung der Leber: • • • • • Aufnahme der über die Nahrung resorbierten Aminosäuren Biosynthese von Proteinen Umwandlung von Aminosäuren durch Abspaltung von Ammoniak Æ Bildung von Ketocarbonsäuren Umwandlung von Ammoniak in Harnstoff Kontinuierliche Abgabe von Aminosäuren an das Blut (Pufferfunktion) Zentrale Stellung der Leber: Intrazellulärer Aminosäurestoffwechsel: Es bestehen enge Verknüpfungen zwischen Aminosäure-, Fett- und Kohlenhydratstoffwechsel. Durch verschiedene Reaktionen können Aminosäuren z.B. in αKetocarbonsäuren wie Pyruvat oder Oxalacetat umgewandelt werden, die dann weiter verstoffwechselt werden können. Besondere Bedeutung für den Aminosäurestoffwechsel hat das Pyridoxalphosphat (PALP). H O O P O H2C O O O + N H CH3 1. Transaminierung: Austritt eines Protons, das sich an die Schiff‘sche Base anlagert Stabilisierung der Schiff‘schen Base durch eine kationische Gruppe des aktiven Zentrums des Enzyms E Bildung einer Schiff‘schen Base zwischen PALP und der Aminogruppe der Aminosäure PALP (Pyridoxalphosphat) Anlagerung des Protons führt zum „Umklappen“ der Doppelbindung Hydrolyse der Schiff‘schen Base, Freisetzung einer aKetosäure PAMP (Pyridoxaminphosphat) Die Aminogruppe der ehem. Aminosäure bleibt kovalent gebunden. PAMP (Pyridoxaminphosphat) Bindung einer anderen aKetosäure, Bildung einer Schiff‘schen Base Austritt eines Protons, das sich an die Schiff‘sche Base anlagert Anlagerung des Protons führt zum „Umklappen“ der Doppelbindung PALP (Pyridoxalphosphat) Hydrolyse der Schiff‘schen Base, Freisetzung einer Aminosäure E = Aminotransferase bzw. Transaminase 2. a-,ß-Eliminierung: Bildung einer Schiff‘schen Base zwischen PALP und der Aminogruppe der Aminosäure (Serin: X = O; Cystein: X = S) PALP (Pyridoxalphosphat) Stabilisierung der Schiff‘schen Base durch eine kationische Gruppe des aktiven Zentrums des Enzyms E Austritt des Protons führt zum „Umklappen“ der Doppelbindung Austritt von XH(Serin: X = O; Cystein: X = S) PALP (Pyridoxalphosphat) Hydrolyse der Schiff‘schen Base, Freisetzung einer Aminosäure Bildung von H2X (Serin: X = O; Cystein: X = S) Abspaltung von Ammoniak; Hydrolyse zur a-Ketosäure E = Dehydratase Weitere PALP-abhängige Reaktionen: Decarboxylierung: Durch Elektronenverschiebung Labilisierung der C-C-Bindung; Abspaltung der Carboxylgruppe; Hydrolyse der Schiff‘schen Base bewirkt Freisetzung eines Amins. E = Decarboxylase Aldolspaltung: Durch Elektronenverschiebung Labilisierung der C-C-Bindung zwischen a- und ß-C-Atom; Freisetzung einer Aminosäure sowie z.B. bei Threonin von Acetaldehyd bzw. bei Serin von einer Hydroxymethylgruppe. E = Aldehydlyase bzw. Aldolase Der Ammoniakstoffwechsel: Ammoniak: • • • Æ N H nach der Definition von Broensted: Base H kann biologische Membranen gut passieren liegt bei physiologischem pH-Wert (7,40 im Blut; 6,0-7,1 in Körperzellen) zu etwa 99% als NH4+ vor Gefahr der Alkalisierung des Blutes bei erhöhter Ammoniakkonzentration H Ausscheidung von Ammoniak: • nach Umbau durch die Leber als Harnstoff (90-95%) • als freies Ammoniak (5-10%) mit dem Urin • für fast alle Lebewesen essentiell Verwendung von Ammoniak: zur Biosynthese von • Aminosäuren (insbesondere Gln, Asp, Gly) • Porphyrinen • • Purinen Pyrimidinen • Kreatin (als Phosphat wichtige Energiequelle in Muskeln) Aminozuckern • Toxizität von Ammoniak: • schwere zerebrale Schäden schon bei geringen Mengen • Ammoniakvergiftung: Flattertremor der Hände, verwaschene Sprache, Sehstörungen, in schweren Fällen Koma und Tod Æ freies Ammoniak muss kovalent gebunden oder ausgeschieden werden! „Entgiftung“ von Ammoniak: z.B. durch die mitochondrialen Enzyme Glutamatdehydrogenase (GLDH, v.a. in der Leber) und die Glutaminsynthetase (in allen Geweben) Reaktion der GLDH ist stark durch die freie Energie begünstigt (27,2 kJ/mol) Æ keine Rückreaktion = Freisetzung von Ammoniak Pathobiochemie & Therapie: Ammoniak im Pfortaderblut stammt aus dem Stoffwechsel von Mikroorganismen, die Nahrung sowie Harnstoff durch das Enzym Urease in Ammoniak und CO2 spalten können. Diagnose (hier am Beispiel einer Infektion mit Helicobacter pylori): mittels Atemtest Therapie: mit Lactulose (Disaccharid aus Galaktose und Fructose) Æ Bildung von Lactat, Acetat, Formiat und CO2 Æ Abfall des pH-Wertes Æ Umwandlung von Ammoniak in Ammoniumionen Æ Ausscheidung der Ammoniumionen mit dem Stuhl mit schwer resorbierbaren Antibiotika wie z.B. Neomycin Æ Eindämmung der Ammoniakproduktion Aminostickstoff-Stoffwechsel • Der Aminostickstoff der Aminosäuren kann durch Transaminierung in anderen Aminosäuren gesammelt werden • Hauptsächlich in Alanin, Aspartat und Glutamat • Diese wiederum stellen den Stickstoff für die Biosynthese und Harnstoffbiosynthese bereit • Alanin, Aspartat und Glutamat bieten sich besonders an, weil ihre α-Ketosäuren ständig im Stoffwechsel produziert werden Glutamat als Drehscheibe des Aminostickstoff-Stoffwechsels •freies Ammoniak bildet durch Fixierung an α- Ketoglutarat Glutamat Glutamat α-Ketoglutarat NH3 Die Aminogruppe von Glutamat kann durch reversible Transaminierung auf die α-Ketosäure Pyruvat unter Bildung von Alanin übertragen werden Pyruvat Glutamat Transaminierung ist eine durch Aminotransferasen katalysierte und vollständig reversible Reaktion, bei der eine Aminogruppe von einer Aminosäure (Ketosäure) auf eine Ketosäure (Aminosäure) übertragen wird. Alanin α-Ketoglutarat NH3 Oder die Aminogruppe wird auf die α-Ketosäure Oxalacetat unter Bildung der Aminosäure Aspartat übertragen, dessen Aminostickstoff für zahlreiche Biosynthesen und v.a. für die Bildung von Harnstoff verwendet wird Pyruvat Oxalacetat Aspartat Glutamat α-Ketoglutarat Alanin α-Ketoglutarat NH3 Durch Fixierung von Ammoniak an Glutamat bildet sich Glutamin (wirkt ebenfalls als Aminostickstoffdonator bei Biosynthesen und beim Stickstofftransport im Blutplasma) NH3 Glutamin Pyruvat Alanin - NH3+ Oxalacetat Aspartat Glutamat α-Ketoglutarat α-Ketoglutarat NH3 Aus Glutamat kann überschüssiges Ammoniak Pyruvat Alanin durch Desaminierung freigesetzt werden, welches bei der Harnstoffbildung benötigt wird. NH 3 Glutamin - NH3+ Oxalacetat Aspartat Glutamat α-Ketoglutarat α-Ketoglutarat NH3 Harnstoff NH3 Glutamin Pyruvat Alanin - NH3+ Oxalacetat Glutamat α-Ketoglutarat NH3 Aspartat α-Ketoglutarat Fumarat Harnstoff Übertragung der Aminogruppen durch den Aspartatzyklus Aspartatzyklus • Im Aspartatzyklus werden die Aminogruppen von der Aminosäure Aspartat unter Bildung eines zwischenzeitlichen Kondensationsproduktes auf Ketoverbindungen übertragen. • Neben der aminierten Verbindung entsteht auch Fumarat, welches über Malat und Oxalacetat durch Enzymreaktionen und unter Gewinn eines Reduktionsäquivalent (NADH +H+) wieder zu Aspartat regeneriert werden kann. Möglichkeiten der Ammoniakfreisetzung: Æ Im Aspartatzyklus durch Hydrolyse des Kondensationsproduktes Æ Durch enzymatische Überführung der Aminosäuren (und anderen stickstoffhaltigen Verbindungen) in ein Produkt, das durch Wasser leicht angegriffen werden kann (C=N Bindung) Æ Bei den Aminosäuren Serin, Threonin, Cystein, Histidin und Homoserin über den irreversiblen Prozess der Pyridoxalphosphatabhängigen Eliminierung (Nichtdehydrierende Desaminierung). Æ Durch hydrolytischen Abbau der Pyrimidine und Purine Æ Durch Aminosäureoxidasen (in Leber und Niere) werden Aminosäuren irreversibel durch Dehydrierung desaminiert. Ammoniaktransport Alle Organe besitzen einen mehr oder weniger intensiven Aminosäurestoffwechsel, jedoch nur die Leber ist imstande, mit Hilfe der Harnstoffbildung überschüssiges Ammoniak zu entgiften. Aus diesem Grund wird Ammoniak in Form von Alanin und Glutamin im Blutplasma von den peripheren Organen zur Leber transportiert. Das zur Bildung von Alanin benötigte Pyruvat stammt aus dem Glucoseabbau (Glykolyse). In der Leber wird das Kohlenstoffskelett von Alanin zur Glucoseneubildung, der Aminostickstoff zusammen mit Bicarbonat und Energie zur Harnstoffsynthese verwendet (Glucose-Alanin-Zyklus). Das Kohlenstoffgerüst des freigesetzten Glutamins hingegen stammt aus Aminosäuren, und zwar hauptsächlich aus Glutamat und Aspartat. Der Großteil des Glutamins wird nicht wie Alanin in der Leber sondern von Darm- und Nierenzellen aufgenommen. Ammoniakstoffwechsel von Leber, Gehirn und Nieren Eine zentrale Bedeutung im Stoffwechsel der Aminosäuren besitzt die Leber, da nur sie die enzymatische Ausstattung für eine vollständige Biosynthese von Harnstoff aus Ammoniak und Bicarbonat besitzt. Die Synthese von Harnstoff erfolgt deshalb, weil Ammoniak eine äußerst toxische Substanz darstellt. Eine 70kg schwere Normalperson bildet täglich etwa 30 g Harnstoff. Somit steht die Harnstoffbildung im Vergleich zur Biosynthese anderer Stoffe quantitativ an erster Stelle. Harnstoffsynthese (Krebs-Henseleit-Zyklus): Die Harnstoffsynthese läuft in einem auf zwei Zellkompartimente verteilten Zyklus ab. Die ersten beiden Schritte finden im Mitochondrium, die übrigen im Cytosol ab. + HCO3 + NH4 2 ATP CarbamylphosphatSynthetase I N-Acetylglutamat 2 ADP + Pi 1. Schritt: (im Mitochondrium) Durch das Enzym Carbamylphosphat-Synthetase I wird unter Verbrauch von zwei Molekülen ATP aus Bicarbonat und Ammoniak Carbamylphosphat gebildet. Unentbehrlicher Cofaktor dieser irreversiblen Reaktion ist N-Acetylglutamat, das wahrscheinlich als allosterischer Aktivator wirkt AcetylglutamatSnthase I O H N 2 C P Carbamylphosphat Glutamat + Acetyl-CoA Mitochondrium Da die Mitochondrienmembran zwar für CO2, nicht jedoch für Bicarbonat (HCO3-) permeabel ist, muss CO2 zunächst durch eine Carboanhydrase in Bicarbonat überführt werden. Cytosol + HCO3 + NH4 2. Schritt: (im Mitochondrium) + 2 ATP CH2 NH3 CarbamylphosphatSynthetase I N-Acetylglutamat 2 ADP + Pi CH2 CH2 AcetylglutamatSnthase I COO O H N 2 + C H C Der Carbamylrest (NH2-CO-) wird auf ein Trägermolekül (Ornithin) übertragen. Dabei entsteht Citrullin (ebenfalls eine nicht proteinogene Aminosäure) und anorganisches Phosphat. NH3 - Ornithin P OrnithinTranscarbamylase Carbamylphosphat NH 2 Pi C O CH2 NH Glutamat + Acetyl-CoA CH2 CH2 H C COO + NH3 - Citrullin Mitochondrium Cytosol 3. Schritt: (im Cytosol) + HCO3 + NH4 In diesem Schritt soll eine weitere Aminogruppe übertragen werden; da dies nicht durch eine Transaminierung möglich ist, schließt sich die schon erwähnte Aspartatzyklus-Sequenz an. Dabei kondensiert die Carbonylgruppe von Citrullin mit der Aminogruppe von Aspartat (Aminogruppendonator) unter ATP Verbrauch. Es entsteht Argininosuccinat. + 2 ATP CH2 NH3 CarbamylphosphatSynthetase I N-Acetylglutamat 2 ADP + Pi CH2 CH2 AcetylglutamatSnthase I COO O H N 2 + C H C NH3 - Ornithin P OrnithinTranscarbamylase Carbamylphosphat + NH 2 Pi C C O CH2 NH Glutamat + Acetyl-CoA ArgininosuccinatSynthetase CH2 H C COO + Citrullin COO + H3N C H CH2 Aspartat COO - CH CH2 NH CH2 CH2 COO - C COO NH3 - NH CH2 H CH2 Mitochondrium COO NH 2 + NH3 - Argininosuccinat ATP AMP + P– Pi + H2O Pi Pi Cytosol + + HCO3 + NH4 NH 2 C CH2 NH + 2 ATP CH2 NH3 4.Schritt: (im Cytosol)CarbamylN-Acetyl- phosphatSynthetase I glutamat CH2 CH2 Die C-N Bindung wird reversibel gespalten und es 2 ADP CH2 die proteinogene entstehen die Produkte Fumarat und + Pi + Aminosäure Arginin. C NH H CH2 H COO O H N 2 C - NH3 - - OrnithinTranscarbamylase + C C O CH2 NH Glutamat + Acetyl-CoA ArgininosuccinatSynthetase CH2 C COO + Citrullin COO + H3N C H CH2 Aspartat COO - H CH2 CH2 COO - C + NH3 - COO - Fumarat CH CH2 NH COO NH3 - NH CH2 H CH2 H C COO NH 2 NH 2 H C ArgininoSuccinatlyase P Pi OOC Arginin Ornithin Carbamylphosphat Mitochondrium + C COO 3 AcetylglutamatSnthase I NH2 Argininosuccinat Malat ATP AMP + P– Pi + H2O Pi Pi Oxalacetat Cytosol Harnstoff + HCO3 + NH4 NH2 + NH 2 C O NH2 C CH2 NH3 CH2 Arginase I CH2 CH2 CH2 H COO NH3 - COO NH3 - - Ornithin + C O CH2 NH ArgininosuccinatSynthetase CH2 H C COO + COO + H3N C H CH2 Aspartat COO - H CH2 CH2 COO - C + NH3 - COO - Fumarat CH CH2 NH COO NH3 - NH CH2 H Citrullin C COO NH 2 NH 2 H C ArgininoSuccinatlyase OrnithinTranscarbamylase C OOC Arginin CH2 Mitochondrium + C + C H NH2 CH2 NH + 2 ATP 5. Schritt: (im Cytosol) CarbamylN-Acetylphosphatglutamat Der Kreisprozess derSynthetase I Harnstoffbiosynthese 2 ADP wird durch + Pi die hydrolytische AcetylglutamatAbspaltung der Snthase I Guanidinogruppe von O Arginin geschlossen. Dabei entstehen H N C P 2 Harnstoff und CarbamylOrnithin. Ornithin wird durch den phosphat Ornithincarrier wieder ins Mitochondrium Pi zurücktransportiert und dient dort wieder als Trägermolekül. Glutamat + Acetyl-CoA H2 O Argininosuccinat Malat ATP AMP + P– Pi + H2O Pi Pi Oxalacetat Cytosol Harnstoff + HCO3 + NH4 NH2 + NH 2 C O NH2 H2 O C CH2 NH + 2 ATP CH2 NH3 CarbamylphosphatSynthetase I N-Acetylglutamat 2 ADP + Pi CH2 Arginase I CH2 CH2 CH2 AcetylglutamatSnthase I C NH3 - COO NH3 - - OrnithinTranscarbamylase + C C O CH2 NH Glutamat + Acetyl-CoA ArgininosuccinatSynthetase CH2 C COO + Citrullin COO + H3N C H CH2 Aspartat COO - H CH2 CH2 COO - C + NH3 - COO - Fumarat CH CH2 NH COO NH3 - NH CH2 H CH2 H C COO NH 2 NH 2 H C ArgininoSuccinatlyase P Pi OOC Arginin Ornithin Carbamylphosphat Mitochondrium + C + COO O H N 2 H C H NH2 Argininosuccinat Malat ATP AMP + P– Pi + H2O Pi Pi Oxalacetat Cytosol Der in der Leber gebildete Harnstoff tritt ins Blut über und wird von den Nieren in den Urin ausgeschieden. Energiebilanz des Harnstoffzyklus Die Energiebilanz wird durch die Kopplung mit dem Aspartatzyklus bestimmt. Zur Berechnung ist entscheidend, ob der verwendete Stickstoff vorwiegend covalent gebunden (d.h. als Aminogruppe in Alanin, Aspartat oder Glutamat) oder in freier Form (als Ammoniak) vorliegt, da die Fixierung von Ammoniak zur Glutamat- und Aspartatbiosynthese energieabhängig ist Für die Biosynthese eines Harnstoffmoleküls aus einem Molekül Ammoniak und der α-Aminogruppe von Aspartat werden im Harnstoffzyklus drei Moleküle ATP verbraucht, von denen zwei in ADP und Pi und eines in AMP und Pyrophosphat gespalten werden. Da eine Pyrophosphatase das entstandene Pyrophosphat weiter in 2 Pi umwandelt, werden zwar drei Moleküle ATP, jedoch vier energiereiche Bindungen (und damit 4 Mol ATP zur Regeneration) benötig. Bei der Regeneration von Aspartat aus Fumarat wird ein Reduktionäquivalent und damit drei Moleküle ATP gewonnen. In der Bilanz wird für die Biosynthese von 1 mol Harnstoff aus einem Mol Ammoniak und der Aminogruppe von Aspartat 1 mol ATP verbraucht. Regulation der Harnstoffsynthese Die Harnstoffbildung ist proportional zur Aminosäurekonzentration im Blutplasma Jedoch fällt die Harnstoffbildung proportional stärker als die Aminosäurekonzentration ab Sie beträgt Null, wenn die Aminosäurekonzentration etwa 4,5 mg/100 ml beträgt (Dadurch wird eine zunehmende Verarmung des Aminosäurepools durch die Harnstoffbildung vermieden) Harnstoffbildung gesunder Versuchspersonen in Abhängigkeit von der GesamtAminostickstoffkonzentration im Plasma N- Acetylglutamat spielt eine Schlüsselrolle bei der schnell wirkenden Regulation des Harnstoffzyklus In Abwesenheit von N-Acetylglutamat ist die Carbamylphosphatsynthetase I vollständig inaktiv. Wahrscheinlich führt ein vermehrtes Aminosäurenangebot über eine rasche Steigerung des Glutamatspiegels zu einer vermehrten Bildung von Acetylglutamat, das als Signalmetabolit wirkt. Dagegen nimmt die Induktion der Harnstoffzyklusenzyme bei kontinuierlich hoher Proteinzufuhr oder unter dem Einfluss von Glucocorticoiden Stunden bis Tage in Anspruch. N-Acetylglutamat Entgiftung im Gehirn Im Gehirn wird Ammoniak durch Glutamatdehydrogenase und Glutaminsynthetase entgiftet Ammoniak, das im Gehirnstoffwechsels entsteht oder auf dem Blutweg das Gehirn erreicht, wird durch ATP-abhängige Glutaminbildung in den Astrocyten fixiert. Ammoniak ist neurotoxisch!! (Ursache unbekannt) Das zur Ammoniakentgiftung notwendige Glutamat kann nur schlecht die Blut-Hirnschranke permeieren und muss deshalb neben α-Ketoglutarat (Vorstufe von Glutamat) intrazellulär aus anderen Stoffwechselwegen entzogen werden.