Sauerstoff und Stickstoff in organischen Molekülen
Werbung

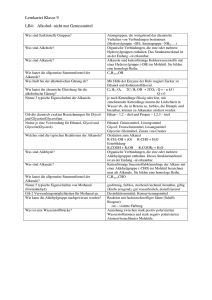
21 Sauerstoff und Stickstoff in organischen Molekülen 1 Alkanole: organische Verwandte des Wassers 1.1 Homologe Reihe und Nomenklatur: die Hydroxylgruppe Alkanole („Alkohole“) sind Hydroxyderivate der Alkane. Ihre Namen werden aus dem Namen des entsprechenden Kohlenwasserstoffs durch Anhängen der Silbe „-ol“ gebildet. Funktionelle Gruppe der Alkanole ist die Hydroxylgruppe (OH-Gruppe). Diese polare Atomgruppierung bestimmt Eigenschaften und Reaktionsverhalten der Alkanole entscheidend. Alkanole bilden eine homologe Reihe. Die ersten Glieder dieser Reihe mit der allgemeinen Summenformel CnH2n + 1OH heißen: Alkanol Trivialname Halbstrukturformel Siedetemperatur in °C Methanol Ethanol Propan-1-ol Butan-1-ol Methylalkohol Ethylalkohol Propylalkohol Butylalkohol CH3 – OH CH3 – CH2 – OH CH3 – CH2 – CH2 – OH CH3 – CH2 – CH2 – CH2 – OH + 65 °C + 78 °C + 97 °C +118 °C 1.2 Isomerie und Klassifizierung: Stellung und Wertigkeit Ab dem Alkanol Propanol kann die Hydroxylgruppe endständig oder mittelständig sein. Es tritt das Phänomen der Isomerie auf. Nach der Stellung ihrer funktionellen Gruppe unterscheidet man primäre, sekundäre und tertiäre Alkanole: R2 H R1 C OH H primärer Alkanol R1 C R2 OH H sekundärer Alkanol R1 C OH R3 tertiärer Alkanol 22 Sauerstoff und Stickstoff in organischen Molekülen Bei primären Alkanolen ist die OH-Gruppe endständig. Das Kohlenstoffatom, das die Hydroxylgruppe trägt, ist an ein weiteres Kohlenstoffatom gebunden. Kennzeichnende Atomgruppe ist die CH2 – OH-Gruppe. Bei sekundären Alkanolen ist das die Hydroxylgruppe tragende Kohlenstoffatom an zwei weitere Kohlenstoffatome gebunden; sie besitzen daher eine CH – OH-Gruppe. Bei tertiären Alkanolen ist das die Hydroxylgruppe tragende Kohlenstoffatom mit drei weiteren Kohlenstoffatomen verknüpft. Vertreter dieser Klasse besitzen eine C – OH-Gruppe im Molekül. Neben der Klassifizierung der Alkanole nach der Stellung ihrer charakteristischen Gruppe ist eine Einteilung nach der Anzahl der Hydroxylgruppen im Molekül üblich: H3C CH2 CH2 OH einwertiger Alkanol: Propan-1-ol H3C CH CH2 OH zweiwertiger Alkanol: Propan-1,2-diol OH HO CH2 CH CH2 dreiwertiger Alkanol: Propan-1,2,3-triol OH OH 1.3 Molekülbau der Alkanole: Dipolcharakter Alkanole können als Hydroxyderivate der Alkane oder als Alkylderivate des Wassers aufgefasst werden. Da die freien Elektronenpaare des Sauerstoffatoms mehr Platz benötigen als seine bindenden, ist der Tetraederwinkel auf 107° gestaucht. Der Unterschied der Elektronegativitäten von Kohlenstoff (EN: 2,5) und Sauerstoff (EN: 3,5) erklärt die Polarität der Bindung und die Tatsache, dass Wasser- und Alkanolmoleküle permanente Dipole sind: H δ+ H H δ– O H δ+ H δ– O C C H H H δ+ gewinkelter Bau und Dipolnatur des Wasser- und Ethanolmoleküls Sauerstoff und Stickstoff in organischen Molekülen 23 1.4 Einwertige Alkanole: Prototyp Ethanol Methanol Das erste Glied der homologen Reihe der einwertigen Alkanole ist Methanol. Die Aufnahme von Methanol verursacht Gehirnschäden und führt zur Erblindung. Die tödliche Dosis für einen Erwachsenen wird mit 30 bis 50 mL angegeben. Experimentell lassen sich Methanol und Ethanol durch die Boraxprobe unterscheiden. Wenige Milliliter des zu testenden Alkohols werden mit einer Spatelspitze Borax (Dinatriumtetraborat, Na2B4O7) in einem Porzellanschälchen entzündet. Bei Methanol zeigt sich eine typische grüne Flammenfärbung, bedingt durch den leichtflüchtigen, brennbaren Borsäuretrimethylester, der unter diesen Bedingungen entsteht. Methanol wird großtechnisch aus „Synthesegas“ hergestellt, einem Gasgemisch aus Kohlenstoffmonooxid und Wasserstoff: CO (g) + 2 H2 (g) 400 °C/200 bar Katalysator H3C OH (g) Ethanol Der bedeutendste Alkanol ist Ethanol. Alkoholische Getränke enthalten Ethanol in unterschiedlicher Konzentration. Ethanol ist ein starkes Gift, verursacht Rauschzustände und führt als Droge in die Abhängigkeit (Alkoholismus). Ethanol kann biotechnisch von Hefepilzen durch alkoholische Gärung aus traubenzuckerhaltigen Lösungen wie Fruchtsäften unter Sauerstoffausschluss (anaerob) hergestellt werden: C6H12O6 (aq) Enzyme der Hefepilze 2 CH3CH2OH (aq) + 2 CO2 (g) Für industrielle Zwecke wird Ethanol durch Addition von Wasser an Ethen großtechnisch synthetisiert. Die Reaktion wird durch Schwefelsäure katalysiert: H2C CH2 + H2O Schwefelsäure H3C CH2 OH Propanole Nach der Stellung der Hydroxylgruppe im Molekül lassen sich zwei isomere Propanole unterscheiden: Propan-1-ol (Propylalkohol) ist ein primärer Alkanol mit einer Siedetemperatur von 97 °C. Propan-2-ol (Isopropylalkohol) mit einer Siedetemperatur von 82 °C ist der einfachste sekundäre Alkanol. 24 Sauerstoff und Stickstoff in organischen Molekülen H H H H C C C H H H OH H Propan-1-ol H H H C C C H OH H H Propan-2-ol Die homologe Reihe der einwertigen Alkanole lässt sich mit Butan-1-ol (Butylalkohol, CH3 – CH2 – CH2 – CH2 – OH, Siedetemperatur 117 °C) und Pentan-1-ol (Amylalkohol, CH3 – CH2 – CH2 – CH2 – CH2 – OH, Siedetemperatur 138 °C) fortsetzen. Feste Alkohole mit 12 bis 18 Kohlenstoffatomen, wie Dodecanol (Laurylalkohol, CH3 – (CH2)10 – CH2 – OH, Schmelztemperatur 24 °C) und Octadecanol (Stearylalkohol, CH3 – (CH2)16 – CH2 – OH, Schmelztemperatur 59 °C) sind wichtige Ausgangsstoffe für die Synthese künstlicher Tenside (waschaktiver Substanzen). Butanole Unter den vier isomeren Butanolen (C4H9OH) finden sich zwei primäre Alkanole: H H H H H C C C C H H H H OH H Butan-1-ol H H H C C C H CH3 H OH 2-Methyl-propan-1-ol 1.5 Sekundäre und tertiäre Alkanole Unter den isomeren Butanolen gibt es einen Vertreter der sekundären Alkanole und den einfachsten Repräsentanten der tertiären Alkanole: H H H H H C C C C H H OH H Butan-2-ol (2° Alkanol) CH3 H H3C C CH3 OH 2-Methyl-propan-2-ol (3° Alkanol)