Aminosäuren und Proteine
Werbung

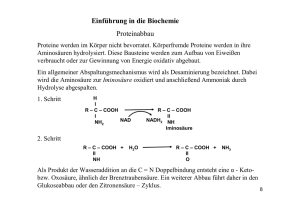
Aminosäuren bilden Proteine Molekülstruktur und Eigenschaften von Aminosäuren Peptidbindung Struktur der Proteine Einführung Der Name Protein leitet sich von dem griechischen Wort proteios ab, das „der Erste“ bedeutet. Sie stehen an erster Stelle aller chemischen Verbindungen, da sie die Bausteine des Lebens sind. Sie machen einen Großteil des tierischen Körpers aus, sie geben ihm Form und halten ihn in Gang. Sie kommen in allen lebenden Zellen vor und bilden den Stoff aus dem Haut, Muskeln, Sehnen, Nerven und das Blut sowie Enzyme, Antikörper und viele Hormone vorwiegend aufgebaut sind. Zusammensetzung des menschlichen Körpers Aminocarbonsäuren allg. Formel: NH2 CH COOH R Bei mehreren AS enthält der Rest R weitere funktionelle Gruppen. Auf Grund der Eigenschaften ihrer Seitenketten können AS in 4 Klassen eingeteilt werden: I. II. III. IV. AS mit unpolaren Resten in Wasser wenig löslich AS mit polaren Resten Reste negativ geladen (saure Gruppen) Reste positiv geladen (basische Gruppen) Struktur der Aminosäuren Es gibt ca. 20 Aminosäuren, die in Proteinen gefunden wurden. Einige von ihnen sind essentiell (unentbehrlich). Sie müssen jungen Tieren od. Menschen zugeführt werden, um ein geregeltes Wachstum zu gewährleisten. Essentielle AS können nicht aus Stoffen der Nahrung synthetisiert werden. Das sind die 20: Widersprüche zur Strukturformel NH2 CH COOH AS sind nicht flüchtig sondern kristallin und zersetzen sich bei hohen Temperaturen Lösen sich nicht in unpolaren Lösungsmitteln, aber merklich in Wasser. In wässrigen Lösungsmitteln zeigen sie ein hohes Dipolmoment R Zwitterionen im Feststoff NH3 CH COO R Gleichgewicht zwischen den 3 Ionen in wässriger Lösung NH2 CH COOH R - - OH NH3 CH COOH R kationische Form Säure + H OH NH3 CH COO R Zwitterion + H NH2 CH COO R anionische Form Base Isoelektrische Punkt In stark saurer Lösung herrschen die Kationen vor; es erfolgt eine Wanderung der AS zur Kathode. Wenn die Konzentrationen von Kationen und Anionen gleich groß sind, findet keine Wanderung statt (Zwitterion). Dies ist der isoelektrische Punkt. Der Neutralpunkt der Monoaminomonocarbonsäuren ist etwas stärker sauer als basisch, deshalb liegt der isoelektrische Punkt im leicht sauren Bereich, z.B.Glycin pH = 6,1. Eine AS zeigt die geringste Löslichkeit in einer Lösung am isoelektrischen Punkt, weil hier die Konzentration an Zwitterionen am Größten ist. Konfiguration natürlich vorkommender Aminosäuren COO + H3N C R - H L-Aminosäure COO + H C NH3 R D-Aminosäure Jede AS mit Ausnahme des Glycins hat mindestens ein Chiralitätszentrum Alle natürlich vorkommenden AS gehören zur LReihe. (Sie leiten sich vom L-(-)-Glycerinaldehyd ab; -Amino- entspricht Hydroxy-Gruppe). Elektrophorese Bei der Elektrophorese wandern die geladenen Verbindungen unter dem Einfluss eines starken elektrischen Feldes durch die Pufferlösung. Negativ geladene Ionen (Anionen) wandern in Richtung Anode (pos. Elektrode). Kationen in Richtung Kathode. Neutrale (Zwitterionen) Moleküle wandern nicht. Skizze zur Elektrophorese-Kammer Elektrophorese-Kammer Haltemagnet Trägerfolie Start Deckplatte Peptidbindung Peptide sind Amide, die durch Wechselwirkung zwischen Amino- und Carboxy-Gruppe von AS gebildet werden. Eine derartige Verknüpfung über eine Amid-Gruppe, -NHCO-, wird als Peptidbindung bezeichnet O C N H Peptide H O + H H3N C C N C COO H H O - + H3N C C N C C N C COO H H H Gly-Gly Glycylglycerin Dipeptid H O H O H R H H R n Polypeptid H CH3 - CH2 Gly-Ala-Phe Glycylalanylphenylalanin Tripeptid H3N C C N C C N C COO R H O H H - Entsprechend der Übereinkunft werden der N-endständige AS.rest an das linke Ende und der C-endständige AS.rest an das rechte Ende geschrieben. Planare Peptid-Bindung H O + H3N C R´ R´´ C N C H H H O COO - + H3N C R´ R´´ C N C COO - H H Alle an der Peptidbindung beteiligten Atome liegen in einer Ebene. Ergebnis einer Kondensation (formale Abspaltung von H2O). Geometrie der Peptid-Bindung Die C-N-Bindung besitzt einen hohen Doppelbindungscharakter. Primärstruktur, AS-Sequenz (Peptidkette) Proteine bestehen aus Peptidketten, d.h. aus Aminosäuren, die über Peptidbindungen (Amidbindung) aneinander gefügt sind. Sie unterscheiden sich zu den Polypeptiden durch ihre höhere molare Massen (über 10 000 g/mol) und kompliziertere Strukturen. An jedem dritten Atom einer Peptidkette befindet sich eine Seitenkette H H H N CH C N CH C N CH C R O R´ O R´´ O Seitenketten H H H N CH C N CH C N CH C R O R´ O R´´ O H O N CH C O N CH C (CH2)4 CH2 COO H - + NH3 Einige dieser Seitenketten enthalten basische Gruppen, -NH2, z.B. Lysin Andere Seitenketten enthalten saure Gruppen, –COOH, z.B. Asparaginsäure Wie sich ein Protein im elektr. Feld verhält richtet sich nach der relativen Anzahl der pos. und neg. Ladungen und diese wiederum nach der Acidität der Lösung. Isoelektrischer Punkt Elektrophorese Voraussetzungen für die Sekundärstruktur Bindungslänge und Bindungswinkel Planare Peptidbindung Ähnlichkeit der Konfiguration am Chiralitätszentrum (alle gehören zur L-Reihe) Größe und Sequenz der Seitenketten Wasserstoffbrücken Größtmögliche Anzahl von Wasserstoffbrücken -Helix Eine alpha-Helix entsteht, wenn eine einzelne Polypeptidkette sich um die eigene Achse dreht und somit einen starren Zylinder bildet. Zwischen jeder vierten Peptidbindung wird eine Wasserstoffbrücke ausgebildet, indem die C=OGruppe der einen Peptidbindung mit der N-HGruppe der zweiten verbunden wird. Auf diese Weise entsteht eine gleichmäßige Helix mit 3,6 Aminosäuren pro Windung. -Faltblatt-Struktur beta-Faltblätter können entweder von benachbarten Polypeptidketten, die in die gleiche Richtung laufen (parallele Ketten) gebildet werden oder von einer Polypeptidkette, die auf sich selbst zurückfaltet, so dass die Laufrichtung zu der des direkten Nachbarn entgegengesetzt ist (antiparallele Ketten). Sowohl das antiparallele als auch das parallele beta-Faltblatt werden durch Wasserstoffbrücken, die die Peptidbindungen benachbarter Ketten verbinden, zusammengehalten und erzeugen somit eine sehr starre Struktur. http://www.bioinformatik-wegweiser.de/Sekundaerstruktur.html Sekundärstruktur Tertiärstruktur Die Schlingen und Knäuel scheinen völlig willkürlich zu sein, sie sind es aber bestimmt nicht. Die Aminosäuresequenz wird genetisch festgelegt, ist die Kette aber einmal gebildet, nimmt sie von sich aus diejenige Anordnung ein, die für diese spezielle Sequenz die Stabilste ist. Hier finden wir alle „intermolekularen“ Kräfte wieder (v.d.Waals-Kräfte, H-Brücken, elektrostatische Anziehung od. Abstoßung, Disulfidbrücken), jedoch wirken sie hier zwischen verschiedenen Teilen des selben Moleküls (=intramolekular). Stabilisierung von Tertiärstrukturen durch z.B.: Hämoglobin-Struktur (Nobelpreis 1962) Proteid (Quartärstruktur) Die vier gefalteten Ketten fügen sich zu einem kugelförmigen Molekül zusammen. Vier ebene Häm-Gruppen, von denen jede ein „Eisen-Atom“ enthält, das ein SauerstoffMolekül binden kann, passen in getrennte Taschen dieser Kugel. Die Taschen sind von KW-resten der AS eingefasst. Eine solche unpolare Umgebung verhindert die Elektronenübertragung zwischen Sauerstoff und Fe2+ und ermöglicht die für den Sauerstofftransport notwendige Komplexbildung. Nomenklatur der Proteine Einfache Proteine; auschließlich -AS verbunden durch Peptidbindungen Albumine: wasserlöslich koagulieren in der Hitze (Milch, Eiklar, Blutserum) Globuline: wasserunlöslich, löslich in verd. Kochsalzlösungen (Samen, Nüsse, Serum, Zellgeweben) Scleroproteine: Löslich in starken Säuren und Basen (Kreatin in Haaren, Knorpel und Knochen) Zusammengesetzte Proteine Proteide: einfache Proteine mit einem nichtproteinhaltigem Molekül (prosthetische Gruppe) z.B. Hämoglobin Albumin wichtige, formal definierte Gruppe von tierischen u. pflanzlichen Eiweißen (Proteinen), die in Wasser löslich sind. Eigenschaften: Das Serum-Albumin ist ein kohlenhydratfreier Eiweißkörper von elliptischer Gestalt, einem Molekulargewicht von ca. 66 000, mit starkem Anteil an schwefelhaltigen Aminosäuren. Isoelektrischem Punkt von 4,6 und mit ampholytischem Verhalten. Globuline Gruppe von Proteinen, die in reinem Wasser unlöslich, aber in verdünnten Neutralsalzlösungen löslich sind (Einsalzung). Bei höheren Salzkonzentrationen fallen die Globuline aus (Aussalzung). Eigenschaften u. Stoffwechsel: Sie sind durch eine große Mannigfaltigkeit in Struktur u. Funktion gekennzeichnet. Im Blutplasma machen die Globuline etwa 40% des gesamten Proteins aus (Plasmaproteine). Der hauptsächliche Bildungsort der Globuline ist die Leber. Globuline sind durch Enzyme oder Hydrolyse abbaubar Scleroproteine bilden durch ihre Tertiärstrukturen Fibrillen diese sog. Gerüsteiweiße sind Kollagen, Keratin u. Elastin. Keratine (Cystein-haltig) in Haar, Schafwolle, Horn und Seidenfibroin Eigenschaften der Proteine Aus den großen Molekülmassen resultieren: hohe Viskosität, geringe Diffusionsgeschwindigkeiten Bildung kolloidaler Lösungen. Proteine denaturieren bevor sie schmelzen. Es sind amphotere Elektrolyte; die vorhandenen AS bestimmen ihr SäureBase-Verhalten. Proteine haben ein großes Dipolmoment. Denaturierung von Proteinen = Änderung der natürlichen Struktur Unter Denaturierung versteht man Prozesse, durch welche die typische Struktur (Quartärstruktur, Kettenkonformation, Primärstruktur) des nativen Proteins geändert wird. Charakteristisch ist, dass damit eine starke Beeinträchtigung der biologischen Funktion verbunden ist. Denaturierung durch: Hitze, UV-Bestrahlung, Chemikalien (organische Lösungsmittel), Harnstoff, extreme pH-Bedingungen, bestimmte Schwermetallionen u.a.