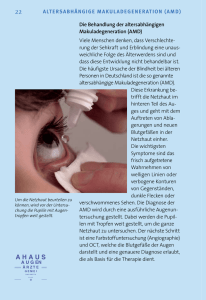
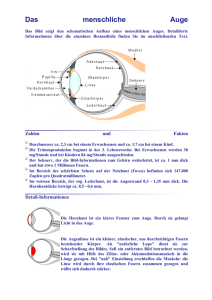
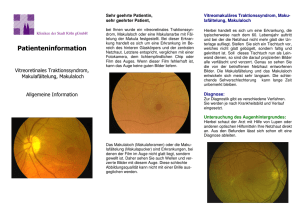
Kapitel 2 3D-OCT
Werbung

Kapitel 1 Ein Überblick über die Optische Kohärenztomographie Optische Kohärenztomographie (OCT) ist eine noninvasive, berührungsfreie, bilderzeugende Technik, die Querschnittsbilder mit einer Darstellungstiefe von ungefähr 2-3 Millimeter im Gewebe und eine Axial- und Quer-Auflösung im Mikrometerbereich hat. Nicht nur die Netzhaut und der Sehnerv, sondern auch der vordere Augenabschnitt können bildlich dargestellt werden. Die Technik wurde zuerst 1991 mit einer axialen Auflösung von < 30 ȝP demonstriert. Durch die technische Weiterentwicklung sind herkömmliche OCT bei einer axialen Auflösung von <l0 ȝP Das 3D-OCT jedoch bietet eine noch höhere Auflösung von 5 ȝP Das Funktionsprinzip des OCT ist dem Ultraschall ähnlich, der Echos verwendet, um innerhalb des Körpers Strukturen zu erkennen. Die verwendete Signalgeschwindigkeit ist Millionen Mal schneller als der Ton des Ultraschalls und erlaubt so die Darstellung von Strukturen mit einer Auflösung unter 10 ȝPLP9HUJOHLFK]XP8OWUDVFKDOOPit einer Auflösung von 100 Mikron. OCT nutzt die fantastischen Möglichkeiten der Niedrigkohärenz Interferometrie. Durch eine Superluminescentdiode wird Licht, nahe der Bandbreite von Infrarotlicht (820 nm) erzeugt, und auf die Netzhaut projiziert. Das reflektierte Licht wird dann gebrochen (gewöhnlich von einem Spiegel) und von zwei Armen erfasst. Dem Abtastarm (beinhaltet den Abtastbereich) und dem Referenzarm. Die Kombination des reflektierten Lichtes vom Abtastarm und des Lichtes vom Referenzarm erzeugt ein Interferenzmuster. (time domain OCT). Dieses Reflexionsprofil, genannt A-scan enthält Informationen über die räumlichen Dimensionen und die Position der Strukturen innerhalb des Abtastbereichs. Einen Querschnitt (B-scan) erhält man, indem man seitlich einige dieser axialen Tiefenscans (A-scan) kombiniert. Das OCT kann deutlich die Hornhaut, Lederhaut, Iris und Linse in den vorderen Abschnitten des Auges darstellen. Dies ist durch das Benutzen von infrarotem Licht mit einer Wellenlänge von 13.10 nm möglich. (Abbildung 1.1) Das OCT ist die einzige Technik, die die Tiefenstruktur der Netzhaut am lebenden Auge darstellt. Aus diesem Grund ist es zu einem unabkömmlichen Diagnoseverfahren für den Umgang mit vitreoretinal erkrankten Patienten geworden. Abbildung 1.2 veranschaulicht die Fähigkeit der OCT, unter der Oberfläche liegende mikroskopische Gewebeschichten in vivo (am lebenden Objekt) zu erkennen. (Abbildung 1.2: OCT entlang der papillomakulären Achse, die die Makula mit dem Sehnerv verbindet.) Neue dreidimensionale optische Geräte der Kohärenztomographie (3D-OCT) entwickelt durch Firmen wie Topcon Inc. sind innovative Lösungen der Augenheilkunde, die Technologie, Geschwindigkeit, Qualität und vielseitige klinische Verwendbarkeit miteinander vereinen. Diese Geräte sind bis zu 50mal schneller und 25mal genauer als herkömmliche OCT. Mit höheren Geschwindigkeiten gewinnt 3D-OCT mehr Daten in weniger Zeit, die den Abtastungsprozess für Patienten und Anwender erleichtert. 3D-OCT liefert unvergleichliche Ansichten von der Netzhaut und deren tieferen Strukturen mit der besten Auflösung, der derzeit erhältlichen kommerziellen Geräte. Die Bilderfassung, Betrachtung und das Analysieren sind mit den Software-Verbesserungen einfacher. In Verbindung mit einer Non-Mydriatischen Netzhautkamera wie im Topcon 3D-OCT ermöglicht dies einen direkten Vergleich zwischen den Rasterabbildungen der Netzhaut und den entsprechenden Tomographieschichten des OCT. Das 3D-OCT, basierend auf der spectral domain Technik (SD-OCT), ersetzt den beweglichen Teil des herkömmlichen OCT-Gerätes mit einem unbeweglichen Spectrometer. Indem es mathematische Berechnungen verwendet, kann ein SD-OCT sehr schnell ein Bild erfassen, bevor ein Patient den Blick verändert. Die höhere Geschwindigkeit, höhere Auflösung und das verbesserte Signal-Rausch-Verhältnis der SD-OCT Systeme können so die Erkennung der äußeren Netzhautgrenze und der Netzhautschichten verbessern. So ermöglicht es auch die Erfassung und Quantifizierung der klinisch relevanten Krankheitseigenschaften, wie z.B. die subretinale Flüssigkeit. Eine der herausragenden Eigenschaften des 3D-OCT-Gerätes ist, dass es 528 B-scans in kürzester Zeit erfassen kann, die einen dichten, dreidimensionalen OCTDatenwürfel ergeben. Diese 3-D Daten können entweder als Ansicht von vorn („en face“) „Cscan“ betrachtet werden oder in einer endlosen Anzahl von Lagebestimmungen und Richtungen betrachtet werden, um spezielle Regionen des Gewebefundus zu visualisieren. Trotz zahlreicher technischer Fortschritte in den letzten Jahrzehnten haben herkömmliche Time Domain OCT Geräte viele Hardware- und Software-Beschränkungen. Da das Gerät für die Dickenmessung auf mechanische Bewegungen der inneren Komponenten angewiesen ist, ist die Geschwindigkeit der Bilderfassung begrenzt. Dies begrenzt ebenfalls die Anzahl von Scans, die erzeugt werden können, bevor der Patient von seinem Fixpunkt abweicht. Derzeitig verwendete time domain OCT-Geräte erzeugen die Netzhautbilder, indem sie sechs strahlenförmig ausgerichtete B-scans in 8-10 Sekunden einfangen. Allerdings misst das Gerät auf diese Weise weniger als 5% des Makula-Bereiches wirklich exakt. Die restlichen 95% der Daten muss durch Interpolation erzeugt werden. Aus diesem Grund kann es sein, dass das Gerät die Netzhautdicke falsch bewertet und somit eventuell kleinere Verletzungen zwischen den Strahlenlinien nicht scannt (Abbildung 1.3). (Abbildung 1.3: (A) Die weißen Linien auf diesem Fundus- Bild zeigen die Positionen der sechs Radialstrahlen der B-scans bei einem Stratus OCT. (B) Rote Linien zeigen die Messpunkte, die vom Stratus OCT gemessen werden, und nicht-rote Punkte werden durch annähernde Berechnungen geschätzt. (C) Beispiel einer fokalen Verletzung, die durch das Radiallinien Verfahren übersehen werden könnte.) Im Gegensatz dazu, erfasst 3D-OCT ein dichtes und einheitliches Raster an Daten. Somit ist es unwahrscheinlich, dass kleine Verletzungen übersehen werden. Des Weiteren ermöglicht die Datendichte einen Vergleich der Blutgefäße des Patienten zu vorherigen Arztbesuchen und einen Vergleich der Scans mit anderen diagnostischen Abbildungsmodalitäten, wie z.B. Fluoreszenzangiographie. (Abbildung 1.4: Beispieldaten eines Topcon 3D-OCT Gerätes: Dichtes Raster von B-scans (im Bereich der weichen Drusen) Die Stellung der OCT Bildgebung OCT ist hilfreich bei der Diagnose und der Einteilung einer Krankheit in Stadien, sowie das Abschätzen der Wirkung einer Behandlung und der Überwachung der Krankheit. Vergleich 3er verschiedener OCT-Typen Merkmal konventionelles OCT UHR-OCT* 3D-OCT Messprinzip Time domain Time domain Spektral domain Messfähigkeit A-Scan A-Scan A-Scan B-Scan B-Scan B-Scan C-Scan 3D-Scan Lichtquelle SL Diodenlaser Femtosek-Safirlaser SL-Diodenlaser Wellenlänge 820nm 815nm 840nm Bandbreite 25nm 125nm 50nm Axiale Auflösung 10μm 3μm 5μm Transvers. Aufl. 20μm 15-20μm 18-20μm Scangeschw. 1,3 sek. 4,0 sek. 0,05 sek. Dialation erforderlich erforderlich nicht erforderlich Makular Scan 6 radial scans 6 radial scans Raster cube scan * Ultra High Resolution Verschiedene Typen von Spektral / Fourier Domain OCT sind kommerziell erhältlich: 1. TOPCON - 3D OCT Mark II 2. TOPCON - SL-OCT SL-SCAN 1 3. ZEISS - CIRRUS 4. OTI - OCT / SLO 5. OPTOVUE - RTVue-100 6. OPTOPOL - SOCT Copernicus Kapitel 2 3D-OCT (Abbildung 2.1: TOPCON 3D-OCT-1000 MARK II) Wie das 3D-OCT-1000 Mark II arbeitet Optical coherence tomography (OCT) ist eine Methode, bei der Licht von einer bestimmten Lichtquelle (üblicherweise einer Superlumineszenzdiode (SLD), welche Licht mit ca. 850 Nanometer Wellenlänge produziert) in zwei separate Ausleger geteilt wird. Einer der Ausleger wird über die Oberfläche des zu analysierenden Gewebeteils gegeben, wie z.B. über die Netzhaut, bevor es zu dem Sensor zurückreflektiert wird. Die zweite Hälfte des Original-Auslegers, Referenzausleger genannt, wird von einem Spiegel reflektiert, statt der Netzhaut, bevor es zu dem Lichtsensor zurückreflektiert wird. Durch Abgleichen der Distanz zwischen dem Referenzspiegel (und somit der Zeit, die nötig ist, bis das reflektierte Licht den Sensor erreicht) und dem Vergleichen der zwei Lichtausleger, misst das time domain OCTGerät die optische Rückstreuung des Lichtes und stellt eine Pixel-Darstellung der anatomischen Schichten innerhalb der Netzhaut dar. Anstatt die Position des Referenzspiegels anzugleichen, zeigt das TOPCON 3D-OCT-1000 Mark II (Abbildung 2.1) optical coherence tomography System die interferometrischen Informationen an, indem es eine Fourier domain spektrometrische Methode benutzt und somit die Scan- Geschwindigkeit (~27,000 A-scans/Sekunde) steigert. Durch eine Vernetzung mit der TOPCON non-mydriatischen Retina-Kamera, erstellt das 3DOCT-1000 Mark II eine hoch aufgelöste Abbildung eines OCT B-scan-Querschnitts (mit bis zu 4096 Linien) und dreidimensionale Abbildungen dar, welche ein Fläche von bis zu 6 x 6 mm der Netzhaut abdecken. Die erlangten 3D-OCT Daten werden von der Software weiterverarbeitet und analysiert (Abbildung 2.2 und 2.3). (Abbildung 2.2 schematische Darstellung der OCT Funktionsweise) Das 3D-OCT-1000 Mark II besteht aus vier Hauptteilen: - Kamera / OCT - Stromversorgungseinheit - PC-Steuereinheit - Spektroskop-Einheit (Abbildung 2.3) Die Spezifikationen des optischen 3D-OCT-1000 Mark II Systems für die Betrachtung und Fundusfotographie sind wie folgt: x Bildwinkel für die Fotographie: 45° ± 7% oder weniger. Digitaler Zoom: 2x und 4x x Photographierbarer Durchmesser der Pupille unter 45°: ij3.5 mm oder mehr Digitaler Zoom: ijPPRGHUPHKU Scan- Bereich des Fundus: 8,2 x 3,0 mm ± 5% 6 x 6 mm ± 5% 4.5 x 4.5 mm ± 5% 3 x 3 mm ± 5% Bildfrequenz- B-scan Methode: 5 Hz oder mehr (variabel) Bildfrequenz- 3D-scan Methode: 0.2 Hz oder mehr (variabel) Laterale Auflösung: 20 μm oder weniger Detaillierte Auflösung: 5 μm oder weniger Start und Beenden des 3D-OCT-1000 Programms 3D-OCT starten Klicken Sie auf das Kamerasymbol auf dem Desktop, um das Programm zu starten. Das 3D-OCT-1000 PC Software Hauptfenster wird angezeigt. (Abbildung 2.4:Startbild) 3D-OCT-1000 beenden: Klicken Sie auf das Schließen-Symbol (rotes X am rechten oberen Fensterrand) Das 3D-OCT-1000 Programm besteht aus drei Teilen: Capture Data (Aufnahme), View Data (analysierte Daten ansehen) und Datenmanagement (Archivieren, Patientendaten ändern, Kopieren) Der Benutzer kann die gewünschte Funktion auswählen, indem er auf die jeweilige Schaltfläche im linken Fensterteil klickt. Kapitel 3 Erfassen von 3D-OCT Scans Das Erfassen von Abbildungen in 3D-OCT Format erfordert normalerweise die folgenden Schritte: 1. Bereiten Sie den Patienten vor. 2. Tragen Sie die Patientendaten ein. 3. Wählen Sie ein OCT Scan Muster aus (MAKULA Modus, Glaukom Modus oder NUR Fundusbild) 4. Justieren sie den OCT Scan ab und optimieren Sie ihn (im live Modus). 5. Erfassen Sie das gewünschte Gewebestück. 6. Bewerten Sie die erfassten Scans. 7. Speichern oder löschen Sie die erfassten Scans. Nach dem Speichern analysiert das System automatisch alle gespeicherten Daten im Hintergrund und es kann weiter Aufgenommen werden. Bereiten Sie den Patienten vor Die 3D-OCT Untersuchung ist der non-mydratischen Netzhaut-Kamera-Untersuchung sehr ähnlich, denn sie dauert normalerweise nicht lange und ist angenehm für den Patienten. Der Patient wird üblicherweise gebeten, sich bestmöglich auf einen Punkt zu konzentrieren, um somit ein bestmögliches OCT-Bild zu erfassen. Demzufolge ist es hilfreich, den Patienten vor der Untersuchung kurz einzuweisen, wo er oder sie hingucken muss und wann man blinzeln und wann nicht blinzeln darf. Das 3D-OCT-1000 ist fähig sowohl OCT als auch Netzhautabbildungen bei einem Pupillendurchmesser von nur 3,5mm zu erfassen. Ein Mydriatikum zur Pupillenerweiterung ist optional anwendbar. Andererseits ist es im Allgemeinen einfacher, adäquate Abbildungen bei einer erweiterten Pupille zu erhalten. Wird kein Mydriatikum benutzt, wird empfohlen den Raum zu verdunkeln, so dass die Pupille sich auf natürliche Weise ein wenig erweitert. Eine Aufnahme starten: 1. Klicken Sie auf das Aufnahme-Symbol „Capture Data“ 2. Das Patientendaten-Fenster erscheint (Abbildung 3.1). Einen neuen Patienten erfassen: (Abbildung 3.1:Erfassungsbildschirm) 1. Füllen Sie die Patientendaten in die Felder des Dialogfensters ein. 2. Klicken Sie auf REGISTER 3. Sie können weitere Informationen eintragen, indem Sie auf den „More“-Knopf klicken (Abbildung 3.2). (Abbildung 3.2) 4. Wenn die Patientendaten bereits auf der Datenbank existieren, klicken Sie auf den „Select-Patient…“-Knopf und dann auf den gewünschten Patienten. (Hinweis) Die Patientennummer und der Name des Patienten müssen angegeben werden. Weitere Informationen sind optional. Geburtsdatum und Geschlecht können verpflichtend sein, sollte dies von dem Benutzer gewünscht werden. Außerdem sind alle Felder, mit Ausnahme der Patientennummer, editierbar. Nachdem die Patienteninformationen eingetragen wurden und der Scan Modus gewählt wurde, öffnet der 3D-OCT-1000 PC den „Live“ Modus automatisch. (Abbildung 3.3: Live Fenster im Aufnahmemodus) (Hinweis) Die OCT Daten werden normalerweise als Miniaturbild dargestellt, welches aus zwei Teilen besteht. Bei einem gewöhnlichen B-Scan ist die obere Abbildung der Miniatur-OCT B-scan und die untere Abbildung ein Foto des dazugehörigen Miniatur-Farb-Fundus. Bei einem 3D-Scan ist die obere Abbildung der MiniaturOCT B-Scan in der Mitte des Fundus (foveal zentriert) und die untere eine Abbildung einer Miniatur Projektionsabbildung. Dies sind Miniaturbilder für Linienanalyse und 3D-scan (Abbildung 3.4). (Abbildung 3.4: Miniaturbild Anzeige) Sobald das Aufnahmebild im live Modus ist, müssen Sie als erstes das richtige OCT-ScanProtokoll für die Datenerfassung aussuchen. Der Benutzer wählt unter Scan-Parameter das gewünschte Scan-Protokoll aus (3D Scan, Radial Scan oder Raster Scan (im Makula Modus) (Abbildung 3.5) (Abbildung 3.5: Scannprotokoll Fenster Makula Modus) Das 3D-OCT-1000 ist fähig, die Netzhaut mit verschiedenen, vordefinierten, Scan- Mustern, Bereichen und -Dichten darzustellen, wie in der folgenden Tabelle dargestellt. Anschließend wählt der Benutzer die angemessene Fixierungsmethode des Patienten aus. 3D-OCT-1000 hat sowohl eine interne als auch externe Fixierung. Der Benutzer wählt das gewünschte Fixierungsprotokoll mit den Fixationsmodi (Macula oder Glaucoma) aus der Scan-Parameter-Tabelle, basierend auf dem zu scannenden Bereich der Netzhaut des Patienten. Die folgenden Schritte sind notwendig, um den Patienten für die Untersuchung vorzubereiten: (Abbildung 3.6: Position des Patienten) 1. Setzen Sie den Patienten bequem in einen Untersuchungsstuhl. 2. Stellen Sie die Tischhöhe oder Stuhlhöhe ein, so dass der Patient entspannt sein Kinn zentral auf die Kinnablage legen und seine Stirn an die Stirnablage lehnen kann. 3. Stellen Sie die Höhe der Kinnablage ein, so dass der Augenwinkel des Patienten auf einer Höhe mit dem Canthus Marker an der Außenseite der Kopfstütze ist. 4. Benutzen Sie den Joystick, um das Gerät in Richtung des Benutzers zurückzuziehen. Für optimale Resultate sollte der Patient den inneren grünen Fixierungspunkt in der Mitte des Displays fokussieren. 5. Bewegen Sie das Gerät in alle Richtungen, bis das Auge des Patienten in der Mitte des Monitors zu sehen ist. OCT Scans ausrichten und optimieren Die folgenden Schritte sind notwendig, um die Abbildung der Netzhaut auszurichten. 1. Bringen Sie auf dem Video-Monitor die Anzeige „( )“ der Pupille des Patienten entgegen (Abbildung 3.7). Versichern Sie sich, dass die Pupille des Patienten größer ist als die Anzeige. Der Vergleich zwischen der Anzeige und der Pupille bestimmt, ob die Pupille groß genug ist für eine gute Netzhaut-Photographie. (Abbildung 3.7: Klammer für die Justierung) 2. Die Z-Achse muss angepasst werden, um die Abbildung der Netzhaut auf dem Bildschirm anzupassen. Dies kann durch zwei Methoden erreicht werden. Jede Methode sollte einzeln durchgeführt werden: a. Drehen Sie die unteren linken und rechten Knöpfe an dem 3D-OCT1000 Gerät, um die zwei weißen Linien anzupassen und somit zu synchronisieren. b. Wählen Sie die blauen „hoch“ und „runter“ Pfeile auf der linken Seite des Displays, indem Sie darauf klicken und die linke Maustaste gedrückt halten. Drehen Sie die Knöpfe oder halten Sie die Maustaste bis die Abbildung der Netzhaut angezeigt wird. Bearbeiten Sie es weiter, falls notwendig, um ein optimales Bild zu erhalten. 3. Bringen Sie das 3D-OCT-1000 näher an den Patienten, bis zwei helle Punkte sichtbar werden( Abbildung 3.8). 4. Diese zwei hellen Punkte müssen übereinandergelegt werden, indem der Joystick bewegt oder gedreht wird, bis die zwei Punkte einen Punkt darstellen. Dieser Punkt wird Fokussierpunkt genannt. 5. Passen Sie den Fokussierpunkt innerhalb der Anzeige „( )“ auf dem Video Monitor an (Abbildung 3.9). (Abbildung 3.8: Helle Punkte) 6. Der Fokussierbalken ist eine vertikale Linie in der Mitte der 3D-OCT-1000 Abbildung. Benutzen Sie den Fokussierknopf, um es der Abbildung der Netzhaut anzupassen. 7. Der letztendliche Fokus wird erreicht, indem Sie an den oberen, linken und rechten Knöpfen des 3D-OCT-1000 drehen, um die Abbildung der Netzhaut anzupassen (Abbildung 3.10). (Abbildung 3.9: korrekte Ausrichtung) (Abbildung 3.10: Bildschirmansicht des Netzhautbildes) (Abbildung 3.11: 2D Bild im Aufnahmemodus mit Bildqualitätsanzeige) Bilderfassung, Aufnahme Um eine Aufnahme zu machen, drücken Sie den Knopf auf dem Joystick oder die Auto-ZTaste neben dem Joystick. Es wird dann die Aufnahme als Miniaturbild unterhalb des Aufnahmefensters abgelegt. (Hinweis) Der Patient wird gebeten, nicht zu blinzeln während das Bild erstellt wird. Die OCT Daten werden erfasst und vorübergehend in der Hardware gespeichert und im Hintergrund bearbeitet. Das Miniaturbild der OCT Daten wird dem Miniaturbildansicht-Panel hinzugefügt. Klicken Sie auf „save“, wenn der Scan im oberen Teil des Miniaturbildes mittig ist und das Projektionsbild im unteren Teil des Miniaturbildes ohne schwarze Querlinien zu sehen ist. Die Aufnahme wird automatisch im Hintergrund vollständig analysiert. (Abbildung unten) Verwenden Sie den „Live-Button“ um eine weitere Aufnahme desselben Patienten zu machen und das Live-Aufnahmefenster wird wieder gestartet). Nachdem die OCT-Scans erstellt wurden, kann die Qualität der erstellten Daten ausgewertet werden, indem sofort der Playback-Modus gestartet wird. Dies geschieht durch einen Doppelklick auf ein Miniaturbild in dem Miniaturbildansicht-Panel oder durch einfachen Klick auf das Play Back Symbol auf der Taskleiste. Bewertung eines B-Scan 1. Ein einzelner B-Scan (Linie) hat keine Bildlaufleiste. 2. Ran- und wegzoomen ist mit der rechten Maustaste und schieben der Maus möglich. 3. Schieben des Scans ist mit der mittleren Maustaste möglich. 4. Nachdem der Scan gespeichert ist, wird er automatisch analysiert. Allerdings ist die Analyse auf eine 2D Ansicht begrenzt. Bewertung eines 3D-Scan 1. Ein 3D-Scan hat eine Bildlaufleiste. Diese kann benutzt werden, um verschiedene Teile des Scans anzuzeigen. 2. Ran- und wegzoomen ist mit der rechten Maustaste möglich. 3. Schieben des Scans ist mit der mittleren Maustaste möglich. 4. Nachdem der Scan gespeichert ist, wird er automatisch analysiert. In beiden Modi wird mit Doppelklick im Scan die entsprechende Referenzstelle im Fundusfoto angezeigt. Diese Funktion ist auch umgekehrt durchführbar, indem Sie eine Stelle im Foto mit Doppelklick markieren. Sobald die erfassten OCT-Scans angezeigt werden, entscheidet der Benutzer, ob sie gelöscht oder in der Datenbank gespeichert werden sollen. Löschen eines Scans 1. Markieren Sie das Miniaturbild in dem Miniaturbildansicht-Panel 2. Klicken Sie auf das Feld löschen (delete) in dem Miniaturbildansicht-Panel 3. Bestätigen Sie die Löschung. Klicken Sie auf OK. Speichern eines Scans 1. Markieren Sie das Miniaturbild in dem Miniaturbildansicht-Panel 2. Klicken Sie auf das Feld speichern in dem Miniaturbildansicht-Panel 3. Die Beschriftung des Miniaturbildes wird sich ändern und „saved“ anzeigen. Alle Scans gleichzeitig speichern 1. Klicken Sie auf das Feld „alle speichern“ (Save all) in dem Miniaturbildansicht-Panel 2. Bestätigen Sie ihre Wahl, indem Sie auf „alle speichern“ (save all) klicken. Klicken Sie auf OK. Kapitel 4 Analysieren von 3D-OCT Scans Sobald ein analysierter OCT-Scan ausgewählt ist, öffnet sich automatisch der Betrachtungsmodus (View Mode) zur Auswertung der Daten für den Benutzer. In den meisten Fällen sind Benutzer besser vertraut mit OCT-B-scan Abbildungen als mit OCT 3DAbbildungen. Um den Übergang von der Analyse konventioneller B-Scan Abbildungen zu 3D Abbildungen zu vereinfachen, enthält das 3D-OCT Sichtfenster sowohl 2D- als auch 3DTabellen von 3D-Scans. Das Sichtfenster öffnet standardmäßig im 2D-Modus. Falls die OCT Datenanzeige ein herkömmlicher B-scan (Linien-Scan) (line scan), KreuzScan cross-scan, oder Ring-Scan circle scan ist, so werden die Daten lediglich im 2D-Modus angezeigt. Das 3D-OCT Betrachtungsfenster besteht aus den folgenden 4 Unter-Fenstern (Abbildung 4.1): 1. Haupt-OCT Sichtfenster (BScan). 2. Retina-Foto Sichtfenster mit Steuertools. 3. Zusatz-OCT Sichtfenster (Grafik und Topografie). 4. Miniaturbild-Vorschaufenster. (Abbildung 4.1: Betrachtungsfenster) (Hinweis) Eine der Leistungsfähigen Funktionen der 3D-OCT Software ist die direkte Interaktion zwischen den OCT Daten und der „en face“ (Ansicht von vorne) Fundus-Abbildung Eine der wesentlichen Funktionen der 3D-OCT Software ist die Bereitstellung einer direkten Verknüpfung von OCT Scans mit den korrespondierenden en face Netzhautabbildungen, die im Fotografie-Fenster angezeigt werden (Abbildung 4.2). Es gibt 4 Typen von Netzhaut-Abbildungen, die mit den OCT Daten verknüpft werden können: - Non-mydriatische Farbfundusfotografie - Schwarz/Weiss infrarot-Abbildung (Live-Foto) - Projektions-Foto (reale Scanaufnahme) - Referenz-Foto (z.B. importierte Angiografie) (Abbildung 4.2) B-1: Non-mydriatische Fundus Farbabbildung, B-2: Projektionsbild der 3-D OCT Daten, B-3 S/W infrarot Fundus-Abbildung, B-4: Maximieren des Unterfensters oder wechseln zur Ansicht in Originalgröße, B-5: Der B-Scan Lageindikator zeigt die Position, an der der BScan erstellt wurde, B-6: 3D Scannbereich, B-7: Menüschaltfläche (ÜberlagerungsProjektion und Neu-Positionierung sind Untermenüs von „Overlay“ ( Überlagerung). Pin-point Registration™ Bei einem herkömmlichen OCT muss der Patient für einige Sekunden den Blick auf den Fixierungs-LED richten. Leider sind hierbei kleinere Bewegungen der Augen während dieser kurzen Zeit kaum zu vermeiden. Dies reduziert die Zuverlässigkeit der Datenanalyse in Bezug auf wo auf der Netzhaut das OCT das Bild abgegriffen hat. Folglich reduziert dies auch die Zuverlässigkeit des Vergleichs eines OCT-Scan Befundes mit einem „en face“ (Ansicht von vorn) Befundes von Netzhautbildern. Projektionsbild (Projection Image) (Abbildung 4.3) 3D-OCT bietet durch die Einführung des „Projection image“ eine einzigartige Möglichkeit genau dieses Problem zu beheben. Ein hochgerechnetes Bild wird erstellt, indem alle Messpunkte der 3D-OCT Daten longitudinal summiert werden, üblicherweise als S/W Bild dargestellt. Interessanterweise werden die Netzhauteigenschaften (z. B. Blutgefäßmuster) im hochgerechneten Bild sichtbar, während es mathematisch ein Pixel-zu-Pixel Verhältnis zwischen dem hochgerechneten Bild und dem 3D-OCT Scan gibt. 3D-OCT Software bedient sich dieser einzigarteigen Eigenschaften des hochgerechneten Bildes und wendet hoch entwickelte Computeralgorithmen an, um eine klinisch nutzbare Funktion namens Pin-point Registration™ zu erreichen. (Abbildung 4.3) Automatische Ausrichtung (Automatic Registration) 3D-OCT Software verwendet hoch entwickelte Mustererkennungs-Algorithmen, um das „projection image“ mit den Fotos des Augenhintergrunds zu verknüpfen. Ausführen einer Automatischen Ausrichtung 1. Klicken Sie auf das Feld „Registration“ in dem Bildbearbeitungs-Fenster. 2. Eine Projektionsabbildung wird innerhalb der Grenzen des Fundusfensters erscheinen. Die Projektionsabbildung innerhalb der Grenzen sollte ebenfalls proportional angepasst innerhalb der Fundusabbildung erscheinen (Abbildung 4.4). (Abbildung 4.4) Die automatische Ausrichtung könnte fehlschlagen wenn die Projektionsabbildung nicht ausreichend Merkmale bietet. Der Benutzer kann die Projektionsabbildung manuell ausrichten. Ausführen einer manuellen Ausrichtung 1. Drücken Sie die <Shift> Taste auf der Tastatur und ziehen Sie gleichzeitig mit der mittleren Maustaste. 2. Die Projektionsabbildung wird transparent, um es dem Benutzer zu ermöglichen dieses zu bewegen und deckungsgleich mit der Fundusabbildung auszurichten. (Abbildung 4.5 und 4.6). (Abbildung 4.5 und 4.6) Entsprechungspunkte (korrespondierende Punkte) (Abb. 4.7) Sobald die Projektionsabbildung mit der Fundusabbildung richtig registriert ist, sind die 3DOCT Daten punktgenaue Fundusabbildungen. Die 3D-OCT Software bietet ein benutzerfreundliches Interface, mit dem der Benutzer einen zusätzlichen Einblick der wesentlichen Merkmale, von Fundusabbildung und OCT-Scan, gewinnt. Dies ist an jeder beliebigen Position durch einen einfachen Mausklick möglich. Im Fundus Fenster doppelklicken Sie auf den gewünschten, näher zu betrachtenden, Punkt. Der Punktbereich wird mit einer grünen Linie mit einem Rautensymbol angezeigt, wo die grüne Linie mit dem Bereich des resultierenden B-Scan korrespondiert. Des Weiteren korrespondiert die Mitte des Rautensymbols mit dem Bereich der weißen Linie auf dem BScan und dem A-Scan, welches zusätzlich in dem OCT Fenster angezeigt wird. (Abbildung 4.7: Sichtfenster, das die Entsprechungspunke zeigt) Alternativ kann der Benutzer auch auf jeden beliebigen Bereich der B-Scan-Abbildung doppelklicken und die korrespondierenden Punkte werden auf der Fundusabbildung markiert. (Hinweis) Die Qualität und Präzision der Pin-point registration™ hängt von der Qualität der Projektionsabbildung ab. Wenn blinzeln, ruckartige Bewegungen oder andere Augenbewegungen während der Aufnahme auftreten, ist die Verlässlichkeit der exakten Übereinstimmung von OCT und Fundusabbildung gefährdet. Die 3D-OCT Software bietet dem Benutzer außerdem die 3D Darstellung für eine gründliche Analyse der 3D-OCT Daten. Dieser 3D-Modus kann durch Aussuchen des 3D-Tab in dem 3D-OCT Anzeigefenster gestartet werden. (Abbildung 4.8) (Abbildung 4.8: Analyse Fenster) Ist der OCT Datensatz ein Radial- oder 3D-Scan so werden die Daten im 2D- Modus angezeigt. Dennoch sind sowohl 2D- als auch 3D-Tabs abrufbar. Dies ermöglicht dem Benutzer, den Datensatz im 2D- und 3D-Modus anzusehen. Der 3D-Scan Modus ist ähnlich dem des 2D-Modus mit einer Ausnahme, denn die 3D Darstellung wird im Haupt-OCT-Fenster angezeigt und 2D-Abbildungen werden im OCTZusatzfenster (unten rechts) angezeigt. Dennoch werden bei einem radialen Scan die radial wiedergebenden Abbildungen im HauptOCT-Fenster und 2D-Abbildungen als OCT-Zusatzfenster angezeigt. Das „radial rendering“ hat kein 3D-Menü, sondern ein Schnitt-Menü, ohne Unter-Menüs. X,Y,Z Ebenen und Schnitte (Planes and Slicing) Die 3D-OCT volumetrischen Daten entstehen durch abrufen von horizontalen, sequentiellen B-Scans in einem Rastermuster. Normalerweise werden die X, Y, und Z Ebenen auf die folgende Art und Weise definiert: X-Ebene ist der horizontale B-Scan, wie er erstellt wurde. Beachten Sie, dass die anatomischen OCT-Merkmale, die in der X- Ebene angezeigt werden, „real“ sind, da die Augenbewegung vernachlässigbar ist. Y- Ebene ist der vertikale, “rekonstruierte“ B-Scan. Die Augenbewegungen in diesem “rekonstruierten“ B-Scan machen sich bemerkbar. Z- Ebene wird auch Coronal Scan oder C-Scan genannt. Es ist eine “rekonstruierte“ en face (Ansicht von vorn) Abbildung. Die Ebenenzuordnung zwischen X-, Y- und Z-Ebenen-Abbildungen mit dem volumetrischen 3D Rendering kann am besten durch Einschalten des „Slicing“ (schneiden) dargestellt werden (Abbildung 4.9). X-Ebene Y-Ebene Z-Ebene (Abbildung 4.9) Zuschneiden (Cropping) Um die Pathologie, die sich innerhalb der erstellten 3D Abbildung befindet, zu visualisieren, kann es sein, dass der Benutzer einige Teile der 3D Abbildung (Abbildung 4.10) zuschneiden muss. Die 3D-OCT Software bietet einfach zu benutzende Hilfsmittel zur Bewältigung dieser Aufgabe. (Abbildung 4.10) Klicken Sie auf die Volumen “Volume“ Æ Zuschneiden “Cropping“ Schaltfläche und die Schneidegriffe werden, wie angezeigt, erscheinen. Der Benutzer verwendet die Maus, um den gewünschten Schneidegriff an die korrespondierende Oberfläche zu ziehen / drücken. Die zugrundeliegende 3D Abbildung verändert sich dementsprechend. Das Ablösen und Separieren von Schichten (Peeling und Layer separation) sind zusätzliche Optionen, die sich in dem 3D-Fenster befinden. Die Funktionen werden hauptsächlich im 3DModus ausgeführt. Der Benutzer kann diese Optionen nutzen, um Schichten der 3DAbbildung (Abbildung 4.11) zu untersuchen und zu trennen. Diese Schichten sind analog zu den weiß umrandeten Grenzflächen im 2D-Modus. Zunächst wählen Sie die 3D Modus Anzeige aus der oberen linken Menüleiste. Wählen Sie keine der anderen Optionen und wählen Sie Volumen Æ Peeling Schaltfläche in dem 3DFenster. Die Peel 1 und Peel 2 Schaltfläche sind nun verfügbar. (Abbildung 4.11) Um Schichten zu „peelen“ (ablösen): Wählen Sie zwischen der Subvolumen 1 oder Subvolumen 2 Schaltfläche, um die gewünschte Schicht zu „peelen“. Um Ebenen (Layers) zu separieren (trennen): Wählen Sie entweder die Sub 1Æ Bewegen Schaltfläche (Move) oder Sub 2Æ Bewegen Schaltfläche. Bewegen Sie die Schaltflächen, um die gewünschte Schicht zu separieren. Bewegen Sie die ausgewählte Schicht, indem Sie mit der mittleren Maustaste scrollen, bis die gewünschte Separationsdistanz erreicht ist. Um den „peeling“- und Schichtenseparationsprozess rückgängig zu machen: Wiederholen Sie den Separationsprozess in umgekehrter Reihenfolge, um zu der Ausgangsform zurückzugelangen. Ergebnisvergleich (Compare Results) (Optional) Falls vorhanden, kann der Benutzer verschiedene Scan Resultate eines Patienten vergleichen. Zunächst wählen sie die Vergleichsschaltfläche aus der oberen Menüleiste. In dem erzeugten Abbildungsvergleich-Fenster werden sowohl Fundus als auch 2D-ScanAbbildungen auf dem Bildschirm als Übersicht angezeigt. (Abbildung 4.12: Vergleich) 1. Drücken Sie die (Select) Auswahlschaltfläche in dem Vergleichsfenster. Dieser öffnet ein pop-up Fenster (“Select Record“), welches alle anderen vorhandenen Analyseaufzeichnungen des Patienten anzeigt (Abbildung 4.13). (Abbildung 4.13: Vergleichsfenster, Analyseaufzeichnung hinzufügen) (Abbildung 4.14) Ergebnisvergleich ausführen 1. Markieren Sie die synchronisiert (Synchronized) Checkbox, um die Pin-point Registration™ Anwendung zu starten und verknüpften Abbildungen zum Vergleich anzuzeigen. 2. Es gibt zusätzliche Optionen in dem Abbildungsvergleich-Fenster. Benutzer haben die selben Optionen wie im Fundus-Fenster: Überlagerung (Overlay) 1. Projection (Standard) 2. Shadowgram 3. Thickness Map (Dickendiagramm) 4. Reposition Gitter (Grid) 1. Rechtwinklig (Rectangular 2. ETDRS (Early Treatment Diabetic Retinopathy Study) ) (Abbildung 4.15) (Abbildung 4.15: ETDRS Überlagerung) Filme erstellen Wählen Sie das Filmzeichen aus der Menüleiste oben links aus. Die drei Fenster werden wie folgt angelegt (Abbildung 4.16): a. 3D Volumenabbildung b. Film - Kontroll – Menü c. Patienten und Scan Informationen (Abbildung 4.16: Film Fenster) Die Volumenabbildung wird an der rechten Seite zusammen mit den Bildschirmparametern (Cropping, Peeling, Slicing, Surface 1-3 und Volumen) angezeigt. (Hinweis) Für einen Radial Scan sind Zuschneiden (Cropping) und Trennen (Peeling) deaktiviert, denn sie sind für diese Scan Typen nicht anwendbar. 1. Automatisches erstellen vorgefertigter Filme (Make Pre-arranged Movies-Automatic) a. Parameter x Rotation- (X-Ebene, Y-Ebene und Z-Ebene) und Wiederherstellungsbox. x Beschneiden (Cropping-) (X-Ebene, Y-Ebene, Z-Ebene, XZ-Ebene und XZYEbenen) und Wiederherstellungsbox. x Ablösen (Peeling-) RPE, Wiederherstellungs-box. (X-Ebene, Y-Ebene und-Z Ebene) und b. Wählen Sie zwischen den oben genannten Parametern um einen automatischen Film herzustellen. c. Drücken Sie die „Preview“ (Vorschau) Schaltfläche. d. (Optional) Drücken Sie STOP in dem pop-up Fenster, um eine Vorschau zu vermeiden. e. Wiederholen Sie die Schritte (b) und (c), bis der gewünschte Effekt erreicht wurde. Drücken Sie die „reset“-Schaltfläche in dem Auswahlmenü, um den Prozess der Filmherstellung erneut zu starten. (Hinweis) Versichern Sie sich, dass das 3D-Fenster frei von allerlei blockierenden Abbildungen oder anderen Fenstern ist. x Wählen Sie die „Save“ (Speichern) Schaltfläche. In dem pop-up Save-As Fenster geben Sie den Namen ein und drücken Sie die „Save“- Schaltfläche. x (Optional) Drücken Sie STOP in dem pop-up (process) Bearbeiten-Fenster, um den Speicherprozess abzubrechen. Der Film wird bis zu diesem Punkt gesichert. 2. Manuell erstellte Filme (Make Custom Movies- Manual) Wenn Sie einen Film machen möchten bei dem Sie alle Ereignisse selber kontrollieren möchten, wählen Sie die manuelle (Manual) Option. Ihre Mausbewegungen bestimmen dann ihr Endergebnis. Markieren Sie die „Record Events checkbox“ um einen Film herzustellen, in dem Ihre Mausbewegungen aufgenommen werden. Die manuellen Parameter (Record, Replay und Create) werden automatisch aktiviert, wo hingegen die Vorschau- und Sicherungs-Schaltflächen im Automatik-Bereich deaktiviert sind. (Hinweis) Versichern Sie sich, dass das 3D-Fenster frei von blockierenden Abbildungen oder anderen Fenstern ist. x Drücken Sie die „Record“-Schaltfläche (aufnehmen). x Benutzen Sie Ihre Maus, um manuelle Bewegungen wie zuschneiden „cropping“, ablösen „peeling“, drehen „rotation“, Schnitte erstellen „slicing“, Zoomen oder Umsetzen der Abbildungen im 3D-Fenster zu benutzen. x Drücken Sie die Stopp-Schaltfläche wenn Sie fertig sind. x Um eine Vorschau zu erhalten, drücken Sie „replay“. x Wiederholen Sie Schritt (c) bis (f), bis die gewünschten Effekte erreicht sind. Drücken Sie die Reset-Schaltfläche, um den Prozess der Filmherstellung mit der ausgewählten Abbildung erneut zu starten. x Beachten Sie: Wenn Sie ruckartige Handbewegungen ausgleichen wollen, markieren Sie die Interpolate check-box. x Wählen Sie die „Create“-Schaltfläche, tragen Sie den Namen der Datei in das „popup Save As“ Fenster ein und drücken Sie auf Speichern (Save). Kapitel 5 OCT Darstellung der unauffälligen Netzhaut Die OCT ermöglicht, die Netzhaut aus Sicht eines Querschnitts des Vitreous (Glaskörkers) von der inneren Grenzmembran bis zur Choriocapillaris und der oberflächlichen Aderhaut zu untersuchen (Abbildung 5.1a bis 5.2). Die innere Grenzmembran des Auges ist in dem OCT-Scan auf Grund der Kontraste zwischen der nicht-reflektierenden Vitreous and der reflektierenden Netzhaut deutlich erkennbar. Der hintere Hyaloid ist oft als eine sehr schwache, dünne und leicht reflektierende Linie sichtbar. Er kann mit der Netzhaut in Kontakt sein oder alleine stehen. Direkt hinter dem Vitreous befindet sich die stark reflektierende Netzhaut-Nervenfaserschicht. Diese Schicht ist auf Grund der Dichte des Papillomakular-Bündels besser auf der nasalen Seite der Fovea sichtbar. Die Fovea ist mit ihrer charakteristischen Grube in dem Netzhautprofil einfach erkennbar. Es ist oft, aber nicht immer, möglich, die interne und externe Plexiformschicht, die leicht reflektierend sind, zu erkennen. Der Reflektionsgrad der Plexiformschicht ist höher als die der Nuklearschicht. Normale Netzhautgefäße, welche sich in der Nervenfaserschicht befinden, können auf Grund des Blutinhalts nicht eindeutig unterschieden werden. Nichts desto trotz können sie einfach durch den Schattenkegel, den sie auf den hinteren Schichten formen (Abbildung 5.1 A und B), lokalisiert werden. Die Photorezeptoren bilden ein schwach reflektierendes Band direkt vor dem Pigmentepithel. Der schwache Reflektionsgrad entsteht durch die vertikale Orientierung der Photorezeptoren. Das Photorezeptorenband ist in der Umgebung der fovealen Grube dicker. Der externe Teil der neuralen Netzhaut ist durch ein stark reflektierendes Band, welches mit dem Netzhaut-Pigment-Epithelium korrespondiert, verbunden, wo hingegen die Bruchssche Membran und die Choriocapilaris als einzelne schwach reflektierende Struktur auf dem optischen Scan erscheinen. Dennoch kann dieses Band in drei Strukturen geteilt werden: Die Erste ist dünn und hyper-reflektierend (Verbindung der Inneren- und ÄußerenPhotorezeptorsegmente), die Zweite ist sehr dünn, hyper-reflektierend und nicht immer feststellbar, und die Dritte ist dicker und hyper- reflektierend (Netzhaut Pigmentepithelium). (Abbildung 5.1 A Farbfundusfoto mit Scanlinie durch die Fovea) (Abbildung 5.1 B) (Abbildung 5.2) Tabelle: descriptive Statistik der makulären Dickenmessung in „Normalaugen“ (Indien (n=76)) mit Topcon 3D-OCT-1000 Variable in μm Reichweite (min-max) Mittel +- SD 95% zutreffend intervall Foveale Dicke 154 – 282 205,59 +- 30,60 198,55 – 212,63 Temporal makulär 220 – 308 270,89 +- 17,89 266,78 – 275,01 Superior makulär 248 – 325 288,72 +- 17,54 284,69 – 292,76 Nasal makulär 231 – 322 286,28 +- 21,50 281,33 – 291,23 Inferior makulär 210 – 311 272,77 +- 21,91 267,73 – 277,82 Temporal ex makulär 210 – 276 237,49 +- 16,33 233,74 – 241,25 Superior ex makulär 217 – 283 248,88 +- 13,86 245,69 – 252,07 Nasal ex makulär 217 – 311 272,71 +- 16,68 268,87 – 276,55 Inferior ex makulär 224 – 311 255,76 +- 19,02 251,38 – 260,14 OCT Darstellung des Sehnervkopfes (Abb 5.6 a&b) Ein horizontaler OCT-Scan offenbart den physiologischen „CUP“ in den die stark reflektierenden Nervfasern eindringen. Die Netzhaut ist an der Grenze der Papille unterbrochen. Das retinale Pigment-Epithelum und die Choriocapillaris sind scharf verkürzt, während die oberflächlichen Nervenfasern zusammen mit den Fasern des Sehnervs, durchgehend sichtbar sind. Der Skleral-Ring ist sichtbar. (Abbildung 5.6 a) (Abbildung 5.6 b) Sektion 2 OCT Scan-Muster bei verschiedenen Krankheitsbildern Kapitel 6 „zentrale seröse Chorioretinopathie“ Idiopathic central serous chorioretinopathy (ICSC) ist eine Krankheit bei der eine seröse Ablösung der neurosensorischen Netzhaut über eine Leckage der Choriocapillaris durch das Netzhaut-Pigment-Epithelum (RPE) auftritt. Es ist generell eine selbstbegrenzende Krankheit, dennoch kann sie wiederholt auftreten. Klassischerweise tritt das ICSC am meisten bei Patienten zwischen dem 20. und 55. Lebensjahr mit einer Typ A Kategorie auf. Dieses Krankheitsbild betreffen Männer 6 -10 mal häufiger als Frauen. Patienten, die im Alter von 50 Jahren und älter diagnostiziert werden, haben eine bilaterale Krankheit und zeigen häufiger diffuse RPE Veränderungen. Optical coherence tomography (OCT) offenbart viele Aspekte der Pathophysiologie des ICSC, von „subretinaler Flüssigkeit“, „Pigment-Epithelialer-Abhebung bis hin zur „subklinischen, neurosensorischen-Makula-Ablösung). Das ICSC kann in zwei deutlich zu unterscheidende Erscheinungsformen eingeteilt werden. FA des klassischen ICSC zeigt ein oder mehrere „fokale Leckagen“ auf Höhe des RPE. Die klassische Schornstein-Erscheinung der Fluorescein-Leckage ist lediglich in 10 -15% der Fälle sichtbar. Das FA der diffusen retinalen Pigmentepitheliopathie zeigt fokale, körnige Hyperfluoreszenz, korrespondierend mit Durchlassdefekten und Blockaden, hervorgerufen durch RPE Atrophien und Verklumpen und dadurch mit einem oder mehreren Bereichen eine subtile, kontinuierliche Durchlässigkeit verursacht. ICG Angiografie zeigt frühzeitig hypofluoreszente Bereiche im Angiogramm an, gefolgt von später Hyperfluoreszenz und Leckage im Gefäßsystem der Aderhaut. Oft sind mehrfache „Leckage“ Bereiche im ICG erkennbar, die jedoch klinisch oder bei der FA nicht offensichtlich sind. Fall 6.1: ICSC mit seröser Netzhaut-Ablösung Krankheitsfall Ein 45 Jahre alter Mann mit einem verminderten Sehvermögen innerhalb eines Tages auf dem linken Auge. Die bestkorrigierte Sehschärfe dieses Auges betrug 0,6. Die FluoreszenzAngiografie zeigte eine „Nebel-Erscheinung“, welche die Diagnose von ICSC bestätigte (Abbildung 6.1.1 und 6.1.2). Optical Coherence Tomography Ein horizontaler Linien-Scan durch die Fovea zeigte eine Erhebung der neurosensorischen Netzhaut mit einem deutlichen Abstand unterhalb der Fovea, korrespondierend zu der serösen Flüssigkeit unter der Fovea (Abbildung 6.1.3). Die Netzhauttopografie zeigte eine foveale Dicke von 528 Mikrometer. Verlaufskontrolle (Follow- up) Der Patient wurde konservativ behandelt und bei der Nachfolgeuntersuchung nach 3 Monaten hatte sich die Sehschärfe auf 1,0 verbessert. Ein wiederholtes OCT zeigte eine Wiederkehr der fovealen Kontur mit einer Abschwächung der serösen Netzhaut-Ablösung und der gemessenen Dicke der Fovea von nun 280 Mikrometer (Abbildung 6.1.3 F bis I). Fall 6.2: ICSC mit seröser Netzhaut-Ablösung und Pigmentepithelabhebung in einem Auge und mehrfache Pigmentepithelabhebung im anderen Auge Krankheitsfall Ein 37 jähriger Mann mit zweimonatigen Beschwerden mit vermindertem Sehvermögen auf dem rechten Auge. Seine bestkorrigierte Sehschärfe dieses Auges betrug 0,6. Die Fluoreszenz-Angiographie zeigte eine „smoke stack“ Erscheinung mit seröser NetzhautAnhebung, welche die Diagnose ICSC bestätigte (Abbildung 6.2.1 und 6.2.2). Optical Coherence Tomography Ein horizontaler Linien-Scan durch die Mitte der Fovea zeigte einen hyperreflektierenden Bereich unter der Fovea, welcher eine seröse Flüssigkeitsansammlung andeutet mit einem kleinem „RPED“ darin (Abbildung 6.2.3 A bis D). (Abbildung 6.2.3 A bis D) Die bestkorrigierte Sehschärfe des linken Auges des Patienten betrug 1,0. Die FluoreszenzAngiographie zeigte hyperfluoreszente Punkte, ein Hinweis auf Pigmentepithel-Ablösungen (Abbildung 6.2.4 und 6.2.5). Optical Coherence Tomography Ein horizontaler Linien-Scan in verschiedenen Ebenen zeigte kuppelförmige hyporeflektierende Zwischenräume in der Fovea, in Übereinstimmung mit den Pigmentepithelabhebungen (Abbildung 6.2.6 A bis G). (Abbildung 6.2.6 A bis G) Fall 6.3: ICSC mit seröser Retinaablösung und Pigmentepithelabhebung Krankheitsfall Ein 36 jähriger Mann mit einem einmonatigen verminderten Sehvermögen auf dem linken Auge. Die bestkorrigierte Sehschärfe dieses Auges betrug 0,2. Optical Coherence Tomography Ein horizontaler Linien-Scan durch die Fovea zeigte einen hyperreflektierenden Bereich übereinstimmend mit seröser Netzhaut-Ablösung (Abbildung 6.3.1 A und B). (Abbildung 6.3.1 A und B) Ein horizontaler Linien-Scan, seitlich der Fovea, zeigte eine seröse Netzhautablösung und Pigmentepithelabhebung an (Abbildung 6.3.1 C bis F). (Abbildung 6.3.1 C) (Abbildung 6.3.1 D bis F) Fall 6.4: ICSC mit seröser Netzhaut-Ablösung und multipler Epithelabhebung Krankheitsfall Es wurde ein 39 Jahre alter Mann mit einer einmonatigen Beschwerde von vermindertem Sehvermögen auf dem rechten Auge dargestellt. Seine bestkorrigierte Sehschärfe dieses Auges betrug 0,1. Die Fluoreszenz-Angiographie zeigte eine „Tintenfleck“-(ink blot)Erscheinung mit seröser Netzhautablösung, was die Diagnose von ICSC bestätigt (Abbildung 6.4.1 und 6.4.2) Optical Coherence Tomography Ein horizontaler Linien-Scan in verschiedenen Ebenen zeigte eine seröse Netzhautablösung mit mehrfacher Pigmentepithelabhebung (Abbildung 6.4.3 A bis I). (Abbildung 6.4.3 E bis I) Fall 6.5: Multifokale ICSC Krankheitsfall Es wurde ein 48 Jahre alter Mann mit einer Vorgeschichte von zweiwöchigem vermindertem Sehvermögen auf dem linken Auge untersucht. Seine bestkorrigierte Sehschärfe dieses Auges betrug 0,5. Die Fluoreszenzangiographie zeigte eine multifokale zentrale seröse Chorioretinopathie mit seröser Netzhautanhebung (Abbildung 6.5.1 und 6.5.2). Optical Coherence Tomography Ein horizontaler Linien-Scan durch die Fovea zeigte eine Absonderung innerhalb der serösen Netzhautabhebung. Ein erheblicher Grad an Hyper-Reflektion ist in dem FovealBereich sichtbar, in der Nähe der erhöhten Photorezeptoren. Eine kleine Vorwölbung von der RPE ist nasal zu der Flovea sichtbar (Abbildung 6.5.3 A bis D). (Abbildung 6.5.3 A) (Abbildung 6.5.3 B bis D) Kapitel 7 Aderhautkolobom (Choroidal Coloboma) Aderhautkolobom (Choroidal Coloboma) ist ein erblich bedingter Defekt, verursacht durch defekte Schließung der embryonalen Fissur. Die Schließung der Fissur findet normalerweise in der 6. Schwangerschaftswoche statt. Es wurden sowohl genetische als auch umweltbedingte Faktoren als Ursache für die intrauterine Herabsetzung genannt, welcher zum Schließungsdefekt der embryonalen Fissur und somit zu Coloboma des Fundus führen kann. Das Spektrum dieser Anomalie kann variieren, von schwachen Coloboma die sich im äquatorialen Bereich befinden und das Sehvermögen nicht störend beeinflusses, bis hin zu starken Colobomas in der Papille und Macula mit starker Sehbeeinträchtigung. Eine Netzhautablösung tritt in 40 % der Fälle mit Aderhautkolobom (Choroidal Coloboma) auf. Histologisch gesehen ist der colobomatische Bereich unvollständig in der normalen Aderhaut (choroid), dem retinalen Pigmentepithelium und der Netzhaut. Die neurosensorische Netzhaut besteht weiterhin als eingefügte Membran (ICM) in dem Coloboma Bereich. Rolle der optischen Kohärenz-Tomographie Der Seitenrand der Choroidal Coloboma enthält wichtige Informationen, denn es ist eine Übergangszone zwischen dem normalen- und abnormalen Teil des Fundus und der Ort der Zellkommunikation zwischen dem vorgelagerten Membranenraum und dem subretinalen Raum. OCT ist hilfreich, um die Seitenränder der Choroidal Coloboma auszuwerten. Es hilft bei der Erkennung von subklinischer Netzhautablösung entlang der Seitenränder und der Identifikation der Position der Zellkommunikation zwischen Sub-ICM-Räumen und den subretinalen Räumen. Diese könnten wichtig sein, um die Behandlung der Augen zu planen. Fall 7.1: Aderhautkolobom (Choroidal Coloboma) Krankheitsfall Ein 23 Jahre alter Mann kam zur Routineuntersuchung. Seine bestkorrigierte Sehschärfe des rechten Auges betrug 0,1. Das vordere Segment zeigte ein Iris-Coloboma. Optical Coherence Tomography Der horizontale Linien-Scan, der durch den Seitenrand der Coloboma ging, zeigte eine normale Netzhaut mit einem Totaldefekt (Fehlen der Netzhaut, RPE und Choroid) in der Region der Coloboma (Abbildung 7.1.1 A bis C). (Abbildung 7.1.1 A bis C) Kapitel 8 Degenerative Myopie Fall 8.1: Myopie mit Choroidal Neovascular Membrane (CNVM) behandelt mit PDT und Intravitreal Ranibizumab Krankheitsfall Es wurde ein 30 Jahre alter Mann mit starker Kurzsichtigkeit (Myopie), mit vermindertem Sehvermögen und Metamorphopsie auf dem rechten Auge mit einmonatiger Dauer untersucht. Seine bestkorrigierte Sehschärfe betrug 0,25. Die Fluoreszenz-Angiographie zeigte Choroidale Atrophie (Peripapilläre Atrophie) mit einer klassischen sub-fovealen neovaskularen Membran und Bereiche der RPE Atrophie (Abbildung 8.1.1 und 8.1.2). Die Indocyanin Grün Angiographie zeigt die Ausdehnung der CNVM (Abbildung 8.1.3 und 8.1.4) Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine erhöhte Netzhautdicke (326 Mikrometer) mit einem Bereich von moderatem Hyper-Reflektionsgrad in den äußeren Netzhautschichten mit kleinen zystischen Räumen in den darüberliegenden Netzhautschichten, ein Hinweis auf überwiegend klassische CNVM (Abbildung 8.1.5 A bis D). Der Patient machte eine Photodynamische Therapie, gefolgt von intravitreal Ranibizumab an dem darauf folgenden Tag. Einen Monat später zeigte das OCT eine Abschwächung der Netzhautdicke (268 Mikrometer) mit einer fibrösen Gewebebildung (Abbildung 8.1.6 A bis D). Die Sehschärfe verbesserte sich auf 0,5. (Abbildung 8.1.5 A) (Abbildung 8.1.5 A bis D) (Abbildung 8.1.6 B bis D) Optical Coherence Tomography Nach zweimonatiger Verlaufskontrolle zeigte das OCT eine weitere Abschwächung der Netzhautdicke (253 Mikrometer) (Abbildung 8.1.7 A bis D). Die Sehkraft verbesserte sich auf 0,7. (Abbildung 8.1.7 A) (Abbildung 8.1.7 B bis D) Fazit OCT ermöglicht, die Entwicklung der neovascular Membran im Anschluss an eine Photodynamische Behandlung (PDT) anzuzeigen und vor allem hilft es bei der Entscheidung, ob eine PDT wiederholt werden soll. Kapitel 9 Diabetisches Maculaödem (DME) Das Diabetische Maculaödem (DME) ist die häufigste Ursache für einen moderaten Verlust der Sehkraft bei Patienten mit Diabetischer Retinopathie. Wird die Krankheit nicht behandelt, so besteht das Risiko, dass 25 - 30% der Patienten mit starkem klinischen Maculaödem innerhalb von drei Jahren eine Verdoppelung des Sehwinkels aufweisen. Wird die Krankheit behandelt, so verringert dies das Risiko um 50 %. Es kann in jedem Stadium der Krankheit auftreten. Dennoch, je fortgeschrittener die Retinopathie ist, desto häufiger tritt die Krankheit auf. Die Fluoreszenz-Angiographie ist hilfreich, um fokale Gefäßundichtigkeiten zu unterscheiden und zu lokalisieren. Bereiche von diffusen Optical Coherence Tomography Die drei Hautaufgaben des OCT in dem DME sind: 1) Das Krankheitsbild des DME zu bestimmen, 2) anatomische Veränderungen in Folge der Behandlung anzuzeigen, sowie 3) Anzeichen für eine Vitrektomie zu bestimmen. Das OCT ermöglicht einen moderaten Zusammenhang zwischen der Netzhautdicke und der besten Visus zu erstellen. Es wurden fünf Krankheitsbilder des „Diabetischen Makulaödems“ (DME) mit Hilfe des OCT beschrieben. Diese fünf sind: 1. Schwammähnliche Retinaverdickung 2. Zystoides Makulaödem 3. Seröse Netzhautablösung 4. Foveale Traktion 5. Grenzmembranablösung (TPHM – taut posterior hyaloid membrane) Fall 9.1: CSME mit schwammähnlicher Verdickung Krankheitsfall Es wurde eine 67 Jahre alte Frau mit nicht-proliferativer Diabetischen Retinopathie und einem starkem Maculaödem auf dem rechten Auge untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,7. Die Fluoreszenz-Angiographie deckte eine späte „Leckage“ auf, welche einem Maculaödem entsprach (Abbildung 9.1.1 und 9.1.2). Optical Coherence Tomography Der horizontale Linien-Scan deckte eine seitliche Makula–Verdickung der Fovea mit einer reduzierten optischen Rückstreuung auf Grund der Ansammlung von Flüssigkeit in den äußeren Netzhautschichten auf. Die hyperreflektierenden Bereiche sind ein Hinweis auf massive Ausschwitzungen (Abbildung 9.1.3 A bis D). (Abbildung 9.1.3 A) (Abbildung 9.1.3 B bis D) Case 9.2: CSME mit zystoidem Maculaödem Krankheitsfall Es wurde eine 59 Jahre alte Frau mit einer 25 jährigen Vorgeschichte von NIDDM (nicht insulinabhängiger Diabetes mellitus) untersucht, die bereits eine fokale Laserbehandlung hatte. Ihre bestkorrigierte Sehschärfe im rechten Auge betrug 0,3. Die FluoreszenzAngiographie zeigte Narben einer Photokoagulation mit später „Leckage“ (Abbildung 9.2.1 und 9.2.2). Optical Coherence Tomography Ein horizontaler Linien-Scan durch die Fovea zeigte eine Makulare-Verdickung mit zwei beinahe vollständig zystoiden Anhebungen unterhalb der Fovea mit einer Scheidewand zwischen ihnen. Die Zysten in der angrenzenden Netzhaut waren kleiner und befanden sich hauptsächlich in den äußeren Netzhautschichten. Die hintere Hyaloid-Abtrennung war nasal von der Fovea sichtbar (Abbildung 9.2.3 A bis D). (Abbildung 9.2.3 A) (Abbildung 9.2.3 B bis D) Fall 9.3: CSNE mit seröser Netzhautablösung Krankheitsfall Eine 59 Jahre alte Diabetikerin mit einer nicht ausgeprägten diabetischen Retinopathie und einem zystenartigen Maculaödem wurde untersucht. Sie hatte bereits 3 Fokal-LaserPhotokoagulation Behandlungen. Ihre bestkorrigierte Sehschärfe des linken Auges betrug 0,1. Die Fluoreszenz-Angiographie deckte Photokoagulations-Narben mit zystoiden Stellen im späten Stadium auf (Abbildung 9.3.1 und 9.3.2). Optical Coherence Tomography Ein horizontaler Linien- Scan bestätigte die zystoiden Räume unterhalb der Fovea mit einer Scheidewand zwischen ihnen. Zusätzlich bestand ein hyporeflektierender Bereich in der subfovealen Region, der mit einer serösen Netzhautablösung übereinstimmte. Eine hintere Hyaloid-Abtrennung war in der perifovealen Region (Die äußerste Zone der Macula) sichtbar (Abbildung 9.3.3 A bis D). (Abbildung 9.3.3 A) (Abbildung 9.3.3 B bis D) Fall 9.4: CSME mit klinisch unauffälliger Grenzmembranablösung (TPHM) Krankheitsfall Eine 67 Jahre alte Frau mit 10-jähriger Typ-2 Diabetes wurde auf Grund von proliferativer Diabetes Retinopathie untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,1 auf dem linken Auge. Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine verstärkte Dicke der Netzhaut in der Mitte der makula mit Grenzmembranablösung (TPHM). Die hyperreflektierenden Bereiche in den Netzhautschichten sind auf Grund von massiven Ausschwitzungen (Abbildung 9.4.1 A bis D) sichtbar. (Abbildung 9.4.1 A bis B) (Abbildung 9.4.1 C bis D) Fall 9.5: CSME mit Foveo-vitrealer Traktion Krankheitsfall Eine 63 Jahre alte Frau, die seit 27 Jahren Diabetes hatte, wurde auf Grund von proliferativer (mit Gewebswucherung einhergehend) Diabetes Retinopathie untersucht. Ihre bestkorrigierte Sehschärfe auf dem rechten Auge betrug 0,05. Sie hatte bereits eine vollständige Netzhaut-Photokoagulation erhalten. Die Fluoreszenz-Angiographie deckte eine persistierende (fortbestehende) Neovaskularisation mit Maskulaödem auf. Eine foveovitrealeTraktion war klinisch nicht sichtbar (Abbildung 9.5.1 und 9.5.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine erhöhte Netzhautdicke mit vitreoschisis an, d.h. eine Trennung der posterior vitreous Phase in zwei Lamellen. Dies verursachte eine fokale Traktion der Fovea mit resultierendem zystoidem Makulaödem (Abbildung 9.5.3 A bis D). Eine Laser-Photokoagulation würde die Situation in diesem Fall verschlechtern. Andererseits wäre dies ein idealer Fall für eine pars plana Vitrektomie. Dieser Fall zeigt die Wichtigkeit des OCT in Zusammenhang mit widerspenstigen (recalcitranten) diabetischen Maculaödemen, denn ohne OCT wäre eine angemessene Behandlung nicht möglich. (Abbildung 9.5.3 A) (Abbildung 9.5.3 B bis D) Fall 9.6: Intravitreale Triamcinolone Acetonide in Diabetischem Makulaödem Krankheitsfall Ein 56 Jahre alter Mann mit insulinunabhängiger Diabetes Mellitus seit 12 Jahren wurde auf Grund eines hartnäckigen CSME auf dem linken Auge untersucht, das nicht auf LaserPhotokoagulation ansprach. Seine bestkorrigierte Sehschärfe betrug 0,2 auf diesem Auge. Die Fluoreszenz-Angiographie deckte ein zystoides Maculaödem auf (Abbildung 9.6.1 und 9.6.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Verlust der Foveal-Kontur mit einer gemessenen Netzhautdicke von 572 Mikrometer in der Mitte der Fovea und mehreren hyperreflektierenden Bereichen mit intervenierenden hyperreflektierenden Scheidewänden an, übereinstimmend mit „zystoidem Makulaödem“. Ein anderer hyperreflektierender Bereich unterhalb der Fovea deutete auf eine seröse Netzhautablösung hin (Abbildung 9.6.3 A bis D). Der Patient bekam intravitreal Triamcinolon-acetonid (4mg). Der wiederholte Scan nach einem Monat zeigte eine Abschwächung der fovealen Dicke auf 168 Mikrometer und das Sehvermögen verbesserte sich auf 0,4. OCT wies eine Wiederherstellung der fovealen Depression und das Verschwinden der Netzhaut-Zyste und der serösen Netzhautablösung nach (Abbildung 9.6.4 A bis D). (Abbildung 9.6.3 A) (Abbildung 9.6.3 B bis D) (Abbildung 9.6.4 A) (Abbildung 9.6.4 B bis D) Kapitel 10 Epiretinale Membranen Epiretinale Membranen (ERMs) sind gefäßlose, fibrocellulare Membranen, die auf der Oberfläche der Netzhaut wuchern. Diese Membranen haben kontraktile Eigenschaften und Patienten können Metamorphosismus und Veränderungen der Sehkraft auf Grund der Effekte auf die untere Netzhaut aufzeigen. ERMs können mit einer Vielzahl von okularen Zuständen assoziiert werden, wie z.B. hintere Glaskörperabhebung (PVD), Netzhautrisse („retinal tears“), Netzhautablösungen, retinale Gefäßverschluss-Erkrankungen, Okular entzündliche Erkrankung und Glaskörperblutung. Dennoch, eine große Anzahl tritt nicht in Zusammenhang mit den assoziierten Krankheiten oder bekannten Vorgeschichten auf und wird somit als „idiopathische epiretinale Membran“ klassifiziert. Gass hat ein Klassifikationssystem formuliert, basierend auf dem Erscheinen der Membran und den darunter befindlichen Netzhautgeweben und – gefäßen. Grad 0 - Membranen sind lichtdurchlässige Membranen, die nicht mit einer Netzhaut Distorsion assoziiert werden. Diese ERMs werden auf Grund des zellophanen Glanzes der inneren Netzhautoberfläche, der durch das Ophthalmoskop sichtbar ist, auch als Zellophane Makulopathie bezeichnet. Grad 1 - Membranen verursachen eine irreguläre Faltenbildung der inneren Netzhautoberfläche. Feine, oberflächliche, sternförmige Falten erstrecken sich außerhalb der Ränder der geschrumpften Membran. Die Faltenbildung kann ausreichend sein, um eine vermehrte Schlängelung der paramakularen Gefäße in Richtung der Fovea zu erreichen. „Zystoides Makulaödem“, Netzhautblutung, Exsudate (Ausschwitzungen) und RPEStörungen sind typischerweise nicht vorhanden. Grade 2 - Membranen haben eine lichtdichte dicke Erscheinung. Grobe, völlige dicke Fältelung der Makula (fleckenförmiges Gebilde) kann vorhanden sein, zusammen mit einem Netzhautödem, kleinere Blutungen, „Watte-Flecken“ und selten eine zu lokal begrenzte Netzhautablösung. Diese Membranen werden auch „Makula Packer“ genannt (epiretinale Gliose). Optical coherence tomography kann die Anwesenheit oder Abwesenheit von ERM aufklären. Es kann objektiv andere Effekte der ERM auf die Netzhaut messen, wie z.B. eine makulare Verdickung, „zystoides Makulaödem“ und jegliche assoziierte Glaskörpertraktionen auf der Netzhaut. Es ermöglicht sowohl die Überwachung der postoperativen Wiederherstellung von Netzhautstrukturen, als auch die Anwesenheit einer anhaltenden Traktion oder Faltung der Netzhaut anzuzeigen. Basierend auf dem OCT, gibt es zwei epiretinale Membran-Typen: 1. Fokal festhaftende Membran 2. Global festhaftende Membran Fall 10.1: Grade 1 ERM: Gekräuselte zellophane Makulopathie Krankheitsfall Es wurde ein 72- Jahre alter Mann mit Beschwerden über eine eingeschränkte Nahsicht von einem Jahr Dauer untersucht. Seine bestkorrigierte Sehschärfe auf dem rechten Auge betrug 0,3. Die Fluoreszenz-Angiographie zeigte deformierte paramakulare Gefäße an, die in Richtung der Fovea gezogen erschienen (Abbildung 10.1.1 und 10.1.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte die Anwesenheit eines hyperreflektierenden Bandes am vitreoretinalen Übergang mit einer Traktion der darunterliegenden Netzhaut, welches als Hinweis auf ERM mit „focaler Festhaftung“ angesehen wurde (Abbildung 10.1.3 A bis D). OCT half durch Informationen bezüglich des Status der darunterliegenden NetzhautTraktion des Patienten, eine Operation zu diesem Zeitpunkt zu rechtfertigen. (Abbildung 10.1.3 A bis C) (Abbildung 10.1.3 D) Fall 10.2: Grade 2 ERM: epiretinale Gliose (Macular Pucker) Krankheitsfall Es wurde ein 60 Jahre alter Mann mit einjähriger, beidseitig verminderter Sehkraft untersucht. Seine bestkorrigierte Sehschärfe auf dem linken Auge betrug 0,1. Die Fluoreszenz-Angiographie zeigte deformierte und gewundene paramakulare Gefäße, welche in Richtung der Fovea weggezogen erschienen, mit „Leckage“ aus den Netzhautgefäßen (Abbildung 10.2.1 und 10.2.2). (Abbildung 10.2.1) (Abbildung 10.2.2) Optical Coherence Tomography Der horizontale Linien-Scan zeigte die Anwesenheit eines hyperreflektierenden Bandes am vitreoretinalen Übergang an, verbunden mit einer Traktion der darunterliegenden Netzhaut, welche als faltig angesehen wurde. In einigen Bereichen war die Membran deutlich von der Netzhaut getrennt (Abbildung 10.2.3 A bis D). Außerdem gab es verminderte Rückstreuungen von den äußeren Netzhautschichten, welche darunterliegende Netzhautödeme andeuteten und mit dem auf der Fluoreszenz-Angiographie sichtbaren „Leckage“ korrespondierten. OCT war hilfreich bei der Diagnose der darunterliegenden Netzhautödeme, was die Prognose einer folgenden Operation stellen könnte. (Abbildung 10.2.3 A bis C) (Abbildung 10.2.3 D) Optical Coherence Tomography Der horizontale Linien-Scan kurz oberhalb der Fovea zeigte kleine zystische Räume in den inneren Netzhautschichten und eine ERM-verursachende Netzhauttraktion (Abbildung 10.2.3 E bis G). Somit ist der 3D-OCT Scan, durch die Fahigkeit einen kontinuierlichen Raster-Scan durchzuführen, in der Lage, den ganzen Umfang der ERM darzustellen. (Abbildung 10.2.3 E) (Abbildung 10.2.3 F bis G) Fall 10.3: ERM bei Eales-Syndrom Krankheitsfall Es wurde ein 31 Jahre alter Mann nach einer Laser Photokoagulation wegen des EalesSyndrom auf dem rechten Auge untersucht. Seine bestkorrigierte Sehschärfe betrug 0,5 auf diesem Auge. Die Fluoreszenz-Angiographie zeigte eine Deformierung der paramakular Gefäße, welche in Richtung der Fovea, mit „Leckage“, gezogen erschien. (Abbildung 10.3.1 und 10.3.2). Optical Coherence Tomography Der horizontale Linien-Scan kurz oberhalb der Fovea zeigte Riffeln auf der inneren Oberfläche der Netzhaut, hinweisend auf „global anheftende ERM“ (Abbildung 10.3.3 A bis C). Kapitel 11 Foveale Blutung Fall 11.1: foveale Blutung (Foveal Hemorrhage) Krankheitsfall Es wurde eine 68 Jahre alte Frau mit leichter non-proliferativer (ohne Gewebswucherung) Diabetes Retinopathie, mit plötzlichem Verlust der Sehkraft seit 2 Tagen auf dem rechten Auge, untersucht. Ihre bestkorrigierte Sehschärfe auf diesem Auge ermöglichte es ihr gerade noch Finger zu zählen. Der Fundus zeigte einen dunkelroten Punkt auf der Fovea. Die Fluoreszenz-Angiographie offenbarte eine blockierte Fluoreszenz der Fovea, die die Präsenz einer Blutung bestätigte (Abbildung 11.1.1 und 11.1.2). Optical Coherence Tomography Der horizontale Linien-Scan oberhalb der Fovea zeigte die Anwesenheit eines hyperreflektierenden Bandes der vitreoretinalen Schnittstelle mit einer Traktion der darunterliegenden Netzhaut, welche als faltig angesehen wurde (Abbildung 11.1.3 A bis C). (Abbildung 11.1.3 A bis C) Optical Coherence Tomography Der horizontale Linien-Scan durch die Mitte der Fovea zeigte die Präsenz eines fokalen Bereiches von verstärkten Rückstreuungen, die mit dem Bereich, in welchem Blut klinisch sichtbar war, korrespondierte. Der erzeugte Schatten verdeckt alle unteren Netzhautschichten (Abbildung 11.1.4 A bis D). OCT half, das Vorhandensein von EpiretinalMembranen anzuzeigen, welche vermutlich eine Traktion der Netzhaut verursachten, die wiederum eine oberflächliche, foveale Blutung verursachte. (Abbildung 11.1.4 A bis C) (Abbildung 11.1.4 D) Fazit Bei Patienten mit fovealen Blutungen hilft OCT die präzise Lage und Tiefe der Blutung zu Skizzieren und kann bei der Ursachenfindung hilfreich sein. Kapitel 12 Heredodegeneration der Makula Stargardt Sysndrom Das Stargardt Syndrom ist die am häufigsten verbreitete erbliche Makula-Dystrophie und macht ungefähr 7% aller Netzhaut-Dystrophien aus. Sie vererbt sich normalerweise als autosomales, rezessives Merkmal. Dennoch kann sie auch als autosomales, dominantes Erbe auftreten. Das Kennzeichen dieses Krankheitsbildes sind fischförmige Flecken, welche sich hauptsächlich auf den hinteren Pol und die Makula beschränken und bereits in jungen Jahren existieren. Geographisch gesehen, verschmelzen, bzw. verwachsen die Flecken der atrophischen RPE oft und geben der Makula eine „beaten bronze“ Erscheinung. Fluoreszenz-Angiografie Das charakteristischste was auf Fluoreszenzangiografien zu sehen ist, ist das Phänomen bekannt als „dunkles“ oder „stilles“ Choroid, welches als eine ansehnliche Retinadurchblutung gegenüber einem hypofluorezenten Choroid erscheint. Fall 12.1: Stargardt Syndrom Krankheitsfall Es wurde ein 13 jähriger Junge mit vermindertem Sehvermögen auf beiden Augen untersucht. Seine bestkorrigierte Sehschärfe auf dem linken Auge betrug 0,2. Die Fluoreszenz-Angiographie zeigte ein „dark“ (dunkles) Choroid mit einem zentralen atrophischen Bereich der Hyperfluoreszenz anzeigte (Abbildung 12.1.1 und 12.1.2). Das Elektroretinogram war normal. Optical Coherence Tomography Der horizontale Linien-Scan des linken Auges zeigte eine foveale Atrophie (Abbildung 12.1.3 A bis E). (Abbildung 12.1.3 A) (Abbildung 12.1.3 B bis D) Zentrale areoläre Aderhautdystrophie Central Areolar Choroidal Dystrophy ist eine seltene autosomale (genetisch) dominante Makula-Degeneration, welche dem Chromosom 17p zugeordnet wird. Es scheint eine primäre Dystrophie, entweder der Aderhaut-Gefäße oder des retinalen Pigmentepithels, mit einer untergeordneten Mitwirkung der Aderhaut zu sein. Eine Fluoreszenz-Angiographie im frühen Stadium der Krankheit zeigt hintergründliche „Hyperfluoreszenz“ der retinalen Pigmentepithel Atrophie. Wenn die choroidocapillaris verloren ist, schwindet das „Hyperfluoreszenz“ und die Blutgefäße der Aderhaut werden deutlich sichtbar. Die Ränder der Verletzung zeigen „Hyperfluoreszenz“ auf Grund der Undichtigkeit am Rand der choroidocapillaris. Optical Coherence tomography zeigt eine Verdünnung der Netzhaut mit vermehrter Rückstreuung der Aderhaut. Fall 12.2: Zentrale areoläre Aderhautdystrophie Krankheitsfall Eine 76 Jahre alte Frau mit non-proliferativer Diabetes Retinopathie auf beiden Augen wurde auf Grund von Schwierigkeiten beim Lesen in den letzten 6 Monaten untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,25; N24 auf dem rechten Auge und 0,1; N24 auf dem linken Auge. Eine Fluoreszenz-Angiographie des rechten Auges zeigte auffällige ChoroidalGefäße in einem frühen Stadium mit Hyperfluoreszenz an der Grenze der Läsion im späterem Verlauf (Abbildung 12.2.1 und 12.2.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine erhöhte Rückstreuung unterhalb der foveal, neurosensorischen Netzhaut mit einem Verlust der normalen Netzhaut-Architektur. Der darunter liegende RPE-Choroid Komplex zeigte einen erhöhten Hyper-Reflektionsgrad, wahrscheinlich auf Grund der überlagernden Netzhaut-Verdünnung an (Abbildung 12.2.3 A bis D). (Abbildung 12.2.3 A) (Abbildung 12.2.3 B bis D) Eine Fluoreszenz-Angiographie des linken Auges zeigte ebenfalls größere ChoroidalGefäße innerhalb des Bereichs der RPE Atrophie mit hyperfluoreszenz an der Grenze der Läsion im späterem Verlauf (Abbildung 12.2.4 und 12.2.5). Optical Coherence Tomography Der horizontale Linien-Scan des linken Auges zeigte eine Netzhaut–Verdünnung mit erhöhter Rückstreuung und einem erhöhten Reflektionsgrad des darunter liegenden RPEChoroid Komplexes (Abbildung 12.2.6 A bis D) (Abbildung 12.2.6 A) (Abbildung 12.2.6 B bis D) Progressive Zapfendystrophie „Progressive cone dystrophy“ wird entweder als autosomal dominantes Chromosom oder Xgekoppelte Chromosomenstörung vererbt. Allerdings können auch sporadische Fälle auftreten. Die Krankheit tritt gewöhnlich zwischen dem ersten und dritten Jahrzehnt des Lebens, verbunden mit Photoaversion, progressivem Verlust der Sehschärfe, Tagblindheit und gestörter Farbwahrnehmung auf. Fall 12.3: progressive Zapfendystrophie (Progressive Cone Dystrophy) Krankheitsfall Es wurde ein 29 Jahre alter Mann mit vermindertem Sehvermögen seit einem Jahr auf beiden Augen untersucht. Seine bestkorrigierte Sehschärfe auf dem rechten Auge betrug 0,3 und auf dem linken 0,5. Er war auf beiden Augen absolut farbenblind. Das Elektroretinogram zeigte eine verminderte Zapfenresonanz. Die Fluoreszenz-Angiographie zeigte das „bull’s eye pattern“ (Zielscheibenmuster) der RPE-Atrophie mit einem ringförmigen Bereich aus fleckige Hyperfluoreszenz (Abbildung 12.3.1 und 12.3.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine Netzhaut-Verdünnung. Der darunter liegende RPEChoroid-Komplex zeigte einen erhöhten Hyper-Reflektionsgrad, wahrscheinlich auf Grund der überlagernden Netzhaut-Verdünnung an (Abbildung 12.3.3 A bis D). (Abbildung 12.3.3 A bis C) (Abbildung 12.3.3 D) Die bestkorrigierte Sehschärfe des linken Auges betrug 0,5. Die Fluoreszenz-Angiographie zeigte ein Zielscheibenmuster der RPE-Atrophie mit ringförmigen Bereichen aus getupfter Hyperfluoreszenz (Abbildung 12.3.4 und 12.3.5). (Abbildung 12.3.4) (Abbildung 12.3.5) Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine Verdünnung der Netzhaut mit Unregelmäßigkeiten der Netzhaut-Pigment-Schicht. Der darunter liegende RPE-Choroid-Komplex zeigte einen erhöhten Hyper-Reflektionsgrad. Wahrscheinlich auf Grund der überlagernden Verdünnung der Netzhaut (Abbildung 12.3.6A bis D). (Abbildung 12.3.6 A bis C) (Abbildung 12.3.6 D) Kapitel 13 Entzündliche Krankheiten von Retina und Choroid Akute posteriore multifokale plakoide Pigmentepitheliopathie (APMPPE) APMPPE ist eine erworbene, entzündliche Störung, welche die Netzhaut, das NetzhautPigment Epithelium und Choroid von ansonsten gesunden jungen Erwachsenen angreift. Das Krankheitsbild ist selbst-limitierend und ist gekennzeichnet durch multiple gelblich-weiße Placoid-Subretinale Läsionen am hinteren Pol. Die Wunden sind häufig bilateral und in verschiedenen Entwicklungsstadien, typischerweise über Wochen und Monate zurückgehend und hinterlassen eingegrenzte Bereiche von Netzhaut-Pigment-EpithelStörungen. Fluorescein angiography: Die Läsionen im frühen Stadium zeigen eine charakteristische frühzeitige Hypofluoreszenz, gefolgt von Hyperfluoreszenz im fortgeschrittenem Stadium. Das fortgeschrittene Stadium kann RPE-Fensterdefekte aufweisen. Die Indocyanin grün Angiographie (ICG) zeigte zahlreiche runde hypofluoreszente, choroidale Defekte, in denen die größeren Choroidal-Gefäße sichtbar sind. Optical coherence tomography: In der akuten Phase, offenbart das OCT einen leicht hyperreflektierenden Bereich oberflächlich zu dem RPE und in der späteren Phase eine mit Knötchen versehenen hyperreflektierende Läsion auf der RPE-Ebene. Selten wird eine seröse Netzhaut-Trennung gefunden. Fall 13.1: Acute Posterior Multifocal Placoid Pigment Epitheliopathy Krankheitsfall Es wurde ein 22 Jahre alter Mann mit zweitägigem vermindertem Sehvermögen auf dem rechten Auge untersucht. Seine bestkorrigierte Sehschärfe auf diesem Auge betrug 0,3. Die Fluoreszenz-Angiographie zeigte eine frühe Hypofluoreszenz mit späterer Hyperfluoreszenz der Läsionen (Abbildung 13.1.1 und 13.1.2) Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Schaden der fovealen Kontur, zentrale MakulaVerdickung und einen hyporeflektierenden Raum in der subfovealen Region, welche eine seröse Netzhaut-Trennung bestätigte (Abbildung 13.1.3 A bis E). Der Patient wurde mit oralen Steroiden behandelt und bei der 45 Tage späteren Nachuntersuchung zeigte das OCT die Auflösung der serösen Trennung und eine Wiederherstellung der normalen Fovealkontur. Die bestkorrigierte Sehschärfe betrug 1,0 (Abbildung 13.1.4 A bis E). (Abbildung 13.1.3 A bis B) (Abbildung 13.1.3 C bis E) (Abbildung 13.1.4 A bis B) (Abbildung 13.1.4 C bis E) Angeborene Toxoplasmose Toxoplasmose wird dem Fetus im Uterus übertragen. Der Netzhautbefall ist Teil einer generalisierten Infektion und zeigt charakteristischerweise eine große, atrophische, exkavierte Narbe in der Makula oder anderenorts. Die meisten Fälle sind subklinisch. Fall 13.2: Angeborene Toxoplasmose Krankheitsfall Bei einem 13 Jahre alten Jungen wurden bei einer Routineuntersuchung, bilaterale geheilte chorioretinale Narben entdeckt. Die Narbe zeigte drei Zonen: 1. Äußere weiße Zone 2. Zwischenzone mit Pigment-Hyperplasia 3. Zentrale Zone der Atrophie Optical Coherence Tomography Der horizontale Linien-Scan, der durch die obere Begrenzung der Narbe durchgeführt wurde, zeigte einen erhöhten Hyperreflektionsgrad des unteren Netzhaut-Pigment-Epitheliums und Choroids mit intakter oberer neurosensorischer Netzhaut (Abbildung 13.2.1 A bis C). (Abbildung 13.2.1 A bis B) (Abbildung 13.2.1 C) Optical Coherence tomography Der horizontale Linien-Scan durch den Übergangsbereich zeigte eine Atrophie der neurosensorischen Netzhaut (Abbildung 13.2.2 A bis C). (Abbildung 13.2.2 A bis B) (Abbildung 13.2.2 C) Optical Coherence Tomography Der horizontale Linien-Scan durch die zentrale Zone zeigte ein vollständiges Fehlen der neurosensorischen Netzhaut über dem Zentralen Bereich (Abbildung 13.2.3 A bis C). (Abbildung 13.2.3 A bis B) (Abbildung 13.2.3 C) Kapitel 14 Juxtafoveale Telangiektasie Idiopathic juxtafoveolar retinal telangiectasis (IJT) wurde 1982 zum ersten mal von Gass und Oyakawa als eine unilaterale oder bilaterale Krankheit im Zusammenhang mit unfunktionellen Netzhaut Kapillaren in nur dem perifovealen- oder juxtafovealen Bereich definiert. Die anfängliche Klassifizierung, Stadien-Einteilung, und Pathogenese von IJT basierte zum großee Teil auf klinischen Auswertungen und Fluoreszenz-Angiographie. Gass1, 2 definierte folgende Klassifizierung: Gruppe 1A: Unilaterale angeborene parafoveale Telangiektasie mit telangiektasischen Kapillaren temporal zu der Fovea. Gruppe 1B: Unilaterale, ideopathische, fokale juxtafoveale Telangiektasie mit einem kleinem fokalen Bereich von inkompetenten Kapillaren neben der fovealen, gefäßlosen Zone. Gruppe 2A: Bilaterale, ideopathisch erworbene parafoveale Telangiektasie mit NetzhautVerdickung temporal zu der Fovea, rechtwinkligen kleinen Venen, hyperplastischer Belag des Netzhaut-pigment-Epithel, subretinale Neovaskularisation und kristallinen Einlagen. Diese Gruppe hat 5 Stadien: Stadium 1: Keine biomikroskopische Anomalie. Fluoreszenz-Angiographie zeigt eine minimale oder nicht-kapillare Dilatation (Erweiterung) in der frühen Phase und leichte Färbungen in der späten Phase. Stadium 2: Leichte Netzhaut-Ergrauung mit minimaler oder nicht vorhandenen telangiektasischen Gefäßen. Fluoreszenz-Angiographie zeigt eine leichte kapillare Telangiektasie. Stadium 3: Klinisch gesehen zeigt es parafoveale geweitete und abgestumpfte NetzhautVenen und lichtbrechende Einlagerungen. Fluoreszenz-Angiographie zeigt eine Kapillar-Dilatation mit Leckage in der äußeren Netzhaut. Stadium 4: sternförmige Herde von schwarzer RPE-Hypertrophie sind am hinteren Ende der Netzhaut-Venen sichtbar. Stadium 5: Subretinale Neovaskularisation tritt in dem parafovealen Bereich auf. Zystische Ödeme und gelbe Exsudate sind lediglich in der subretinalen Neovaskularisation sichtbar. Gruppe 2B: Jugendliche okkulte familiäre IJT. (Juvenile occult familial IJT) Gruppe 3A: Okklusive IJT mit Verlust der Sehkraft auf Grund von Auslöschung der perifovealen Kapillaren. Gruppe 3B: Okklusive IJT assoziierbar mit zentralem Nervensystem Vaskulopathie. In der klinischen Praxis ist die häufigste Form von juxtafovealer Telangiektasie eine unilaterale Form welche normalerweise a-symptomatisch ist und typischerweise bei Männern im Alter von 40 Jahren aufwärts (Gruppe 1B) auftritt und die bilaterale Form, welche sowohl bei Frauen als auch bei Männern auftritt, typischerweise zwischen dem 40sten und 60sten Lebensjahr (Gruppe 2A). Die am häufigsten auftretende unilaterale Form von IJT kann Makulaödeme aufweisen, welche die zentrale Sehschärfe beeinflusst. Die bilaterale Form hingegen weist parafoveale Blutungen, Netzhaut-Pigment-Epithelium (RPE) Hyperplasie, senkrechte Venen und gelegentlich Choroidal-Neovaskularisation auf, obwohl das Sehvermögen tendenziell relativ normal ist. Gruppe 1B und Gruppe 2A werden als „idiopathische juxtafoveale retinale Telangiektasie“ bezeichnet. Kürzlich wurde die Photodynamische Therapie, bei Patienten mit schwerer Erkrankung und Choroidal Neovaskularisation, in Betracht gezogen. Optical Coherence Tomography OCT Merkmale von IJT: 1. Fehlen einer Korrelation zwischen Netzhaut-Verdickung im OCT und „Leckage“ in der Fluoreszenz- Angiographie. 2. Verlust und Riss der Photorezeptorschicht. 3. Zystische Struktur in der Fovea und innerhalb der inneren Netzhautschichten wie z.B. die innere nuklearen- oder Ganglion-Zellschichten. 4. Eine einzigartige, intern limitierende Membran, umhüllend über die Fovea, ILM Abdeckung genannt, verbunden mit einem unteren Gewebeverlust. 5. Intraretinale Neovaskularisation in der Nähe der Fovea. 6. Zentrale Intraretinale Einlagen und Plaques. Fall 14.1: Gruppe 2A Idiopathische Juxtafoveale Retinale Telangiektasie Krankheitsfall Es wurde eine 48 Jahre alte Frau mit vermindertem Sehvermögen auf beiden Augen seit 3 Jahren untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,3 auf dem rechten Auge. Fluoreszenz-Angiographie zeigte telangiektasische Gefäße temporal zur Fovea mit Färbung in der späten Phase (Abbildung 14.1.1 und 14.1.2). Optical Coherence Tomography Der horizontale Linien-Scan durch die Fovea zeigte einen kleinen hypo-reflektierenden Bereich auf der Ebene des RPE–Photorezeptoren Komplexes, ein Hinweis auf einen lokalisierten Verlust dieser Schichten. Trotz der Verfärbung, die auf der Fluoreszenz- Angiographie sichtbar war, gab es keine erhöhte Verdickung im OCT, somit zeigte es keinerlei Zusammenhang zwischen der Netzhaut–Verdickung auf dem OCT und der „Leckage“ in der Fluoreszenz-Angiographie (Abbildung 14.1.3 A bis E). (Abbildung 14.1.3 A bis B) (Abbildung 14.1.3 C bis E) Case14.2: Gruppe 2A Idiopathische Juxtafoveale Retinal-Telangiektasie Krankheitsfall Es wurde ein 69 Jahre alter Mann mit einer Vorgeschichte von fokaler Photokoagulation bei einer Routineuntersuchung untersucht. Seine bestkorrigierte Sehschärfe betrug 0,25 auf dem rechten Auge. Fluoreszenz-Angiographie zeigte telangiektasische Gefäße temporal zu der Fovea mit Verfärbung in der späten Phase (Abbildung 14.2.1 und 14.2.2) Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen hypo-reflektierenden Bereich unterhalb der Fovea und auf der Ebene des RPE-Photorezeptor-Komplexes, ein Hinweis auf einen lokalisierten Verlust dieser Schichten. Außerdem gab es Belege für eine posterior Hyaloid-Separation, auf beiden Seiten der Fovea (Abbildung 14.2.3 A bis E). (Abbildung 14.2.3A) (Abbildung 14.2.3 B bis D) (Abbildung 14.2.3 E) Fall 14.3: Gruppe 2A Idiopathische Juxtafoveale Retinal-Telangiektasie mit Choroidaler Neovaskular-Membran Krankheitsfall Es wurde eine 47 Jahre alte Frau mit unscharfem, trübem Sehvermögen untersucht, was durch eine bilaterale, erworbene, juxtafoveale Telangiektasie verursacht wurde. Ihre bestkorrigierte Sehschärfe auf dem rechten Auge betrug 0,6. Fluoreszenz-Agiographie des rechten Auges zeigte eine gefleckte Hyperfluoreszenz, welche sich in der späten Phase erhöhte, ein Hinweis auf eine darunterliegende klassische Choroidale neovaskulare Membran (CNVM) (Abbildung 14.3.1 und 14.3.2) (Abbildung 14.3.1) (Abbildung 14.3.2) Eine „Indocyanin Grün Angiographie“ zeigte den Umfang der CNVM (Abbildung 14.3.3 und Abbildung 14.3.4). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Photorezeptor-Defekt und einen Bereich mit moderater Reflektivität oberhalb der RPE; temporal zu der Fovea mit zystischen Räumen in der darüberliegenden Netzhaut, das die Anwesenheit einer klassischen CNVM bestätigte (Abbildung 14.3.5 A bis D). Der Patient wurde mit Photodynamischer Therapie und intravitreal mit Ranibizumab behandelt. Follow- up Das nach einem Monat wiederholte OCT zeigte eine Regression des CNVM mit der Bildung von Narbengewebe (Abbildung 14.3.6 A bis D). Der Visus war gleichbleibend bei 0,6. (Abbildung 14.3.5 A bis D) (Abbildung 14.3.6 A bis D) Ihre bestkorrigierte Sehschärfe auf dem linken Auge betrug 1,0. Die FluoreszenzAngiographie auf dem linken Auge zeigte ein telangiektasisches Gefäß temporal zu der Fovea mit Verfärbung in der späten Phase. Dies bestätigt die Diagnose von Idiopathischer juxtafovealer Retinal-Telangiektasie (Abbildung 14.3.7 und 14.3.8). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Photorezeptor-Defekt mit fovealer Verdünnung (Abbildung 14.3.9 A bis E). (Abbildung 14.3.9 A) (Abbildung 14.3.9 B bis D) (Abbildung 14.3.9 E) Schlussfolgerung 1. OCT ermöglicht die Differenzierung ob die Poolbildung, die auf der FluoreszenzAngiographie sichtbar ist, auf Grund einer „Leckage“ oder einer Anhäufung von Färbung in den verletzten Netzhautzellen entstanden ist. 2. Es hilft die Ursachen eines Verlusts des Sehvermögens im Fall von IJT zu begründen. Kapitel 15 Makula-Drusen Drusen sind gerundete, gelbliche, degenerative Formationen die mit der „Bruchschen“ Membran assoziiert werden, welche vorwiegend an dem hinteren Pol präsent sind. Die Progression der Drusen findet entweder in Richtung atrophisch (trockener) Form oder in Richtung der absondernden (nasser) Form der Makula-Degeneration statt. Große (> 63 μm) gestaltlose, unklare weiche Drusen und konfluierende (verschmelzende) Drusen entwickeln sich am wahrscheinlichsten zu fortgeschrittener altersbedingter Makula-Degeneration, in Kontrast zu diskreten (mit wenig auffallender Symptomatik), gut abgegrenzten, harten Drusen. Fluoreszenz-Angiographie Harte Drusen zeigen frühe Hyperfluoreszenz, welches sich in der ateriovenösen Phase erhöht und in der späten Phase nachlässt. Softe Drusen hingegen zeigen bis zur späten Phase keine Hyperfluoreszenz. Optical Coherence Tomography Drusen treten als Wellenform oder lokal erhöhter Dicke des Netzhaut-Pigment-Epitheliums auf. Es wird durch die Abwesenheit von optisch klaren Räumen innerhalb der Wellenformen von Pigment-epithelialer Trennung unterschieden. Fall 15.1: Makula Drusen Krankheitsfall Ein 78 Jahre alter Mann kam zu einer Routineuntersuchung der Augen. Seine bestkorrigierte Sehschärfe betrug 1,0 auf dem linken Auge. Die Fluoreszenz-Angiographie zeigte frühe Hyperfluoreszenz, welche später nachließ und somit die Anwesenheit von Drusen bestätigte (Abbildung 15.1.1 und 15.1.2). Optical Coherence Tomography Der horizontale Linien-Scan oberhalb der Fovea durch den Bereich der Drusen zeigte irreguläre Erhebungen des RPE ohne Schatten vom unteren Choroid (Abbildung 15.1.3 A bis D). (Abbildung 15.1.3 A) (Abbildung 15.1.3 B bis D) Kapitel 16 Makula-Loch Die Rolle des OCT OCT ist ein äußerst hilfreiches System für die Diagnose und Behandlung von makularen Löchern. 1. Es ist effektiv bei der Unterscheidung von Makula-Löchern der gesamten Dicke, partiellen, unvollständigen Makula-Löchern, makularen Pseudolöchern und Zysten. 2. Es ist hilfreich, die makularen Löcher in Stadien einzuteilen. 3. Es unterstützt eine quantitative Messung des präoperativen Loch-Durchmessers. 4. Es wird angewandt um die vitreoretinale Grenzfläche in dem anderen Auge des Patienten zu bewerten und dadurch die Chancen einer ähnlichen Erkrankung vorauszusagen. OCT Klassifikation von Makula-Löchern Stufe 1A: Foveale Pseudozysten Stufe 1B: Drohendes Makula-Loch charakteristisch durch Risse in der äußeren Netzhaut. Stufe 2: Lamellares Makula-Loch. Stufe 3: Makula-Loch der gesamten Dicke ohne PVD. (Posterior Vitreous Detachment) Stufe 4: Makula-Loch der gesamten Dicke mit PVD. (Posterior Vitreous Detachment) Fall 16.1: Stufe 1A Macula-Loch: Foveale Pseudozysten Krankheitsfall Eine 73 Jahre alte Frau wurde routinemäßig auf dem rechten Auge untersucht. Ihre bestkorrigierte Sehschärfe auf diesem Auge betrug 1,0. Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine intraretinale Pseudozyste in dem inneren Teil der Fovea (Abbildung 16.1.1 A bis D). OCT war hilfreich bei der Aufdeckung der fovealen Pseudozyste, die der erste Schritt zur Bildung eines Makula-Loches ist. (Abbildung 16.1.1 A bis B) (Abbildung 16.1.1 C bis D) Fall 16.2: Stufe 2 Lamellares Makula-Loch Krankheitsfall ( Es wurde eine 60 Jahre alte Frau mit vermindertem Sehvermögen auf dem linken Auge untersucht. Ihre bestkorrigierte Sehschärfe betrug 1,0 auf diesem Auge. Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine Netzhaut Dehiszenz (Aufriß), begrenzt durch die inneren Netzhautschichten, ein Hinweis auf ein Lamellen-Makula-Loch (Abbildung 16.2.1 A bis D). (Abbildung 16.2.1 A bis B) (Abbildung 16.2.1 C bis D) Fall 16.3: Stufe 3 Macula-Loch Krankheitsfall Es wurde eine 73 Jahre alte Frau, die seit einem Monat unter vermindertem Sehvermögen auf beiden Augen leidet, untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,05 auf dem Rechten und 0,06 auf dem linken Auge. Optical Coherence Tomography Der horizontale Linien-Scan des rechten Auges zeigte die Präsenz einer Dehiszenz (Aufriß) der gesamten Dicke der Netzhaut mit einem darüber liegenden Operculum (Deckel) (Abbildung 16.3.1 A bis D). Trotz der unscharfen Medien aufgrund eines Linsen-Tausches, war der 3D-OCT Scan fähig die makularen Löcher anzuzeigen. (Abbildung 16.3.1 A bis B) (Abbildung 16.3.1 C bis D) Fall 16.4: Stufe 4 Macula-Loch Optical Coherence Tomography Der horizontale Linien-Scan auf dem linken Auge zeigte ein makulares Loch über die gesamte Dicke mit hinterer Glaskörperabhebung (posterior vitreous detachment) (Abbildung 16.4.1 A bis D). Die umgebende Netzhaut zeigte zystische Räume, gekennzeichnet durch hypo-reflektierende Räume. Trotz der unscharfen Medien aufgrund eines Linsen-Tausches, war der 3D-OCT Scan fähig, die makularen Löcher anzuzeigen. (Abbildung 16.4.1 A bis B) (Abbildung 16.4.1 C bis D) Kapitel 17 Medulläre Nervenfasern Medulläre Nervenfasern ist eine angeborene Anomalie, bei der die oberflächlichen Schichten der Nervenfaser, während des späteren Teils des intrauterinen Lebens, versagen und demyelinisieren (entmarken). Fluoreszenz-Angiographie zeigte eine Maskierung der Netzhautgefäße ohne Hinweise auf Gefäßundichtigkeiten (Leckage). Optical coherence Tomography Oberflächenschichten. zeigte einen erhöhten Reflektionsgrad in den Fall 17.1: Medulläre Nervenfasern Krankheitsfall Eine 23 Jahre alte Frau kam zu einer Routine-Untersuchung. Ihre bestkorrigierte Sehschärfe betrug 0,5 auf dem linken Auge. Fluoreszenz-Angiographie zeigte eine überlagernde Verschwommenheit der Gefäße im oberen und unteren Bereich der Disc (Abbildung 17.1.1 und 17.1.2). Optical Coherence Tomography Der horizontale Linien-Scan durch das Medulläre Nervengewebe zeigte eine HyperReflektivität (Abbildung 17.1.3 A bis D). (Abbildung 17.1.3 A) (Abbildung 17.1.3 B bis D) Kapitel 18 Altersabhängige Makula-Degeneration (AMD) ist die Hauptursache für irreversiblen Verlust der Sehkraft. Es ist eine bilaterale Fehlsteuerung mit CNV-Membranen, die sich zu 26% in Augen entwickelt, welche zunächst frei von Neovascular-AMD waren. Neovascular-AMD ist Charakterisiert durch die Bildung von Choroidal Neovaskularisation zunächst unter dem RPE, resultierend in klinischen Befunden, wie z. B. subretinalen Blutungen, subretinale Flüssigkeit, Netzhaut-Ödem, RPE-Abhebung und eventueller scheibenförmiger Narbenbildung. Makula-Photokoagulation-Studienermittler definierten zwei „leckage“-Muster für Choroidal Neovaskularisation durch „Rapid-sequence Fluoreszenz-Angiographie“ (RSFA) (schnelles erfassen einer Bildfolge, um das Einstömverhalten zu dokumentieren): 1. Klassisch, welches in diskrete und frühe Hyperfluoreszenz mit später „Leckage“ in die obige neurosensorische Netzhaut-Ablösung resultiert. 2. Okkult, welches wiederum in zwei elementare Formen kategorisiert wird: i. Späte „Leckage“ mit unbestimmter Quelle tritt augenscheinlich als Regionen von getupften oder unklarer „leckage“ in eine darüber liegende neurosensorische Netzhaut-Ablösung auf, ohne eine bestimmte Quelle auf den frühen Bildern des Angiograms zu identifizieren. ii. Fibrovasculare PED’s erscheinen als unregelmäßige Erhebung des RPE, verbunden mit getüpfter „Leckage“ in die darüber liegende neurosensorische Netzhaut-Ablösung, in frühen und späten Bildern des Angiogramms. Abhängig von der Distanz zu der foveal gefäßlosen Zone kann die „Leckage“ als subfoveal, juxtafoveal (1-199 μm) oder extrafoveal (200-250 μm) klassifiziert werden. Rolle des OCT OCT ermöglicht es, alle Komponenten der Altersbezogenen neovascular MakulaDegeneration darzustellen. Die typischen Komponenten beinhalten seröse Erhebung des Netzhaut-Pigment-Epitheliums, seröse Erhebung der Netzhaut und subretinale Pigment Epithel und subretinale Blutung. Harte Exsudate können an den äußeren Grenzen einer serösen Trennung erkannt werden. Choroidal neovascular Membranen resultieren in diesen serösen Erhebungen und Blutungen. 1. OCT ist hilfreich bei der Aufdeckung von okkulter CNV, welche klinisch und mit Fluoreszenz-Angiographie schwierig zu identifizieren ist. 2. OCT ist besonders hilfreich bei der Auswertung von Resultaten der Photodynamischen Therapie (PDT), indocyanine green vermittelten Photothrombose (i-MP), transpapilläre Thermotherapie (TTT) und den neuen Antiangiogenic Therapien (Hemmung der Neubildung von Blutgefäßen). Anknüpfend an eine PDT wurden fünf Stufen (stages) beschrieben: Stage 1: Ersichtlich innerhalb der ersten Therapiewoche und charakterisiert durch akute entzündliche Reaktion mit einer Erhöhung der subretinalen Flüssigkeit. Stage 2: Ersichtlich innerhalb der 1. – 4. Behandlungswoche und charakterisiert durch Auflösung der serösen Flüssigkeit mit Wiederherstellung der fovealen Kontur. Stage 3: Ersichtlich innerhalb der 4. –12. Woche und charakterisiert durch die Anwesenheit von entweder vermehrter subretinaler Flüssigkeit relativ zu dem faserigen Gewebe, ein Hinweis auf aktive CNV Stage 3a, oder mehr faserigem Gewebe mit minimaler subretinaler Flüssigkeit, ein Hinweis auf Inaktivität Stage 3b. Stage 4: Charakteristisch durch die Anwesenheit von zystoiden Räumen. Stage 5: Auflösung der subretinalen Flüssigkeit mit Verdünnung der Netzhaut und der Verschmelzung des faserigen Gewebes damit. Fall 18.1: Neovascular AMD Krankheitsfall Es wurde eine 58 Jahre alte Frau mit Metamorphosia auf dem rechten Auge untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,25 auf diesem Auge. Die Fluoreszenz-Angiographie zeigte eine große subfoveale überwiegend klassische CNVM mit einem umgebenden Kranz aus subretinalen Blutungen (Abbildung 18.1.1 und 18.1.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Bereich mit moderatem Reflektionsgrad, darüberliegendem Netzhautödem und minimaler subretinaler Flüssigkeit, eine Hinweis für eine aktive CNVM (Abbildung 18.1.3 A bis D). (Abbildung 18.1.3 A) (Abbildung 18.1.3 B bis D) Case 18.2: Neovascular ARMD Krankheitsfall Ein 72 Jahre alter Mann, der seit 5 Monaten unter Beschwerden beim Lesen und Metamorphosia auf dem rechten Auge litt, wurde untersucht. Seine bestkorrigierte Sehschärfe auf diesem Auge betrug 0,33. Fluoreszenz-Angiographie zeigte eine blutige Pigment Epithel Trennung mit Anzeichen für eine okkulte CNVM (Abbildung 18.2.1 und 18.2.2). Indiocyanine green angiography zeigte den Umfang des CNVM (Abbildung 18.2.3 und 18.2.4) Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine große Erhebung des RPE, in Übereinstimmung mit einer RPE-Trennung. Die Blutzellen innerhalb der Trennung verursachen einen Schatteneffekt, der die Sichtbarkeit der Choroicapillaris verhindert. Seröse Erhebung der Netzhaut ist an beiden Seiten der RPE Trennung sichtbar (Abbildung 18.2.5 A bis D). (Abbildung 18.2.5 A bis C) (Abbildung 18.2.5 D) Optical Coherence tomography Der horizontale Linien-Scan zeigte eine blutige (hämorrhagisch) Pigmentepithel-Trennung. Auf der rechten Seite der Trennung ist das Netzhaut-Pigmentepithel, aufgrund der anwesenden Choroidal neovascular Membran zerrissen (Abbildung 18.5.E bis G). (Abbildung 18.5.E) (Abbildung 18.2.5 F bis G) Case 18.3: Neovaskular AMD mit RPE „Tear“ Krankheitsfall Es wurde ein 65 Jahre alter Mann untersucht, der seit zwei Jahren unter vermindertem Sehvermögen auf dem linken Auge litt und nur noch Finger zählen konnte. Die FluoreszenzAngiographie zeigte eine klassische Choroidal neovascular Membran (Abbildung 18.3.1 und 18.3.2). (Abbildung 18.3.1) (Abbildung 18.3.2) Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Bereich von moderater Reflektion vor dem Netzhaut-Pigment-Epithel in der subfovealen Region, in Übereinstimmung mit einer klassischen Choroidal Neovascularisation. Die zystoiden Räume mit der Netzhautverdickung deuten an, dass es sich um aktive CNV handelt. Eine gebogene Trennung des NetzhautPigments mit offensichtlicher Verdickung war augenscheinlich. Die Trennung beinhaltete Blutzellen, die einen dichten Schatten auf den hinteren Schichten verursachten. Der getrennte hintere Hyaloid war vor der Netzhautoberfläche sichtbar (Abbildung 18.3.3 A bis D). (Abbildung 18.3.3 A bis B) Abbbildung 18.3.3 C bis D) Fall 18.4: Neovaskular AMD behandelt mit Indocyanine Grün Mediated Phototrombosis (i-MP) Krankheitsfall Es wurde eine 68 Jahre alte Frau mit vermindertem Sehvermögen auf dem rechten Auge untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,03 auf diesem Auge. Die FluoreszenzAngiographie zeigte einen umfangreichen Bereich von erhöhter Hyperfluorescence der RPEVeränderung mit dichten Bereichen darin, ein Hinweis auf okkulte CNV (Abbildung 18.4.1 und 18.4.2) ICG bestätigte das Vorhandensein von CNV in dem juxtafovealen Bereich mit einem Bereich von RPE-Veränderung, temporal dazu mit Verlust der Choriocapillaris (Abbildung 18.4.3 und 18.4.4). Optical Coherence Tomography Der horizontale Linien-Scan zeigte Wellenformen in der RPE, in Übereinstimmung mit Drusen. Es gab Bereiche mit stark zerrissenem und verdicktem RPE mit schwach definierten Grenzen, ein Hinweis auf okkulte CNV mit darüber liegendem Netzhautödem (Abbildung 18.4.5 A bis E). Der Patient wurde mit indocyanin grün vermittelte Photothrombose behandelt. Nachbeobachtung (Follow- up) Einen Monat nach der i-MP, wurde die OCT wiederholt und zeigte eine Zunahme im Netzhaut-Ödem und eine Reduzierung in der CNVM (Abbildung 18.4.6 A bis E). (Abbildung 18.4.5 A bis E) (Abbildung 18.4.6 A bis E) Das nach 3 Monaten erneut wiederholte OCT zeigte ein restauratives Ödem, ohne Hinweise auf CNV (Abbildung 18.4.7). (Abbildung 18.4.7) Fazit OCT ist daher nicht nur hilfreich bei der Diagnose von CNV, sondern auch bei Nachuntersuchungen von Patienten, die mit verschiedenen Therapien behandelt wurden. Kapitel 19 Papillen Drusen Papillen Drusen bestehen aus kleinen Klumpen aus Muscopolysacchariden und proteinartigem Material, das mit dem Alter verkalkt. Sie sind in 70% der Fälle bilateral und können in jedem Alter und Geschlecht auftreten. Sie können als erbliches autosomales Merkmal mit unregelmäßig irregulärer Penetranz auftreten. Die Mehrheit aller Patienten ist a-symptomatisch. Dennoch, könnten einige Patienten vorübergehende, visuelle Trübungserscheinungen erfahren. Drusen sind entweder oberflächlich, wenn sie als kleine, weiß bis gelbliche, granulöse Wulst aus der Substanz der Disk erscheinen, oder sie sind tief eingebettet in der Nerven-Substanz. Oberflächliche Drusen können Autofluoreszenz aufweisen, wo hingegen eingebettete DiskDrusen nicht autofluoreszieren. Disk Drusen können mit retinitis pigmentosa und Pseudoxanthoma elasticum assoziiert werden. Fall 19.1: Optic Disc Drusen Krankheitsfall Es wurde ein 17 Jahre altes Mädchen mit zweiwöchiger, vorübergehenden, visuellen Trübungserscheinungen der Sehkraft auf dem linken Auge untersucht. Ihre bestkorrigierte Sehschärfe auf diesem Auge betrug 6/6. Fluoreszenz-Angiographie zeigte eine Färbung der Disk (Abbildung 19.1.1 und 19.1.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine Erhebung der Disk mit dichten fingerähnlichen Schatten unterhalb der Disk (Abbildung 19.1.3 A bis D). Eine ausgeprägte Verdünnung der RNFL (retinale Nervenfaserschicht) war offensichtlich (Abbildung 19.1.3 E) Ultrasonographie zeigte einen Bereich von moderater Reflektivität am Sehnervkopf, somit wurde die Diagnose Optic Disk Drusen bestätigt (Abbildung 19.1.3 F). (Abbildung 19.1.3 A) (Abbildung 19.1.3 B bis D) (Abbildung 19.1.3 E) (Abbildung 19.1.3 F) Fazit OCT Ergebnisse können besonders in Fällen von Vorteil sein, bei denen die klinische Beurteilung des optischen Nervenkopfs die Drusen nicht aufdeckt. Kapitel 20 Papillenödem Papillenödem ist eine Schwellung der Disk, die sekundär ist, für einen erhöhten intrakraniellen Druck. Im Gegensatz zu anderen Ursachen der SehnervenscheibenSchwellung, ist das Sehvermögen bei akutem Papillenödem normalerweise gut erhalten. Sie tritt fast immer als bilaterales Phänomen auf und kann sich in Stunden und Wochen entwickeln. Fall 20.1: Papillen Ödem Krankheitsfall Eine 25 Jahre alte Frau wurde mit Dengue-Fieber und Diplopie (Doppelsichtigkeit) seit 4 Tagen diagnostiziert. Ihre bestkorrigierte Sehschärfe betrug 1,0 auf beiden Augen. Fluoreszenz-Angiographie zeigte erweiterte Disk-Kapillare mit später Färbung der Disk (Abbildung 20.1.1 und 20.1.2). Optical Coherence Tomography Der horizontale Linien-Scan durch die rechte Papille zeigte eine substanzielle DiskErhebung mit einem klaren optischen Raum, aufgrund der ausgeprägten GewebeVerdickung und Flüssigkeits-Ansammlung innerhalb der Disk (Abbildung 20.1.3 A bis D). (Abbildung 20.1.3 A) (Abbildung 20.1.3 B bis D) Die Fluoreszenz-Angiographie des linken Auges zeigte geweitete Disk-Kapillare mit später Färbung der Disk (Abbildung 20.1.4 und 20.1.5). Optical Coherence Tomography Der horizontale Linien-Scan durch die linke Sehnervenscheibe zeigte eine substanzielle Disk- Erhebung mit einem klaren optischen Raum darin aufgrund der ausgeprägten GewebeVerdickung und Flüssigkeits-Ansammlung (Abbildung 20.1.6 A bis D). (Abbildung 20.1.6 A) (Abbildung 20.1.6 B bis D) Fazit OCT ist hilfreich bei Fällen von Papillenödemen, um den Verlauf verfolgen. der Erkrankung zu Kapitel 21 Retinaler Arterienverschluß OCT ist bei Retinalem Arterienverschluß hilfreich, um sowohl Makulaödeme oder Atrophie zu dokumentieren. Die ischämische Netzhaut zeigt einen erhöhten Reflektionsgrad der inneren Netzhautschichten mit einem verminderten Reflektionsgrad der PhotorezeptorSchichten und dem Netzhaut-Pigment-Epithelium in der perifoveolaren Region, sekundär zu dem Schatteneffekt. Die ischämische Netzhaut hingegen gewinnt ihre Reflektivität mit der Zeit wieder zurück. Fall 21.1: Nebenarterienverschluß mit Macula-Loch der 4. Stufe Krankheitsfall Eine 72 Jahre alte Frau wurde auf Grund eines plötzlichen Sehverlusts auf dem rechten Auge seit einer Woche untersucht. Sie konnte lediglich Licht auf diesem Auge wahrnehmen. Fluoreszenz-Angiographie zeigte eine verspätete arterielle Füllung mit Hyperfluoreszenz an der Fovea, welche in der späteren Phase nachließ (Abbildung 21.1.1 und 21.1.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte eine Hyper-Reflektivität der inneren Netzhautschichten, entsprechend der klinisch undurchsichtigen Netzhaut. Es gab eine hyper-reflektierende Membran, eng haftend mit der darunterliegenden Netzhaut. Die Posterior-Hyaloid-Membran war vor der Netzhaut sichtbar (Abbildung 21.1.3 A bis C). (Abbildung 21.1.3 A) (Abbildung 21.1.3 B bis C) Optical coherence Tomography Der horizontale Linien-Scan durch die Fovea zeigte ein vollständiges Aufplatzen, über die gesamte Dicke, der Netzhaut und der Epiretinal-Membran. Die Posterior-Hyaloid-Membran war vor der Netzhaut sichtbar (Abbildung 21.1.3 D bis F). (Abbildung 21.1.3 D bis F) Kapitel 22 Netzhautablösung Netzhautablösungen am hinteren Pol, insbesondere Traktionen, können leicht durch das OCT aufgedeckt werden. Preretinal- und Epiretinal-Membranen und die entgegenwirkende vitreoretinale Traktion können einfach beschrieben werden. Fall 22.1: Tractional Retinal Detachment Krankheitsfall Es wurde ein 68 Jahre alter Mann mit proliferativer-, diabetischer- Retinopathie mit vermindertem Sehvermögen auf dem rechten Auge untersucht. Er hat eine Vorgeschichte von Laser- Photokoagulation. Seine bestkorrigierte Sehschärfe betrug 0,03 auf diesem Auge. Optical Coherence Tomography Der horizontale Linien-Scan deckte eine flache Spaltung, in der Ebene des RPEChoriocappillaris-Komplexes, mit einer optisch klaren Kavität von subretinaler Flüssigkeit, auf (Abbildung 22.1.1 A bis C). (Abbildung 22.1.1 A bis C) Der OCT-Scan durch die Fovea zeigte eine normale Fovea-Kontur ohne Anzeichen einer Netzhauttrennung. Es gab zystenähnliche Räume in der neurosensorischen Netzhaut, ein Hinweis auf ein Netzhautödem (Abbildung 22.1.2 A bis D). (Abbildung 22.1.2 A bis C) (Abbildung 22.1.2 D) Der horizontale Linien-Scan unterhalb der Fovea zeigte Anzeichen für eine Netzhauttrennung. Die Wellenformen der Netzhaut-Oberfläche deuten auf eine Traktion hin (Abbildung 22.1.3 A bis C). Dadurch hat das 3D OCT, mit seiner Fähigkeit auf verschiedenen Ebenen zu scannen, geholfen, den Umfang der Netzhauttrennung an dem hinteren Pol zu bestätigen, was wiederum hilfreich war, das chirurgische Ergebnis in diesem Fall vorauszusagen. (Abbildung 22.1.3 A) (Abbildung 22.1.3 A bis C) Fall 22.2: Netzhautablösung Krankheitsfall Es wurde ein 53 Jahre alter Mann mit vermindertem Sehvermögen seit 4 Tagen auf dem rechten Auge untersucht. Seine bestkorrigierte Sehschärfe betrug 0,33 auf diesem Auge. Optical Coherence Tomography Der horizontale Linien-Scan deckte eine flache Spaltung, in der Ebene des RPEChoriocappillaris-Komplexes, mit einer optisch klaren Kavität von subretinaler Flüssigkeit, auf (Abbildung 22.2.1 A bis D). (Abbildung 22.2.1 A bis C) (Abbildung 22.2.1 D) Der horizontale Linien-Scan durch die Fovea zeigte eine erhöhte Netzhaut-Dicke mit Anzeichen für eine Netzhauttrennung und Schisis (Abbildung 22.2.2 A bis C). (Abbildung 22.2.2 A) (Abbildung 22.2.2 A bis C) Der horizontale Linien-Scan unterhalb der Fovea zeigte eine erhöhte Netzhaut-Dicke und Anzeichen für eine Netzhautabtrennung. Die Wellenformen auf der Netzhaut-Oberfläche weisen auf eine Traktion hin. Die schwache Reflektivität des RPE ist durch die Höhe der Trennung zu erklären (Abbildung 22.2.3 A bis C). (Abbildung 22.2.3 A bis C) Fall 22.3: Retinoschisis Krankheitsfall Es wurde ein 17 Jahre alter Junge mit starker Myopie auf Grund von 3 Monate andauernden Beschwerden von vermindertem Sehvermögen auf dem linken Auge untersucht. Seine bestkorrigierte Sehschärfe betrug 0,25 auf diesem Auge. Fluoreszenz-Angiographie zeigte eine peripapilläre Atrophie mit progressiver Hyperfluoreszenz am hinteren Pol (Abbildung 22.3.1 und 22.3.2). Optical Coherence Tomography Der horizontale Linien-Scan unterhalb der Fovea zeigte eine Spaltung der neurosensorischen Netzhaut, ein Hinweis auf eine Retinoschisis. Somit war das 3D-OCT mit der Möglichkeit, den Bereich innerhalb des blauen Quadrats kontinuierlich zu scannen, fähig, Retinoschisis unterhalb der Fovea aufzudecken (Abbildung 22.3.3 A bis C). (Abbildung 22.3.3 A) Kapitel 23 Retinale Venenverschlüsse (RVO) Netzhaut-Venen-Okklusion (Haupt- und Nebenarm) ist die zweithäufigste Netzhaut-VascularErkrankung nach Diabetes-Retinopathie. Erkrankte Patienten befinden sich für gewöhnlich zwischen dem fünften und sechsten Lebensjahrzehnt. Dieses 10 Jahre Risiko auf eine Entwicklung von cardiovasculären Komplikationen ist größer bei Patienten mit NetzhautNebenvenen-Okklusion (BRVO) (branch retinal vein occlusion), als bei NetzhautZentralvenen-Okklusion (CRVO) (central retinal vein occlusion). Fluoreszenz-Angiographie hilft die Ursache des visuellen Verlust –durch Makulaödeme und / oder Makula-Ischämie – zu bestimmen. Optical Coherence Tomography ermöglicht die Aufdeckung von subtilen Makulaödemen, selbst beim Vorhandensein von signifikanten Blutungen. Es zeigt die Präsenz von zystoiden Räumen, seröser Netzhaut-Trennung, epiretinal Membranen und Makular-Löchern. Es spielt eine wichtige Rolle, um das Ansprechen auf die zahlreichen angewandten Behandlungsmöglichkeiten zu verfolgen und dabei die Notwendigkeit wiederholender Angiogramme zu reduzieren. Fall 23.1: Zentral-Netzhautvenen-Okklusion Krankheitsfall Es wurde eine 62 Jahre alte Frau, mit Beschwerden von vermindertem Sehvermögen seit einem Monat, untersucht. Ihre bestkorrigierte Sehschärfe auf diesem Auge betrug 0,1. Fluoreszenz-Angiographie zeigte eine nicht-ischämische zentrale Netzhaut–VenenOkklusion mit „Leckage“ an der Fovea und Disk (Abbildung 23.1.1 und 23.1.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Verlust der Foveal-Kontur, zentrale NetzhautVerdickung und hypo-reflektierende Bereiche mit hyper-reflektierenden Scheidewänden dazwischen, ein Hinweis auf zystoide Makulaödeme. Des Weiteren gab es einen Bereich mit Hypo-Reflektivität in der subfovealen Region, übereinstimmend mit subfoveal seröser Netzhauttrennung (Abbildung 23.1.3 A bis D). Abbildung 23.1.3 A) (Abbildung 23.1.3 B bis D) Optical Coherence Tomography Der horizontale Linien-Scan durch die rechte Papille zeigte eine beträchtliche Diskerhebung mit einem klaren optischen Raum innerhalb der Disk aufgrund der ausgeprägten GewebeVerdickung und Flüssigkeitsansammlung darin (Abbildung 23.1.4 und 23.1.5). Fall 23.2: Inferior Temporale Nebenvenenokklusion Krankheitsfall Es wurde eine 55 Jahre alte Frau mit vermindertem Sehvermögen seit 15 Tagen auf dem linken Auge untersucht. Ihre bestkorrigierte Sehschärfe betrug 0,17 auf diesem Auge. Fluoreszenz-Angiographie zeigte einen unteren temporalen Venenastverschluss (inferior temporal branch retinal vein occlusion) mit „Leckage“ (Abbildung 23.2.1 und 23.2.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Verlust der Foveal-Kontur, zentraler NetzhautVerdickung und vielen hypo-reflektierenden Bereichen und hyper-reflektierenden Scheidewänden dazwischen, übereinstimmend mit zystoiden Makulaödemen. Ein weiterer hypo-reflektierender Bereich unterhalb der Fovea war ein Hinweis auf seröse Netzhauttrennung (Abbildung 22.2.3 A bis D). (Abbildung 22.2.3 A) (Abbildung 22.2.3 B bis D) Fall 23.3: Inferior Hemi Nebenvenenokklusion Krankheitsfall Es wurde ein 72 Jahre alter Mann mit vermindertem Sehvermögen seit 2 Monaten auf dem rechten Auge untersucht. Seine bestkorrigierte Sehschärfe betrug 0,33 auf diesem Auge. Fluoreszenz-Angiographie zeigte einen unteren einseitigen Venenastverschluss mit „Leckage“ in der Fovea (Abbildung 23.3.1 und 23.3.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte einen Verlust der Foveal-Kontur, zentraler NetzhautVerdickung und mehrere hypo-reflektierende Räume in der neurosensorischen Netzhaut, ein Hinweis auf zystoide Maculaödeme. Außerdem gab es eine hyper-reflektierende Membran auf der Netzhaut-Oberfläche (Abbildung 23.3.3 A bis D). (Abbildung 23.3.3 A) (Abbildung 23.3.3 B bis D) Fall 23.4: Superior Temporale Nebenvenenokklusion Krankheitsfall Eine 45 Jahre alte Frau kam zu einer routinemäßigen Augenuntersuchung. Ihre bestkorrigierte Sehschärfe betrug 0,67 auf dem rechten Auge. Fluoreszenz-Angiographie zeigte einen Venenverschluss des oberen seitlichen Astes (superior temporal branch retinal vein occlusion) mit „Leckage“ in der Fovea (Abbildung 23.4.1 und 23.4.2). Optical Coherence Tomography Der horizontale Linien-Scan zeigte hypo-reflektierende zystenähnliche Räume in der äußeren Netzhaut, ein Hinweis auf ein Netzhautödem (Abbildung 23.4.3 A bis D). (Abbildung 23.4.3 A) (Abbildung 23.4.3 B bis D)