2.1. Das Wasserstoffatom
Werbung

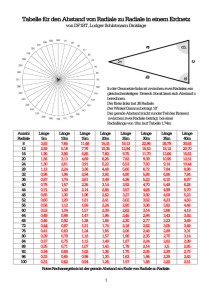
2.1. Das Wasserstoffatom 2.1.1. Atommodelle (vor 1900) 105 2.1.2. Eigenzustände des Wasserstoffatoms Ein einfaches Beispiel: Wasserstoff in Wechselwirkung mit einem klassischen Feld. Eigenenergien wasserstoffähnlicher Atome: Klassisches Feld (monochromatische Lichtwelle): Annahme: Die Frequenz des Lichtes ist in der Nähe der Übergangsfrequenz vom Übergang: d.h.: Für die Beschreibung des Systems müssen i.W. nur zwei Zustände berücksichtigt werden. 106 Die Eigenzustände des Wasserstoffatoms werden aus der stationären Schrödingergleichung berechnet. Allgemeines Problem (Zentralkraft): reduzierte Masse In Polarkoordinaten löst man die Gleichung durch einen Separationsansatz, d.h.: Theorielehrbücher Es ergeben sich 3 zu lösende Differentialgleichungen: 1) Azimutalgleichung (für Φ) 107 2) Polargleichung (für Θ) 3) Radialgleichung (für R) Diese Separation gilt ganz allgemein für alle Zentralpotentiale V(r)! Für physikalisch sinnvolle Lösungen (Verschwinden von ψ im Unendlichen; Eindeutigkeit der Lösung; Quadratintegrierbarkeit) folgen gewisse Bedingungen für die Separationskonstanten m und l: m magnetische Quantenzahl l Drehimpulsquantenzahl 108 Gleichzeitig gilt: oder Die normierten Funktionen die die Winkelverteilung der Eigenfunktionen im Zentralpotential angeben, heissen Kugelflächenfunktionen. Spezielle Eigenschaften der Kugelflächenfunktionen: a) Orthonormalität b) Parität 109 Die Radialgleichung lässt sich zur besseren physikalischen Interpretation noch umformen: mit: folgt: Man kann ein effektives Potential definieren: Es besteht eine Analogie zur Rotationsenergie Erot eines klassischen Teilchens der Masse mr um ein Zentrum im Abstand r: mit dem Bahndrehimpuls 110 Aus der formalen Energie ergibt sich die „Mutmassung“: oder Quantenmechanischer Drehimpuls Das Zentrifugalpotential verschiebt das Minimum der radialen Wellenfunktion zu größeren Abständen. Veff Das rechte Bild zeigt die Kombination vom Zentrifugalpotential und von einem Coulombpotential zu einem effektiven Potential ∝ 1 r2 radiale AufenthaltsWahrscheinlichkeit r ∝− 1 r 111 Das Potentialminimum des effektiven Potentials Veff liegt bei: mit Man bezeichnet rl als den Bahnradius. Spezialfall für das Wasserstoffatom Radialgleichung: Es folgt Theorielehrbücher Hauptquantenzahl Drehimpulsquantenzahl Magnetische Quantenzahl 112 Bemerkungen: • Jeder Energieeigenwert ist n2-fach entartet. • Die Unabhängigkeit der Energie von m folgt für alle Zentralpotentiale. • Die Unabhängigkeit der Energie von l ist ein Spezialfall für das Coulombpotential! Spektroskopische Notation: ℓ |m| Zustand Zustand 0 s 0 σ 1 p 1 π 2 d 2 δ 3 f 3 ϕ 4 g 4 γ … … … … Beispiel: n = 4 , ℓ = 3 , m = −2 ↔ 4 f δ - Zustand 113 Einfaches Termschema des Wasserstoffs: E 0 n=3 s p d (ℓ=0) (ℓ=1) ( ℓ = 2) 3s 3p 3d 3-fach entartet −Ry* n=2 2s n=1 1s 5-fach entartet 2p 114 2.1.3. Der Drehimpuls Hypothese: In Anlehnung an die klassische Physik lässt sich ein quantenmechanischer Drehimpulsoperator für den Bahndrehimpuls aufschreiben: Schreibweise als Determinante: Somit in Analogie: Drehimpulsoperator 115 Zusammenfassung der Eigenschaften des Bahndrehimpulsoperators 1) Der Bahndrehimpuls wird beschrieben durch den Operator 2) Die Eigenwerte von sind oder formal: mit 3) vertauscht mit vertauscht nicht mit und nicht mit vertauscht nicht mit und nicht mit vertauscht nicht mit und nicht mit 4) Die Eigenwerte der z-Komponente des Drehimpulsoperators sind mit 5) Die Drehimpulsquantenzahl l ist die Maximalkomponente des Drehimpulsoperators gemessen in . 116 Darstellung des quantenmechanischen Drehimpulses im Kreiselmodell: Beispiel: ℓ = 3 Kugelradius = l (l + 1) h m=3 m=2 z y m =1 m=0 x m = −1 m = −2 m = −3 h Ist eine Quantisierungsachse festgelegt (hier zRichtung) und präpariert man das quantenmechanische System mit genau bestimmter Projektion auf diese Achse, so sind die Komponenten in der x- und yRichtung vollständig unbestimmt, d.h. sie liegen auf einem Kreiskegel. Bem: Auch für maximale z-Projektion (hier m=3) ist der Drehimpuls nicht parallel zur Z-Achse. 117 2.1.4. Diskussion der Wasserstoffwellenfunktion Winkelverteilung Die Winkelverteilung ist durch die Kugelflächenfunktionen bestimmt. Die nachfolgende Abbildung zeigt eine Polardarstellung von für die Hauptquantenzahl n=4. Allgemeine Bemerkungen: • Nur Zustände mit l=0 sind kugelsymmetrisch • Die Winkelverteilung der quantenmechanischen (Wellen-)Lösung kann als Projektion kreisförmiger Bewegungen eines klassischen Teilchens interpretiert werden. 118 l=0 m=0 l=1 m=0 l=2 m=0 l=3 m=0 l=1 m=1 l=2 m=1 l=3 m=1 l=2 m=2 l=3 m=2 z y x Bsp.: l=1, m=0 Im klassischen System zeige der Drehimpuls z.B. in die x-Richtung. Dies entspricht einer klassischen Bewegung in der z-y-Ebene. Eine Projektion dieser Bewegung auf die z-xEbene liefert maximale Aufenthaltswahrscheinlichkeit an den Polen. l=3 m=3 119 Radiale Verteilung Zusammenstellung verschiedener Funktionen: Radiale Wellenfunktion Radiale Aufenthaltswahrscheinlichkeitsamplitude Definition der radialen Aufenthaltswahrscheinlichkeitsdichte : gibt die Wahrscheinlichkeit an, das Elektron in einer Kugelschale (Dicke dr) mit Radius r zu finden. 120 Allgemeine Bemerkungen zur radialen Wellenfunktion : • Kugelsymmetrische Zustände mit l=0 haben stets bei r=0 das Maximum der radialen Wellenfunktion. • Bei gösseren Drehimpulsquantenzahlen verschiebt das Zentrifugalpotential das Maximum der radialen Wellenfunktionen zu grösseren Abständen. • Die radiale Wellenfunktion kann auch durch die Anzahl der Knoten charakterisiert werden. Es ist: Mittelwert von r Bem.: Beim Bohrschen Radius ist die Aufenthaltswahrscheinlichkeit maximal. Im Mittel befindet sich das Elektron aber im Abstand 1,5 a0 zum Kern. 121 Radiale Aufenthaltswahrscheinlichkeiten der ersten drei Energieniveaus im Wasserstoffatom: n = 1, ℓ = 0 nr = 0 n = 3, ℓ = 0 nr = 2 n = 3, ℓ = 1 nr = 1 n = 2, ℓ = 0 nr = 1 n = 3, ℓ = 2 nr = 0 n = 2, ℓ = 1 nr = 0 122 Gesamte räumliche Verteilung Das Gesamtbild der räumlichen Verteilung ergibt sich durch Multiplikation der Winkelverteilung mit der radialen Verteilung, d.h. von mit Allgemeine Bemerkungen: • Die Summe über alle magnetischen Quantenzahlen m für alle Stehwellen (zu einer Drehimpulsquantenzahl l und einer Hauptquantenzahl n) ergibt stets eine kugelsymmetrische Verteilung, d.h. die Wahl der Quanisierungsachse (meist z-Achse genannt) ist irrelevant. 123 für die ersten beiden Zustände des Wasserstoffatoms 100 1s 200 2s 210 2p 211 2p 124 300 3s 310 3p 320 3d 311 3p 321 3d für den Zustand n=3 des Wasserstoffatoms 322 3d 125 2.1.5. Zusammenfassung: Wellenfunktionen des H-Atoms Die Winkelwellenfunktion Normierungsfaktor 126 Die Radialwellenfunktion assoziiertes Laguerre-Polynom mit: und: = 0.529 Angstroem 127 2.1.6. Experimente mit einzelnen Atomen Atomfallen Einzelne Ladungen können nicht allein durch statische elektrische Felder stabil im Raum gehalten werden (Earnshaw-Theorem). Elektrische Wechselfelder (Paul-Falle) Elektrische und magnetische Felder (Penning-Falle) Eine Paul-Falle (Nobelpreis 1989) besteht aus zwei parabolischen Elektroden und einer Ringelektrode: 128 Wird eine Gleichspannung Udc und eine Wechselspannung Vac mit der Frequenz Ω angelegt, so hat das Potential nahe des Fallenzentrum die Form: Wobei r0 und z0 den Abstand vom Fallenzentrum zu den Elektroden angibt. Das Potential ist harmonisch und stellt für einen bestimmten Zeitpunkt eine rücktreibende Kraft in einer Dimension dar: 129 Die Trägheit des gefangenen Teilchens verhindert, dass das Teilchen in der anderen Richtung aus der Falle getrieben wird, bevor cos(Ωt) das Vorzeichen wechselt! Für bestimmte Ω rücktreibende Kraft in allen drei Raumrichtungen Bewegungsgleichungen in der Paul-Falle: Mit der Transformation: 130 folgt: Mathieu‘sche Differentialgleichung Falls (gilt üblicherweise) ist die Lösung: mit Die Lösung besteht aus einer schnellen Bewegung der Frequenz ω (Mikrobewegung) und einer langsamen Bewegung (Makrobewegung) in einem harmonischen Potential. Im Fallenzentrum verschwindet die Mikrobewegung! 131 Experimentelle Realisierungen (Beispiel: Iontraps in Innsbruck, AG Blatt) Linear LinearIon IonTraps Traps Courtesy: Rainer Blatt, University Innsbruck Paul mass filter Innsbruck Ann Arbor München Boulder, Mainz, Aarhus Innsbruck, Oxford 132 Innsbruck Innsbrucklinear linearion iontrap trap(2000) (2000) 1.0 mm 6 mm ω z ≈ 0.7 − 2 MHz ω x , y ≈ 1.5 − 4 MHz 133 40 ++ ions in a linear Paul trap 40 String of Ca String of Ca ions in a linear Paul trap row of qubits in a linear Paul trap forms a quantum register 70 µm 134 + Level Levelscheme schemeof ofCa Ca+ qubit on narrow S - D quadrupole transition P3/2 854 nm P1/2 866 nm 393 nm D5/2 397 nm D3/2 729 nm S1/2 135 Spectroscopy Spectroscopywith withquantized quantizedfluorescence fluorescence(quantum (quantumjumps) jumps) P D monitor spectroscopy absorption and emission cause fluorescence steps (digital quantum jump signal) S detection efficiency: 99.85% Fluorescence intensity S # of measurements Anzahl der Messungen 8 7 D-Zustand besetzt SS-Zustand D state occupied state occupied besetzt 6 5 4 3 2 1 D time (s) 0 0 20 40 60 80 100 120 Zählrateper pro 99 ms ms counts 136