Thermodynamik
Werbung

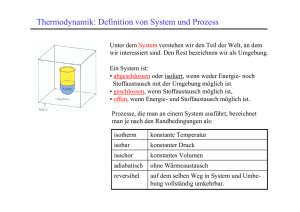
Theorie Thermodynamik Seite 1 Wärme Führt man einem Körper Wärme zu, reagiert er mit einer Temperaturerhöhung, einem Schmelz- oder einem Verdampfungsprozess. Ein Gas kann Wärme ohne Temperaturerhöhung aufnehmen, indem es sich ausdehnt. Die mengenartige Grösse, die bei allen thermischen Vorgängen ausgetauscht und gespeichert wird, heisst Entropie S. Entropie ist der eigentliche Wärmestoff. Wärmezufuhr Durch Reibung entsteht Wärme; Entropie kann also auch erzeugt werden. Entropieproduktion ist der gemeinsame Nenner aller Reibungsvorgänge. Die Entropiemenge, die erzeugt wird, hängt von der freigesetzten Energie und der herrschenden Temperatur ab. Die folgende Tabelle zeigt eine Zusammenstellung möglicher Reibungsvorgänge Entropieproduktion Prozesstyp konkrete Reibungsvorgänge Gravitationsprozess Wasserfall hydraulischer Prozess Rohrreibung, Filter elektrischer Prozess Elektroheizung, Glühbirne translationsmechanischer Prozess Gleitreibung, rotationsmechanischer Prozess Lagerreibung, Rutschkupplung chemischer Prozess chemische Reaktion, Diffusion thermischer Prozess Wärmeleitung Entropie ist die einzige mengenartige Grösse der Physik, die nur erzeugt und nicht vernichtet werden kann. Damit verhindert die Entropieproduktion bei den meisten Prozessen die Zeitumkehr. Nimmt man einen reibungsbehaftetenVorgang auf Video auf und lässt das Band rückwärts laufen, erhält man infolge Entropievernichtung einen physikalisch unmöglichen Prozess. Reibungsbehaftete Vorgänge heissen denn auch irreversibel. Zeitumkehr Die Temperatur eines Körpers ist wie der Druck, das elektrische Potential, die Geschwindigkeit oder die Winkelgeschwindigkeit eine Grösse, die den Füllzustand eines Systems angibt. Misst man die Temperatur bezüglich des absoluten Nullpunktes, verwendet man Kelvin als Einheit. Kelvin ist eine der sieben Basiseinheiten des technischen Einheitensystems (SI). Temperatur Der Zusammenhang zwischen Entropie (Füllmenge) und Temperatur (Füllzustand) ist leider nicht linear. Beim Schmelzen und beim Verdampfen bleibt die Temperatur konstant, obwohl Entropie zugeführt wird. Zudem ist die Entropie-Temperatur-Beziehung vom Druck abhängig. So kann ein Gas bei gleicher Temperatur je nach Druck unterschiedlich viel Entropie speichern. Das erste der beiden unten abgebildeten T-S-Diagramme gehört zu einem Festkörper, der bei konstantem Druck bis in den gasförmigen Zustand erwärmt. Das zweite Diagramm beschreibt das T-S-Verhalten eines Gases, das bei hohem Druck erwärmt, dann mittels eines Kolbens schnell entspannt und zuletzt langsam unter konstanter Kühlung wieder in den alten Zustand gedrückt wird T-S-Diagramm T T gasförmig iso ch or flüssig isotherm fest isentrop verdampfen schmelzen S S Auf der atomaren Ebene äussert sich die Entropie als eine Art Unordnung. Je mehr Anordnungsmöglichkeiten den Teilchen offen stehen, desto höher ist die Entropie des Systems. Anordnungsmöglichkeiten können im Kristallgitter, im Raum oder in der Impulsverteilung realisiert werden. Entropie als Unordnung Theorie Thermodynamik Seite 2 zugeordneter Energiestrom und Prozessleistung Energie wird immer zusammen mit einer mengenartigen Grösse ausgetauscht. Bildlich gesprochen ist die physikalische Menge beim Transport mit Energie beladen. Das Energiebeladungsmass heisst Potential. Bei einem Speicher zeigt das Potential den Füllzustand an. Potential als Energiebeladungsmass Das allgemeine Schema mit zugeordnetem Energiestrom und Prozessleistung lässt sich am Beispiel des Wasserfalles anschaulich erläutern. Der schweren Masse kommt die Rolle der mengeartige Grösse zu und als Energiebeladungsmass amtet das Gravitationspotential. Im Falle des erdnahen, homogenen Gravitationsfeldes ist das Potential gleich dem Produkt aus Gravitationsfeldstärke und Höhe über Meer. Nun können wir sowohl dem zufliessenden als auch dem abfliessenden Wasser einen potentiellen Energiestrom zuordnen. Der Unterschied zwischen den beiden Energieströmen heisst Prozessleistung. Diese Prozessleistung wird im Wasserfall freigesetzt und kann im Prinzip genutzt werden Wasserfall als Archetyp P IW1 zg. Energiestrom IW = j ◊ IM Prozessleistung P = (j1 - j 2 )◊ IM IW2 j1 IM Gravitations M ∫ m j = g◊ h j2 Das Wasserfallbild lässt sich direkt auf die andern sechs grundlegenen Prozesse der klassischen Physik übertragen Gebiet Menge Einheit allgemeines Schema Potential Einheit Gravitation schwere Masse m Kilogramm (kg) Gravitationspotential J/kg oder m2/s2 Hydraulik Volumen V Kubikmeter (m3) Druck Pascal (Pa) Elektrizität el. Ladung Q Coulomb (C) oder A·s el. Potential Volt (V), J/C, W/A Translationsmechanik Impuls p kg·m/s oder N·s Geschwindigkeit m/s Rotationsmechanik Drehimpuls L kg·m2/s oder N·m·s Winkelgeschwind. 1/s Thermodynamik Entropie S J/K Temperatur Kelvin (K) Chemie Stoffmenge n Mol (mol) chem. Potential J/mol Masse und Stoffmenge werden in den Basiseinheiten Kilogramm und Mol gemessen. Die Einheiten von elektrischer Ladung und Impuls können als A·s oder N·s geschrieben werden. Weil das thermische Potential eine Basiseinheit ist, wird die Entropie in Joule pro Kelvin gemessen. Einheiten Physikalische Prozesse lassen sich grob in drei Gruppen einteilen: Beispiele Gebiet treibend getrieben irreversibel Gravitation hyd. Kraftwerk Pumpwerk Wasserfall Hydraulik Hydraulikmotor Pumpe Rohrströmung Elektrizität Elektromotor Generator Widerstandselement Translationsmechanik treib. Riemenscheibe getr. Reimenscheibe Gleitreibung Rotationsmechanik Generator Elektromotor Lagerreibung Thermodynamik therm. Kraftwerk Wärmepumpe Wärmeleitung Chemie Brennstoffzelle Elektrolyse chemische Reaktion Theorie Thermodynamik Seite 3 Wärmespeicher Ein Körper nimmt beim Heizen Entropie auf und gibt sie beim Kühlen wieder an die Umgebung zurück. Weil die Temperatur während des Schmelz- oder Verdampfungsvorganges konstant bleibt, kann die Entropie eines Systems nicht als Funktion der Temperatur dargestellt werden. Nimmt man dagegen die umgekehrte Relation T(S), ist die Zuordnung eindeutig. Weil der Körper zusammen mit der Entropie auch noch Energie austauscht, stellt sich die Frage, wie aus der graphischen Darstellung der Funktion T(S), dem T-S-Diagramm, die thermisch ausgetauschte Energie zu bestimmen ist. Heizen Historisch bedingt hat man der Energie verschiedene Namen und Formelzeichen zugeordnet. Diese Einteilung soll nun kurz vorgestellt werden. Tauscht ein System mechanisch, also zusammen mit dem Impuls Energie aus, nennt man die Energie Arbeit und bezeichnet sie mit W. Wird die Energie von der Entropie über die Systemgrenze „getragen“, nennt man sie Wärme und schreibt dafür Q hin. Gemäss dieser Definition sind Arbeit und Wärme reine Austauschgrössen. In der Physik gibt es deshalb weder Wärme- noch Arbeitsspeicher. Wärme und Arbeit Die im Sytem gespeicherte Energie heisst innere Energie. Gemäss einer Erkenntnis Einsteins ist die Energie des Körpers gleich Masse mal Lichtgeschwindigkeit im Quadrat. Dieser Wert ist aber viel zu gross. Man setzt deshalb die innere Energie eines Systems bei einem bestimmten Zustand (Temperatur, Druck und Aggregatszustand) gleich Null. Da bei den einzelnen Prozessen nur die Veränderung interessiert, ist diese Normierung vertretbar. Die innerer Energie als Wärmeinhalt zu bezeichnen, ist eine weit verbreitete Unsitte. Diese Fehlbezeichnung führt zu einem Widerspruch, sobald ein System wahlweise Energie zusammen mit Entropie als Wärme oder zusammen mit dem Impuls als Arbeit abgeben kann. Innere Energie Ein Gas, das unter konstantem Druck erwärmt wird, nimmt die zugeführt Entropie vollständig auf, gibt aber einen Teil der mitgeführten Energie als Expansionsarbeit an die Umwelt zurück. Um die Bilanz zu vereinfachen, hat man als weitere Grösse die Enthalpie definiert. Die Enthalpie ist eine Energiegrösse, die so konstruiert ist, dass sie beim Heizen unter konstantem Druck die Änderung der inneren Energie sowie die Expansionsarbeit zusammenfasst. Deshalb ist beim Heizen unter konstantem Druck die zugeführte Wärme gleich der Änderung der Enthalpie. Das Wort Enthalpie heisst wörtlich übersetzt Wärmeinhalt, womit wir wieder bei der alten Unsitte angelangt sind. Für die Enthalpie schreibt man das Formelzeichen H. Enthalpie Wie hängt nun die Enthalpie eines Systems mit der Entropie zusammen? Dazu betrachten wir nochmals den Heizprozess und multiplizieren die Energie-Entropiestrom-Beziehung mit dem beliebig kleinen Zeitschritt dt (beliebig kleine Austauschgrössen werden mit einem d statt einem d markiert) Wärme-Entropie-Beziehung IW = T ◊ IS | ◊dt fi dQ = T ◊ dS Steht die Oberfläche eines Körper im thermischen Gleichgewicht mit dem Inhalt, ist die ausgetauschte Entropie gleich der Entropieänderung. Dann gilt der oben formulierte Zusammenhang auch für die Speichergrössen dQ = dH dQ = T ◊ dS = TdS also dS = dQ dH = T T Die zugeführte Wärme ist gleich der Entropieänderung mal die absolute Temperatur. Weil sich die Temperatur oft mit der Entropie ändert, ist nur die differentielle Beziehung mathematisch korrekt. Graphisch kann die Wärme als Flächenstück aus dem T-S-Diagramm herausgelesen werden T Heizen: dQ = dH = T·dS Kapazitivgesetze: dH = C·dT dS = (C/T)dT Hs= Ts·Ss Hv= Tv·Sv Schmelzenthalpie Verdampfungsenthalpie Q S Quasistatisches Heizen Wärme als Fläche unter dem T-S-Diagramm Theorie Thermodynamik Seite 4 Entropieproduktion Mechanische Systeme (Pendel, Sonnensystem, Klotz an einer Feder, Schwungrad an einer Drehfeder) kommen zur Ruhe, sobald eine Reibung vorhanden ist. Unter dem Einfluss der Reibung streben die Systeme gegen einen Endzustand. Solche Vorgänge nennt man irreversibel. Streng genommen sind alle natürliche Prozesse irreversibel. Wenn zwei Autos aufeinander prallen, ein Schwungrad abgebremst wird oder der eine Kondensator den andern teilweise auflädt, muss man von aussen einwirken, um den alten Zustand wieder herzustellen. irreversibel Reibungsbehaftete Systeme verlieren einen Teil ihrer frei verfügbaren Energie. Die Energie ist wohl noch vorhanden, steht aber für den fraglichen Vorgang nicht mehr zur Verfügung. Halbgebildete reden dann von der Umwandlung mechanischer oder elektrischer Energie in Wärme (mechanische, elektrische Energie oder Wärme sind Austauschformen und können nicht ineinander umgewandelt werden). Korrekterweise muss man bei irreversiblen Prozessen von Entropieproduktion sprechen. Entropieproduktion Im Motor einer Ständerbohrmaschine treibt der elektrische Strom einen Drehimpulsstrom an. Die vom elektrischen Strom freigesetzte Energie wird vom Drehimpuls aufgenommen. Liegen Motor und Bohrer nicht auf der gleichen Achse, lädt der Drehimpulsstrom die Energie im ersten Rad des Riementriebs auf den durch den Riemen fliessenden Impulsstrom um. Im zweiten Rad wird die Energie dann auf einen zweiten Drehimpulsstrom umgeladen. In der Schnittfläche zwischen Bohrer und Werkstück geht die Energie endgültig „verloren“. Bei Prozessketten wird Energie vom ersten Prozess freigesetzt und von einem zweiten aufgenommen. Prozessketten Umladeprozesse in einer Prozesskette verlaufen nie optimal. Der Sekundärprozess nimmt nur einen Teil der im Primärprozess freigesetzte Energie auf. Der Rest wird auf die neu entstandene Entropie umgeladen. Um die unerwünschte Entropie abzuleiten, weisen Elektromotoren sowie Generatoren Kühlschlitze auf, Brennsoffzellen müssen gekühlt werden. Wird die Enerige verlustfrei umgeladen, spricht von einem idealen oder reversiblen Prozess. Wird die im Primärprozess freigesetze Energie vollständig auf die produzierte Entropie umgeladen, liegt ein total irreversibler Prozess vor. Solche Prozesse laufen im Wasserfall, in einer hydraulischen oder pneumatischen Drosselstelle, im elektrischen Widerstand oder in einer Reibfläche ab. Bei der Wärmeleitung, dem Entropietransport durch einen Festkörper, eine Flüssigkeit oder ein Gas, wird mit der thermisch freigesetzen Energie ebenfalls Entropie erzeugt. Die Wärmeleitung ist auch ein total irreversibler Prozess. irreversibler Porzess Ein irreversibler Vorgang sieht in einem rückwärts laufenden Film unnatürlich aus. Dies hängt damit zusammen, dass bei allen rückwärts laufenden, irreversiblen Prozessen Entropie vernichtet werden müsste. So kann ein Auto der Umgebung keine Wärme entziehen, um sich in Bewegung zu setzen. Um die zum Impulspumpen benötigte Leistung freizukriegen, müsste die zugeführte Entropie fortlaufend vernichten werden. Die Entropieproduktion legt die Richtung, in die ein Prozess ablaufen muss, fest. Richtung der Zeit Die in einem Prozess freigesetzte Energie ist gleich Stärke des durchfliessenden Stromes dividiert durch die Potentialdifferenz (Fallhöhe) Prozessleistung Prozessleistung: P = (j1 - j 2 ) ◊ I Menge Der zusammen mit einer Menge durch eine Grenzfläche oder Systemoberfläche transportierte Energiestrom ist gleich Potential mal Stärke des Mengenstromes zugeordneter Energiestrom: IW = j ◊ I Menge Im stationären Prozess kann die dissipierte Leistung gleich der Stärke des wegfliessenden thermischen Energiestromes gesetzt werden stationärerProzess: stationärer irreversibler Prozess Pdiss = TI S In instationären Prozessen muss die produzierte Entropie nicht unmittelbar wegfliessen. Mit der Erkenntnis aus dem stationären Prozesslässt sich die Entropieproduktionsrate aber direkt berechnen Entropieproduktionsrate: zugeordneter Energiestrom PS = Pdiss T Ort der Produktion Entropieproduktionsrate Theorie Thermodynamik Seite 5 Energie in der Thermodynamik Die Energie eines Systems kann in einen äusseren und einen inneren Anteil zerlegt werden. Der äussere Anteil besteht aus Bewegungs- und Gravitationsenergie. Die innere Energie (U) hängt weder von der Lage noch von der Bewegung des Systems ab. Die innere Energie bildet die eigentliche Energie des Systems. Nach Einstein ist die innere Energie gleich der Masse mal das Quadrat der Lichtgeschwindigkeit. innere und äussere Energie Ein homogener Stoff kann Energie in Form von Arbeit, also zusammen mit dem Impuls, austauschen. Dazu muss er bei gegebenem Druck das Volumen ändern. Lässt man Verformung nur in eine Richtung zu, kann der Zusammenhang zwischen Arbeit, Druck und Volumenänderung recht einfach hergeleitet werden. Arbeit vx1 vx2 A P = (v x1 - vx 2 ) ◊ I px Ipx x | ◊dt dWumgesetzt = (dx1 - dx 2 )◊ I px dWumgesetzt = (dx1 - dx 2 )◊ p ◊ A = p◊ dV Ú Ú WStoff = - dWUmgesetzt = - p◊ dV Der homogene Stoff tauscht auch Energie in Form von Wärme (Q), also zusammen mit der Entropie aus IW = T ◊ I S Wärme | ◊dt dQ = T ◊ dS reversibel : dS = dS Ú Q = T ◊ dS Der homogene Stoff besitzt mindestens zwei Energiepforten. Eine für Arbeit und eine für Wärme. Häufig ist die eine Pforte direkt mit der Umwelt verbunden. Der zugehörige Energieaustausch ist dann weder mess- noch steuerbar. Wir nennen eine solche Pforte passiv. Die von uns beeinflussbare Energiepforte heisst dann aktive Pforte. Umwelt Umwelt Q W homogener Stoff p = konst. homogener Stoff T = konst. Heizt man ein System, das im Druckgleichgewicht mit der Umgebung ist, auf oder kühlt es ab, gilt für die Wärme Q = DU - W aktive und passive Pforte aus W = - p ◊ DV folgt Enthalpie Q = DU + p ◊ DV Nun definieren wir als neue Energiegrösse die Enthalpie (H). Bei isobarer Prozessführung ist die Wärme gleich der Enthalpieänderung H = U + p◊V falls p = konstant gilt Q = DH Tauscht ein System, das im Temperaturgleichgewicht mit der Umgebung steht, Energie in Form von Arbeit aus, gilt W = DU - Q aus Q = T ◊ DS folgt W = DU - T ◊ DS Nun definieren wir als weitere Energiegrösse die freie Energie (F). Bei isothermer Prozessführung ist die Arbeit gleich der Änderung der freien Energie F =U -T ◊S falls T = konstant gilt W = DF freie Energie Theorie Thermodynamik Seite 6 Isobares Heizen und Kühlen Heizt man einen Körper bei konstantem Druck auf, ist die zugeführte Wärme gleich der Änderung der Enthalpie. In der Regel durchläuft ein Stoff beim isobaren Heizne alle drei Aggregatszustände. In Tabellen sind die Enthalpieänderungen entweder auf ein Kilogramm Masse oder auf ein Mol Stoffmenge bezogen. Im ersten Fall spricht man von spezifischer im zweiten von molarer Enthalpieänderung. Formelzeichen für spezifische Grössen schreibt man klein, molare kennzeichnen wir mit einem “^“. Die spezifischen Schmelz- und Verdampfungsenthalpie nennt man oft auch spezifische Schmelz- und Verdampfungswärme. Ist der Druck zu gering, geht der Stoff vom festen direkt in den gasförmigen Zustand über. Diesen Prozess nennt man Sublimation. Die spezifische Enthalpie wirdfür einen ausgewählten Zustand (p0, T0) willkürlich gleich Null gesetzt. h spezifische Grössen h spez. Verdampfungsenthalpie r spez. Sublimationsenthalpie spez. Schmelzenthalpie q T Tsm T Tsb Tsd Bei vielen Stoffen nimmt die Enthalpie ungefähr proportional mit der Temperatur zu. In diesem Fall lohnt es sich, eine spezifische Enthalpiekapazität c einzuführen. Die Enthalpiekapazität heisst auch Wärmekapazität bei konstantem Druck. c= 1 dH ◊ m dT p = konstant Wärmekapazität DH = m ◊ c ◊ DT Setzt man die Enthalpie eines festen Körpers bei einer bestimmten Temperatur T0 gleich Null, kann die Enthalpie im gasförmigen Zustand näherungsweise wie folgt berechnet werden Enthalpie eines Gases H = m[c fest (Tsm - T0 ) + q + c flüssig (Tsd - Tsm ) + r + cgas (T - Tsd )] In Tabellenbüchern sind oft nur die energetischen Grössen wie spezifische Schmelz- und Verdampfungswärme sowie die zugehörige Wärmekapazität aufgeführt. Interessiert man sich für die Entropie, ist diese aus der Enthalpie abzuleiten Energiebilanz : dQ = dH Entropiebilanz : dS = dS Zuordnung : dQ = T ◊ dS entropische Grössen also : dH = T ◊ dS Die Entropieänderung ist demnach gleich der Enthalpieänderung dividiert durch die aktuelle Temperatur. Diese Division überträgt sich auf die Materialwerte qS = q Tsm rS = r Tsd cS = c T Falls die Enthalpie- oder Wärmekapazität wie oben angenommen unabhängig von der Temperatur ist, nimmt die spezifische Entropiekapazität cS mit steigender Temperatur ab; der warme Körper vermag weniger Entropie pro Temperaturänderung zu speichern als der kalte. Die totale Entropieänderung eines homogenen Stoffes, erhält man durch eine Summation über die Temperatur Ú DS = m cS ◊ dT = m T2 Ú T ◊ dT = m ◊ c ◊ ln( T ) T1 c T2 1 Verändert sich die Wärmekapazität mit der Temperatur, muss die Integration numerisch ausgeführt werden. Entropieänderung Theorie Thermodynamik Seite 7 Das ideale Gas Heizt man ein Gas (Stickstoff, Helium, Argon) von 0˚C bei konstant gehaltenem Volumen auf, erhöht sich der Druck pro Grad Celsius um den 273-ten Teil des Anfangswertes. Diese Beobachtung war einer der ersten Hinweise auf den absoluten Temperaturnullpunkt (-273.15˚C). Führt man die absolute Temperaturskala ein, lässt sich diese Beobachtung als einfaches Gesetz schreiben p p0 = T T0 V = konst. Gesetz von Amantons Verändert man das Volumen eines Gases und misst den Druck bei konstant gehaltener Temperatur, findet man das Boyle-Mariottesche Gesetz p ◊ V = p0 ◊ V0 T = konst. p◊V = f1 (V ) ◊ V T p◊V f (T ) = 2 T T p ◊ V = f2 ( T ) R = 8.3145 J mol ◊ K H = U + p◊V = U + n◊ R◊T DH = n ◊ cˆ p ◊ DT = n ◊ cˆV ◊ DT + n ◊ R ◊ DT V1 Ú V1 V2 Enthalpiekapazität also cˆ p = cˆV + R Lässt man mit Hilfe eines langsam hinausfahrenden Kolbens ein Gas expandieren, gibt dieses Energie in mechanischer Form an den Kolben ab. Um den Prozess isotherm zu führen, um also die Temperatur konstant zu halten, taucht man das Gas zusammen mit dem umhüllenden Zylinder in ein sogenanntes Wärmebad ein. Nun hängt die innere Energie des Gases nicht vom Volumen ab. Folglich führt das Wärmebad die gleiche Energie in Form von Wärme zu, wie über den Kolben in Form von Arbeit weggeht. Die Arbeit kann mit Hilfe der universellen Gasgleichung berechnet werden W = - p ◊ dV = n ◊ R ◊ T Enthalpie DH = DU + n ◊ R ◊ DT Die molare Enthalpiekapazität (molare Wärmekapazität bei konstantem Druck) ist demnach um die universelle Gaskonstante grösser ist als die molare Energiekapazität V2 Energiekapazität cˆV : molare Energiekapazität Aus der universellen Gasgleichung folgt die Temperaturabhängigkeit der Enthalpie Ú universelle Gasgleichung R : universelle Gaskonstante Die innere Energie eines Gases hängt bei grosser Verdünnung kaum vom Volumen ab. Zudem ist die Energiezunahme über grosse Bereiche proportional zur Temperaturerhöhung. In diesem Fall lohnt es sich, eine molare Energiekapazität (molare Wärmekapazität bei konstantem Volumen) einzuführen. Ist diese bekannt, berechnet sich die Änderung der inneren Energie wie folgt DU = n ◊ cˆV ◊ DT allgemeine Gasgleichung p ◊ V p0 ◊ V0 = T T0 Nach einer von Avogadro gefundenen Gesetzmässigkeit nimmt ein Mol eines gasförmigen Stoffes, unabhängig von seiner chemischen Beschaffenheit im Normzustand (1013.25 mbar und 273.15 K) immer das gleiche Volumen von 22.414 dm3 ein. Kombiniert man diese Beobachtung mit dem allgemeinen Gasgleichung, erhält man ein für alle stark verdünnten Stoffe gültiges Gesetz p◊V = n◊ R T Gestz von Boyle-Mariotte Gesetz von Boyle - Mariotte Um die Gesetze von Amantons und Boyle-Mariotte zu kombinieren, schreiben wir das erste als Funktion des Volumens und das zweite als Funktion der Temperatur. Multipliziert man das Gesetz von Amantons mit dem Volumen und dividiert das Gesetz von Boyle-Mariotte durch die absolute Temperatur, erhält meine eine Aussage, die weder vom Volumen noch von der Temperatur und schon gar nicht vom Druck abhängig sein kann p = f1 (V ) T Gesetz von Amantons isotherme Expansion dV V = n ◊ R ◊ T ◊ ln( 1 ) = -Q V V2 Die Energie, die das Gas bei der isothermen Expansion in mechanischer Form an den Kolben abgibt, entstammt vollständig dem Wärmebad. Das Gas selber hat seinen Energieinhalt nicht verändert. Diese Einsicht steht im Widerspruch zu unserer naiven Vorstellung von Arbeitsvermögen. UnsereVorstellung von Arbeitsvermögen steckt in der Definition der freien Energie. Die freie Energie des Gases nimmt mit der Expansion ab. Arbeitsvermögen Theorie Thermodynamik Seite 8 Prozesse des idealen Gases Das Modell des idealen Gases ist durch die universelle Gasgleichung sowie durch die Energiezuordnung U(T) vollständig beschrieben. Die erste Gleichung heisst thermische, die zweite kalorische Zustandsgleichung. Weil das Modell des idealen Gases absolute Homogenität voraussetzt, beschreibt es ausschliesslich Gleichgewichtszustände. In diesem Modell wird genausowenig Entropie produziert wie im Modell des starren Körpers. Alle Prozesse, die mit dem idealen Gas beschrieben werden, verlaufen prinzipiell reversibel, sind also ohne Verlust umkehrbar. Wir untersuchen nun vier ausgewählte Prozesse. Zustandsgleichung und reversible Prozesse Bei der isothermen Expansion wird Wärmeenergie vollständig in Arbeit umgewandelt. Die Entropie, welche mit der Energie thermisch zugeführt wird, lagert sich im expandierenden Gas ab. Die Entropieänderung kann mit Hilfe der Energiebilanz berechnet werden isotherme Expansion W = - n ◊ R ◊ T ◊ ln( V2 ) = -Q V1 DS = Saus = Q V = n ◊ R ◊ ln( 2 ) T V1 Je nach experimenteller Anordnung wird ein Gas isochor (V = konst.) oder isobar (p = konst.) erwärmt. Solange die Energie- und damit auch die Enthalpiekapazität konstant ist, gelten die weiter oben abgeleiteten Beziehungen DU = n ◊ cˆV ◊ DT DS = n ◊ cˆV ◊ ln( T2 ) T1 DH = n ◊ cˆ p ◊ DT DS = n ◊ cˆ p ◊ ln( T2 ) T1 Lässt man ein ideales Gas ohne thermischen Kontakt expandieren, bleibt die Entropie erhalten und die Arbeit ist gleich der Änderung der inneren Energie dW = dU mit dW = - p ◊ dV und dU = n ◊ cˆV ◊ dT - p ◊ dV = n ◊ cˆV ◊ dT mit p = - R dV dT = cˆV V T isochores und isobares Heizen isentrope Expansion n◊ R◊T V beidseits integrieren und Exponentialfunktion anwenden R Ê V1 ˆ cˆV T2 Á ˜ = T1 Ë V2 ¯ Der Zusammenhang zwischen Volumen und Temperatur kann direkt aus der Entropiebilanz abgeleitet werden. Bei der isentropen Expansion wandelt sich aktuelle (thermisch wirksame) in latente (thermisch nicht nachweisbare) Entropie um DS = DSaktuell + DSlatent = n ◊ cˆV ◊ ln( T2 V ) + n ◊ R ◊ ln( 2 ) = 0 T1 V1 Eliminiert man die Temperatur mit Hilfe der thermischen Zustandsgleichung, erhält man eine zweite Beschreibung der isentropen Expansion oder Kompression R Ê V1 ˆ cˆV T 2 p2 ◊ V2 = = Á ˜ T1 p1 ◊ V1 Ë V2 ¯ mit R + cˆV cˆ p = =k cˆV cˆV Ê V1 ˆ Á ˜ Ë V2 ¯ k T1 ◊ V1k -1 = T2 ◊ V2k -1 T1 Ê p1 ˆ =Á ˜ T2 Ë p2 ¯ T durch p ersetzen p = 2 p1 Die dimensionslose Zahl k (Kappa), die gleich dem Verhältnis der beiden Wärmekapazitäten (Enthalpie- zu Energiekapaziät) ist, heisst Isentropen- oder Adiabatenexponent. Die isentrope Zustandsänderung kann auf drei Arten formuliert werden p1 ◊ V1k = p2 ◊ V2k aktuelle und latente Wärme Isentropenexponent k -1 k Bei einatomigen Gasen ist die Energiekapazität gleich 1.5 R und bei zweiatomigen ungefähr gleich 2.5 R. Die zugehörigen Isentropenexponenten sind somit gleich 1.67 und 1.4. einatomige und zweiatomige Gase Theorie Thermodynamik Seite 9 reale Stoffe Das einatomige, ideale Gas ist das einfachste Modell. Es gibt das Verhalten von realen Stoffen bei grosser Verdünnung wieder. Das Modell wird durch die thermische (universelles Gasgesetz) und durch die kalorische Zustandsgleichung (U(T)) eindeutig beschrieben p◊V = n◊ R◊T DU = n ◊ cˆV ◊ DT cˆV = 3 R 2 Aus praktischen Gründen schreibt man die beiden Zustandsleichungen molar, d.h. man dividiert alle mengenartigen Grössen durch die Stoffmenge p ◊ vˆ = R ◊ T sˆ(vˆ, T ) = cˆV ◊ ln( T vˆ ) + R ◊ ln( ) T0 vˆ0 cˆV = sˆ( p, T ) = cˆ p ◊ ln( T p ) + R ◊ ln( ) T0 p0 V2 Ú V1 Druck statt Volumen cˆ p = cˆV + R Die thermische Zustandsgleichung kann entweder als 3D-Graphik oder mit Hilfe von Diagrammen (p-V- und p-T-Diagramm) dargestellt werden. Im p-V-Diagramm liefern die Isothermen und im p-TDiagramm die Isochoren die fehlende Information. Entsprechend lässt sich die Entropiefunktion als 3D-Schaubild oder mit Hilfe eines S-T- und eines S-p-Diagrammes Darstellen. Zur Analyse des Energieaustausches zieht man das p-V- und das T-S-Diagramm bei. Die Fläche unter dem ersten Diagramm entspricht der Arbeit und die Fläche unter dem zweiten der Wärme W = - p ◊ dV grundlegende Gleichungen 3 R 2 Weil in vielen Prozessen der Druck statt des Volumens konstant gehalten wird, schreiben wir mit Hilfe des universellen Gasgesetzes die Entropiefunktion um p ◊ vˆ = R ◊ T molare Schreibweise Duˆ = cˆV ◊ DT Aus systemdynamischer Sicht ist die innere Energie keine sehr aussagekräftige Grösse. Deshalb ersetzen wir die kalorische Zustandsgleichung durch die Entropiefunktion p ◊ vˆ = R ◊ T Modell des idealen Gases Diagramme S2 Q= Ú T ◊ dS S1 Nun haben wir das Rüstzeug, um homogene Stoffe zu beschreiben. Aus praktischen Gründen bezieht man die mengenartigen Grössen auf die Masse und nicht auf die Stoffmenge. Die zugehörigen Formelzeichen werden klein und ohne “^“ geschrieben. Der im Stoff herrschende Druck kann als Funktion der Temperatur und des spezifischen Volumens ausgedrückt werden. Bei Aggregatszustandsänderungen bleibenTemperatur und Druck konstant. Die graphische Darstellung der Funktion p(v,T) nennt man Zustandsfläche. Projiziert man die Zustandsfläche auf die p-T-Ebene, erscheinen die Gebiete, welche die Aggregatszustandsänderungen beschreiben als Linien. Die eine Linie, die Dampfdruckkurve beginnt im Tripelpunkt und endet im kritischen Punkt. Im Tripelpunkt können alle drei Phasen (fest, flüssig, gasförmig) koexistieren. Oberhalb des kritischen Punktes macht die Unterscheidung von gasförmig und flüssig keinen Sinn mehr, d.h. der Stoff lässt sich durch isotherme Kompression nicht mehr verflüssigen. Mit der Projektion auf die p-v-Ebene erhält man das Arbeitsdiagramm. Zustandsfläche Die spezifische Entropiefunktion s(T,p) liesse sich ebenfalls als Fläche im dreidimensionalen Raum darstellen. Man wählt stattdessen das T-s-Diagramm und stellt mit Hilfe von Isobaren die Zustände gleichen Drucks dar. T-s-Diagramm Die Zustandsfunktion p(v,T) und die Entropiefunktion s(T,p) beschreiben nur die Gleichgewichtszustände eines homogenen Stoffes. Entsprechend verlaufen alle Prozesse, die mit diesen Funktionen beschrieben werden, reversibel. Entropie wird dabei keine produziert. Prozesse, die nicht allzuweit vom thermischen Gleichgewicht weg sind, lassen sich in guter Näherung im T-s-Diagramm darstellen. Nur muss deklariert werden, welcher Teil der Entropieänderung durch Austausch und welcher durch Produktion verursacht worden ist. reversible und irreversibel Prozesse Die h(p,T)-Funktion ist gut messbar und die u(v,T)-Funktion kann teilweise aus mikroskopischen Modellen abgeleitet werden. Zur Ermittlung der zugehörigen s(p.T)-Funktion zieht man am besten eine Datenbank bei. Innere Energie, Enthalpie und Entropie Theorie Thermodynamik Seite 10 Wärmetransport Die von einem elektrischen Strom im Widerstand freigesetzte Leistung dient der Entropieproduktion. Nimmt man an, dass die gesamte Leistung das Widerstandselement bei der aktuellen Temperatur T als Wärme verlässt, folgt aus den Bilanzgleichungen und der Energiezuordnung Energiebilanz : Pdiss + IW , therm = 0 Zuordnung : Entropiebilanz : IS + P S = 0 Produktionsrate : P S = Widerstand und Entropieproduktion IW , therm = T ◊ IS Pdiss T Bei der Wärmeleitung setzt der „thermisch herunterfallende“ Entropiestrom ebenfalls eine Prozessleistung frei. Die dabei produzierte Entropie vergrössert den primären Entropiestrom. Rein mathematisch kann man den thermischen Prozess analog zum elektrischen behandeln. Dies macht oft wenig Sinn, weil viele Aussagen zur Wärmeleitung ohne Entropiebetrachtung gemacht werden können. Entropie und Wärmeleitung In der Wärmelehre, der Thermodynamik der irreversibelen Prozesse, nimmt man die Energie statt der Entropie als Grundgrösse. Die Temperaturdifferenz betrachtet man aber weiterhin als Antrieb oder Ursache für die Wärmeleitung. Der thermischen Widerstand liesse sich wie in der Elektrizitätslehre als Verhältnis von Antrieb und Energiestromstärke definieren. Aus praktischen Gründen bildet man den Leitwert, den Reziprokwert zum Widerstand Antrieb und Widerstand GW = IW DT Aus der Definition des Leitwertes folgt die Vorschrift für Parallel- und Serieschaltung. Bei der Parallelschaltung addieren sich die einzelnen Ströme bei gleicher Temperaturdifferenz. Folglich sind die einzelnen Leitwerte zum Gesamtleitwert zu addieren. Bei der Serieschaltung müssen die Reziprokwerte der einzelnen Leitwerte zum Reziprokwert des Gesamtleitwertes aufaddiert werden parallel : GW = ÂG Wi 1 = GW seriell : i ÂG 1 i Wi Im Festkörper fliesst die Wärme immer in Richtung des grössten Temperaturgefälles. Die Energiestromdichte (Energiestromstärke pro Querschnitt) ist proportional zum Temperaturgradienten (Temperaturunterschied pro Länge). Der Proportionalitätsfaktor hängt vom Material ab und heisst Wärmeleitungskoeffizient l. Summiert man diesen lokalen Zusammenhang über den ganzen Querschnitt und über die Fliessstrecke des Stromes erhält man je nach Geometrie eine andere Formel Strom durch konstanten Querschnitt A : Strom radial durch Zylindermantel : Strom radial durch Hüllkugel : A l 2 ◊p ◊ h GW = l ◊ ln(ra ri ) GW = l ◊ p ◊ ra ◊ ri ra - ri Wärmeübergang GW = a ◊ A Tritt die Wärme durch eine Mauer, ein Fenster oder das Dach, müssen die Teilleitwerte für die Übergänge sowie die Leitung reziprok addiert werden. Wird der Gesamtleitwert durch den zugehörigen Querschnitt dividiert, erhält man eine Vergleichszahl, den Wärmedurchgangskoeffizienten k Wärmedurchgangskoeffizient : Wärmeleitung GW = l ◊ An der Grenzschicht zwischen Festkörper und Flüssigkeit oder Gas wird Wärme konvektiv zu- oder abgeführt. Zudem koppelt die Oberfläche des Festkörpers strahlungsartig an die weitere Umgebung. Um all diese Einflüsse abzuschätzen, macht man einen einfachen Ansatz. Demnach ist die Wärmestromdichte proportional zum Temperaturgefälle von Festkörper zur Flüssigkeit oder zum Gas. Der Proportionalitätsfaktor heisst Wärmeübergangskoeffizient a. Summiert man über den ganzen Querschnitt, folgt für den Wärmeleitwert Wärmeübergang : Serie- und Parallelschaltung k= GW .tot A Falls sich der Querschnitt längs des Stromes nicht ändert, kann der Durchgangskoeffizient direkt aus den Übergangskoeffizienten, den Leitungskoeffizienten und den Dicken berechnet werden. Wärmedurchgang Theorie Thermodynamik Seite 11 Strahlung im Hohlraum Der leere Raum ist nie ganz leer. Ein Hohlraum im Innern eines Körpers enthält immer ein elektromagnetisches Strahlungsfeld. Dieses Strahlungsfeld ist isotrop und homogen, falls der umgebende Körper überall die gleiche Temperatur aufweist. Die Energiedichte des Strahlungsfeldes hängt nur von der Temperatur und nicht vom Material oder der Beschaffenheit der umgebenden Wände ab. Aus der Theorie des elektromagnetischen Feldes folgt, dass bei einem isotropen Strahlungsfeld der Druck gleich einem Drittel der Energiedichte ist. Der Strahlungsdruck im Innern eines Hohlraumes ist damit eine reine Funktion der Wandtemperatur. Strahlung im Hohlraum Über die freie Oberfläche einer Flüssigkeit tritt ein Teil der Stoffmenge in den gasförmigen Zustand über. Gasförmige Stoffe, die bei gleicher Temperatur auch flüssig oder fest sein können, heissen Dämpfe. Im Gleichgewichtszustand hängt die Dichte des Dampfes nur von der Temperatur ab. Dämpfe im Gleichgewichtszustand nennt man gesättigt. Der zugehörige Druck, der sogenannte Dampfdruck, ist ebenfalls eine reine Funktion der Temperatur. Der Graph dieser Funktion ist die weiter vorne erwähnte Dampfdruckkurve. Hohlraumstrahlung und gesättigte Dämpfe haben eines gemein: im thermodynamischen Gleichgewicht hängen Druck und Energiedichte nur von der herrschenden Temperatur ab. gesättigter Dampf Nun verwenden wir den gesättigten Dampf als Medium in einem Kreisprozess. Im ersten Teilprozess wird dem Flüssigkeits-Dampf-Gemisch isotherm ein bestimmte Entropiemenge S zugeführt. Im dritten Teilprozess entziehen man dem Flüssigkeits-Dampf-Gemisch bei einer tieferen Temperatur die gleiche Menge Entropie wieder. In den beiden andern Teilprozessen wird der Stoff isentrop expandiert bzw. isentrop komprimiert. Je näher die Temperaturen der beiden isothermen Prozesse beieinander liegen, desto weniger fallen die isentropen Prozesse ins Gewicht. Ist der Temperaturunterschied beliebig klein, kann die Volumenänderung bei den isentropen Vorgängen vernachlässigt werden. Für die zu- und die abgeführte Wärme sowie die Nettoarbeit gelten dann die folgenden Beziehungen Kreisprozess mit Dampf Q1 = DH1 = S ◊ (T + dT ) Q2 = DH2 = - S ◊ T WNetto = DV ◊ dp Die Nettoarbeit entspricht der thermisch umgesetzten Energie, d.h. der von der Entropie S beim Hinunterfallen um dT freigesetzten Energie. Nun leiten wir eine Gleichung für p(T) ab W frei Q2 = S ◊ dT W Netto DV ◊ dp V = = ª dp S ◊T | H2 | | DH 2 | DH1 dT V = dp T DH Ist die Dichte des Dampfes klein verglichen mit der Dichte der Flüssigkeit, darf der Dampf als ideales Gas behandelt werden. dT dp R ◊ T dp =V = T | DH | n ◊ p n ◊ rˆ oder dp rˆ dT = ◊ p R T2 Clausius-Clapeyron also p(T ) = p0e Verdünnte Dämpfe rˆ Ê 1 1 ˆ Á - ˜ R Ë T0 T ¯ Im Falle der Hohlraumstrahlung kann die innere Energie durch den oben erwähnten Zusammenhang von Energiedichte und Druck geschrieben werden. Für die Enthalpe gilt dann Energiedichte im Strahlungsfeld dT DV ◊ dp dp = = T | DH | 4p H = U + p ◊ V = rW ◊ V + p ◊ V = 4 p ◊ V Die Integration der Gleichung von Clausius-Clapeyron liefert den Zusammenhang zwischen Druck und Temperatur bzw. zwischen Energiedichte und Temperatur. Der fehlende Faktor a ist im Jahre 1900 von Max Planck mit Hilfe einer damals revolutionären Hypothese berechnet worden p = Konstante ◊ T 4 3 p = rW = a ◊ T 4 mit a = 7.56 ◊ 10-16 J 3 m ◊K4 Beim isochoren Heizen des Hohlraumes kann die Entropieänderung mit der Energieänderung in Beziehung gebracht werden. Eine Integration über die Temperatur liefert den Entropieinhalt des Hohlraumes dS = dS = dQ dU V ◊ drW = = = V ◊ 4 a ◊ T 2 ◊ dT T T T S= Ú dS =Ú 4 a ◊ V ◊T 2 ◊ dT = 4a V ◊T 3 3 Entropie der Strahlung Theorie Thermodynamik Seite 12 Wärmestrahlung Die Strahlung im Hohlraum eines Körpers hängt nur von der Temperatur der Wände ab. Weist der Hohlraum ein Loch auf, tritt Wärmestrahlung mit Lichtgeschwindigkeit aus. Die Strahlung normal zur Oberfläche ist am intensivsten. Seitlich dazu nimmt sie ab. Strahlung aus dem Hohlraum Um die Stärke des austretenden Energiestromes zu berechnen muss man zuerst die Intensität (Strahlungsleistung pro Fläche und Raumwinkel) im Innern des Hohlraumes kennen. Dank der Isotropie ist die Intensität dort richtungsunabhängig. Ihr Wert ist gleich der Energiedichte mal die Lichtgeschwindigkeit dividiert durch den vollen Raumwinkel (4p). Integriert man an der Oberfläche über den Halbraum und über die Querschnittsfläche des Loches, erhält man für die austretenden Energiestromstärke Strahlungsleistung IW = s ◊ A ◊ T 4 mit s = a◊c W = 5.67 ◊ 10 -8 2 4 4 m K Die Grösse s heisst Stefan-Boltzmann-Konstante. Sie legt fest, wie stark ein Hohlraum bei gegebener Temperatur Energie abstrahlt. Die Umgebung strahlt in den Hohlraum zurück. Weist die ganzen Umgebung die gleiche Temperatur auf, strahlt diese wie ein zweiter Hohlraum in den ersten hinein. Der netto durch das Loch hindurchtretende Energiestrom entspricht deshalb der Differenz von zwei Abstahlungen. Rückstrahlung Max Planck berechnete mit Hilfe seiner Hypothese von der Quantisierung (Stückelung) der Hohlraumstrahlung nicht nur die Stefan-Boltzmann-Konstante. Er konnte auch noch zeigen, wie sich die Energie auf die verschiedenen Frequenzen der elektromagnetischen Strahlung verteilt. Planck hat damit eine Beobachtung von Wilhelm Wien, wonach sich das Maximum in der spektralen (frequenzbezogenen) Energieverteilung bei steigender Temperatur zu kürzeren Wellenlängen verschiebt, bestätigt. Spektrale Verteilung In der Regel wird die Wärmestrahlung von der Oberflächenschicht eines materiellen Körpers abgegeben. Solche Oberflächen geben wie der Hohlraum entsprechend ihrer Temperatur Energie und Entropie ab. Dass sich die von einer Oberfläche abgegebene Strahlung entsprechendMaterial und Beschaffenheit von der Hohlraumstrahlung unterscheidet, ist nachvollziehbar. Dass diese Strahlung in jedem Frequenzintervall höchstens gleich stark wie die Strahlung eines gleich warmen Hohlraumes sein kann, erkennt man erst nach dem folgenden Gedankenexperiment. Körperstrahlung Ein absolut wärmeisolierter Behälter ist durch ein Interferenzfilter in zwei Räume unterteilt. Das Interferenzfilter lässt nur Strahlung mit wohldefinierter Wellenlänge durch. Der eine Raum wird vom zu untersuchenden Körper ausgefüllt, im andern Teil hat sich eine Hohlraumstrahlung aufgebaut. Zu Beginn sind beide Teilräume gleich warm. Würde der Körper nun mehr Strahlung absorbieren als emittieren, würde er sich auf Kosten des andern Teiles erwärmen. Im umgekehrten Fall würde er sich abkühlen. Da beides nicht möglich ist, emittiert der fragliche Körper in jedem Frequenzintervall den gleichen Prozentsatz der Hohlraumstrahlung wie er absorbiert Kirchhoffsche Strahlungsgesetz adiabatische Hülle Interferenzfilter Körper Hohlraum Das Kirchhoffsche Strahlungsgesetz, wonach ein schlechter Absorber auch ein schlechter Emitter ist, gilt nur für die gleich Wellenlänge oder Frequenz. Emittiert ein Körper über grosse Frequenzbereiche einen festen Prozentsatz der Hohlraumsrahlung, nennt man ihn grau. Der Prozentsatz wird oft in Form einer Emissionszahl e angegeben. Für graue, konvexe Körper gilt ein einfaches Abstrahlungsgesetz 4 ) IW , netto = e ◊ s ◊ A(T 4 - TUmgebung e : Emissionszahl graue Körper