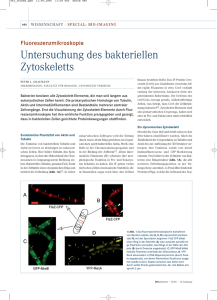
Entwicklung eines Verfahrens zum biologischen Pflan - bio-ferm
Werbung

Abschlussbericht Zum Forschungsvorhaben Gesellschaft für Anwendungen biologischer Verfahren mbH Entwicklung eines Verfahrens zum biologischen Pflanzenschutz durch den Einsatz bakterieller Antagonisten gegen Bakteriosen im Pflanzenbau Autoren des Berichts: Dr. Stefan Kunz (Bio-System GmbH, Konstanz) Dr. Peter Laux (BBA, Inst. für biol. Pflanzenschutz, Darmstadt) Auftragnehmer: Bio-System GmbH Auftraggeber: Bundesministerium für Bildung, Forschung und Wissenschaft Förderkennzeichen: 0311785 Laufzeit des Vorhabens: 01. April 1998 bis 30. Juni 2001 Berichtszeitraum: 01. April 1998 bis 30. Juni 2001 Projektleiter: Dr. Stefan Kunz ( ab 01.04.1999) Dr. Friedhelm Berger (01.04.1998-31.03.1999) Mitarbeiter/innen: Prof. Dr. Eckart Frehland Dipl. Biol. Michael Schuster Dipl. Ing. Gudrun Mögel Dipl. Biol. Clas Busack Dipl. Biol. Thomas Reinberg Inken Martens Kristina Hofer Abschlussbericht zum Projekt 0311785 Inhalt 1. AUFGABENSTELLUNG..........................................................................................................................4 2. VORAUSSETZUNGEN UNTER DENEN DAS PROJEKT DURCHGEFÜHRT WURDE ..............5 3. WISSENSCHAFTLICHER UND TECHNISCHER STAND, AN DEN ANGEKNÜPFT WURDE .6 4. ZUSAMMENARBEIT MIT ANDEREN STELLEN..............................................................................7 5. DARSTELLUNG DER ERZIELTEN ERGEBNISSE ...........................................................................8 5.1 AUSWAHL GEEIGNETER MIKROORGANISMEN ...........................................................................................8 5.2 ENTWICKLUNG VON PRODUKTIONSVERFAHREN .......................................................................................9 5.2.1 Bacillus subtilis .............................................................................................................................11 5.2.2 Rahnella aquatilis .........................................................................................................................13 5.2.3 Aureobasidium pullulans ..............................................................................................................13 5.2.4 Sporobolomyces roseus.................................................................................................................14 5.3 LAGERFÄHIGKEIT DER MIKROORGANISMEN ...........................................................................................14 5.3.1 Bacillus subtilis BD170.................................................................................................................15 5.3.2 Rahnella aquatilis 39 ....................................................................................................................17 5.3.3 Aureobasidium pullulans CF40 ....................................................................................................18 5.4 EINSATZ DER MIKROORGANISMEN GEGEN DEN FEUERBRANDERREGER ..................................................18 5.4.1 Aufbau eines in vivo Testsystems ..................................................................................................19 5.4.1.1 Wirkung verschiedener Mikroorganismen ...........................................................................................20 5.4.1.2 Einfluss der Formulierung auf die Wirkung .........................................................................................21 5.4.1.3 Einfluss der Anwendungskonzentration auf die Wirkung ....................................................................22 5.4.1.4 Einfluss des Einsatzzeitpunktes auf die Wirkung.................................................................................23 5.4.2 Wirkung der Mikroorganismen im Freiland .................................................................................25 5.4.2.1 Freilandversuche mit künstlicher Inokulation ......................................................................................25 5.4.2.2 Kombinationsverfahren ........................................................................................................................27 5.4.2.3 Freilandversuche unter natürlichen Infektionsbedingungen .................................................................28 5.4.2.4 Wirkung auf im Freilandversuch entnommenen Apfelblüten...............................................................29 5.5 MISCHBARKEIT MIT PFLANZENSCHUTZMITTELN UND WACHSTUMSREGULATOREN ................................30 5.6 WIRKUNGSMECHANISMEN DER MIKROORGANISMEN..............................................................................32 5.6.1 Bildung antibiotischer Substanzen durch die Mikroorganismen .................................................32 5.6.1.1 Agardiffusionstest ................................................................................................................................32 5.6.1.2 Extraktion von Überstand und Zellsubstanz mit organischen Lösungsmitteln .....................................33 5.6.1.3 Wachstum von E. amylovora 7/74 in Kulturfiltraten antagonistischer Stämme ...................................34 5.6.3 Nährstoffkonkurrenz......................................................................................................................35 2 Abschlussbericht zum Projekt 0311785 5.6.3 6. Resistenzinduktion.........................................................................................................................36 DARSTELLUNG DER VERWERTBARKEIT DER ERGEBNISSE ................................................40 6.1 PRODUKTIONSVERFAHREN .....................................................................................................................40 6.2 UNTERSUCHUNGEN ZUR FEUERBRANDBEKÄMPFUNG .............................................................................41 7. DARSTELLUNG DER WÄHREND DER DURCHFÜHRUNG VON DRITTER SEITE BEKANNT GEWORDENEN ERGEBNISSE .......................................................................................42 8. VERÖFFENTLICHUNGEN...................................................................................................................43 9. LITERATUR ............................................................................................................................................44 3 Abschlussbericht zum Projekt 0311785 1. Aufgabenstellung Pflanzen werden in allen Entwicklungsstadien oberflächlich von einer Vielzahl von Bakterien besiedelt. Besonders bei feuchten Bedingungen können diese epiphytisch lebenden Organismen leicht durch Spaltöffnungen, Hydathoden, Lenticellen oder Wunden in das Pflanzengewebe eindringen. Während sich bei kompatiblen Interaktionen eindringende Bakterien in den Intercellularen der Pflanze vermehren, ausbreiten und Symptome bilden, werden die Bakterien bei inkompatiblen Interaktionen durch pflanzliche Abwehrmechanismen inaktiviert. Weltweit sind ca. 400 bakteriell bedingte Pflanzenkrankheiten mit zum Teil erheblicher wirtschaftlicher Bedeutung bekannt (Kleinhempel et al., 1989). Viele Mikroorganismen besiedeln Pflanzen epiphytisch, ohne dabei Schäden zu verursachen. Im biologischen Pflanzenschutz wird versucht, durch eine gezielte Ansiedlung epiphytischer Mikroorganismen die Ansiedlung und Vermehrung phytopathogener Bakterien auf der Pflanzenoberfläche zu reduzieren, und dadurch deren Eindringen und die Infektion der Pflanze zu verhindern. Mehrere Forschungsarbeiten zeigen, dass die Ansiedlung von antagonistischen Bakterien auf den Narben von Apfel- und Birnblüten die Vermehrung des Feuerbranderregers Erwinia amylovora unterdrückt, und dadurch der Befall reduziert wird (Johnson und Stockwell, 1998; Pusey, 1997). Aufbauend auf diesen Ergebnissen sollte im Rahmen dieses Forschungsvorhabens ein biologisches Präparat mit pflanzenstärkender Wirkung gegen schwer bekämpfbare Bakteriosen im Obstbau entwickelt und zur Marktreife geführt werden. Der Schwerpunkt der Forschung lag auf der Bekämpfung des Feuerbranderregers (Erwinia amylovora) mit Mikroorganismen. Dazu mussten geeignete Stämme selektiert und charakterisiert werden, für die dann ein biologisch und ökonomisch günstiges Produktionsverfahren entwickelt werden sollte. Für ein kommerziell nutzbares Präparat musste eine geeignete Formulierung gefunden werden. Die Formulierungsstoffe dürfen keinen negativen Einfluss auf die Wirkung des Präparates haben und müssen die Lagerfähigkeit und die Handhabung des Präparates verbessern. Der Aufbau eines in vivo Testsystems, bei dem Obstbaumblüten auch außerhalb der Blühperiode für Versuche zur Verfügung standen, erlaubte die Untersuchung der Wirksamkeit verschiedener Mikroorganismen und Formulierungen und auch eine Optimierung der Anwendungskonzentration. Zum Nachweis der Wirksamkeit mussten mit den Präparaten Freilandversuche unter natürlichen und künstlichen Infektionsbedingungen durchgeführt werden. Untersuchungen 4 Abschlussbericht zum Projekt 0311785 zum Wirkungsmechanismus der eingesetzten Mikroorganismen sollten Rückschlüsse auf den richtigen Applikationstermin geben. Um die Aktzeptanz der Präparate zu erhöhen, wurden Daten zur Mischbarkeit mit handelsüblichen Fungiziden, Insektiziden und Wachstumsregulatoren erarbeitet. 2. Voraussetzungen unter denen das Projekt durchgeführt wurde Die Firma Bio-System GmbH arbeitet zusammen mit der Tochterfirma Bi-Utec GmbH an der Entwicklung von mikrobiologischen Verfahren in der Abfallentsorgung und Abwasserreinigung. Der Einsatz von Mikroorganismen im biologischen Pflanzenschutz sollte als weiterer Geschäftszweig etabliert werden. Die Erfahrung beider Unternehmen in der Produktion und in der Handhabung von Mikroorganismen sollte in dieses Projekt einfließen. Die Forschungsarbeiten konzentrierten sich hauptsächlich auf die Bekämpfung des Feuerbranderregers Erwinia amylovora. Hier konnte auf die Erfahrung aus über zehnjähriger Forschung am Institut für biologischen Pflanzenschutz der BBA zurückgegriffen werden. Außerdem war durch den Standort der Firma Bio-System im Bodenseegebiet, welches selbst vom Feuerbrand betroffen ist, und durch die Kontakte zu Obstbauern und den amtlichen und privaten Beratern ein ständiger Austausch mit der Praxis gewährleistet. Die Nähe zur Schweiz, in der sich der Feuerbrand in den letzten Jahren sehr stark ausbreitete, entpuppte sich als weiterer Vorteil. Da auch dort dringend nach Bekämpfungsmöglichkeiten gesucht wird, konnten weitere Partner für die Durchführung von Freilandversuchen gewonnen werden. Der Feuerbrand zählt zu den gefährlichsten Krankheiten im Obstbau. Unter günstigen Befallsbedingungen können ganze Obstanlagen innerhalb eines Jahres absterben. Das Bakterium E. amylovora wurde in Nordamerika bereits 1878 als Verursacher des Feuerbrandes identifiziert. In Europa trat diese Krankheit erstmals 1957, in Deutschland 1971 auf. Mit den daraufhin erlassenen Quarantänemaßnahmen konnte eine weitere Ausbreitung des Erregers nicht verhindert werden, so dass er seit Anfang der 1990er Jahre alle Obstbaugebiete in Deutschland erreicht hatte. Bis im Jahr 2000 waren auch alle Anbaugebiete der Schweiz betroffen. Der Befall breitete sich innerhalb der Anbaugebiete weiter aus, so dass vor allem im Streuobst auch schon eine umfangreiche Rodung nötig war. Als mögliche Bekämpfungsmaßnahmen werden der Einsatz von Antibiotika, Gesteinsmehlpräparaten, Pflanzenaktivatoren, Pflanzenextrakten oder bakterieller Antagonisten diskutiert (Backhaus und Klingauf, 1998). Von den Obstbauverbänden und von den Pflanzenschutzdiensten der Länder wird seit Jahren die Zulassung von Plantomycin gefordert. 5 Abschlussbericht zum Projekt 0311785 Plantomycin enthält den Wirkstoff Streptomycin, der als Antibiotikum auch in der Humanmedizin eingesetzt wird. In den USA, Kanada und in Israel, wo dieser Wirkstoff in großem Umfang angewendet wurde, hat der Feuerbranderreger Resistenzen entwickelt (Johnson und Stockwell, 1998; Manulis et al., 1998; Sholberg et al., 2001). Obwohl in Deutschland bisher keine resistenten Erreger aus dem Freiland isoliert werden konnten (Moltmann, 1999), darf diese Gefahr nicht vernachlässigt werden. Zusätzlich warnen Ökologen und Mediziner davor, dass bei großflächigem Streptomycineinsatz in der Landwirtschaft auch viele Nicht-Zielorganismen dem Selektionsdruck ausgesetzt werden, und sich die Streptomycinresistenz in vielen Bakterien bis hin zu Humanpathogenen ausbreiten könnte. Aufgrund dieser ständigen Diskussion zwischen Befürwortern und Gegnern eines Streptomycineinsatzes herrschte in den letzten sieben Jahren eine unklare Zulassungssituation für Plantomycin. So wurde in den Jahren 1994-1998 jeweils kurzfristig vor Saisonbeginn eine Zulassung per Sonderverfügung der BBA erteilt. 1999 war Plantomycin nicht zugelassen. Im Jahr 2000 wurde dann eine Zulassung für Streptomycin erteilt, die aber seit März 2001 ausgesetzt ist, da Rückstände des Wirkstoffes in Honigen gefunden wurde. Diese auch für die Obstbauern unbefriedigende Situation führte dazu, dass die Suche nach möglichen Alternativen von vielen Seiten unterstützt wurde und das Interesse von Pflanzenschutzdiensten, Obstbauern und Politikern an den Forschungsarbeiten groß war. Die unklare Zulassungssituation beim Plantomycin führte aber auch dazu, dass eine wirtschaftliche Kalkulation für den Aufbau einer Produktion eines alternativen Präparates und für dessen Vertrieb bisher nicht möglich war, da der Markterfolg sehr stark von der Verfügbarkeit von Plantomycin abhängig sein wird. 3. Wissenschaftlicher und technischer Stand, an den angeknüpft wurde Am Institut für biologischen Pflanzenschutz der BBA in Darmstadt beschäftigt man sich seit Ende der 1980er Jahren mit der Suche nach bakteriellen Antagonisten zum Einsatz gegen den Feuerbrand. Mikroorganismen mit vielversprechender Wirkung wurden isoliert, charakterisiert und auf Ihre Wirkung gegen den Feuerbranderreger mit verschiedenen Methoden getestet (Wolf, 1994). Aufbauend auf diesen Ergebnissen sollte ein marktfähiges Präparat zum Einsatz gegen den Feuerbrand im Obstbau entwickelt werden. Die in den Vorversuchen am Institut für biologischen Pflanzenschutz verwendeten Bakterienstämme wurden für die jeweiligen Versuche frisch angezogen. Die so gefundenen Wirkungen in vitro und in vivo zeigen das Potenzial, das diese Mikroorganismen bei der 6 Abschlussbericht zum Projekt 0311785 Bekämpfung des Feuerbranderregers haben (Wolf, 1994). Ein ökonomisch günstiges Produktionsverfahren musste gefunden werden, welches die großtechnische Produktion der Mikroorganismen erlaubt, aber keinen negativen Einfluss auf deren Wirksamkeit hat. Ebenso verhält es sich mit Formulierungsstoffen, die dem Präparat zur Verbesserung der Lagerfähigkeit und des Handlings zugegeben werden müssen. Ansätze zur Formulierung von Mikroorganismen zum Einsatz gegen Feuerbrand konnten aus amerikanischen Forschungsarbeiten abgeleitet werden (Johnson et al., 1993). Johnson und Mitarbeiter (1993) setzten den Bakteriensuspensionen Milchpulver zu und gewannen durch Lyophilisierung ein Bakterienpulver, das von Bienen ausgetragen wurde oder in Wasser gelöst gespritzt werden konnte. Der Stamm A506 (Pseudomonas flourescens) ist in den USA in dem kommerziellen Präparat Blight Ban A506 enthalten, C9-1S (Erwinia herbicola) wird in den USA hinsichtlich seiner Eignung zur Feuerbrandbekämpfung getestet. Beide Stämme haben eine Antibiotikaresistenz, was eine Genehmigung in Deutschland erschweren würde. Allerdings konnten aus den Erfahrungen mit diesen Antagonistenstämmen in den USA wertvolle Anhaltspunkte für die Entwicklung eines Präparates gewonnen werden. So konnte für A506 und C9-1S gezeigt werden, daß sich gefriergetrocknete Bakterien im Freiland auf Apfel– und Birnenblüten besser etablieren als frisch angezogene Bakterien (Stockwell et al., 1998). Da getrocknete Bakterien auch besser zu lagern und zu handhaben sind, war es naheliegend ein Präparat auf der Basis von getrockneten Mikroorganismen anzustreben. Weitere Versuchsergebnisse zeigen, daß ausgebrachte Mikroorganismen sich in Abhängigkeit von der Witterung in der Obstanlage über mehrere Reihen ausbreiten (Nuclo et al., 1998). Das Verteilen der Mikroorganismen durch Insekten wird beim kommerziellen Einsatz helfen, einen gleichmäßigen Besatz der Blüten zu bekommen. Selbst Blüten, die bei der Applikation noch nicht geöffnet sind, können durch die Insekten später noch mit Mikroorganismen besetzt werden. Dadurch kann man im Vergleich zu Antibiotika eventuell die Anzahl der Behandlungen reduzieren. 4. Zusammenarbeit mit anderen Stellen Das Projekt wurde in Zusammenarbeit mit dem Institut für biologischen Pflanzenschutz der BBA in Darmstadt durchgeführt. Dadurch konnte auf die dort bereits im Vorfeld getesteten Stämme zurückgegriffen werden. Die bereits vorhandenen Ergebnisse zur Wirkung der Mikroorganismen dienten als Anhaltspunkt bei der Auswahl des Produktionsstammes. Zusätzlich wurden am Institut für biologischen Pflanzenschutz Versuche zum Wirkungs7 Abschlussbericht zum Projekt 0311785 mechanismus der Isolate und zur Wirksamkeit der Stämme und der Präparate unter künstlichen und natürlichen Infektionsbedingungen durchgeführt. Weitere Versuche unter künstlichen oder natürlichen Infektionsbedingungen wurden von den Pflanzenschutzdiensten der Länder Baden-Württemberg und Rheinland Pfalz, der Fachhochschule Weihenstephan (Versuchsstation Schlachters) sowie von der eidgenössischen Versuchsanstalt Wädenswil und den kantonalen Pflanzenschutzdiensten der Schweiz durchgeführt. Den Versuchsanstellern wurden die Präparate zur Verfügung gestellt. Die Rückmeldungen ergaben wichtige Anhaltspunkte für die weitere Entwicklung der Präparate. Eine Kooperation mit der Universität Konstanz führte zum Aufbau eines in vivo Testsystems. In den Gewächshäusern der Universität konnten Apfelblüten auch außerhalb der Blühsaison gewonnen werden, an denen die Wirksamkeit verschiedener Mikroorganismen und verschiedener Formulierungen getestet wurden. Für die Produktion der Mikroorganismen wurde mit der Firma Bi-Utec GmbH und mit dem Interuniversitären Forschungsinstitut für Agrarbiotechnologie in Tulln (IFA) zusammengearbeitet. Bei Bi-Utec steht für die Produktion eines mikrobiellen Rohrreinigungsmittels eine kleine Produktionseinheit (Volumen: 10l). Diese konnte für die Anzucht der Mikroorganismen für Freilandversuche genutzt werden. Das Scale-up des Produktionsverfahrens in den technischen Maßstab und die Pilotproduktion wurde am IFA durchgeführt. 5. Darstellung der erzielten Ergebnisse 5.1 Auswahl geeigneter Mikroorganismen Vom Institut für biologischen Pflanzenschutz der BBA wurden drei Isolate zur Verfügung gestellt, die in Vorarbeiten zur Bekämpfung des Feuerbranderregers eingesetzt wurden (Wolf und Zeller, 1993). An der Universität Konstanz wurden diverse Bakterien und Pilze von Apfelpflanzen isoliert und auf ihre Wirkung gegen Apfelfäuleerreger getestet (Falconi und Mendgen, 1994; Leibinger, 1996; Schiewe und Mendgen, 1992). Da diese Mikroorganismen auf Apfelpflanzen epiphytisch vorkommen wird eine gute Etablierung auf Apfel erwartet, was Voraussetzung für die Wirkung ist. Vor allem die pilzlichen Isolate waren von großem Interesse. Von Hefen ist bekannt, dass sie bei hohen Zuckerkonzentrationen wie sie im Nektar von Apfelblüten vorkommen, besser wachsen können als viele Bakterien (Pusey, 1999). Eine gute Vermehrung in der Apfelblüte ist zur Bekämpfung des Feuerbranderregers von entscheidendem Vorteil. 8 Abschlussbericht zum Projekt 0311785 Alle im Projekt verwendeten Isolate wurden zur Bestimmung bei der DSMZ eingereicht (Tab.1). Nur mit Isolaten, die der Risikogruppe 1 zugeordnet werden konnten wurden weitere Versuche durchgeführt. Aus diesem Grund wurde der Stamm Pantoea agglomerans 21889 nicht weiter untersucht, obwohl er in Vorarbeiten gute Wirkung gegen den Feuerbranderreger zeigte (Laux et al., 1999; Wolf, 1994). Tabelle 1: Bezeichnung und Einordnung der Mikroorganismen Bezeichnung Art (Nach Bestimmung bei der Risikogruppe DSMZ) Herkunft BD170 Bacillus subtilis 1 BBA Darmstadt AG704 Bacillus subtilis 1 Uni Konstanz HG77 Bacillus amyloliquefaciens 1 Uni Konstanz Ra39 Rahnella aquatilis 1 BBA Darmstadt Pa21889 Pantoea agglomerans 2 BBA Darmstadt CF35 Sporobolomyces roseus 1 Uni Konstanz CF10 Aureobasidium pullulans 1 Uni Konstanz CF40 Aureobasidium pullulans 1 Uni Konstanz Die anderen Stämme wurden in einem in vivo Test auf Apfelblüten auf Ihre Wirksamkeit überprüft (Glp. 5.4.1). Parallel wurden Versuche zur wirtschaftlichen Produzierbarkeit der Stämme durchgeführt (Glp. 5.2). Anhand beider Parameter wurde der Bacillus subtilis Stamm BD170 als Wirkorganismus für das zu entwickelnde Präparat ausgewählt. 5.2 Entwicklung von Produktionsverfahren Das Produktionsverfahren für ein mikrobielles Präparat wird in die Arbeitsschritte Stammerhaltung, Fermentation, Aufarbeitung und Konfektionierung gegliedert (Abb. 1). Während der Aufarbeitung und Konfektionierung können geeignete Formulierungsmittel zugesetzt werden. Der gesamte Produktionsablauf muss mit geeigneten Methoden der Qualitätskontrolle überwacht werden. Die Stammerhaltung wird parallel im Labor und bei der Sicherheitshinterlegung der DSMZ durchgeführt. Dauerkulturen werden entweder in Glycerin bei –20° C oder lyophilisiert gelagert. Alle Experimente wurden mit aus Dauerkulturen angezogenen Kulturen durchgeführt, um Stammveränderungen durch mehrmaliges überimpfen zu vermeiden. Auch bei 9 Abschlussbericht zum Projekt 0311785 der Produktion von Versuchschargen wurde die Anzucht jeweils mit einer Probe aus der Sicherheitshinterlegung begonnen. Stammerhaltung Fermentation Vermehrung und Anzucht der MikroKonservierung des organismen in Produktionsstammes mehrstufiger Fermentation Aufarbeitung Trennung von Zellen und Überstand Konfektionieren Einstellen der gewünschten Endkonzentration Trocknen oder flüssig formulieren Verpacken Zugabe von Formulierungsmitteln Qual itätskontrolle Abbildung 1: Schematische Darstellung des Produktionsverfahrens für mikrobielle Präparate Für die Fermentation eines Mikroorganismus muss das Medium optimiert und die Temperatur- und pH-Bereiche für optimales Wachstum müssen bekannt sein. Alle verwendeten Mikroorganismen konnten in einem kostengünstigen Produktionsmedium ohne Zusatz von organischem Stickstoff angezogen werden. Bei der Anzucht im Schüttelkolben, mussten Pufferkomponenten entsprechend dem pH-Optimum zugegeben werden. Die einzelnen Mikroorganismen zeigten unterschiedliche Ansprüche an die Wachstumsbedingungen (Tab. 2). Die Aufarbeitung, Formulierung, Qualitätskontrolle und Konfektionierung wurde nicht für alle Mikroorganismen im Detail geklärt. Die Arbeiten konzentrierten sich auf den B. subtilis Stamm BD170. Mit diesem Wirkorganismus wurde das Pflanzenstärkungsmittel BIOPRO® entwickelt. Im folgenden sind die Produktionsbedingungen für die verschiedenen Arten aufgeführt, soweit sie im Rahmen dieses Forschungsprojektes erarbeitet werden konnten. 10 Abschlussbericht zum Projekt 0311785 Tabelle 2: Wachstumsbedingungen für die Mikroorganismen. Zur Bestimmung der optimalen Bedingungen wurden Wachstumskurven in Schüttelkulturen mit Produktionsmedium anhand der Zunahme der OD660 (Bakterien) bzw. der Zellzahl (Hefen) ermittelt. Stamm Temperaturoptimum (Bereich)a pH-Optimum (Bereich) a Max. Zelldichte Verdopplungszeit bei Optimum (h) BD170 42 (<22->50) 7 (<6->8) 5x 109 Sporen/ml 1,1 AG704 42 (<17->42) n.b. n.b. 1,4 HG77 32 (<17->42) n.b. n.b. 3,9 Ra39 22 (<17-32) n.b. 1x 1010 Zellen/ml 3,4 CF35 25 (<10-27) 7 (3->8) 5x 108 Zellen/ml 3,4 CF10 27 (<19-32) n.b. 5x 108 Zellen/ml 3,0 CF40 27 (<7-32) 5 (<3-7,5) 8x 108 Zellen/ml 2,9 a Angegeben wird der Bereich, in dem das Isolat gewachsen ist. < bzw. > bedeutet, dass keine tieferen bzw. höheren Werte getestet wurden. 5.2.1 Bacillus subtilis B. subtilis ist ein sporenbildendes Bakterium (Sneath et al., 1986). Die Endosporen werden als Dauerorgane zur Überbrückung ungünstiger Wachstumsbedingungen wie Nährstoffmangel und Austrocknung gebildet. Die Sporen sind hitzeresistent und bleiben über Jahre keimfähig. Diese Eigenschaften erleichtern die Herstellung von stabilen Präparaten. Deshalb war das Ziel, ein Produktionsverfahren zu finden, das eine möglichst hohe Ausbeute an hitzeresistenten Sporen ergibt. Dazu mussten Fermentationsbedingungen (Medium, Sauerstoffversorgung, Temperatur, pH) gefunden werden, die ein gutes Wachstum der B. subtilis Kultur ermöglicht und am Ende der Wachstumsphase die Sporulation induziert. Vorversuche im Schüttelkolben (100ml) zeigten, dass B. subtilis in einem Medium ohne organischen Stickstoff Zelldichten bis zu 5x109 Sporen/ml erreicht. Deshalb wurden die weiteren Optimierungsschritte und das Scale-up mit diesem kostengünstigen Produktionsmedium durchgeführt. Die Verwendung von größeren Schüttelkolben (1l) führte zu einem deutlichen Rückgang bei der Ausbeute. Dies wird auf die schlechte Sauerstoffversorgung in den Kolben zurückgeführt. Im Laborfermenter (Labfors, Infors GmbH) konnten die Wachstums- und Sporulationsbedingungen optimiert werden, so dass eine reproduzierbare Ausbeute von 5 x109 Sporen/ml nach 30h erreicht wurde. 11 Abschlussbericht zum Projekt 0311785 Das Scale-up in den technischen Maßstab wurde am IFA-Tulln durchgeführt. Fermentationen im 800l und 3000l Fermenter ergaben Ausbeuten von 2 x109 – 5 x109 Sporen /ml. Dies zeigt, dass die Fermentation des B. subtilis Stammes BD170 auch im Großfermenter mit befriedigenden Ausbeuten möglich ist. Bei einer Ausbeute von 5x 109 Sporen/ml ist eine wirtschaftliche Produktion möglich. Durch weitere Optimierungsschritte werden Ausbeuten von 1x 1010 Sporen/ml angestrebt, wie sie für andere B. subtilis Stämme beschrieben wurden (Junge et al., 1998). Zur Aufarbeitung der Sporensuspension zu einem handelsfähigen Produkt, wurden verschiedene Methoden getestet. Zur Reduktion des Volumens wurde Zentrifugation oder Filtration eingesetzt. Keine der Methoden wirkte sich negativ auf die Keimfähigkeit der Sporen aus. Bei diesem Schritt werden auch die Reststoffe aus dem Fermentationsmedium abgetrennt. Dies ist bei der Zulassung von mikrobiellen Präparaten von Bedeutung, da im Medium diverse schwer definierbare Stoffwechselprodukte der Bakterien vorhanden sein können (Lüth, 2000). Bei der Pilotproduktion im Großfermenter wurde die Sporensuspension über eine Zentrifuge aufkonzentriert. Dabei wurden ca. 95% des Fermentationsmediums abgetrennt. Es entstand ein Bakterienschlamm mit einem Anteil von 1416% Trockensubstanz. Neben der Verwendung dieses Bakterienschlammes in flüssigen Formulierungen wurden Möglichkeiten zum Trocknen der Sporen mit geeigneten Trägerstoffen getestet. Das Ziel war, ein leicht resuspendierbares Pulver mit geringem Staubanteil zu bekommen. Die Keimfähigkeit der Sporen sollte durch den Trocknungsprozess nicht beeinträchtigt werden. Mit dem Gerfriertrocknen, Sprühtrocknen, und Wirbelschichttrocknen stehen drei Verfahren zum Trocknen von Mikroorganismen zur Auswahl. Die Gefriertrocknung wurde mit kleineren Mengen nach Zugabe verschiedener Formulierungsmittel getestet. Das Gefriertrocknen hatte keinen Einfluss auf die Keimrate der Sporen. Die Keimraten wurden auch nicht vom verwendeten Trägerstoff beeinflusst. Das Gefriertrocknen wurde zur Erstellung von Proben mit verschiedenen Formulierungsmitteln eingesetzt. Für die großtechnische Produktion ist das Sprühtrocknen wirtschaftlicher. Die Optimierung der Sprühtrocknung wurde von der Firma Nubilosa in Konstanz auf einer Pilotanlage durchgeführt. Dort gelang es wirtschaftlich vertretbare Trocknungsbedingungen zu finden, die ein rieselfähiges, staubarmes Sporenpulver ergaben. Das Sporenpulver kann problemlos in Wasser resuspendiert und mit praxisüblichen Spritzen im Obstbau ausgebracht werden. Das so gewonnene Sporenpulver des Isolates B. subtilis BD170 ist 12 Abschlussbericht zum Projekt 0311785 werden. Das so gewonnene Sporenpulver des Isolates B. subtilis BD170 ist Grundlage für die Herstellung des Pflanzenstärkungsmittel BIOPRO® . Zur Qualitätskontrolle wurde während des gesamten Produktionsablaufs die Konzentration an Zellen bzw. Sporen von B. subtilis überprüft. Auf geeigneten Selektivmedien, auf denen B. subtilis nicht wächst, wurde nach Kontaminanten gesucht. Dadurch wurde sichergestellt, dass das Präparat nicht mit anderen Mikroorganismen verunreinigt ist. Parallel zur Entwicklung von BIOPRO®, wurden auch Versuche zur Entwicklung einer flüssigen Formulierung des B. subtilis Isolates durchgeführt. Es zeigte sich, dass die Sporen in Wasser gelagert zwar stabil sind. Die Gefahr, dass Kontaminanten (anaerobe Bakterien, Pilze) in oder auf der Sporensuspension wachsen, ist aber sehr groß. Deshalb müssen der Sporensuspension geeignete Konservierungsmittel zugegeben werden, die das Wachstum möglicher Kontaminanten verhindern. 5.2.2 Rahnella aquatilis Das gram-negative Bakterium Rahnella aquatilis vermehrt sich im Schüttelkolben im Produktionsmedium bis zu einer Bakteriendichte von 1010 Zellen/ml. Die Dichte der Kultur war dabei nicht von der Größe des Schüttelkolbens abhängig. Durch diese hohen Ausbeuten wäre dieses Bakterium für eine technische Produktion geeignet. Allerdings bildet dieses Bakterium keine Dauerformen, so dass die Konservierung hoher Lebendkeimzahlen sich als schwierig erwies. Die Aufarbeitung der Zellsuspension in der Zentrifuge überlebten noch 90% der eingesetzten Zellen. Das Gefriertrocknen mit Magermichpulver als Trägerstoff führte jedoch zu Lebendkeimzahlen von maximal 7% der eingesetzten Zellen. Dieses Pulver war nicht lagerstabil. Bisher konnte auch keine stabile Flüssigformulierung entwickelt werden. Das Bakterium müsste also jeweils kurz vor dem Applikationstermin produziert und ausgeliefert werden. Dies erschwert die Verwendung in einem Präparat erheblich. 5.2.3 Aureobasidium pullulans Aureobasidium pullulans wird der Gruppe der schwarzen Hefen zugeordnet. Die Art kann Mycel und mehrere Sorten morphologisch unterschiedlicher Hefezellen bzw. Sporen bilden (Andrews et al., 1994). Am einfachsten lassen sich die als Blastosporen bezeichneten Hefezellen in Submerskultur produzieren. In bisherigen Versuchen zur Bekämpfung der Apfelfäulen (Leibinger, 1996) und zur Bekämpfung des Feuerbrandes (Glp. 5.5) wurden Blastosporen mit gutem Erfolg eingesetzt. 13 Abschlussbericht zum Projekt 0311785 Der Stamm Aureobasidium pullulans CF40 wächst im Schüttelkolben im Produktionsmedium bei pH 5,0 und 27°C auf eine Dichte von 5x 108 Zellen/ml. Auch bei der Fermentation dieses Stammes im Laborfermenter konnte diese Zelldichte reproduzierbar erreicht werden. Die Hefezellen eignen sich auch für eine kontinuierliche Anzucht, so dass mit verhältnismäßig kleinen Fermentern große Mengen produziert werden können. Als problematisch erwies sich allerdings die Aufarbeitung der Hefezellen zu einem stabilen, lagerfähigen Produkt. In weiteren Arbeiten sollen deshalb Produktionsbedingungen für Chlamydosporen erarbeitet werden. Diese dienen bei A. pullulans als Dauerorgane und sind vergleichbar den Bakteriensporen resistent gegenüber diversen Umweltbedingungen. Chlamydosporen haben gegenüber Blastosporen auch den Vorteil, das sie besser auf Blattoberflächen anhaften (Andrews et al., 1994). Dadurch erreicht man eine bessere Etablierung des Wirkorganismus auf der Pflanze, wodurch die Wirkung bei der biologischen Schädlingsbekämpfung verbessert wird. 5.2.4 Sporobolomyces roseus Die rote Hefe S. roseus bildet weder Mycel noch Dauerformen. Im Schüttelkolben wurden mit dem Isolat CF35 unter optimalen Bedingungen im Produktionsmedium Dichten von 5x 108 Hefezellen/ml erreicht. Auch hier war die Aufarbeitung der Hefezellen zu einem stabilen Präparat bisher nicht möglich. 5.3 Lagerfähigkeit der Mikroorganismen Ein wichtiger Aspekt für die Vermarktung eines Präparates ist seine Haltbarkeit. Bei einer Lagerstabilität von weniger als einem Jahr, muss die Produktion termingerecht zur Saison erfolgen. Die Saison für Präparate, die gegen den Feuerbranderreger eingesetzt werden sollen, ist mit ca. 4 Wochen kurz und der Einsatz des Mittels hängt von den Witterungsbedingungen ab. Die Bereitstellung von ausreichenden Mengen eines Präparates, das in der darauffolgenden Saison nicht mehr eingesetzt werden kann, wäre mit einem hohen wirtschaftlichen Risiko verbunden. Deshalb war es notwendig, Formulierungen und Lagerbedingungen für die mikrobiellen Präparate zu finden, die eine Haltbarkeit von mindestens 15 Monaten möglich machen. 14 Abschlussbericht zum Projekt 0311785 5.3.1 Bacillus subtilis BD170 Die von B. subtilis gebildeten Endosporen sind als Dauerorgane resistent gegenüber verschiedenen Umwelteinflüssen. Endosporen können über 10 Jahre lang keimfähig bleiben (Sneath et al., 1986). Zur Beurteilung der Haltbarkeit eines Präparates reicht es aber nicht aus, dass einzelne Sporen keimfähig bleiben, sondern der Titer an keimfähigen Sporen muss hoch bleiben. Um den Einfluss der Formulierungsmittel und der Lagerbedingungen auf die Haltbarkeit zu testen, wurden mit verschiedenen Proben Lagerversuche angesetzt. Eine der ersten Proben war ein gefriergetrocknetes Sporenpulver (Trägerstoff: Magermilchpulver) mit einem Gehalt von 1,5x 1010 Sporen/g und einer Restfeuchte von 9%. Dieses wurde in Alliquots aufgeteilt, die bei -20°C, bei 4° C, bei Raumtemperatur oder im Freien, den natürlichen Temperaturschwankungen ausgesetzt, gelagert wurden. Nach 20 Monaten Lagerung konnten in den Varianten noch bis zu 8,4x109 Sporen/g festgestellt werden. Dies entspricht noch über 50% der Ausgangskonzentration (Abb. 2). Die Schwankungen zwischen den Messungen werden auf die Inhomogenität des Pulvers zurückgeführt. Tendenziell sind die Sporen bei tiefen Temperaturen stabiler. Die Haltbarkeit getrockneter Sporen hängt vom Restfeuchtegehalt des Pulvers ab. Die Haltbarkeit ist bei geringen Restfeuchten besser (Junge et al., 1998). Beim Sprühtrocknen konnte mit ca. 2,5% ein geringerer Restfeuchtegehalt im Pulver erreicht werden als beim Gefriertrocknen. Dies sollte die Haltbarkeit der Sporen verbessern. Die für die Freilandversuche 2001 produzierte Charge von BIOPRO® hatte einen Restfeuchtegehalt von 2,3%. Eine Rückstellprobe wurde nach zwei Monaten Lagerzeit auf die Konzentration an keimfähigen Sporen überprüft. Direkt nach der Produktion wurden in 5 Stichproben Konzentrationen zwischen 1,8x1010 und 2,2 x1010 Sporen/g gefunden. Nach zwei Monaten waren es in 5 Stichproben zwischen 1,7 x 1010 und 2,4 x 1010 Sporen/ g. Die Sporenkonzentration im BIOPRO® war über den begrenzten Zeitraum stabil. Weitere Bestimmungen werden Aufschluss darüber geben, ob das sprühgetrocknete Präparat tatsächlich stabiler ist, als die gefriergetrockneten Pulver. Zur Überprüfung der Lagerfähigkeit von B. subtilis Sporen in flüssiger Formulierung wurde eine Sporensuspension zentrifugiert und in drei Alliquots aufgeteilt. Die Pellets wurden in entionisiertem Wasser oder Leitungswasser aufgenommen, bzw. nach der Aufnahme in entionisiertem Wasser mit 20% Milchpulver gefriergetrocknet. Die drei Proben wurden bei 20° C gelagert und in regelmäßigen Abständen wurde die Keimrate bestimmt (Abb. 3). 15 Abschlussbericht zum Projekt 0311785 Die Sporenkonzentration nimmt im Pulver über den Versuchszeitraum von 300d um 50% ab. Dies entspricht den Erfahrungen mit anderen gefriergetrockneten Pulvern. In den flüssig formulierten Ansätzen, war die Konzentration über den Versuchszeitraum stabil. 11 log cfu/g 10 9 20° C 8 -18°C 4°C 7 im Freien 6 0 100 200 300 400 500 600 Zeit (d) Abbildung 2: Entwicklung der Konzentration von B. subtilis BD170 Sporen in gefriergetrocknetem Pulver bei der Lagerung unter verschiedenen Bedingungen. log cfu/g 11 10 ention. Wasser 9 Leitungswasser Magermilchpulver 8 0 50 100 150 200 250 300 Zeit (d) Abbildung 3: Entwicklung der Konzentration von BD170 Sporen in gefriergetrocknetem Pulver und in Lösung in entionisiertem Wasser und in Leitungswasser bei der Lagerung bei 20°C. 16 Abschlussbericht zum Projekt 0311785 Alternativ zum Trocknen ist also eine Lagerung der Sporen in flüssiger Formulierung möglich. Hier müssen aber noch geeignete Maßnahmen gefunden werden, die das Wachstum von Pilzen in der Suspension unterdrücken. Im Lagerversuch wurde die Sporensuspension steril in sterilisierte Gefäße abgefüllt. Dies ist in einer Produktionsanlage nicht praktikabel. Deshalb müssen andere Möglichkeiten zur Konservierung der Sporen gefunden werden. Zu diesem Zweck wurden Alliquots einer Sporensuspension mit Säure oder Base versetzt und pH-Werte von pH 3,0 bis 11,0 eingestellt. Weder das Absenken noch das Anheben des pH-Wertes in der Suspension hatte nach 3 Monaten einen Einfluss auf die Keimfähigkeit der Sporen. Nur beim tiefsten und höchsten pH-Wert konnte allerdings das Wachstum von Kontaminanten vollständig unterdrückt werden. Lagerversuche, zur Untersuchung der Stabilität der flüssigen Formulierungen wurden angesetzt. 5.3.2 Rahnella aquatilis 39 cfu (% des Startwertes) 150 Pulver 20°C 125 Flüssig 4°C 100 Konzentrat 4°C 75 Flüssig 20°C 50 25 0 0 20 40 60 80 100 120 Zeit (d) Abbildung 4: Entwicklung der Konzentration von Ra39 Kulturen bei der Lagerung als Pulver oder in flüssiger Formulierung. Zwei Chargen von R. aquatilis 39 mit einer Zellzahl von 1x 1010 cfu/ml wurde mit Milchpulver versetzt gefriergetrocknet. Nach dem Trocknen war die Keimrate um 94% verringert. 17 Abschlussbericht zum Projekt 0311785 Das Pulver war auch nicht stabil. Die Keimrate sank innerhalb von 14 Tagen auf 1% ab (Abb. 4). Bei Lagerung in flüssiger Formulierung bleibt die Keimrate bei 4°C höher als bei 20°C. Bei 4°C erfolgte nach 20 Tagen ein Rückgang um 75%. Danach blieb die Kultur aber über 100 Tage stabil. Ein durch Zentrifugation gewonnenes Konzentrat (Startwert: 1 x 1011 cfu/ml) verhielt sich ähnlich. Für das Isolat R. aquatilis 39 konnte bisher keine praktikable Formulierung gefunden werden, die die Erhaltung des Titers über einen längeren Zeitraum garantiert. Proben für Versuche wurden entweder frisch angezogen, oder maximal 3 Wochen bei 4°C gelagert. 5.3.3 Aureobasidium pullulans CF40 Aureobasidium pullulans CF40 wurde mehrfach in einer Flüssigformulierung bei 4°C und als gefriergetrocknetes Pulver bei 20°C gelagert. Die Lebendzellzahl in der Flüssigformulierung reduzierte sich nach 10 Tagen um über 90%. Außerdem ergab sich in dieser Formulierung häufig das Problem von pilzlichen Kontaminanten. Mit dem gefriergetrockneten Pulver gab es zwischen den einzelnen Ansätzen Unterschiede. Durch das Trocknen reduzierte sich die Keimzahl auf 50- 90%. Auch die Stabilität des Pulvers war bei Raumtemperatur von Präparation zu Präparation unterschiedlich. Eine Charge konnte bisher ohne Reduktion der Keimzahl über 80 Tage gelagert werden. Die Faktoren, die diese Stabilität beeinflussen, müssen noch erforscht werden, bevor dieses Isolat als Wirkorganismus in einem biologischen Präparat eingesetzt werden kann. 5.4 Einsatz der Mikroorganismen gegen den Feuerbranderreger Der Feuerbrand, verursacht durch das Bakterium Erwinia amylovora, ist die gefährlichste Bakteriose im Obstbau. Quarantänemaßnahmen konnten seine Ausbreitung in alle wichtigen Anbaugebiete Europas nicht verhindern (Backhaus und Klingauf, 1998). Der Erreger infiziert die Wirtspflanzen (Apfel, Birne, Quitte und div. Ziersträucher) hauptsächlich über Blüten und Wunden. Die Gefahr der Infektion über Wunden ist nach Hagel oder Schnittmaßnahmen besonders groß. Für die Infektion über die Blüte benötigt der Erreger eine Wärmeperiode, in der er sich auf der Narbe der Blüte epiphytisch vermehrt, die dann durch Regen oder starken Tau gefolgt wird (Moltmann, 1996). Mit dem Wasser wird der Erreger auf den Blütenboden gespült, von wo er über die Nektarien ins Gefäßsystem der Pflanze einwandert. Für die Bekämpfung des Feuerbrandes steht die Blühperiode im Vordergrund. Jeder Baum bietet während der Blüte hunderte von potenziellen Eintrittspforten für den Erreger. 18 Abschlussbericht zum Projekt 0311785 Verschiedene Methoden zur Verringerung des Blütenbefalls werden diskutiert. Neben dem Einsatz von Antibiotika werden Gesteinsmehle, Wachstumsregulatoren, Pflanzenextrakte und Mikroorganismen auf ihre Wirksamkeit gegen Feuerbrand getestet (Backhaus und Klingauf, 1998; Zeller und Laux, 2001). Arbeiten aus den USA (Johnson und Stockwell, 1998) zeigen, dass der Einsatz von Bakterien ein vielversprechender Ansatz in der Feuerbrandbekämpfung darstellt. Zur Entwicklung von wirksamen Präparaten wird ein Screening-System benötigt, das den natürlichen Infektionsvorgang nachahmt und trotzdem für den Durchsatz hoher Probenmengen geeignet ist. Agarplattentests eignen sich zum Screening auf Mikroorganismen, die antibiotisch wirksame Substanzen bilden. Allerdings hängt die Bildung dieser Substanzen oft vom Nährmedium ab. So ist nicht sicher, dass alle Mikroorganismen, die solche Substanzen auf Agarplatten bilden, diese auch auf der Obstbaumblüte unter Freilandbedingungen bilden. Neben der Bildung von antibiotischen Substanzen kann der Antagonismus auch auf Nährstoffkonkurrenz beruhen. Auch dieser hängt stark von der Zusammensetzung des Mediums ab. Gesicherte Ergebnisse sind deshalb nur im natürlichen Habitat zu erwarten. Die Obstbaumblüten als natürliches Habitat des Feuerbrandbakteriums stehen aber nur wenige Wochen im Jahr für Versuche zur Verfügung. Deshalb wurde nach Möglichkeiten gesucht, Blüten für Versuche auch außerhalb der Blühperiode zur Verfügung zu haben. 5.4.1 Aufbau eines in vivo Testsystems Das in vivo Testsystem zur Untersuchung der Wirksamkeit von Mikroorganismen gegen den Feuerbranderreger wurde in Anlehnung an Arbeiten von Pusey in den USA (Pusey, 1997; Pusey, 1999; Pusey, 2000) durchgeführt. Anstelle der dort verwendeten Holzapfelsorten, wurden blühfähige Birnen- (Conference auf QC) und Apfelbäume (Gala auf M9) verwendet. Der Zeitpunkt der Blüte wurde entweder durch Aufstellen der Pflanzen im Gewächshaus unter künstlicher Beleuchtung vorgezogen oder durch Lagerung des Pflanzmaterials bei Dunkelheit im Kühlraum verzögert. Auf diese Weise konnten von Januar bis September Blüten für Versuche bereitgestellt werden. Die Blüten wurden abgenommen und mit dem Blütenstiel in eine 10% ige Saccharoselösung gestellt (Abb. 5A). Dies gewährleistete, dass die Blüten über den Versuchszeitraum intakt blieben (Abb. 5B). Die Blüten wurden in feuchten Kammern inkubiert. Nach dem Aufbringen von Mikroorganismen und/oder E. amylovora konnte die Populationsentwicklung auf den Blüten mittels Ausplattierung von Waschlösungen verfolgt werden, oder es konnte nach 6 Tagen Inkubation die Wirkung der Mikroorganismen auf die Symptombildung durch das Feuerbrandbakterium ausgewertet werden (Abb. 5C). 19 Abschlussbericht zum Projekt 0311785 B A C Abbildung 5: In vivo Test-System zur Untersuchung der Wirksamkeit von Mikroorganismen gegenüber dem Feuerbranderreger E. amylovora. A: Apfelblüten wurden in 10% Saccharoselösung gestellt und bei 100% Luftfeuchtigkeit inkubiert. B: Nicht befallene Blüte nach 6d Inkubation. C: Blüte mit Feuerbrandsymptomen. Am Blütenstiel tritt Bakterienschleim aus (Pfeil). 5.4.1.1 Wirkung verschiedener Mikroorganismen Tabelle 3: Verringerung des Feuerbrandbefalls an abgeschnittenen Apfelblüten durch Mikroorganismen oder durch Streptomycin. Pro Blüte wurden ca. 500.000 Bakterien oder 50.000 Hefen auf die Narbe getropft. 24 h danach wurden 1.000 Zellen E. amylovora auf die Narben getropft. In jedem Versuch wurden pro Behandlung 3 x 20 Blüten inokuliert und bei 24° C inkubiert. Antagonist Bakterien Hefen Anzahl der Versuche Wirkungsgrad (%) B. subtilis BD170 8 60 B. amyloliquefaciens Hg77 1 67 R. aquatilis 39 1 64 A. pullulans CF10 1 100 A. pullulans CF40 2 88 S. roseus CF35 2 88 Streptomycin (0,02%) 3 92 20 Abschlussbericht zum Projekt 0311785 Im in vivo Testsystem wurde B. subtilis BD170 am häufigsten eingesetzt. Bei 8 Versuchen ergab sich ein durchschnittlicher Wirkungsgrad von 60%. Die anderen Bakterien hatten vergleichbare Wirkungsgrade. Wegen der guten Fortschritte bei der Erarbeitung des Produktionsverfahrens von B. subtilis BD170 und wegen der positiven Freilandversuche mit diesem Stamm wurden die anderen Bakterien vorerst nicht weiter verfolgt. Die drei Hefeisolate hatten gute Wirkung im in vivo Testsystem (Tab. 3). Weitere Versuche bei niedrigeren Temperaturen (18-23°C) zeigten, dass sich das Isolat A. pullulans CF40 über den gesamten Temperaturbereich auf den Blüten vermehrte und die Feuerbrandsymptome um 80-100% reduzierte. 5.4.1.2 Einfluss der Formulierung auf die Wirkung Der Einfluss von verschiedenen Trägerstoffen auf die Wirkung von B. subtilis BD170 gegen Feuerbrand wurde im in vivo Testsystem überprüft (Abb. 6). Zum Trocknen der Sporen wurden Milchpulver, Dextran und Aerosil verwendet. Zusätzlich wurde eine flüssig formulierte Probe eingesetzt, die zur Lagerung auf pH 3,0 eingestellt war. Wirkungsgrad (%) 80 60 69 69 67 58 44 40 20 0 Kultur Milchpulver Dextran Aerosil Säure pH 3,0 Abbildung 6: Einfluss der Formulierung von B. subtilis BD170 auf die Verringerung der Bakterienschleimbildung auf mit E.a.385 (1000 cfu/Blüte) inokulierten Birnenblüten. 24h vor der Inokulation wurden 5x105 cfu/Blüte B. ubtilis. BD170 auf die Narbe der Blüten getropft. Dazu wurde eine 72h alte Kultur von BD170 oder 72h alte Kulturen, die mit 20% Milchpulver, 20% Dextran oder 20% Aerosil versetzt gefriergetrocknet wurden, oder eine mit Säure auf pH3,0 eingestellte Sporensuspension benutzt. Pro Behandlung wurden 2 Wiederholungen mit je 20 Blüten durchgeführt. 21 Abschlussbericht zum Projekt 0311785 Die mit Milchpulver und Dextran getrockneten Sporen hatten tendenziell eine höhere Wirkung als die Flüssigkultur. Aerosil reduzierte die Wirkung der Sporen geringfügig. Die flüssige Formulierung war vergleichbar mit den mit Milchpulver getrockneten Sporen. Als Trägerstoff für das Pflanzenstärkungsmittel BIOPRO® wurde Milchpulver ausgewählt, da dieses im Obstbau als Zusatz zu Viruspräparaten schon verwendet wurde und keine phytotoxischen Nebeneffekte bekannt sind. Für Dextran lagen keine entsprechenden Daten vor. 5.4.1.3 Einfluss der Anwendungskonzentration auf die Wirkung Im in vivo Testsystem wurden verschiedene Konzentrationen eines gefriergetrockneten Pulvers von B. subtilis BD170 eingesetzt (Abb. 7). In einem Konzentrationsbereich von 108 Sporen/ml bis 107 Sporen/ml wurde ein Wirkungsgrad von über 75% erreicht. Eine Sporenkonzentration von 106/ml erbrachte keine Wirkung mehr. Für den Einsatz im Freiland wurde eine Anwendungskonzentration für BIOPRO® von 0,1-0,5% in Abhängigkeit der Wasseraufwandmenge empfohlen. Dies entspricht einer Sporenkonzentration von 2x 107 – 1x 108 pro ml. 100 77 79 80 Wirkung (%) 75 50 25 4 0 8 7,3 7 6 B. subtilis Konzentration (log Sporen/ml) Abbildung 7: Reduktion der Bakterienschleimbildung auf mit E.amylovora 385 (1000 cfu/Blüte) inokulierten Apfelblüten. 24h vor der Inokulation wurden unterschiedlich konzentrierte Sporensuspensionen auf die Blüten gesprüht. Pro Behandlung wurden 3 Wiederholungen mit je 20 Blüten durchgeführt. 22 Abschlussbericht zum Projekt 0311785 5.4.1.4 Einfluss des Einsatzzeitpunktes auf die Wirkung log(cfu/Blüte) 8 7 A 6 5 E. amylovora (log(cfu/Blüte)) 4 9 B 8 7 6 5 4 3 0 24 48 72 Inkubationszeit (h) Abbildung 8: A: Populationsentwicklung von B. subtilis BD170 oder A. pullulans CF40 auf Apfelblüten. B: Populationsentwicklung von E. amylovora auf Apfelblüten. Blüten wurden nicht behandelt (blau), mit Suspensionen von 108 Sporen /ml B. subtilis (grün) oder 107 Zellen /ml A. pullulans (rot) besprüht und bei 21°C und 100% rel.LF inkubiert. Nach 1h (Dreieck) oder 24h (Raute) wurden die Blüten mit E. amylovora inokuliert (5000 cfu/Blüte). Zu jedem Zeitpunkt wurden je Behandlung 5 Blüten abgewaschen. Die Waschlösungen wurden zur Bestimmung der Konzentration von B. subtilis auf NBLiCl, von A. pullulans auf YM+Streptomycin und von E. amylovora auf Miller-Schroth Medium (Brulez und Zeller, 1981) ausplattiert. 23 Abschlussbericht zum Projekt 0311785 Apfelblüten wurden mit B. subtilis BD170 oder A. pullulans CF40 besprüht und 1h danach oder 24h danach mit E. amylovora inokuliert. Über einen Zeitraum von 72h wurde der Populationsverlauf der Mikroorganismen verfolgt (Abb. 8). Unter den in diesem Versuch gewählten Bedingungen von 21°C und 100% rF vermehrte sich BD170 in den ersten 24h nur wenig. Ein deutlicher Populationsanstieg (Faktor 160) war erst nach 48h zu erkennen. Allerdings wird die Vermehrung durch die Anwesenheit von E. amylovora gehemmt. Dies zeigt sich an den Blüten, die schon nach 1h mit E. amylovora inokuliert wurden. Auf diesen Blüten ist die Vermehrung von BD170 deutlich geringer (Abb. 8A). A. pullulans CF40 vermehrt sich in den ersten 24h um Faktor 40. Die Population steigt auch am 2. Tag weiter an. Die Inokulation mit E. amylovora hat keinen Einfluss auf den Populationsverlauf von A. pullulans CF40. Dies zeigt, dass sich A. pullulans CF40 bei 21°C schneller auf der Blüte etabliert als B. subtilis BD170. In Versuchen bei 25°C vermehrte sich B. subtilis BD170 in den ersten 24h um durchschnittlich Faktor 120. Die Temperatur hatte also einen großen Einfluss auf die Etablierung der Mikroorganismen auf der Blüte. Tabelle 4: Einfluss des Zeitpunktes der Inokulation mit E. amylovora (5000 cfu/Blüte) auf die Reduktion der E. amylovora Population auf der Blüte und auf die Wirkung gegen die Feuerbrandsymptombildung an der Blüte durch B. subtilis BD170 und A. pullulans CF40 im in vivo Test System. Behandlung Inokulation (h nach der Behandlung ) Reduktion der E. amylovora Population Wirkungsgrad (%) B. subtilis BD170 1 0,45 12 B. subtilis BD170 24 0,11 51 A. pullulans CF40 1 0,07 68 A. pullulans CF40 24 0,002 100 In der unbehandelten Kontrolle vermehrt sich E. amylovora innerhalb 48h um Faktor 100.000 von 5x 103 cfu/Blüte auf 5x 108 cfu/Blüte. Die Populationsentwicklung von E. amylovora wird bei der Inokulation 1h nach der Behandlung durch B. subtilis BD170 kaum beeinflußt. A. pullulans CF40 reduziert in diesem Fall die E. amylovora Population nach 48h im Vergleich zur Kontrolle auf 0,1. Entsprechend der höheren Reduktion der E. amylovora Population war auch die Wirkung auf die Feuerbrandsymptomentwicklung durch A. pullulans CF40 höher als von B. subtilis BD170 (Tab. 4). Eine wesentlich deutli- 24 Abschlussbericht zum Projekt 0311785 chere Reduktion des E. amylovora Population nach 48h wurde in den Varianten erreicht, in denen die Inokulation 24h nach der Behandlung durchgeführt wurde. Entsprechend konnte hier auch die Feuerbrandsymptome besser unterdrückt werden (Tab.4). Behandlungen im Freiland sollten deshalb mindestens 24h vor einem möglichen Befall durch den Erreger stattfinden. 5.4.2 Wirkung der Mikroorganismen im Freiland 5.4.2.1 Freilandversuche mit künstlicher Inokulation Die Mikroorganismen wurden im Freiland in mehreren Versuchen mit künstlicher Inokulation durch den Feuerbranderreger eingesetzt. Die künstliche Inokulation soll einen ausreichenden Befall für eine statistische Auswertung sicherstellen. Da für den Feuerbranderreger Quarantänebestimmungen gelten, dürfen künstliche Inokulationen nur an isolierten Standorten mit behördlicher Genehmigung durchgeführt werden. Solche Versuche wurden vom Institut für biologischen Pflanzenschutz der BBA in Darmstadt und von den Pflanzenschutzdiensten der Länder Baden-Württemberg und Rheinland-Pfalz durchgeführt. Diese Versuchsansteller haben verschiedene Präparationen von Mikroorganismen getestet, die im Rahmen dieses Projektes produziert wurden (Tab. 5). In den Versuchen mit künstlicher Inokulation mit dem Erreger wurde an Apfel mit den Mikroorganismen B. subtilis BD170 und Rahnella aquatilis 39 eine maximale Befallsre- duktion von 65% erreicht (Tab. 5). Im Jahr 2000 herrschten während der Obstbaumblüte für den Feuerbranderreger sehr günstige Infektionsbedingungen. In Neustadt waren trotz der geringen Inokulumsdichte von 106 cfu/ml an unbehandelten Pflanzen 98% der Blütenbüschel befallen. Dieser starke Befall konnte mit keinem der eingesetzten Präparate deutlich reduziert werden. Selbst eine Behandlung mit Plantomycin zeigte nur eine geringe Wirkung. Ähnlich war die Situation in Oppenheim, wo R. aquatilis eingesetzt wurde. Bei Versuchen an Cotoneaster konnte 1999 auch sehr starker Befall von 98% befallener Blütenbüschel an unbehandelten Pflanzen durch zwei Behandlungen mit B. subtilis BD170 um 82% reduziert werden. Diese hohe Wirksamkeit dieses Stammes auf Cotoneaster bestätigten Ergebnisse aus dem Jahr 1993 (Wolf, 1994). Die bessere Wirkung auf Cotoneaster könnte mit den höheren Temperaturen während der Cotoneasterblüte im Juni zusammenhängen. 25 Abschlussbericht zum Projekt 0311785 Tabelle 5: Wirkung von Bacillus subtilis BD170 (BsBD170) und Rahnella aquatilis (Ra39) in Freilandversuchen mit künstlicher Inokulation mit E. amylovora . Versuchsansteller / Jahr /Sorte/ E.amylovora Inokulum (cfu/ml) Behandlung (Organismus/ Anzahl) Befall in unbeh. (%) Wirkung (%) Wirkung von 0,6% Plantomycin (%/N Beh.) BBA/99/ Idared/5 x 107 BsBD170/1 37 49 Ra39/1 37 65 BBA/00/Idared/1 x 107 BsBD170/2 25 44 SLFA Neust./ 00/ Fuji/ 1 x 107 BsBD170/3 98 14 23/1 SLVA Oppenheim/00/Rubinette/ 1x 107 Ra 39/3 45,3 18 47/1 SLVA Oppenheim/00/Elstar/ 1x 107 Ra39/3 50,9 12 23/1 BsBD170/2 97 82 72/2 BBA/99/ Idared/5 x 10 7 BBA/99/Cotoneaster/ 7 x 107 Insgesamt muss die Versuchsdurchführung mit künstlicher Inokulation kritisch betrachtet werden, da dabei hohe Konzentrationen des Feuerbranderregers in die Blüte gebracht werden. Bei der natürlichen Inokulation besiedelt E. amylovora zuerst die Narbe, vermehrt sich dort und muss dann durch Regen oder starken Tau auf den Blütenboden gewaschen werden, wo er über Nektarien in die Pflanze eindringt (Basarab et al., 1992; Moltmann, 1996). Durch den hohen Eintrag an Feuerbrandbakterien bei der künstlichen Inokulation wird die Vermehrung des Erregers auf der Narbe der Blüte umgangen. Die Bakterien werden auch direkt auf den Blütenboden gesprüht, wo sie sofort in die Blüte eindringen können. Im Gegensatz zum Antibiotikum Streptomycin können die Mikroorganismen die Feuerbrandbakterien nicht abtöten. Die Vermeidung des Feuerbrandbefalls durch Bakterien und Hefen ist darauf ausgerichtet, die Vermehrung von E. amylovora auf der Narbe zu verhindern (Johnson und Stockwell, 1998). Aus diesem Grund muss bei Versuchen mit künstlicher Inokulation mit einem geringeren Wirkungsgrad als bei natürlichen Infektionsbedingungen gerechnet werden. 26 Abschlussbericht zum Projekt 0311785 5.4.2.2 Kombinationsverfahren Bei dieser Versuchsvariante wird in jeder Parzelle ein Teil der Bäume künstlich inokuliert. Der Rest wird durch natürliche Übertragung des Erregers befallen. Ausgewertet werden die inokulierten und die nicht inokulierten Bäume getrennt (Fried, 1999). Dieses Verfahren soll in die EPPO-Richtlinie zur Prüfung von Präparaten gegen den Feuerbranderreger eingehen. Tabelle 6: Wirkung von Bacillus subtilis BD170 (BsBD170) im Vergleich zu Plantomycin (0,06%) in Freilandversuchen, die nach dem Kombinationsverfahren durchgeführt wurden. 1999 wurden frisch angezogene Zellen eingesetzt. Im Jahr 2000 gefriergetrocknete Sporenpulver und ab dem Jahr 2001 das Pflanzenstärkungsmittel BIOPRO®. Die Anwendungskonzentration bei B. subtilis BD170 lag bei 1x 108 Bakterien/ml. Versuchsansteller / Jahr / Sorte / E. amylovora Inokulum (cfu/ml) Behandlung (Mittel/ Anzahl) Wirkung inokulierte Parzelle Wirkung nicht inokulierte Parzelle (%) (%) BBA / 99 / Gloster / 1x108 (Laux et al., 1999) BsBD170/2 43 71 RP Karlsruhe /2000 / James Grieve / 2x108 (Fried, 2001a) BsBD170/2 7 22 Plantomycin/3 59 89 BIOPRO®/5 25 20 Plantomycin/3 69 93 BIOPRO®/4 13 9 BsBD170 flüssig/4 31 38 Plantomycin/2 63 83 BIOPRO®/6 20 51 RP Karlsruhe / 2001 / James Grieve / 2x108 (Fried, 2001b) SLFA Neustadt /2001 / Jonagold/1x 107 (Harzer, 2001) BBA / 2001 / Boskoop Im vom Institut für biologischen Pflanzenschutz der BBA 1999 durchgeführten Freilandversuch konnte in den inokulierten Parzellen der starke Befall an unbehandelten Pflanzen durch zwei Behandlungen mit BD170 um 43% reduziert werden. Bei den nicht inokulierten Pflanzen waren 45% der unbehandelten Blütenbüschel befallen. Hier reduzierten zwei Behandlungen mit B. subtilis BD170 den Befall um 71%. 27 Abschlussbericht zum Projekt 0311785 Dieser hohe Wirkungsgrad konnte in den Versuchen des Regierungspräsidiums Karlsruhe (Fried, 2001a; Fried, 2001b) und der SFLA Neustadt (Harzer, 2001) nicht bestätigt werden(Tab. 6). Im Jahr 2000 wurde das B. subtilis BD170 Präparat nicht zum optimalen Zeitpunkt eingesetzt. Bei der herrschenden warmen Witterungen öffneten sich in den 3 Tagen zwischen der ersten Behandlung und der Inokulation sehr viele Blüten, die nicht mit B. subtilis belegt wurden. Die Behandlung am Tag der Inokulation ist für B. subtilis BD170 zu spät. Die Laboruntersuchungen zeigten, dass B. subtilis BD170 in Abhängigkeit von der Temperatur mindestens einen Tag vor der Inokulation eingesetzt werden muss (Glp. 5.4.1.3). Im Jahr 2001 wurden allerdings auch keine höheren Wirkungsgrade erreicht, obwohl die vorgegebenen Behandlungstermine eingehalten wurden. Auffallend war, dass sowohl vom Regierungspräsidium Karlsruhe als auch der SLFA Neustadt geringere Wirkungsgrade in den nicht inokulierten Parzellen gefunden wurden. Dies widerspricht den bisherigen Versuchen, und auch dem Ergebnis des Instituts für biologischen Pflanzenschutz der BBA aus dem Jahr 2001. In diesem Versuch wurde in der nicht inokulierten Variante ein Wirkungsgrad von 51% erreicht. 5.4.2.3 Freilandversuche unter natürlichen Infektionsbedingungen Tabelle 7: Wirkung von Bacillus subtilis BD170 (BsBD170) im Vergleich zu Plantomycin (0,06%) in Freilandversuchen. Im Jahr 1999 und 2000 wurden gefriergetrocknete Sporenpulver, ab dem Jahr 2001 das Pflanzenstärkungsmittel BIOPRO® eingesetzt. Die Anwendungskonzentration bei B. subtilis BD170 lag bei 1x 108 Sporen/ml. Ort / Jahr /Sorte Behandlung (Mittel/ Anzahl) Befall in unbehandelt (%) Wirkung (%) Nobarya, Ägypten/ 1999/ Birne, Le unbehandelt 9 Conte BsBD170/4 4 56 Plantomycin/4 3 67 Burdur, Türkei/1999/ Birne, Santa Maria (Basim et al., 2000) BsBD170/4 64 Isparta, Türkei/1999/ Birne, Williams (Basim et al., 2000) BSBD170/4 62 Schlachters, Deutschland/2001/ Apfel, Elstar, Gloster, Jonagold,Idared, Golden Delicious, Cox Orange unbehandelt 17,2 BIOPRO®/4 25,7 0 Plantomycin/3 2,9 83 28 Abschlussbericht zum Projekt 0311785 In zahlreichen Versuchen, die in Deutschland und in der Schweiz in den Jahren 1999 bis 2001 unter natürlichen Infektionsbedingungen angelegt wurden, kam es nicht zu einem für die statistische Auswertung ausreichenden Feuerbrandbefall. Bisher liegen drei Versuchsergebnisse aus Ägypten, der Türkei und aus Deutschland vor. Bei den Versuchen in Ägypten und in der Türkei wurden mit B. subtilis BD170 hohe Wirkungsgrade erreicht (Tab. 7). In Ägypten wurden die Behandlungen nach dem Feuerbrandprognoseprogramm Marblyt terminiert, so dass die Termine für den Einsatz von Streptomycin optimal waren. B. subtilis BD170 müsste früher eingesetzt werden. Trotzdem war der Wirkungsgrad von Streptomycin nur wenig höher als der von B. subtilis BD170. Im Gegensatz dazu konnte in einem Versuch in Deutschland mit B. subtilis keine Verringerung des Feuerbrandbefalls erreicht werden. Auch hier könnte der Unterschied von den höheren Temperaturen während der Obstbaumblüte in Ägypten und der Türkei kommen. 5.4.2.4 Wirkung auf im Freilandversuch entnommenen Apfelblüten Bei Versuchen zur Feuerbrandbekämpfung unter natürlichen Infektionsbedingungen, reicht der Befall für eine statistische Auswertung häufig nicht aus. Mit der hier beschriebenen Methode, Blüten aus dem Versuch im Labor zu infizieren, erhält man trotzdem eine Aussage über die Wirksamkeit der Präparate. In Überlingen wurde im Jahr 2000 ein Feuerbrandversuch an der Sorte Jonagold vom amtlichen Pflanzenschutzdienst durchgeführt. Die verschiedenen Varianten wurden in 4 Blöcken in einem randomisierten Design angelegt, um die Wirkung der Präparate unter natürlichen Infektionsbedingungen zu überprüfen. Zur Vollblüte am 04.05.00 wurden aus den Parzellen der unbehandelten, der mit B. subtilis BD170 behandelten und aus der Plantomycinvariante je 20 Blüten entnommen. Diese wurden in 10% Zuckerlösung gestellt und mit 400 cfu/Blüte E. amylovora 285 inokuliert. Nach 6d bei 25°C in einer feuchten Kammer wurde die Anzahl infizierter Blüten bestimmt. Die Proben wurden zur Vollblüte entnommen, so dass sich seit der letzten Behandlung kaum noch neue Blüten öffneten. Die mit B. subtilis BD170 oder mit Plantomycin behandelten Blüten waren signifikant weniger anfällig gegenüber dem Feuerbranderreger als die unbehandelten Blüten (Tab. 8). Die Behandlung mit B. subtilis BD170 schützte die Apfelblüten vergleichbar dem Antibiotikum Plantomycin. 29 Abschlussbericht zum Projekt 0311785 Tabelle 8: Reduzierung des Feuerbrandbefalls auf im Freilandversuch entnommenen Blüten durch B. subtilis BD170. Die Blüten wurden am 04.05.2000 entnommen, in 10% Zuckerlösung gestellt und mit 400 cfu/Blüte E. amylovora 285 inokuliert. Nach 6d bei 25°C in einer feuchten Kammer wurde die Anzahl infizierter Blüten bestimmt. Standort Mittel Überlingen Unbehandelt Behandlungstermine Apfel, Jonagold 0,5% B. s. BD170 (108 25.04.;28.04; cfu/ml) 02.05. Probenahme: 04.05.00 0,06% Plantomycin 28.04.; 03.05. 5.5 Befall (%) Wirkung (%) 39 11 72 8 79 Mischbarkeit mit Pflanzenschutzmitteln und Wachstumsregulatoren Im integrierten und ökologischen Obstbau werden diverse Fungizide und Insektizide eingesetzt. Ein Teil der Behandlungen muss zur Bekämpfung von Apfelschorf und Fäulerregern auch während der Blüte durchgeführt werden. Ebenfalls werden während der Blüte Wachstumsregulatoren zur Ausdünnung eingesetzt. Bei der Verwendung von Mikroorganismen zur Bekämpfung von Blüteninfektionen des Feuerbrandes muss deshalb überprüft werden, ob die eingesetzten Pflanzenschutzmittel und Wachstumsregulatoren die Wirkung der Mikroorganismen beeinflussen. Pflanzenschutzmittel, die während der Blüte eingesetzt werden, und das Pflanzenstärkungsmittel Myco-Sin wurden deshalb auf ihre Wirkung auf das Wachstum von B. subtilis BD170 getestet (Tab. 9). Die unspezifischen Fungizide (Schwefel, Dichlofluanid, Captan, Mancoceb, Metiram, Dithianon) haben auch eine hemmende Wirkung auf B. subtilis BD170. Ein gemeinsamer Einsatz von B. subtilis BD170 mit diesen Fungiziden muss also vermieden werden. Da die spezifischen Fungizide keine hemmende Wirkung auf B. subtilis BD170 haben, sollten sie bei einem gleichzeitigen Einsatz mit den Mikroorganismen keinen Einfluss auf deren Wirkung haben. Dadurch können die pilzlichen Erreger (Schorf, Mehltau, Fäulen) auch bei einem Einsatz von B. subtilis BD170 mit Fungiziden bekämpft werden, was die Akzeptanz von BIOPRO® bei den Obstbauern erhöhen sollte. Die Unverträglichkeit von B. subtilis BD170 mit Schwefel kann allerdings zu Problemen beim Einsatz im ökologischen Obstbau führen. Hier wird anstatt Schwefel manchmal das Pflanzenstärkungsmittel Myco-Sin zur Pilzbekämpfung eingesetzt. Dieses zeigte in den beiden Testmethoden unterschiedliche Wirkung auf B. subtilis BD170. Bei Myco-Sin hängt die Wirkung auf Bakterien vom pH-Wert ab. Agarplatten, die 1% Myco-Sin enthalten 30 Abschlussbericht zum Projekt 0311785 (Meth. A) haben einen pH-Wert von 4, bei dem sich B. subtilis BD170 nicht vermehrt. Mischt man B. subtilis BD170 mit Myco-Sin und plattiert dann auf neutralen Platten aus (Meth. B), wird das Bakterienwachstum nicht gehemmt. Deshalb muss festgestellt werden, welcher pH-Wert in den Blüten nach Myco-Sin Applikation entsteht, um abschätzen zu können, ob Myco-Sin die Vermehrung von B. subtilis BD170 in der Blüte verhindert. Tabelle 9: Auswirkung von Pflanzenschutzmitteln auf die Überlebensrate von B. subtilis BD170 mit zwei verschiedenen Testmethoden: A: Ausplattieren von B. subtilis BD170 auf Agarplatten, die das Präparat in der empfohlenen Anwendungskonzentration enthalten. B: B. subtilis BD170 wird einer Suspension der empfohlenen Anwendungskonzentration zugegeben und 1h inkubiert. 50 µl des Gemisches werden dann zur Bestimmung der Überlebensrate auf NB-Platten ausplattiert. Wirkstoff Handelsname Konzentration (%) Wirkungsgrad (%) A Fungizide: B Captan Malvin 0,12 n.b. 100 Dichlofluanid Euparen 0,15 100 100 Dithianon Delan 0,2 100 96 Mancozeb Dithane Ultra 0,2 100 100 Metiram Polyram WG 0,15 100 n.b. Cyprodinil Chorus 0,03 33 -2 Pyrimethanli Scala 0,075 n.b. -6 Fluquinconazol+Pyrimethanil Vision 0,1 n.b. 5 Kresoxim-methyl Discus 0,012 7 -20 Flusilazol Benocap 0,012 33 -14 Penconazol Topas 0,025 n.b. -18 Triforin Saprol 0,12 100 n.b. Schwefel Sufran 0,25 92 100 1,0 100 -23 Mimic 0,05 - 32 Alpha-Naphtylessigsäure Amidthin 0,10 0 Etephon Cerone 0,15 43 Myco-sin Insektizide: Tebufenozid Wachstumsreegulatoren: 31 Abschlussbericht zum Projekt 0311785 Während der Blüte werden nur wenige Insektizide eingesetzt. Deshalb wurde bisher nur Tebufenozid auf seine Wirkung gegen B. subtilis BD170 überprüft. Der niedrige Wirkungsgrad (Tab. 7) deutet darauf hin, dass ein gleichzeitiger Einsatz beider Mittel in Frage kommt. Zwei Wachstumsregulatoren, die im integrierten Obstbau während der Blüte eingesetzt werden wurden auf Ihre Wirkung gegen B. subtilis BD170 getestet. Alpha- Naphtylessigsäure hat keine negative Auswirkung auf das Wachstum von BD170, und kann daher gleichzeitig mit BIOPRO® eingesetzt werden. Etephon reduziert die Vermehrung von B. subtilis BD170 und kann deshalb nicht empfohlen werden. 5.6 Die Wirkungsmechanismen der Mikroorganismen Wirkung von Mikroorganismen in der biologischen Bekämpfung von Pflanzenkrankheiten kann auf der Bildung antibiotischer Substanzen, auf Konkurrenz um Raum oder Nährstoffe oder auf induzierter Resistenz beruhen. Für die gezielte Anwendung von Mikroorganismen ist es von Vorteil den Wirkungsmechanismus zu kennen. Am Institut für biologischen Pflanzenschutz der BBA wurden deshalb innerhalb des Projektes Untersuchungen zum Wirkungsmechanismus der Isolate Pantoea agglomerans 21889, Rahnella aquatilis 39 und Bacillus subtilis BD170 durchgeführt. Als Stamm des Pathogens wurde Ea7/74 verwendet, der auch in vorangehenden Arbeiten als Testorganismus verwendet wurde und über eine gleichbleibende Virulenz verfügt. 5.6.1 Bildung antibiotischer Substanzen durch die Mikroorganismen 5.6.1.1 Agardiffusionstest Um die Aktivität der Isolate gegen den Erwinia amylovora Stamm Ea7/74 in vitro zu überprüfen, wurden Agardiffusionstests durchgeführt (Gonzales und Kunka, 1987). Da die Hemmaktivität antagonistischer Bakterien in vitro von der Nährstoffzusammensetzung abhängig ist, wurde der Agardiffusionstest auf verschiedenen Medien (Miller Schroth Selektivmedium (Brulez und Zeller, 1981) (MS); King`s Medium B; Tryptic soy agar (TSA); Nutrient Saccharose Agar (NSA)) durchgeführt, auf denen alle zu testenden Bakterienisolate ein gutes Wachstum zeigten. Einzelkolonien der antagonistischen Bakterienstämme wurden auf o.g. Medien transferiert und 48h bei 26°C inkubiert. Die gewachsenen Kolonien wurden auf folgende Weise weiterbehandelt: 32 Abschlussbericht zum Projekt 0311785 1. Variante: Überschichtung der Kolonien mit 3ml Ea7/74 Suspension (1x106 cfu/ml), absaugen überschüssiger Suspension und anschließende Inkubation für 24 h Inkubation bei 26°C. 2. Variante: Exposition der Kolonien in Chloroform-Dampf, weiter wie unter 1. 3. Variante: Für die Testung der bakteriziden Aktivität von Extrakten, Überständen oder Pellets wurden zunächst 100 µl einer Ea7/74-Suspension (106 cfu/ml) auf MS oder KBAgar ausplattiert. Mittels eines Korkbohrers wurden pro Petrischale 4 Löcher ausgestanzt und mit 100 µl der zu testenden Fraktion gefüllt. Lediglich durch die Versuchsdurchführung nach Variante 2 konnte die Ausbildung reproduzierbarer Hemmhöfe durch P. agglomerans 21889 und R. aquatilis 39 erreicht werden. Durch den Stamm B. subtilis BD170 wurde in keinem Fall ein reproduzierbarer Hemmhof verursacht. Aufgrund der Abhängigkeit der Hemmhofausbildung vom Zellaufschluss durch Chloroform im Falle von P. agglomerans 21889 und R. aquatilis 39 konnte eine Lokalisation bakterizider Substanzen in der Zellsubstanz vermutet werden. Um dieses zu überprüfen wurden nachfolgend die Teilfraktionen von Flüssigkulturen untersucht. Zunächst wurden Zellsubstanz und Überstand im Agardiffusionstest eingesetzt (Variante 3). Um die Freisetzung bakterizider Substanzen aus dem Zellinneren zu erreichen, wurde auch eine Ultraschall behandelte Probe des Pellets eingesetzt. 150 ml NS-Flüssigkulturen der Mikroorganismen wurden bei 28°C kultiviert. Nach 48 h wurden die Kulturen abzentrifugiert, Zellsubstanz und Überstand wurden separiert, der Überstand sterilfiltrert. Die beiden Fraktionen wurden anschließend im Agardiffusionstest untersucht. Die Zellsubstanz wurde sowohl nativ als auch in durch Ultraschall aufgeschlossener Form eingesetzt. Zum Ultraschall-Aufschluss wurden 2g Zellfrischmasse für 30 min mit einem Sonificator behandelt. Weder Kulturüberstand noch die unterschiedlich vorbereiteten Proben des Pellets bewirkten im Agardiffusionstest die Ausbildung eines Hemmhofs. Da eine zu geringe Konzentration der bakteriziden Substanz in Betracht gezogen werden musste, wurde versucht durch verschiedene Extraktionsverfahren die Aktivität aufzukonzentrieren. 5.6.1.2 Extraktion von Überstand und Zellsubstanz mit organischen Lösungsmitteln Als Lösungsmittel wurden zunächst Chloroform und Ethylacetat getestet. Nachdem sich gezeigt hatte, dass der Ethylacetat-Extrakt in der DC intensivere Banden verursachte, wurde für die folgenden Extraktionen nur noch Ethylacetat eingesetzt. Überstand und Zellsubstanz von 150 ml NS-Flüssigkulturen (48h, 28°C, 100 upm) wurden mit jeweils 33 Abschlussbericht zum Projekt 0311785 einem Lösungsmittel im Verhältnis 1/1 (v/v) extrahiert. Der Extrakt wurde nachfolgend am Rotationsverdampfer auf ein Endvolumen von ca. 2 ml eingeengt. Zur Extraktion der Zellsubstanz wurde das Pellet zunächst zweimal gewaschen und anschließend in 150 ml Saline resuspendiert. Die Zellsuspension wurde anschließend analog dem Überstand extrahiert. Um die bakteriziden Substanzen aufzureinigen, erfolgte eine präparative Auftrennung des Ethylacetat-Extraktes durch Dickschichtchromatographie. Da der bakterizide Substanzfleck aus dem Ethylacetat-Extrakt von B. subtilis BD170 den größten Hemmhof verursachte, wurde mit dieser Probe begonnen. Hierzu wurde 1 ml des Extraktes auf eine Dickschichtplatte (PSC, Merck) aufgetragen und mit Laufmittel A aufgetrennt. Der bakterizid wirkende Substanzfleck (Rf = 0,8) wurde ausgekratzt und mit 20 ml Methanol extrahiert. Die Probe wurde auf 5 ml eingeengt. Zur Identifizierung der inhibitorischen Substanzen wurde eine HPLC-Untersuchung durch Dr. Ellner, Institut für ökologische Chemie der BBA, Berlin durchgeführt. Die HPLC-Untersuchung der Probe ergab zahlreiche Peaks. Die durch Dickschichtchromatografie versuchte Aufreinigung ist deshalb als unzureichend anzusehen. Die fünf Hauptpeaks wurden fraktioniert und anschließend im Biotest auf ihre bakterizide Wirkung untersucht. Die Testung der Fraktionen erfolgte in 20 ml NS-Flüssigkulturen, die nach Zusatz von jeweils 1% (v/v) der fraktionierten Substanzen und Inokulation mit 0,1% (v/v) NS-Vorkultur bei 28°C inkubiert wurden. Als Kontrolle diente eine Kultur der 1% (v/v) HPLC-Eluent zugesetzt wurde. Das Wachstum wurde anhand der OD590 verfolgt. Bei keiner der getesteten Fraktionen konnte eine bakterizide Wirkung gegen E. amylovora 7/74 festgestellt werden. Als Gründe hierfür kommt neben einer Instabiliät der Substanz der Einsatz der falschen Peakfraktionen in Betracht. Eventuell war die bakterizide Aktivität in einem der kleineren Peaks enthalten, die nicht aufgefangen wurden, oder es wird eine Kombination verschiedener Komponenten für die bakterizide Aktivität benötigt, so dass die Einzelkomponenten nach der Trennung nicht mehr aktiv sind. 5.6.1.3 Wachstum von E. amylovora 7/74 in Kulturfiltraten antagonistischer Stämme Um zu untersuchen, ob P. agglomerans 21889, R. aquatilis 39 und B. subtilis BD170 Stoffe produzieren, die Ea7/74 erst in höherer Konzentration hemmen, oder das Wachstum des Pathogens durch Nährstoffkonkurrenz beeinflussen wurden die Wachstumsraten von Ea7/74 in sterilfiltrierten Überständen der antagonistischen Isolate getestet. 34 Abschlussbericht zum Projekt 0311785 P. agglomerans 21889, R. aquatilis 39, B. subtilis BD170 und E. amylovora 7/74 wurden 48h bei 28°C in 150 ml NS-Flüssigkulturen angezogen. Die Kulturen wurden abzentrifugiert (15 min, 10000g) und die Überstände sterilfiltriert. Die Überstände wurden in sterile 150 ml Kolben überführt und mit 1% einer E. amylovora 7/74 Vorkultur inokuliert. Das Wachstum wurde durch Bestimmung der OD590 verfolgt. Als Standard diente eine NSFlüssigkultur. Das Wachstum von E. amylovora 7/74 in sterilfiltrierten Überständen der NSFlüssigkulturen von P. agglomerans 21889, R. aquatilis 39 und B. subtilis BD170 unterschied sich nicht von dem der Kontrolle mit frischem NS-Flüssigmedium. In sterilfiltriertem Überstand von Ea 7/74 dagegen war ein geringerer Anstieg der Population zu verzeichnen. Dies zeigt, dass keines der Bakterienisolate im im Komplexmedium eine wirksame bakterizide Verbindung in die Kulturflüssigkeit abgab. Um zu testen ob durch Hitzeeinwirkung bakterizide Substanzen aus den Zellen der antagonistischen Isolate freigesetzt werden, wurde E. amylovora 7/74 in autoklavierten Kulturen von P. agglomerans 21889, R. aquatilis 39 und B. subtilis BD170 kultiviert. Über 48h angezogene NS-Flüssigkulturen (28°C) von P. agglomerans 21889, R. aquatilis 39, B. subtilis BD170 und E. amylovora 7/74 wurden autoklaviert und nachfolgend mit 1% (v/v) einer E. amylovora 7/74 Vorkultur inokuliert. Als Standard diente eine NS-Flüssigkultur. Das Wachstum wurde durch Ausplattierung von Verdünnungsreihen verfolgt. Das Wachstum von E. amylovora 7/74 in allen autoklavierten Überständen unterschied sich nicht signifikant von dem in der Kontrolle. Auch durch Hitzeeinwirkung wurden also keine bakterizide Substanzen aus den Zellen freigesetzt. 5.6.3 Nährstoffkonkurrenz Zur Untersuchung der Nährstoffkonkurrenz zwischen den Bakterienisolaten und dem Feuerbranderreger wurde die Populationsentwicklung von Antogonist und Pathogen in Kokultur untersucht. Dazu wurden antibiotikaresistente Mutanten eingesetzt. Die antibiotikaresistenten Stämme wurden mit P. agglomerans 21889Rf, R. aquatilis 39Rf, und E. amylovora 7/74Sm bezeichnet. Anschließend wurden 150 ml NS-Flüssigkulturen mit jeweils 1% (v/v) von P. agglomerans 21889Rf, R. aquatilis 39Rf oder B. subtilis BD170 und E. amylovora 7/74Sm angeimpft und über 5 Tage bei 24°C kultiviert (100 rpm). Jeweils nach 24 Stunden wurde eine Probe genommen und zur Analyse der Populationsentwicklung auf Rf oder Sm haltigem NS-Selektivagar ausplattiert, die Proben aus der Kokultur von B. subtilis BD170 und E. amylovora 7/74Sm wurden auf Sm haltigen Selekti35 Abschlussbericht zum Projekt 0311785 vagar und TSA ausplattiert. Als Kontrolle wurde die Populationsentwicklung einer E. amylovora 7/74Sm-Reinkultur verfolgt. Aus den Wachstumskurven war festzustellen, dass B. subtilis BD170 in Kokultur die Population von E. amylovora 7/74Sm nach 2 Tagen im Vergleich zur Kontrolle um Faktor 1000 reduziert (Abb.9). R. aquatilis 39Rf und P. agglomerans 21889Rf reduzierten die Population von E. amylovora 7/74Sm erst nach 4 Tagen signifikant. Die Reduktion der E.amylovora 7/74Sm Population durch B. subtilis BD170 in Kokultur zeigt, dass eine Wachstumshemmung bei direktem Kontakt stattfindet. Da bisher keine extrazellulären antibiotischen Substanzen bei B. subtilis BD170 nachgewiesen werden konnten (Glp. 5.6.1), ist diese Reduktion des Erregerwachstums auf Konkurrenz zurückzuführen. Der endgültige Nachweis dafür könnte erbracht werden, wenn die Hemmung durch Zugabe von Nährstoffen kompensiert wird. log (cfu/ml) 11 8 E.a. allein 5 E.a. Kokultur B.s. Kokultur 2 0 1 2 3 4 5 6 Zeit (d) Abbildung 9: Wachstumskurven von E.amylovora 7/74Sm und B. subtilis BD170 in Kokultur in NS-Medium im Vergleich zum Wachstum von E. amylovora 7/74Sm allein. 5.6.3 Resistenzinduktion Da bei den Isolaten R. aquatilis 39 und P. agglomerans 21889 in vitro keine starke bakterizide Wirkung gegen E. amylovora 7/74 nachzuweisen war, sollte untersucht werden ob durch die Lipopolysaccharide (LPS) dieser Stämme eine Resistenzreaktion induziert wird. 36 Abschlussbericht zum Projekt 0311785 Es sollte daher überprüft werden, ob durch Applikation von Kulturbestandteilen der Stämme R. aquatilis 39 und P. agglomerans 21889 die Entstehung reaktiver Sauerstoffspezies und eine Resistenzinduktion erzielt werden kann. Für die Reproduzierbarkeit dieser Untersuchungen ist es notwendig, mit der zu testenden Probe die Blattinterzellularen vollständig zu infiltrieren. Aufgrund der schlechten Infiltrierbarkeit von Apfel oder Birnenblättern wurde für den Versuch zunächst das Wirt/Parasit-System Buschbohne (Phaseolus vulgaris L.)/Pseudomonas syringae pv. phaseolicola (Fettfleckenkrankheit der Buschbohne) ausgewählt. Dabei handelt es sich um ein kompatibles System, bei dem das Pathogen auf eine Wirtspflanze trifft. Tabelle 10: Anfärbung von Superoxidradikalen (Doke, 1983) in Blättern der Buschbohne „Red Kidney“ durch Kulturfraktionen von P. agglomerans 21889 und R. aquatilis 39. Kulturübersstand und Pellets wurden durch Zentrifugation bei 600xg getrennt. Pellets wurden 2 mal in Saline resuspendiert. Resuspendierte Zellen wurden 5 min. bei 70°C erhitzt (Hitzeabgetöte Zellen) oder 24h bei Raumtemperatur mit 10µg/ml Proteinase K inkubiert. + = Formazanniederschlag stärker als Kontrolle, - = kein Unterschied zu Kontrolle Probe Bakterienstamm P.a. 21889 R.a.39 Gesamtkultur + + Kulturüberstand - + Pellet in Saline - + Hitzegetötete Zellen - + Proteinase behandelte Zellfragmente - + Nachdem die verstärkte Bildung von Superoxidradikalen durch Infiltration von Buschbohnenblättern mit Gesamtkulturen von R. aquatilis 39 und P. agglomerans 21889 einen Hinweis auf eine Resistenzinduktion durch die Stämme ergeben hatte (Tab. 10), sollte getestet werden ob durch die Präparate auch die Entwicklung der Krankheitssymptome der bakteriellen Fettfleckenkrankheit der Buschbohne beeinflusst werden kann. In diesem Versuch wurde von P. agglomerans 21889 lediglich die Gesamtkultur als Resistenzinduktor getestet, da nur durch diese eine verstärkte Bildung von Superoxidradikalen zu beobachten war. Im Falle von R. aquatilis 39 wurden neben der Gesamtkultur auch mit Proteinase behandelte Zellfragmente eingesetzt. 37 Abschlussbericht zum Projekt 0311785 Für den Versuch wurden pro Variante 12 Bohnenpflanzen in vier Töpfen eingesetzt. 24 h nach Applikation der zu testenden Proben erfolgte die Inokulation der Trifoliaten mit Pseudomonas syringae pv. phaseolicola 1715. Psp 1715 wurde über 24 h in 150 ml KBFlüssigkulturen angezogen (28°C), einmal gewaschen und in Saline resuspendiert. Die OD660 wurde auf 0,06 eingestellt, nachfolgend wurde die Bakteriensuspension 1:1000 verdünnt. Die Keimzahl des Inokulums betrug 1,5x105 CFU/ml. Inokuliert wurden die obersten Trifoliaten durch Sprühinokulation. Die Bonitur erfolgte durch die Ermittlung von Befallsgraden. Die Ergebnisse der Resistenzinduktion gegen Psp1715 (Tab. 11) entsprechen weitgehend denen des Superoxidradikal-Nachweises. Die Gesamtkulturen R. aquatilis 39 und P. agglomerans 21889 sind als Resistenzinduktoren aktiv. Auch die Proteinase-behandelten Zellfragmente von Ra39 verursachten eine deutliche Hemmung der Krankheitsentwicklung. In beiden Fällen entwickelte sich die Krankheit auch nach dem dargestellten Zeitraum von 12 Tagen nicht über das Stadium der wasserdurchtränkten Flecke (Boniturstufe 1) hinaus. Proteinase-behandelte Zellfragmente des Stammes P. agglomerans 21889 hatten nur eine geringfügige Verzögerung der Krankheitsentwicklung zur Folge. Tabelle 11: Resistenzinduktion an Buschbohne gegen Pseudomonas syringae pv. phaseolicola Psp 1715 durch Kulturfraktionen von R. aquatilis 39 und P. agglomerans 21889. 1 = wasserdurchtränkte Flecke, 2 = Chlorose, 3 = Chlorose, Nekrose Variante Befallsgrad an Tagen nach Inokulation 1 2 3 4 5 6 7 8 9 10 11 12 Kontrolle - - - - 1 1 2 2 3 3 3 3 Gesamtkultur von P.a. 21889 - - - - - - - 1 1 1 1 1 Proteinase behandelte Zell- fragmente von P.a. 21889 - - - - 1 1 2 2 2 3 3 Gesamtkultur von R.a. 39 - - - - - - - - 1 1 1 1 Zell- - - - - - - - - 1 1 1 1 Proteinase behandelte fragmente von R.a. 39 Als Konsequenz der bisher dargestellten Ergebnisse mit Kulturfraktionen von R. aquatilis 39 wurde das LPS von R. aquatilis 39 gereinigt und nachfolgend auf eine resistenzinduzierende Wirkung überprüft. Durch Infiltration von Apfel-, Buschbohen-, und Knollenbegonienblättern mit dem LPS-Präparat von R. aquatilis 39 konnte die Bildung von Superoxid38 Abschlussbericht zum Projekt 0311785 Radikalen beobachtet werden. Das LPS von P. syrngae pv. phaseolicola 1715 hatte diesen Effekt nur an Knollenbegonie, das von Xanthomonas campestris b525 nur an Buschbohne (Tab. 12). Tabelle 12: Anfärbung von Superoxidradikalen (Doke, 1983) in Blättern der Buschbohne „Red Kidney“, der Knollenbegonie „Oslo“ und des Apfels „Golden Delicious“ durch LPS von R. aquatilis 39, Pseudomonas syrngae pv. phaseolicola 1715 und Xanthomonas campestris b525; + = stärker als Kontrolle, - = kein Unterschied zur Kontrolle LPS-Präparat Versuchspflanze Apfel „Golden Delicious“ Buschbohne „Red Kidney“ Knollenbegonie „Oslo“ Ra39 + + + Psp1715 + - + Xcb525 + + - Im kompatiblen System Buschbohne - Pseudomonas syringae pv. phaseolicola wurden die LPS-Präparate von R. aquatilis 39 und Psp1715 zur Resistenzinduktion eingesetzt. Mit dem LPS-Präparat von R. aquatilis 39 konnte eine Verzögerung der Symptomausprägung um 3 Tage erreicht werden, während das LPS von Psp1715 keinen Effekt hatte (Tab. 13). Tabelle 13: Resistenzinduktion an Buschbohne gegen Pseudomonas syringae pv. phaseolicola 1715 durch LPS von P. syringae pv. phaseolicola 1715 und R. aquatilis 39. 1 = wasserdurchtränkte Flecke, 2 = Chlorose, 3 = Chlorose, Nekrose Variante Befallsgrad an Tagen nach Inokulation 1 2 3 4 5 6 7 8 9 10 11 12 Kontrolle - - - - 1 1 2 2 3 3 3 3 LPS von P.s.p. 1715 - - - - 1 2 2 3 3 3 3 3 LPS von R.a.39 - - - - - - - 1 1 1 1 1 39 Abschlussbericht zum Projekt 0311785 Es wurde außerdem versucht mit den LPS-Präparaten von R. aquatilis 39, P. syringae pv. phaseolicola 1715 und X. campestris b525 eine Resistenz gegen E. amylovora 7/74 in Apfelsämlingen zu induzieren. Da sich die Blätter von Apfelsämlingen sehr schlecht infiltrieren lassen, wurden die Blätter in eine konzentrierte LPS-Lösung (10 mg/ml) getaucht und 24 Stunden später durch Stichinokulation an 6 Punkten mit E. amylovora7/74 iokuliert. Hier konnten allerdings bis jetzt keine Ergebnisse erzielt werden, da die Infektion unregelmäßig erfolgte. Dies hängt vermutlich mit den durch die Inokulationsmethode bedingten Verletzungen zusammen, durch die allein es schon zu einer Resistenzreaktion der Pflanze kommen kann. Für die Zukunft ist daher vorgesehen die Versuche zur Resistenzinduktion an den Blütenständen von Zieräpfeln fortzuführen. Dabei sollen sowohl die LPS-Applikation als auch die Inokulation durch Besprühen der geöffneten Blütenstände erfolgen. 6. Darstellung der Verwertbarkeit der Ergebnisse 6.1 Produktionsverfahren In der phytopathologischen Literatur finden sich viele Berichte über erfolgreiche Screenings von Mikroorganismen zum Einsatz im biologischen Pflanzenschutz. Nur sehr wenige dieser vielversprechenden Mikroorganismen wurden bis zum marktfähigen Präparat weiterentwickelt. Der Weg vom wirksamen Isolat zum marktfähigen Produkt führt nur über ein geeignetes Produktionsverfahren. Im Rahmen dieses Projektes konnten Grundlagen zur Fermentation, Aufarbeitung und Formulierung von Mikroorganismen für den biologischen Pflanzenschutz erarbeitet werden, die auch bei der Produktion von weiteren wirksamen Isolaten hilfreich sein können. Vor allem das Wachstum vieler Mikroorganismen in dem kostengünstigen Produktionsmedium ist ein wichtiger Schritt auf dem Weg zu ökonomischen Produktionsverfahren. Das im Rahmen des Projektes entwickelte Produktionsverfahren für das Bacillus subtilis Isolat BD170 (Glp. 5.2.1) ist Grundlage für die Produktion des mikrobiellen Präparates BIOPRO®. Nach der Aufnahme von BIOPRO® in die Liste über Pflanzenstärkungsmittel der BBA im Mai 2001 wird, darf dieses Präparat zur Feuerbrandbekämpfung in Deutschland eingesetzt werden. Die für die Produktion der Hefeisolate (A. pullulans CF10, A. pullulans CF40, S. roseus CF35) gewonnenen Ergebnisse sollen in weiteren Forschungsprojekten zu einem prakti- 40 Abschlussbericht zum Projekt 0311785 kablen Produktionsverfahren führen. Die Produktion dieser Stämme ist besonders interessant, da sie sowohl gegen Apfelfäulen (Leibinger, 1996) als auch gegen den Feuerbranderreger einsetzbar sind (Glp. 5.4.1.1). 6.2 Untersuchungen zur Feuerbrandbekämpfung Trotz des zunehmenden Befalls mit Feuerbrand in allen Obstanbaugebieten ist die Durchführung von statistisch abgesicherten Freilandversuchen zur Feuerbrandbekämpfung immer noch sehr schwierig. Viele der in den letzten Jahren angesetzten Versuche konnten wegen eines zu geringen Befalls nicht ausgewertet werden. Gesicherte Ergebnisse sind deshalb nur in Versuchen zu erwarten, wo durch Inokulation mit dem Erreger für ein ausreichendes Inokulumspotenzial gesorgt wird. Beim Feuerbranderreger handelt es sich aber um einen Quarantäneerreger. Deshalb darf die Inokulation nur an isolierten, von den Behörden genehmigten Standorten stattfinden. Die Aggresivität des Erregers führt zusätzlich dazu, dass solche Versuchsanlagen nach dem Versuch meist gerodet werden müssen. Diese Umstände machen Versuche zur Feuerbrandbekämpfung schwierig und teuer. Deshalb war es notwendig ein Testsystem zu finden, das es ermöglicht verschiedene Mikroorganismen und verschiedene Formulierungen zu testen. Dies gelang innerhalb des Projektes mit dem Aufbau des in-vivo Testsystems. Dieses System kann weiter zum Screening von Wirkorganismen und Wirkstoffen genutzt werden, so dass die Suche nach wirksameren Präparaten mit einer höheren Effizienz fortgesetzt werden kann. In den Freilandversuchen wurde hauptsächlich das B. subtilis Isolat BD170 eingesetzt. Die Ergebnisse aus diesen Versuchen werden für das Zulassungsverfahren von BIOPRO® in der Schweiz verwendet. Diese Ergebnisse werden auch zur Einschätzung des Präparates für Berater und Anwender benötigt. Leider bestätigten sich die positiven Versuchsergebnisse aus dem Jahr 1999 nicht in allen Versuchen, so dass sich Zweifel an der Verwendbarkeit von BIOPRO® zur Feuerbrandbekämpfung ergaben. Neue Ergebnisse mit dem in vivo Testsystem zeigen, dass die Temperatur einen großen Einfluss auf die Wirksamkeit von BIOPRO® hat. Bei Temperaturen unter 25°C nimmt die Vermehrung auf der Blüte und damit die Wirksamkeit ab. Im Freiland kann die Temperatur natürlich nicht beeinflußt werden. Allerdings zeigte sich, dass bei geringeren Temperaturen A. pullulans CF40 wirksam ist. So könnte mit der Zugabe dieses Isolates zu BIOPRO® die Wirksamkeit im unteren Temperaturbereich deutlich verbessert werden. Die Ergebnisse zum Wirkungsmechanismus der Mikroorganismen bei der Feuerbrandbekämpfung werden für die Planung weiterer Versuche berücksichtigt. Da die Wirkung von 41 Abschlussbericht zum Projekt 0311785 B. subtilis BD170 auf Konkurrenz beruht, muss hier darauf geachtet werden, dass eine Möglichst gute Vermehrung in der Blüte stattfindet. Der Wirkung von R. aquatilis scheint dagegen auf der Induktion einer Resistenz durch das LPS dieses Bakteriums zu beruhen. Bei der Terminierung von Behandlungen müssen diese unterschiedlichen Wirkungsweisen berücksichtigt werden. Zusätzlich könnte ein Kombination beider Organismen eine deutliche Steigerung der Wirksamkeit bringen. 7. Darstellung der während der Durchführung von dritter Seite bekannt gewordenen Ergebnisse In Deutschland und in anderen europäischen Ländern wie der Schweiz, Österreich, Italien und Ungarn (Németh, 1999) schritt die Ausbreitung des Feuerbranderregers im Berichtszeitraum weiter voran. Obwohl die Befallssituation in Süddeutschland und in der Schweiz (FAW, 2001; Feuerbrandgruppe-FAW, 2001) im Jahr 2001 weniger gravierend war als im Jahr 2000, sollte man nicht von einer Entspannung ausgehen, da diese Schwankungen im Auftreten des Erregers von den Witterungsbedingungen während der Blüte abhängen. Latenter Befall in symptomlosen Pflanzen kann unter günstigen Witterungsbedingungen immer wieder zu neuen Epidemien führen (Crepel und Maes, 2000). Dies zeigt, dass in der Zukunft weltweit vermehrt Präparate zur Bekämpfung des Feuerbrandes benötigt werden. Dass man sich dabei nicht nur auf ein Präparat wie das Antibiotikum Streptomycin verlassen kann, zeigen die Erfahrung mit der Resistenzentwicklung gegenüber diesem Wirkstoff aus USA (Johnson und Stockwell, 1998), Israel (Manulis et al., 1998) und Kanada (Sholberg et al., 2001). In Deutschland konnte das Antibiotikum Streptomycin (Handelsname: Plantomycin) über eine Allgemeinverfügung der BBA von 1994 bis 1998 zur Feuerbrandbekämpfung eingesetzt werden (Backhaus und Klingauf, 1998). Diese Allgemeinverfügung wurde für 1999 nicht mehr ausgesprochen, so daß Plantomycin in Deutschland nicht mehr eingesetzt werden konnte. Im Jahr 2000 erfolgte dann eine auf drei Jahre befristete Zulassung von Plantomycin als PfIanzenschutzmittel, so dass im Jahr 2000 Plantomycin zur Feuerbrandbekämpfung eingesetzt wurde. Der im Vergleich zur Schweiz geringere Befall in Deutschland wurde auf diesen Antibiotikaeinsatz zurückgeführt. Im März 2001 wurde in Deutschland die Zulassung des Antibiotikums Streptomycin ausgesetzt, da Rückstände in Honigen nachgewiesen wurden (Pressemitteilung der BBA vom 13.03.2001). Somit stand im Jahr 2001 in Deutschland kein zugelassenes Pflanzenschutzmittel zur Bekämpfung des Feuerbrandes zur Verfügung. 42 Abschlussbericht zum Projekt 0311785 Durch die Unsicherheit bei der Verfügbarkeit von Plantomycin und der Bedarf an Bekämpfungsmöglichkeiten im ökologischen Obstbau haben in den letzten Jahren zu erhöhten Forschungsaktivitäten in Sachen Feuerbrandbekämpfung geführt. In Israel zeigten Feldversuche an Birnen, dass mit Oxolinsäure eine gute Wirkung gegen den Feuerbranderreger erzielt werden kann (Shtienberg et al., 2001). Ob sich diese Versuche in anderen Anbaugebieten bestätigen und ob dieses synthetisches Quinolinderivat, das von der Japanischen Firma Sumitomo Chemicals als Bakterizid entwickelt wurde, eine Zulassung als Pflanzenschutzmittel in Europa bekommen wird, ist bisher nicht absehbar. In den USA wird das Präparat Blight Ban A506 mit dem Wirkorganismus Pseudomonas flourescens Stamm A506 zum Einsatz gegen den Feuerbrand angeboten (Johnson und Stockwell, 1998). Der Stamm trägt eine Antibiotikaresistenz, was eine Genehmigung in Deutschland erschweren würde. Außerdem konnte mit dem Präparat in Deutschland keine befriedigende Wirkung erzielt werden (Fried, 1999). In Versuchen der Pflanzenschutzdienste der Länder Rheinland-Pfalz und BadenWürttemberg wurden in den letzten Jahren diverse alternative Präparate getestet (Fried, 1999; Fried, 2001a; Fried, 2001b; Harzer, 2001; Knewitz und Lehn, 1999). Keines der Präparate erreichte in den Versuchen mit dem Streptomycin vergleichbare Wirkungsgrade. Getestet wurden Wachstumsregulatoren (Prohexadion-Ca) Gesteinsmehlpräparate (Myco-Sin) und mikrobielle Präparate. Neben den in diesem Forschungsprojekt entwickelten Präparat BIOPRO® wurden noch weitere Präparate mit dem Wirkorganismus B. subtilis getestet (Serenade®; FZB24®WG). Die Schwankungen in der Wirkung der alternativen Präparate war zwischen den einzelnen Versuchen größer als die Unterschiede zwischen den Präparaten. Eine Bewertung der einzelnen Mittel ist deshalb schwierig. Insgesamt waren die Wirkungsgrade mit maximal 58% zu gering, als dass die Präparate von den Pflanzenschutzdiensten empfohlen werden könnten. 8. Veröffentlichungen Teilergebnisse aus diesem Forschungsprojekt wurden vom Institut für biologischen Pflanzenschutz der BBA auf Tagungen vorgestellt und in den Tagungsbänden veröffentlicht (Basim et al., 2000; Laux et al., 2000; Laux et al., 1999). Die Ergebnisse der Freilandversuche, für die Präparate zur Verfügung gestellt wurden, wurden von den Versuchsanstellern veröffentlicht (Fried, 1999; Fried, 2001a; Fried, 2001b; Harzer, 2001; Knewitz und Lehn, 1999). 43 Abschlussbericht zum Projekt 0311785 9. Literatur Andrews, J. H., R. F. Harris, R. N. Spear, G. W. Lau und E. V. Nordheim (1994): Morphogenesis and adhesion of Aureobasidium pullulans. Canadian Journal of Microbiology 40, 6-17. Backhaus, G. F. und F. Klingauf (1998): Die Feuerbrandkrankheit und ihre Bekämpfung in der Bundesrepuplik Deutschland. Nachrichtenbl. Deut. Pflanzenschutzd. 50, 193199. Basarab, G. S., R. S. Livingston, S. J. Vollmer, C. B. Johnson und K. T. Kranis (1992): Design of sterol reductase inhibitors. In: D. R. Baker, J. G. Fenyes und J. J. Steffens (eds.). Synthesis and chemistry of agrochemicals III. pp. 414-427. American Chemical Society, Washington DC. Basim, H., O. Yegen, P. Laux und W. Zeller (2000): Biocontrol of Erwinia amylovora with antagonistic bacteria. 52. Deutsche Pflanzenschutztagung, FreisingWeihenstephan. Brulez, W. und W. Zeller (1981): Seasonal changes of epiphytic Erwinia amylovora on ornamentals in relation to weather conditions and the course of infection. Acta Horticulture 117, 37-43. Crepel, C. und M. Maes (2000): Hibernation of the fire blight pathogen Erwinia amylovora in host Plants. Med. Fac. Landbouww. Rijksuniv. Gent 65, 19-25. Doke, N. (1983): Involvement of superoxide anion generation in the hypersensitive response of potato tuber tissues to infection with an incompatible race of Phythophthora infestans and to hyphal wall components. Physiol. Pl. Path. 23, 345-357. Falconi, C. J. und K. Mendgen (1994): Epiphytic fungi on apple leaves and their value for control of the postharvest pathogens Botrytis cinerea, Monilinia fructigena and Penicillium expansum. Zeitschrift für Pflanzenkrankheiten und PflanzenschutzZeitschrift für Pflanzenkrankheiten und Pflanzenschutz 101, 38-47. FAW, F. (2001): Feuerbrand: Befallssituation bis Anfang August 2001. Schweizerische Zeitschrift für Obst-und Weinbau 137, 504. Feuerbrandgruppe-FAW (2001): Feuerbrand: Befallssituation bis Anfang August 2001. Schweizerische Zeitschrift für Obst-und Weinbau 137, 504. Fried, A. (1999): Feuerbrand - Bekämpfungsversuche 1998 - Fortsetzung der Prüfung alternativer Mittel zu Plantomycin. Obstbau 24, 71-74. Fried, A. (2001a): Feuerbrandbekämpfungsversuche 2000. Obstbau 26, 116-119. Fried, A. (2001b): Feuerbrandversuche 2001 - gibt es wirksame alternativen zu Plantomycin. Obstbau 26, 453-457. Gonzales, C. F. und B. S. Kunka (1987): Plasmid associated bacteriocin production and sucrose fermentation in Pediococcus acidilactici. Appl. Environ. Microbiol. 53, 2534-2538. Harzer, U. (2001): Prüfung von Alternativen zu Plantomycin. Obstbau 26, 450-452. Johnson, K. B. und V. O. Stockwell (1998): Management of fire blight: a case study in microbial ecology. Ann. Rev. Phytopathol. 36, 227-48. Johnson, K. B., V. O. Stockwell, D. M. Burgett, D. Sugar und J. E. Loper (1993): Dispersal of Erwinia amylovora and Pseudomonas fluorescens by honeey bees from hives to apple and pear blossoms. Phytopathology 83, 478-484. Junge, H., B. Krebs, B. Höding, A. Ockhardt und S. Kübart (1998): Verfahrensentwicklung zur Nutzung von Bacillus subtilis: - Abschlussbericht zum Forschungsprojekt 0310140 A. UB/TIB Hannover, Hannover. Kleinhempel, H., K. Naumann und D. Spaar (1989): Bakterielle Erkrankungen der Kulturpflanzen. VEB Gustav Fischer Verlag, Jena 44 Abschlussbericht zum Projekt 0311785 Knewitz, H. und F. Lehn (1999): Feuerbrandbekämpfung - Gibt es Alternativen zu Plantomycin? Obstbau 75-76. Laux, P., Ö. Baysal und W. Zeller (2000): Studies on the mode of action of Rahnella aquatilis Ra39 against Erwinia amylovora. In: (eds.). Proceedings of the 6th IOBC/WRPS-EFPP Biocontrol Workshop. pp. im Druck. Laux, P., K. Hofer und W. Zeller (1999): Untersuchungen im Freiland zur Bekämpfung des Feuerbrandes mit bakteriellen Antagonisten. In: K. Pieber und G. Bedlan (eds.). 2. Symposium Phytomedizin und Pflanzenschutz im Gartenbau. pp. 53-54. Druckerei Lischkar & co., Wien. Leibinger, W. (1996): Biologische Bekämpfung von Lagerfäuleerregern und Etablierung der antagonistischen Mikroorganismen auf der Apfeloberfläche. Universität, Fakultät für Biologie Lüth, P. (2000): Fungizide aus lebenden Mikroorganismen-Probleme und Chancen aus Sicht eines kleinen Unternehmens. Nachrichtenbl. Deut. Pflanzenschutzd. 52, 222ss5. Manulis, A., D. Zutra, F. Kleitmann, O. Dror, I. David, M. Zilberstaine und E. Shabi (1998): Distribution of streptomycin-resistant strains of Erwinia amylovora in Israel and occurence of blossom blight in the autumn. Phytoparasitica 26, 223-230. Moltmann, E. (1996): Erfahrungen mit der Feuerbrandprognose nach verschiedenen Prognosemodellen 1994-1996 in Baden-Württemberg. Nachrichtenbl. Deut. Pflanzenschutzd. 48, 245-252. Moltmann, E. (1999): Streptomycinresistene Feuerbranderreger (Erwinia amylovora) in Baden-Württemberg bisher nicht nachgewiesen. Nachrichtenbl. Deut. Pflanzenschutzd. 51, 293-294. Németh, J. (1999): Fireblight (Erwinia amylovora) of pome fruits in hungary: national phytosanitary measures and management of the disease. Bulletin OEPP/EPPO 29, 235. Pusey, P. L. (1997): Crab apple blossoms as a model for research on biological control of fire blight. Phytopathology 87, 1096-1102. Pusey, P. L. (1999): Effect of nectar on microbial antagonists evaluated for use in control of fire blight of pome fruits. Phytopathology 89, 39-46. Pusey, P. L. (2000): The role of water in epiphytic colonization and infection of pomaceous flowers by Erwinia amylovora. Phytopathology 90, 1352-1357. Schiewe, A. und K. Mendgen (1992): Identification of antagonists for biological control of the post-harvest pathogens Pezicula malicorticis and Nectria galligena on apples. J. Phytopathol. 134, 229-237. Sholberg, P. L., K. E. Bedford, P. Haag und P. Randall (2001): Survey of Erwinia amylovora isolates from British Columbia for resistance to bactericides and virulence on apple. Can. J. Plant Pathol. 23, Shtienberg, D., M. Zilberstaine, D. Oppenheim, Z. Herzog, S. Manulis, H. shwartz und G. Kritzman (2001): Efficacy of oxolinic acid and other bactericides in suppression of erwinia amylovora in pear orchards in Israel. Phytoparasitica 29, 143-154. Sneath, P. H. A., N. S. Mair, M. E. Sharpe und J. G. Holt (1986): Bergey´s Manual of systematic Bacteriology. Williams & Wilkins, Baltimore. Wolf, B. (1994): Zur biologischen Bekämpfung des Feuerbranderrers (Erwinia amylovora (Burrill) Winslow et al.) mit bakteriellen Antagonisten. Ruprecht-Karls-Universität, Fachbereich Biologie Wolf, B. und W. Zeller (1993): Biologische Bekämpfung des Feuerbrandes (Erwinia amylovora) mit bakteriellen Antagonisten. In: J. Kienzle und M. Straub (eds.). 6. Internationaler Erfahrungsaustausch über Forschungsergebnisse zum Ökologischen Obstbau. pp. 187-190. Fördergemeinschaft Ökologischer Obstbau e. V., Weinsberg. 45 Abschlussbericht zum Projekt 0311785 Zeller, W. und P. Laux (2001): Neueste Ergebnisse zur Feuerbrand-Bekämpfung mit alternativen biologischen Verfahren. Gesunde Pflanzen 53, 158-162. 46