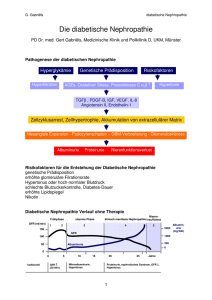
01/2014 - Niere und Antihypertensive Therapie - Nieren
Werbung

ISSN 1605-881X Falls unzustellbar, bitte retour an: MEDMEDIA Verlag, Seidengasse 9/Top 1.1, 1070 Wien P.b.b. GZ 02Z031654 M, Benachrichtigungspostamt 1070 Wien ÖSTERREICHISCHE GESELLSCHAFT FÜR NEPHROLOGIE Interdisziplinäre Fortbildungsreihe der Österreichischen Gesellschaft für Nephrologie Script 17. JAHRGANG/NR. 1/2014 Fa c hk ur zi nf or m at ion sie he S eit e3 2 Niere und antihypertensive Therapie 1 ich erre t s Ö in e r e an i t r m a e s r P Irbe rbepress ® Irbesartan Schutz von Herz und Nieren über 1 die Blutdrucksenkung hinaus sticht zweifach! ng ndlu a h Be der ie n erto Hyp g 40 m mg | 80 Kar bei diov Prä askulär e Hoc vent i hris ikop on atie nten 80 m g IND-frei Teilbare und laktosefreie Filmtabletten TELMI Telmisartan ab 1. Mai 2014 IND – frei!* CARD ® 1/03.2014 Fachinformation Telmicard® Stand Oktober 2013. *geplante Veröffentlichung im WVZ 05/2014 Telmicard_Irbepress_A4_ 297x210mm_19.03.14.indd 1 24.03.2014 08:15:39 Fotos: beigestellt Telmisartan Fachkurzinformation siehe Seite 32 Review: Croom KF et al. Irbesartan: a review of its use in hypertension and in the management of diabetic nephropathy. Drugs 2004; 64:999-1028. Fachkurzinformation siehe Seite xx 1 IND – frei! NEPHRO Script EDITORIAL ao. Univ.-Prof. Dr. Sabine Schmaldienst Ass.-Prof. Priv.-Doz. Dr. Marcus D. Säemann Sehr geehrte Nephrologinnen, Sehr geehrte Nephrologen! Fachkurzinformation siehe Seite 32 ! S D ® 8:15:39 Fotos: beigestellt * Fachkurzinformation siehe Seite xx 014 Bereits Xenophanes (570–470 v. Chr.) wusste von einem ­Fortschritt in unserer Wahrheitssuche: „Nicht von Beginn an enthüllen die Götter den Sterblichen alles. Aber im Laufe der Zeit finden wir, suchend, das Bessere.“ Lasst uns suchen! ich ständig verändernde, ja überraschende Daten zu Themen, welche uns oft nur allzu bekannt vorkommen, zeigen jedes Mal aufs Neue, dass wir uns in der Nephrologie wie auch in der gesamten Medizin in einem Umfeld befinden, wo es letzte Gewissheiten in unserem Verständnis von den Ursachen und letztlich Therapien von Erkrankungen niemals geben kann. Darauf können wir nur durch fortwährende sinnvolle Reflexion neuer Daten und deren Interpretation mit unbestechlichem Hausverstand und vor allem klinischer Erfahrung reagieren, um daraus Schlüsse zu ziehen, von denen letztlich unsere PatientInnen profitieren. So wird NephroScript als die Zeitschrift der Österreichischen Gesellschaft für Nephrologie künftig vermehrt auf neue Erkenntnisse in unserem Fachgebiet unmittelbar reagieren, wobei wir dabei auch versuchen werden, unsere medizinisch-nephrologische Praxis kritisch zu hinterfragen. Dies soll zum einen helfen, sich nicht nur unserer eigentlichen Kernkompetenzen unseres Faches bewusst zu sein, sondern diese auch intensiv zu befördern, und es soll zum anderen auch zur Anregung und Fortbildung unserer jungen NephrologInnen beitragen. Demgemäß finden sich in dieser Ausgabe scheinbar klassische Themen wie die Behandlung der chronischen Niereninsuffizienz und der Hypertonie in der terminalen Phase durch Renin-Angiotensin-Aldosteron-Blockade: bereits hier taucht aber durch neueste Erkenntnisse eine Vielzahl von Widersprüchen in unserem bislang gewohnten Weltbild auf, wobei die Meinung bekannter NephrologInnen unseres Landes hierzu dem/ der kritischen LeserIn nur eine weitere Hilfestellung und Orientierung für das eigene Engagement und klinische Handeln geben soll. Die derzeit gültigen Standards in der Therapie der nicht-diabetischen Niereninsuffizienz sowie neue vielver­sprechende Therapiealternativen der diabetischen Nephropathie erweitern die Darstellungen unseres Fachgebiets in dieser Ausgabe. Viel Spaß beim Lesen! ao. Univ.-Prof. Dr. Sabine Schmaldienst Ass.-Prof. Priv.-Doz. Dr. Marcus D. Säemann 3 ÖSTERREICHISCHE GESELLSCHAFT FÜR NEPHROLOGIE Ausschreibung des Förderungspreises der Österreichischen Gesellschaft für Nephrologie 2014 VORSITZENDER: A. Rosenkranz STELLVERTRETER: E. Pohanka BEIRAT: R. Klauser-Braun K. Lhotta M. Säemann SEKRETÄRIN: K. Eller SCHATZMEISTER: R. Oberbauer KOOPTIERTER VORSTAND: Ch. Aufricht M. Auinger P. Balcke G. Böhmig D. Geissler S. Horn J. Kovarik R. Kramar G. Mayer J. Pidlich H. Regele A. Sadjak S. Schmaldienst O. Traindl A. Vychytil I. Waller B. Watschinger E. Zitt Förderungspreis der Österreichischen Gesellschaft für Nephrologie in der Höhe von 4.500,– Euro Gemäß den Satzungen der Österreichischen Gesellschaft für Nephrologie sind folgende Teilnahmebedingungen zu erfüllen: 1.) Der Bewerber muss österreichischer Staatsbürger sein oder seinen ordentlichen Wohnsitz in Österreich haben. Bei Gemeinschaftsarbeiten gilt diese Bedingung für mindestens einen der Autoren. 2.) Der Bewerber darf nur eine Arbeit einreichen. 3.) Es können nur Arbeiten mit klinischer Relevanz auf dem Gebiet der Nephrologie eingereicht werden, die noch nicht – oder nicht länger als ein Jahr vor dem Datum der Ausschreibung – im Druck erschienen sind. Der (die) Name (Namen) des (der) Autors* (Autoren) soll (sollen) nicht erkennbar sein. Habilitationsarbeiten sind von der Teilnahme ausgeschlossen. 4.)Die Arbeit muss als PDF-Datei per E-Mail ([email protected]) eingereicht werden. Die Institutionen und Namen der Autoren dürfen nicht erkennbar sein. In der E-Mail führen Sie bitte jedoch den Titel der Arbeit, die Namen der Autoren und die Institutionen sowie eine Kontaktadresse (postalisch und E-Mail) an. 5.) Die Zuerkennung des Preises erfolgt unter Ausschluss des Rechtsweges. 6.) Die Einreichung der Arbeit hat an die Österreichischen Gesellschaft für Nephrologie zu erfolgen (siehe Punkt 4). Ausschreibung des Hans-Krister-Stummvoll-Preises der Österreichischen Gesellschaft für Nephrologie 2014 Hans-Krister-Stummvoll-Preis der Österreichischen Gesellschaft für Nephrologie in der Höhe von 3.000,– Euro Erstautoren, deren Arbeiten für den Förderungspreis der Österreichischen Gesellschaft für Nephrologie für das Jahr 2014 eingereicht, aber nicht mit dem Preis bedacht wurden, werden eingeladen, ihre Arbeit im Rahmen der Jahrestagung der Österreichischen Gesellschaft für Nephrologie als Kurzreferat zu präsentieren. Vom Publikum vor Ort wird mittels geheimer Abstimmung der Preisträger gewählt. Falls Sie Ihre Arbeit auch für den Hans-Krister-Stummvoll-Preis einreichen wollen, dann bestätigen Sie dies in der E-Mail, mit der Sie die Arbeit einreichen. Es wird darauf hingewiesen, dass die Präsentation der Arbeit für den Hans-Krister-Stummvoll-Preis durch den Erstautor der Arbeit erfolgen muss. Der Endtermin für die Einreichung ist der 15. Juni 2014. Univ.-Prof. Dr. Alexander Rosenkranz Priv.-Doz. Dr. Katrin Eller (Vorsitzender)(Sekretärin) * Bezeichnungen erfolgen geschlechtsneutral FOCUS NEPHRO Script INHALT 03Editorial 05 Seite der Gesellschaft FOCUS 06 Das RAAS als Therapieansatz in der Nephrologie Dr. Katharina Hohenstein, Univ.-Prof. Dr. Bruno Watschinger 10 Quo vadis RAAS-Blockade? Dr. Marlies Antlanger, Dr. Johannes Kovarik, PhD 16Experteninterview: Blockade des Renin-Angiotensin-Aldosteron-­ Systems bei chronischer Niereninsuffizienz in der Praxis Im Interview: Prim. Univ.-Doz. Dr. Karl Lhotta, Priv.Doz. Dr. Matthias Lorenz, Prim. Univ.-Prof. Dr. Erich Pohanka, Univ.-Prof. Dr. Andreas Vychytil; Interview: Dr. Marlies Antlanger, Dr. Johannes Kovarik, PhD 23 Hypertonietherapie bei Diabetes mellitus ohne Nephropathie Univ.-Prof. Dr. Alexander Rosenkranz HOT TOPIC 28 Fibrate und chronische Niereninsuffizienz: eine unterschätzte therapeutische Option? Dr. Johannes Werzowa, Univ.-Prof. Dr. Marcus Säemann FREIES THEMA (entgeltliche Einschaltung) 38 Nebenschilddrüsen-Antagonist Paricalcitol (Zemplar®) – Sekundärer Hyperparathyreoidismus und ­Nierenersatztherapie 30 10 Jahre Cinacalcet: eine fixe Säule in der sHPT-Therapie! 31 Xarelto (Rivaroxaban) – Klinischer Alltag: DOAK und perioperatives ­Management ® 19 Endothelin-Antagonisten bei diabetischer ­Nephropathie Univ.-Doz. Dr. René R. Wenzel IMPRESSUM Verlag: MEDMEDIA Verlag und Mediaservice Ges.m.b.H. Verlagsleitung: Mag. Gabriele Jerlich. Herausgeber: Österreichische Gesellschaft für Nephrologie, Univ.Prof. Dr. Alexander Rosenkranz, Klinische Abteilung für Nephrologie, M ­ edizinische Universität Graz. Chefredakteur: Univ.-Prof. Dr. Sabine Schmaldienst, Klinische Abteilung für Nephrologie und Dialyse, Universitätsklinik für Innere Medizin III, AKH Wien. Ass.-Prof. Priv.-Doz. Dr. Marcus D. Säemann, Klinische Abteilung für Nephrologie und Dialyse, Universitätsklinik für Innere Medizin III, AKH Wien. Anzeigen/Organisation: MEDMEDIA Verlag und Mediaservice Ges.m.b.H., Seidengasse 9/Top 1.1, 1070 Wien, Tel.: 01/407 31 11. Projekt­leitung: Elisabeth Hönigschnabel. Produktion: Mag. (FH) Sandra Kucharik. Redaktion/Lektorat: Peter Lex. Layout/DTP: Patrick Kloepfer. Cover­: shutterstock.com. Druck: Donau Forum Druck, 1230 Wien. Druckauflage: 7.625 Stück im 1. Halbjahr 2013, geprüft von der Österreichischen Auflagenkontrolle. Bezugsbedingungen: Die Zeitschrift ist zum Einzelpreis von 9,50 Euro plus MwSt. zu be­ziehen. Grundsätze und Ziele von ­ pplikationsformen und IndikatiNEPHRO Script: Information für nephrologisch interessierte Krankenhaus- und niedergelassene Ärzte. Angaben über Dosierungen, A onen von pharmazeutischen Spezialitäten müssen vom jeweiligen Anwender auf ihre Richtigkeit überprüft werden. Herausgeber und Medieninhaber übernehmen dafür keine Gewähr. L ­ iteratur zu den Fachbeiträgen bei den jeweiligen Autoren. Allgemeine Hinweise: Namentlich gekennzeichnete Beiträge geben die persönliche und/oder wissenschaftliche Meinung des jeweiligen Autors wieder und fallen somit in den persönlichen Verantwortungs­bereich des Verfassers. Mit „Freies Thema“ gekennzeichnete Beiträge sind entgeltliche Einschaltungen gem. § 26 Mediengesetz und fallen in den Verantwortungsbereich des jeweiligen Auftraggebers; sie müssen nicht die Meinung von Herausgeber, Reviewer oder Redaktion wiedergeben. Angaben über Dosierungen, Applikationsformen und Indikationen von pharmazeutischen Spezialitäten müssen vom jeweiligen Anwender auf ihre Richtigkeit überprüft werden. Trotz sorgfältiger Prüfung über­nehmen Medieninhaber und Herausgeber kei­nerlei Haftung für drucktechnische und inhaltliche Fehler. Ausgewählte Artikel dieser Ausgabe finden Sie auch unter www.medmedia.at zum Download. Kein Teil des Werkes darf in irgendeiner Form (Fotokopie, Mikrofilm oder ein anderes Verfahren) ohne schriftliche Genehmigung des Verlages reproduziert oder unter Verwendung elektronischer Systeme gespeichert, verarbeitet, vervielfältigt, verwertet oder verbreitet werden. Die gesetzliche Offenlegung gemäß § 25 MedienG finden Sie unter www.medmedia.at/home/impressum. 5 FOCUS NEPHRO Script uu Eine spezifische, blutdruckunabhängige Nephroprotektion durch RAAS-Blocker bei proteinurischen Nierenerkrankungen (und schlechter Blutdruckeinstellung) ist möglich. Für eine Vielzahl von Patienten mit arterieller Hypertonie bieten RAASHemmer aber wahrscheinlich keine oder eine nur sehr geringe Nephroprotektion jenseits der Drucksenkung. uu Die rechtzeitige Diagnose einer arteriellen Hypertonie in Verbindung mit einem frühzeitigen Therapiebeginn ist nach wie vor die beste Nephroprotektion und ist auch effektiv in der Verhinderung kardiovaskulärer Todesfälle. Wirksamkeitsevidenz aus Studien zu am Renin-Angiotensin-Aldosteron-System (RAAS) ansetzenden ­Antihypertensiva Das RAAS als Therapieansatz in der ­Nephrologie H ypertonie und Diabetes sind die zwei wichtigsten Ursachen einer chronischen Niereninsuffizienz und hauptverantwortlich für die steigende Prävalenz ersatztherapiepflichtiger Nierenversagen in Österreich und weltweit in vielen Industrieländern. Gleichzeitig stellen Hypertonie und Diabetes Hauptrisikofaktoren für Herz-Kreislauf-Erkrankungen, kardiovaskuläre Ereignisse und Todesfälle dar. Um diese Krankheitskomplikationen zu vermeiden, konzentrieren sich die Behandlungsstrategien auf eine Verbesserung der Stoffwechseleinstellung und die Kontrolle des arteriellen Blutdrucks. Besonders die Hypertoniebehandlung hat sich für renale Patienten als unabdingbar und wirksam erwiesen. In vielen Studien konnte zweifelsfrei gezeigt werden, dass eine gute Blutdruckeinstellung reno- und kardioprotektiv wirkt. Unterschiedliche Medikamente stehen zum therapeutischen Einsatz zur Verfügung. Ein Mechanismus, der bei der Behandlung von Patienten mit renalen Erkrankungen besonders bedeutend ist, ist die Hemmung des ReninAngiotensin-Aldosteron-Systems (RAAS). Hemmer des RAAS, i. e. ACE-Hemmer, Angiotensin-Rezeptor-Blocker, Renin-Inhibitoren und Aldosteron-Antagonisten, zeigen neben der Blutdrucksenkung auch positive Einflüsse auf die Reduktion einer Proteinurie, die ähnlich der Hypertonie einen Hauptrisikofaktor für die Entwicklung einer Niereninsuffizienz darstellt. Einige wichtige Studien zum Einsatz von RAAS-Hemmern bei nephrologischen Patienten sind im Folgenden kurz zusammengestellt. Renin-Angiotensin-Aldosteron-System (RAAS) Die Aufklärung der Wirkweise des RAAS begann 1898 mit der Entdeckung von Renin durch Tigerstedt und Bergman. Renin wird als Prorenin in den juxtaglomerulären Zellen der afferenten Arteriole gebildet und zum proteolytischen Renin umgewandelt. Dieses spaltet das zehn Aminosäuren lange Angiotensin I von dem 6 Dr. Katharina Hohenstein Univ.-Prof. Dr. Bruno Watschinger Universitätsklinik für Innere Medizin III, Klinische Abteilung für Nephrologie und Dialyse, Medizinische Universität Wien in der Leber gebildeten Angiotensinogen ab. Durch das Angiotensin-Converting Enzyme (ACE) werden weitere zwei Aminosäuren abgetrennt. Das so gebildete Angiotensin II, einer der stärks­ ten Vasokonstriktoren wirkt blutdruckerhöhend und stimuliert die Freisetzung von Aldosteron aus der Zona glomerulosa der Nebennieren. Aldosteron bewirkt eine vermehrte Natrium- und Wasserrückresorption am distalen Tubulus und führt ebenso zu einem Anstieg des arteriellen Blutdrucks. Neben der Vasokonstriktion ist Angiotensin II als Wachstumsfaktor auch für Hypertrophie und Hyperplasie der Gefäßzellen mitverantwortlich. Studien der letzten Jahre haben das Wissen um das RAAS stark erweitert und lassen erkennen, dass das RAAS viel komplexer ist als bisher angenommen. Welche Rolle Rezeptoren, Enzyme, die das klassische RAAS antagonisieren (wie ACE2 und sein Produkt Ang1–7) sowie spezifische Rezeptoren innerhalb dieses Systems (wie der Prorenin-Rezeptor oder der Mas-Rezeptor etc.) spielen und ob neue Medikamente, die auch diese Komponenten selektiv beeinflussen, andere oder stärkere Effekte in der Verhinderung renaler oder kardiovaskulärer Komplikationen haben werden, ist Gegenstand laufender Untersuchungen. FOCUS Renoprotektive Wirkung von RAAS-Hemmern Nach einer Reihe von ACE-Hemmer-Studien (vorwiegend Mikropunktionsstudien) in verschiedenen Tiermodellen zur Verhinderung der glomerulären Hyperfiltration in den 1980er-Jahren wurde 1993 erstmals über eine renoprotektive Wirkung durch Beeinflussung des RAAS im Menschen berichtet. Der Einsatz von Captopril zusätzlich zu anderen Antihypertensiva bei Patienten mit Typ-1-Diabetes führte zu einer statistisch signifikanten Reduktion der Rate von Dialysepflichtigkeit oder Tod (Lewis E. J., N Engl J Med 1993; 329: 1456-62). Auch wenn eine spätere Analyse feststellte, dass sich in der Captopril-behandelten Gruppe weniger Hochrisikopatienten (d. h. Patienten mit großer Proteinurie) befanden als in der Kontrollgruppe und deshalb die Möglichkeit eines besseren Abschneidens der ACE-Hemmer-Gruppe aufgrund des Missverhältnisses in der Randomisierung nicht ausgeschlossen werden konnte (Hebert L. A., Kidney Int 1994; 46: 1688–93), führte die Studie von Lewis et al. zu einem breiten Einsatz von ACE-Hemmern, zuerst bei diabetischen, später auch bei nicht-diabetischen, vor allem aber proteinurischen Patienten (z. B. The GISEN Group; Lancet 1997 Jun 28; 349 [9069]: 1857– 63), wo auch günstige Auswirkungen einer RAS-Blockade be­ obachtet wurden. In den darauffolgenden Jahren wurden Angiotensin-RezeptorBlocker (ARB) vor allem bei Typ-2-Diabetikern untersucht. In der RENAAL-Studie (Auswirkung von Losartan auf renale und kardiovaskuläre Endpunkte bei Typ-2-Diabetikern mit diabetischer Nephropathie) fand sich nach 4 Jahren ein Vorteil bezüglich des Erreichens der terminalen Niereninsuffizienz für die ARB-behandelte Gruppe. Allerdings war der jährliche GFR-Verlust in der Losartan-Gruppe im Vergleich zu Placebo nur um 0,8 ml/min (5,2 vs. 4,4 ml/1,7 m2) geringer (Brenner B. M. et al., N Engl J Med 2001; 345: 861–869). Der kombinierte primäre Endpunkt bestehend aus Verdoppelung des Serumkreatinins, Erreichen der terminalen Niereninsuffizienz und Tod für die Losartan-behandelte und Placebo war zudem nach 4 Jahren kaum unterschiedlich. Zwei andere mit Irbesartan durchgeführte Studien (IRMA2 und IDNT) zeigten Vorteile der ARB-Behandlung, wobei hier die Studiengruppen jeweils niedrigere Blutdruckwerte aufwiesen als die Placebogruppen (Parving H. H., N Engl J Med 2001; 345: 870–8; Lewis E. J., N Engl J Med 2001; 345: 851–60). Unbestritten ist die antiproteinurische Wirkung von RAAS-Hemmern. Dies wird in verschiedenen Metaanalysen bestätigt. Eine Reihe größerer Studien konnte die potente Wirkung der RAASBlockade mit ACE-Hemmern oder Angiotensin-Rezeptor-Blockern (ARBs) auf die Proteinurie belegen (z. B. Collaborative Study, RENAAL, IDNT). In der Analyse der „ACE Inhibitors in Diabetic Nephropathy Trialist Group“ zeigt sich, dass ACE-Hemmer bei Diabetikern die Progression zu einer Makroalbuminurie deutlich reduzieren. Da allerdings Blutdruckunterschiede in den Gruppen nicht berücksichtigt wurden, kann die oft postulierte blutdruckunabhängige nephroprotektive Wirkung für ACE-Hemmer daraus nicht mit letzter Gewissheit abgeleitet werden (Ann Intern NEPHRO Script Med 2001; 134: 370–9). Auch andere kardiovaskuläre Endpunkte wie Schlaganfall, kardiovaskuläre Erkrankungen, koronare Herzerkrankung und Herzinsuffizienz sowie Tod waren in erster Linie durch die Blutdrucksenkung beeinflusst. Ein klassenspezifischer Effekt der RAAS-Hemmer war in der Metaanalyse der „Blood Pressure Lowering Treatment Trialists’ Collaboration“ (Turnbull F., Lancet 2003; 362: 1527–35) nicht nachweisbar. Prävention der Mikroalbuminurie Die Verhinderung oder Verzögerung einer makroalbuminurischen Proteinurie durch RAAS-Hemmer ist durch mehrere Studien gut belegt. BENEDICT: Bei 1.204 normoalbuminurischen Typ-2-Diabetikern entwickelte sich über einen Zeitraum von 3,6 Jahren bei 5,7 % mit Kombinationstherapie, 6 % mit Trandolapril, 11,9 % mit Verapamil und 10 % der mit Placebo behandelten Patienten eine Mikroalbuminurie. Die Effizienz des ACE-Hemmers war bei Blutdruckwerten, die höher als 140/82 mmHg lagen, größer (Remuzzi G., J Am Soc Nephrol 2006 Apr; 17 [4 Suppl. 2]: S90–7). ROADMAP-Studie: Die „Randomised Olmesartan and Diabetes Microalbuminuria Prevention“-Studie widmete sich der Frage, ob Olmesartan bei Typ-2-diabetischen normoalbuminurischen Patienten mit zumindest einem kardiovaskulären Risikofaktor den Übergang von einer Normoalbuminurie zur Proteinurie verzögern oder verhindern kann (Haller H. H ., N Engl J Med 2011; 364: 907–917). In der ARB-behandelten Patientengruppe waren eine Reduktion und Verzögerung des Auftretens einer Mikroalbuminurie (8,2 vs. 9,8 % der Patienten, mit 23 % zeitlicher Verzögerung des Auftretens) nachweisbar. Überraschenderweise waren unter Olmesartan mehr kardiovaskuläre Tode zu verzeichnen (0,7 % vs. 0,1 %) als in der Kontrollgruppe, wobei diese sehr niedrige Zahl zufällig bedingt sein konnte, natürlich auch aber auch nicht ausgeschlossen werden konnte, dass diese mit der Behandlung in Zusammenhang gestanden sind. Eine eingehende Analyse dieser Todesfälle ergab auch, dass die betroffenen Patienten einen sehr niedrigen Ausgangsblutdruck (< 120 mmHg) aufwiesen und möglicherweise eine weitere Drucksenkung bei koronarer Vorerkrankung zu den fatalen Folgen führte. Kardioprotektive Wirkung von RAAS-Hemmern HOPE: In einer kardiovaskulären Risikopopulation wurde die 1-mal tägliche, abendliche Gabe von 10 mg Ramipril mit Placebo verglichen. Diese große Studie zeigte einen signifikanten Vorteil des ACE-Hemmers bei nur 2 mmHg Blutdruckdifferenz, weshalb ein blutdruckunabhängiger Effekt der RAAS-Hemmung diskutiert wurde. In den primären Analysen wurde aber nicht berücksichtigt, dass die abendliche Gabe die Blutdruckwerte während der Nachtstunden bis zu 10 mmHg stärker senkte (laut Ergebnissen aus einer Subgruppe von Patienten mit bestehender ˘ 7 FOCUS NEPHRO Script Duale RAAS-Blockade Die Erfolge einer RAAS-Blockade und pathophysiologische Überlegungen, dass das RAAS durch eine singuläre Beeinflussung möglicherweise nicht ausreichend blockiert ist, führten zur Entwicklung des Konzepts der dualen RAAS-Blockade, die in mehreren prospektiven Studien getestet wurde. AVOID: In der AVOID-Studie wurde bei hypertensiven Typ-2-Di- abetikern mit diabetischer Nephropathie die Wirkung der gemeinsamen Gabe von Aliskiren und Losartan auf die Proteinurie untersucht und eine 20%ige Reduktion unter Kombinationstherapie gezeigt (Parving H. H., N Engl J Med 2008; 358: 2433–2446). ALTITUDE-Studie: Die AVOID-Studie benutzt mit Proteinurie nur einen Surrogatendpunkt, sodass die Wirkung einer dualen RAASBlockade auf kardiovaskuläre und renale Ereignisse in der ALTITUDE-Studie bei Typ-2-Diabetikern mit diabetischer Nephropathie genauer untersucht wurde. Aliskiren wurde als Add-onTherapie zu einer schon bestehenden RAAS-Blockade addiert: bei fehlenden Unterschieden im primären Endpunkt (eine Kombination aus renalen und kardiovaskulären Endpunkten) führte eine erhöhte Rate von Hypotonien und Hyperkaliämien zu einem frühzeitigen Abbruch der Studie (Parving H. H., N Engl J Med 2012 Dec 6; 367 [23]:2204-13). VA-NEPHRON-D: In der VA-NEPHRON-D-Studie (Veterans Af- fairs Nephropathy in Diabetes Study) wurde bei Typ-2-Diabetikern mit diabetischer Nephropathie die Effektivität und Sicherheit von Losartan mit oder ohne Lisinopril hinsichtlich renaler Endpunkte (GFR-Verschlechterung, Dialysepflichtigkeit, Tod) untersucht. Während kein Vorteil in Hinblick auf Mortalität oder Nephroprotektion nachgewiesen werden konnte, führten Sicherheitsbedenken (Hyperkaliämie, akute Nierenfunktionsverschlechterung) auch in dieser prospektiven Untersuchung zu einem frühzeitigen Studienabbruch (Fried L. F., N Engl J Med 2013; 369: 1892–1903). ONTARGET: In ONTARGET wurden bei kardiovaskulären Risi- kopatienten (Patientenkollektiv mit jenem der HOPE-Studie vergleichbar) Telmisartan mit Ramipril bzw. mit einer Kombination bestehend aus Telmisartan und Ramipril verglichen. Telmisartan konnte die Progression der Albuminurie effektiver verlangsamen als Ramipril. In der Telmisartan/Ramipril-Kombinationsgruppe fand sich jedoch kein additiver antiproteinurischer Effekt, allerdings eine erhöhte Inzidenz der präspezifizierten Endpunkte (Dialysepflichtigkeit, Kreatininverdoppelung, Tod) (Yusuf S., N Engl 8 J Med 2008; 358: 1547–1559; Mann J. F. et al., Lancet 2008; 372: 547–553). Die Daten dieser Studie unterstützen daher die kombinierte RAAS-Hemmer-Gabe bei Patienten mit niedrigem renalen Progressionsrisiko nicht. Metaanalysen zu RAAS-Hemmern Die Metaanalyse von Casas et al. kommt zu dem Schluss, dass Hemmsubstanzen des RAAS die Progression einer Niereninsuffizienz und andere renale Ereignisse (Veränderung der glomerulären Filtrationsrate oder der Albuminurie) im Vergleich zu Placebo deutlich senken, im Vergleich zu anderen Substanzklassen allerdings keinen wesentlichen Vorteil bieten (d. h. keine Blutdruck-unabhängige nephroprotektive Wirkung). In dieser Analyse waren aber auch Studien inkludiert, die eine Renoprotektion primär nicht als Studienziel aufwiesen (z. B. ALLHAT) (Casas, Lancet 2005 Dec; 366: 2026–33). Die Metaanalyse der „Blood Pressure Lowering Treatment Trialists’ Collaboration“ kam zu dem Schluss, dass die Prävention kardiovaskulärer Endpunkte primär durch die Drucksenkung erfolgte und ein klassenspezifischer Effekt der RAAS-Hemmer zumindest für die Endpunkte Schlaganfall, kardiovaskuläre Erkrankungen und Tod, die koronare Herzerkrankung und Herzinsuffizienz nicht nachzuweisen war (Turnbull F., Lancet 2003; 362: 1527–35). Eine andere Metaanalyse zeigte, dass Patienten mit proteinurischen Nierenerkrankungen einerseits das höchste Risiko für eine rasch progredient verlaufende Niereninsuffizienz haben, andererseits aber auch am ehesten von einer Drucksenkung durch RAASBlockade profitieren (Jafar T. H,, Ann Intern Med 2003; 139: 244-252). Eine zusätzliche Nephroprotektion besonders bei diabetischer Nephropathie ist möglicherweise durch eine Reduktion der Kochsalzzufuhr, die bei blockiertem RAAS zu einer Abnahme der Proteinurie sowie des arteriellen Blutdrucks führt, erzielbar (Suckling R. J., Cochrane Database Syst Rev 2010). Für nicht-diabetische CKD-Patienten im Stadium 1–3 lassen sich aus den vorhandenen Studienergebnissen keine sicheren Schlüsse in Hinblick auf die Effektivität von ACE-Hemmern und Angiotensin-Rezeptor-Blockern ziehen (Sharma P., Cochrane Database Syst Rev 2011 Oct 5; 10:CD007751). Eine duale RAAS-Hemmung wird auch durch die Ergebnisse einer weiteren Metanalyse, die 59 Studien zu dieser Fragestellung untersucht hat, aufgrund der oben bereits erwähnten Nebenwirkungen derzeit nicht empfohlen (Susantitaphong P., Am J Hypertens 2013 Mar; 26 (3): 424–41). Eine rezente Registeranalyse der Collaborative Transplant Study konnte auch bei nierentransplantierten Patienten keinen Vorteil einer RAAS-Hemmung im Vergleich zu anderen antihypertensiven Therapieregimen in Hinblick auf die Reduktion kardiovaskulärer Todesfälle finden, obwohl dieser in einer rezenten kleineren Studie postuliert wurde (Opelz G., Döhler B., Transplantation 2014 Feb 15; 97 [3]: 310–5). ■ Fachkurzinformation siehe Seite 32 arterieller Verschlusskrankheit, die ein 24-Stunden-BlutdruckMonitoring erhielten) und möglicherweise die niedrigere „Gesamt- oder kumulative Blutdruckbelastung“ in der RamiprilGruppe den Ausschlag für die kardioprotektive Wirkung gegeben haben könnte (Svensson P., Hypertension 2001; 38: E28–32). 1 1 Einfach-3-fach kombinieren mit einer Tablette! STARKE BLUTDRUCKSENKUNG verlässlich über 24h.1,2 COMPLIANCE FÖRDERN durch Fixkombination3 Fachkurzinformation siehe Seite 32 Einfach 3-fach 1) Lacourciere et al.;Journal of Human Hypertension (2011) 25, 615–622. 2) Calhoun DA et al., Hypertension 2009; 54 (1) 32–39. 3) Gerbino & Shoheiber, Am J Health System Pharm 2007; 64: 1279–83. SBD= Systolischer Blutdruck. Datum der Erstellung: 01/2014, AT1401164566 FOCUS NEPHRO Script uu Eine RAAS-Blockade durch entweder ACE-Inhibitoren oder Angiotensin-RezeptorBlocker hat in großen klinischen Studien der letzten zwei Jahrzehnte positive Effekte auf das renale und/oder Gesamtüberleben erbracht, eine Kombination von ACEi und ARB im Sinne einer dualen RAAS-Blockade gilt jedoch aufgrund einer erhöhten Nebenwirkungsrate in allen Stadien der chronischen Niereninsuffizienz als obsolet. uu Speziell bei Dialysepatienten muss bei einer medikamentösen Interferenz am RAAS-System eine verzerrte Volumen-, Hormon- und Angiotensin-Regulation berücksichtigt werden. Die durch Analysen von Patienten mit nicht-dialysepflichtiger Niereninsuffizienz gewonnenen Daten sollten deshalb nicht unreflektiert auf die Dialysepopulation übertragen werden. uu Für alternative Therapieansätze am RAAS wie etwa Aldosteron-Antagonisten gibt es speziell zu Patienten mit Herzinsuffizienz überzeugende Daten als Add-on zu ACEi bzw. ARB. Re-Evaluierung eines alten Systems durch neueste Erkenntnisse Quo vadis RAAS-Blockade? D Status quo bei präterminaler Niereninsuffizienz Da eine RAAS-Blockade durch entweder ACEi oder ARBs in großen klinischen Studien der letzten zwei Jahrzehnte positive Effekte auf renales und/oder Gesamtüberleben erbrachte1–3, war es naheliegend, durch eine Kombination von ACEi und ARB im Sinne einer dualen Blockade das RAAS intensiver zu blockieren, um noch günstigere Effekte zu erreichen. Diese initial durchaus plausibel erscheinende Hypothese wurde jedoch durch klinische Daten widerlegt. In den vergangenen Jahren wurde eine Reihe großer klinischer Studien, welche verschiedene Formen der dualen RAAS-Blockade bei unterschiedlichen Patientenpopulationen untersuchten, aufgrund der erhöht aufgetretenen Rate an Nebenwirkungen vorzeitig abgebrochen. 10 Dr. Marlies Antlanger Dr. Johannes Kovarik, PhD Abteilung für Nephrologie und Dialyse, Universitätsklinik für Innere Medizin III, Medizinische Universität Wien Die rezenteste Arbeit zu diesem Thema stellt die Ende 2013 im „New England Journal of Medicine“ publizierte VA-NEPHROND-Studie von Linda Fried et al. dar, welche chronisch niereninsuffiziente Typ-2-Diabetiker mit Proteinurie, welche bereits unter dem ARB Losartan standen, zusätzlich entweder zu einem ACEi oder Placebo randomisierten4. Die Studie wurde wegen erhöhter Nebenwirkungen und der geringen Wahrscheinlichkeit, einen signifikanten Unterschied bezüglich des primären Endpunktes (GFR-Reduktion um ≥ 30 ml/min oder ≥ 50%ige GFR-Reduktion bzw. Dialysepflichtigkeit oder Tod) zu erreichen, vorzeitig gestoppt. Diese Ergebnisse zeigen Übereinstimmung mit den Resultaten von ONTARGET5 und ALTITUDE6, weiteren großen Analysen der dualen RAAS-Blockade bei chronischer Niereninsuffizienz, die ebenfalls eine erhöhte Nebenwirkungsrate aufzeigten. Fotos: beigestellt ie pharmakologische Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS) durch ACE-Hemmer (ACEi) und Angiotensin-Rezeptor-Blocker (ARB) nimmt durch ihre progressionsverzögernde und antialbuminurische Fähigkeit einen zentralen Stellenwert in der Therapie der chronischen Niereninsuffizienz ein. Darüber hinaus haben in den vergangenen Jahren weitere Substanzen, welche an unterschiedlichen Punkten der RAAS-Kaskade wirken, wie direkte Renin-Inhibitoren, AldosteronAntagonisten, aber auch experimentelle Substanzen wie z. B. (Pro-) Renin-Rezeptor-Blocker, neue Einsichten über die klinische Bedeutung des Systems, bei jedoch unzulänglich explorierten molekularen Effekten, gebracht. Fotos: beigestellt FOCUS Mono- und duale RAAS-Blockade bei terminaler Niereninsuffizienz Die Rolle der RAAS-Blockade mit einem einzigen Präparat bei terminaler Niereninsuffizienz ist aufgrund eines Mangels an geeigneten Studien nicht restlos geklärt. Es stellt sich vielmehr durch rezente Arbeiten generell die Frage, ob die Rationale – nämlich die beobachteten günstigen Effekte einer RAAS-Blockade mittels ACEi oder ARB bei CKD-Patienten – einfach auf dialysepflichtige Patienten zu übertragen ist. In einer 2011 publizierten Be­ obachtungsstudie über 6 Jahre wurden 22.800 Patienten, die nach Andialyse neu auf einen ACEi eingestellt wurden, und 5.828 Patienten, die einen ARB erhielten, beschrieben. Nach Adjustierung für kardiovaskuläre Risikofaktoren konnte kein signifikanter Unterschied hinsichtlich kardiovaskulärer, zerebrovaskulärer oder Gesamtmortalität beobachtet werden; jedoch waren beide Therapieoptionen vorteilhaft gegenüber einer Kombination der Substanzklassen. Dennoch sind die Ergebnisse dieser Analyse kontroversiell, da sie zum einen retrospektiv sind, zum anderen bestand in dieser Analyse auch die Möglichkeit eines „confounding by indication“, da deutlich mehr Patienten mit ACEi kardiovaskuläre Risikofaktoren hatten11. Konträr dazu zeigte eine über 3 Jahre laufende randomisierte, doppelblinde, placebokontrollierte multizentrische Studie ˘ Abb.: Schematische Übersicht des RAAS AngiotensinogenRenin 1–7 ACE 2 Ang I P NE / EP Chymase 1–10 ACE 1–9 ACE/NEP Die RAAS-Blockade bei chronischer Niereninsuffizienz steht demnach auf dem Prüfstand. In frühen Stadien überzeugen positive Effekte, und auch bei präterminaler Niereninsuffizienz gibt es durchaus positive Studien. So zeigte beispielsweise erst Ende 2013 eine große prospektive Kohortenstudie mit über 28.000 Patienten eine geringere Hazard-Ratio für Dialysebeginn (HR 0.94) und den kombinierten Endpunkt aus Langzeit-Dialysepflichtigkeit und Mortalität (HR 0.94) bei präterminal niereninsuffizienten Patienten (Kreatinin > 6 mg/dl), die binnen 90 Tagen nach Verordnung von Erythrozyten-stimulierenden Medikamenten ACEis oder ARB erhielten.6 Diese Daten sind im Wesentlichen konkordant mit jenen einer randomisierten Doppelblind-Studie von Hou et al. aus dem Jahr 2006, welche ebenfalls einen renalen Benefit durch ACEi bei fortgeschrittener CKD nahelegen.7 Während hingegen die Diskussion um die Effizienz einer dualen RAAS-Blockade in allen Stadien der chronischen Niereninsuffizienz weitgehend beendet erscheint8, existiert bei Patienten mit terminalem Nierenversagen an der Hämo- oder Peritonealdialyse weiter ein Mangel an Studien, die sich dezidiert mit der Fragestellung des Einsatzes von RAAS-Hemmern in Bezug auf harte Endpunkte wie kardiovaskuläre Morbidität und Mortalität sowie Gesamtüberleben beschäftigen. Ein wesentlicher weiterer Punkt in Bezug auf klinische Effekte der RAAS-Blockade ist das weitgehende Fehlen eines soliden Wissens um die molekularen Effekte innerhalb des RAAS. Da das RAAS aus zahlreichen Komponenten (Angiotensine, Enzyme und Rezeptoren) besteht (Abb.) und sich dadurch an vielen Punkten Konzentrationsschwankungen, Interferenzmöglichkeiten und krankheitsbedingte Änderungen ergeben, ist eine geradlinige Beantwortung der Frage nach dem Versagen der dualen RAAS-Blockade kaum möglich, bietet jedoch wichtige Incentives für weitere wissenschaftliche Analysen. Dennoch hat sich unser Verständnis über das RAAS in den vergangenen Jahren signifikant erweitert und einige interessante Ansatzpunkte geliefert, um dessen physiologische und pathophysiologische Rolle besser zu verstehen. Neben der „klassischen“ ACE-Ang-II-AT1-Rezeptor-Achse rückte die „alternative“ ACE2-­ Ang(1–7)-MAS-Rezeptor-Achse in den Brennpunkt experimenteller Forschungsansätze.9 Präliminäre Studien deuten darauf hin, dass das RAAS womöglich als ein duales System dieser zwei Achsen angesehen werden kann, wobei dem „klassischen“ RAAS vorwiegend vasokonstriktive, proliferative, proinflammatorische sowie profibrotische Effekte zugeordnet werden, während das „alternative RAS“ eher vasodilatierende, antiproliferative, antiinflammatorische Effekte ausübt. Es soll jedoch an dieser Stelle erwähnt werden, dass gerade die Daten, welche die renale Pathophysiologie betreffen, großteils experimentell sind.10 NEPHRO Script P ACE 2 Ang II 1–8 PCP AT1-R AT2-R MAS-R 11 FOCUS NEPHRO Script Literatur zum Einsatz verschiedener Formen der RAAS-Blockade in den Stadien der chronischen ­Niereninsuffizienz CKD HD PD ACEi REIN, Lancet 1999 Hsu et al., JAMA 2013 Chan et al., Kidney Int 2011 HDPAL, NDT 2014 Moist et al., JASN 2000 Li et al., Ann Int Med 2003 ARB RENAAL, NEJM 2001 IRMA, NEJM 2001 Hsu et al, JAMA 2013 Chan et al., Kidney Int 2011 Suzuki et al., Am J Kidney Dis 2004 Dual ONTARGET, NEJM 2008 ALTITUDE, NEJM 2012 VA-NEPHRON D, NEJM 2013 Chan et al., Kidney Int 2011 DRI Morishita, Int J Nephrol Renovasc Dis 2012 Kuriyama, Clin Exp Nephr 2013 Makowka et al., Kidney Blood Press Res 2012 MRA ALDO-DHF, JAMA 2013 Matsumoto et al., JACC 2014 Ito et al., JASN 2013 Hypervolämie, Herzinsuffizienz und ­Aldosteron-Antagonisten Das RAAS spielt eine zentrale Rolle in der Regulation des Blutdrucks sowie des Salz- und Flüssigkeitshaushaltes des Körpers. 12 Die Renin-produzierende Niere hat in diesem komplexen System von Proteinen, Enzymen und Rezeptoren einen besonderen Stellenwert. Sie kann über Renin den Umsatz von Angiotensinogen aus der Leber steuern und reagiert über verschiedene Mechanismen sensibel auf Änderungen des Flüssigkeitsvolumens. Bei terminaler Niereninsuffizienz scheint diese Regulation nicht mehr adäquat. Volumen-, Hormon- und Angiotensin-Regulation bei Dialysepatienten speziell: Trotz intensiver Bemühungen, Dialysepatienten an ihr so genanntes und nach wie vor schwer zu definierendes Trockengewicht zu dialysieren, ist ein beträchtlicher Teil der Patienten chronisch überwässert. Bei CKD-Patienten konnte gezeigt werden, dass starke Überwässerung und assoziierte, unangemessen hohe Renin- und Aldosteron-Konzentrationen mit linksventrikulärer Hypertrophie und vaskulärer Steifheit, beides unabhängige Prädiktoren für kardiovaskuläre Mortalität, verbunden sind.17, 18 Dies befindet sich in Übereinstimmung mit Daten von Bomback et al., die bei Dialysepatienten feststellten, dass das Körpervolumen und das RAAS vermutlich als weitgehend dissoziiert zu betrachten sind.19 Daten dieser Arbeitsgruppe deuteten neben einer bei Dialysepatienten erwarteten, mittels Bioimpedanz gemessenen Expansion des Extrazellulärvolumens (EZV) auch auf einen relativen Hyperaldosteronismus bei diesen Patienten hin. Dieses abnorme EZV-Aldosteron-Verhältnis (denn man würde bei Hypervolämie ja eigentlich negatives Feedback auf die Aldosteron-Produktion erwarten) weist auf eine pathophysiologisch relevante Verzerrung der Beziehung zwischen EZV und Aldosteron hin, welcher wiederum den Verdacht einer einzigartigen Volumen-, Hormon- und Angiotensin-Regulation bei Dialysepatienten nahelegt. Erst kürzlich wurde die Assoziation von Aldosteron mit dem kardiovaskulären Outcome bei HD Patienten gezeigt20, wo paradoxerweise höhere Aldosteron-Serumwerte invers mit dem Auftreten von kardiovaskulären Events und Mortalität assoziiert waren, gesetzt den Fall, dass die Patienten überwässert waren. Es sollte demnach das Zusammenspiel des Volumenstatus mit Al- Fachkurzinformation siehe Seite 32 in über 30 italienischen Kliniken, dass eine Therapie mit dem ARB Telmisartan zusätzlich zu bestehender ACEi- und Betablocker-Therapie die kardiovaskuläre Mortalität und Hospitalisierungsrate für Dialysepatienten mit chronischem Herzversagen signifikant reduzieren kann.12 Generell bleibt festzuhalten, dass die RAAS-Blockade wohl häufig aus Prädialysezeiten übernommen und dann unreflektiert weiter an der HD verabreicht wird. Hochinteressante Ergebnisse zeigt die kürzlich erschienene HDPAL-Studie von Agarwal et al., bei der die Hypothese getestet wurde, ob Lisinopril verglichen mit Atenolol bei Hämodialysepatienten effektiver in der Reduktion der linksventrikulären Hypertrophie über ein Jahr ist. Diese Studie wurde aus Sicherheitsgründen vorzeitig gestoppt, da sich gehäufte „adverse events“ im Lisinopril-Arm zeigten. Diese Patienten hatten signifikant mehr kardiovaskuläre Events, mehr Hospitalisierungen, mehr Hyperkaliämien und mehr hypertensive Krisen. Zum Zeitpunkt des Studienendes wiesen Patienten mit Atenolol eine stärkere Reduktion der linksventrikulären Hypertrophie auf.13 Diese Ergebnisse rücken ebenso die Frage in den Fokus, ob Hämodialysepatienten verglichen mit Patienten mit normaler oder leicht- bis mittelgradig eingeschränkter Nierenfunktion den kardiovaskulären Benefit, der von ACEi und ARBs vermittelt wird, nicht haben und vielmehr vielleicht sogar größeren Risiken ausgesetzt werden.14 Der Einsatz des direkten Renin-Inhibitors Aliskiren als Monoblockade bei Dialysepatienten wurde bislang kaum untersucht; die große, wegen Nebenwirkungen abgebrochene ALTITUDE-Studie mit CKD-Patienten hat zu äußerst zurückhaltendem Einsatz dieser Substanz geführt; bislang durchgeführte Untersuchungen an Hämodialysepatienten zeigten lediglich neutrale Ergebnisse15, 16. Sic Hä mi be Ka Anz.FO FOCUS NEPHRO Script dosteron auf das kardiovaskuläre Outcome für Hämodialysepatienten nicht unterschätzt werden. Aldosteron-Antagonisten als Add-on bei Patienten mit Herzinsuffi­ zienz: Dass zahlreiche pathophysiologische Faktoren wie chronische Fachkurzinformation siehe Seite 32 Überwässerung, interdialytische Gewichtsschwankungen, dysregulierter Kalzium-Phosphat-Haushalt, arterielle Hypertonie etc. zu systolischer und diastolischer Herzinsuffizienz bei CKD-Patienten führen, ist hinlänglich bekannt. Das therapeutische Credo hierbei liegt weiterhin in der Progressionsverzögerung. Dabei hat sich eine weitere Form der RAAS-Blockade – ja im eigentlichen Sinne sogar eine spezielle Form der dualen Blockade – nun in den letzten Jahren durch die prominente Positionierung von Aldosteron-Antagonisten als Add-on zu ACEi bzw. ARB als sicher und vorteilhaft etabliert. Diese zeigte zuletzt vielversprechende Ergebnisse: Patienten mit Herzinsuffizienz profitieren von dieser Kombination mit einer signifikanten Verbesserung von Mortalität und kardiovaskulären Hospitalisierungsraten.21–23 Explizit mit diastolischer Insuffizienz setzte sich die im Vorjahr publizierte Aldo-DHF-Studie auseinander. Hierbei konnte bei 422 Patienten mit guter Nierenfunktion (durchschnittliche GFR 79 ml/min/1,73 m²) gezeigt werden, dass die Gabe eines Mineralokortikoidrezeptor-Antagonisten (MRA) zu einer Besserung der linksventrikulären Funktion führte, ohne jedoch die Symptomatik zu verbessern. Ob diese Ergebnisse nun auch auf Hämound Peritonealdialysepatienten umgelegt werden können, ist nicht bekannt.24 Bislang zeigten sich jedoch auch bei Dialysepatienten, einer Patientengruppe, welche bekanntermaßen überhäufig unter Herzinsuffizienz leidet, positive Effekte der MRA bezüglich kardiovaskulärer Mortalität und Hospitalisierung25; eine weitere randomisierte Studie, die sich insbesondere mit der Fragestellung der linksventrikulären Hypertrophie, quantifiziert durch kardiale Mag­netresonanz, auseinandersetzt, wird derzeit von der Gruppe um Christoph Wanner durchgeführt26. Ein Review von Linda Shavit aus dem Jahr 2012 fasst die bisherige Datenlage von MRAs bei CKD und an der Dialyse zusammen und kam zu folgendem Schluss: Die positiven kardiovaskulären Effekte von MRAs können bereits bei niedrigen Dosierungen unter sorgfältigem Monitoring des Serum-Kaliums erreicht ˘ Sicherheitsinformationen: Fosrenol® ist zugelassen als phosphatbindendes Mittel zur Vermeidung einer Hyperphosphatämie bei Patienten mit chronischer Niereninsuffizienz, die eine Hämodialysebehandlung oder eine kontinuierliche, ambulante Peritonealdialyse (CAPD) erhalten und bei nicht-dialysepflichtigen, erwachsenen Patienten mit chronischer Nierenkrankheit 13 mit einem Serumphosphatspiegel ≥1,78 mmol/l, bei denen eine phosphatarme Ernährung alleine nicht ausreichend ist, um den Serumphosphatspiegel zu kontrollieren. Bitte beachten Sie, bevor Sie Fosrenol ® verschreiben die zugehörige Fachinformation, insbesondere in Hinblick auf Nebenwirkungen, laufende Überwachung der Leberfunktionswerte und Kalziumserumspiegel, Anwendung bei Patienten mit gastrointestinalen Erkrankungen und Langzeittherapie. * Shinaberger CS et al. Am J Clin Nutr 2008; 88(6): 1511–1518 Anz.FOS 210x148.indd 1 FOS_2014_001 Proteinversorgung und Phosphat in Balance* 07.03.14 13:02 FOCUS NEPHRO Script werden (z. B. < 50 mg Eplerenon bzw. 12,5 mg Spironolacton), dennoch müssen randomisierte prospektive Studien mit einer ausreichenden Fallzahl an Patienten mit CKD und an der Dialyse mit Beobachtung von Surrogatparametern wie Blutdruck und Proteinurie und hinsichtlich Mortalität durch kardiovaskuläre Events durchgeführt werden, um die nach kurzer Beobachtungszeit festgestellten Effekte zu bestätigen (oder zu widerlegen).27 Generell ist der breite Einsatz von MRAs bei CKD 3 und 4 sowie an der Dialyse wegen der Angst vor auftretender Hyperkaliämie derzeit weiterhin limitiert28, 29, doch diese Sorge basiert großteils auf älteren Studien, in denen teils hohe Dosen an MRAs (bis zu 300 mg Spironolacton) bei unter anderem anephrischen Dialysepatienten verwendet wurden30. Obwohl über Hyperkaliämie immer wieder in Studien mit MRAs berichtet wurde, scheint es, als ob dieses Risiko glücklicherweise durch adäquate Patienten­ selektion, Dosisanpassung, Patientenschulung, Monitoring und Follow-up kalkulierbar wäre.31 Einen weiteren Risikofaktor stellt hier eine gleichzeitige Schleifendiuretika-Therapie dar.32 RAAS-Blockade bei Peritonealdialyse Die Peritonealdialyse kristallisierte sich in den vergangenen Jahren zunehmend als adäquates, attraktives Verfahren heraus, einer akut dekompensierten sowie auch chronischen Herzinsuffizienz therapeutisch zu begegnen. Durch geringere interdialytische Volumenschwankungen sowie die Möglichkeit, eine allfällige Rechtsherzbelastung zu reduzieren, ist oft eine brauchbare klinische Lösung für Herzinsuffizienzpatienten mit häufigen Phasen der Dekompensation gefunden. Obwohl bei diesen speziellen Patienten die RAAS-Monoblockade eine breite Anwendung findet, ist die systemische und lokale RAAS-Regulation erstaunlich wenig erforscht. Über duale RAAS-Blockade bei Peritonealdialyse-Patienten liegen bis dato noch keine Daten vor. Zu Peritonealdialyse und Aldosteron-Antagonisten gibt es bis dato wenige Analysen. Die erste größer angelegte randomisierte Studie wurde erst Ende 2013 publiziert und zeigt eine Verlangsamung bzw. sogar Regredienz bei der Entwicklung einer linksventrikulären Hypertrophie sowie systolischen Herzinsuffizienz bei 158 Peritonealdialysepatienten durch Spironolacton, bei jeweils schon etablierter Therapie mit ACEi oder ARBs.33 Zwei länger zurückliegende Case-Reports deuten weiters auf eine Abnahme der diastolischen Dysfunktion durch Spironolacton hin.34, 35 Die aktuelle Datenlage bestätigt demnach also positive Effekte einer An14 wendung von MRAs (zusätzlich zu einem einzigen weiteren Präparat, ACEi oder ARB); wissenschaftlich liegt dieses Gebiet dennoch nahezu brach, um suspizierte Effekte durch Empirie zu untermauern. ZUSAMMENFASSEND soll nochmals darauf hingewiesen werden, dass ein Großteil der bisherigen Daten zur RAAS-Blockade durch Analysen von Patienten mit nicht-dialysepflichtiger Niereninsuffizienz gewonnen wurde und eine unreflektierte Übertragung dieser Daten auf die Dialysepopulation nach letzten Studien nicht mehr länger erfolgen sollte. Es bleibt festzuhalten, dass die RAASBlockade trotz zum Teil eindrucksvoller Verbesserung von Surrogatparametern wie Blutdruck und Proteinurie in frühen Stadien der Niereninsuffizienz im Dialysestadium deshalb nicht mehr uneingeschränkt zu empfehlen ist, sondern möglicherweise keine oder sogar schädliche Effekte bewirken könnte. ■ Lewis E.J. et al., N Engl J Med 1993; 329: 1456–1462 Brenner B.M. et al., N Engl J Med 2001; 345: 861–869 Parving H.H et al., N Engl J Med 2001; 345: 870–878 4 Fried L.F. et al., N Engl J Med 2013; 369: 1892–1903 5 Parving H.H. et al., N Engl J Med 2012; 367: 2204–2213 6 Hsu T.W. et al., JAMA Intern Med 2014; 174 (3): 347–354 7 Hou F.F. et al., N Engl J Med 2006; 354: 131–140 8 de Zeeuw D., N Engl J Med 2013; 369: 1960–1962 9 Zimmerman D. et al., Clin Sci (Lond) 2012; 123: 333–346 10 Pinheiro S.V. et al., Hypertension 2004; 44: 490–496 11 Chan K.E. et al., Kidney Int 2011; 80: 978–985 12 Cice G. et al., J Am Coll Cardiol 2010; 56: 1701–1708 13 Agarwal R. et al., Nephrol Dial Transplant 2014; Mar; 29 (3): 672–81 14 Bajaj R.R. et al., Arch Intern Med 2012; 172: 591–593 15 Kuriyama S. et al.: Effect of aliskiren in chronic kidney disease patients with refractory hypertension undergoing hemodialysis: a randomized controlled multicenter study. Clin Exp Nephrol 2013 16 Ishimitsu T. et al., Ther Apher Dial 2013; 17: 524–531 17 London G.M. et al., J Am Soc Nephrol 2001; 12: 2759–2767 18 Guerin A.P. et al., Circulation 2001; 103: 987–992 19 Bomback A.S. et al., J Renin Angiotensin Aldosterone Syst 2009; 10: 230–236 20 Hung S.C. et al., PLoS One 2013; 8: e57511 21 Pitt B. et al., N Engl J Med 1999; 341: 709–717 22 Pitt B. et al., N Engl J Med 2003; 348: 1309–1321 23 Zannad F. et al., N Engl J Med 2011; 364: 11–21 24 Edelmann F. et al., JAMA 2013; 309: 781–791 25 Matsumoto Y. et al., J Am Coll Cardiol 2014; 63: 528–536 26 Hammer F. et al., Nephrol Dial Transplant 2014; 29: 400–405 27 Shavit L. et al., Kidney Int 2012; 81: 955–968 28 Covic A. et al., Nephrol Dial Transplant 2006; 21: 854–858 29 Bertocchio J.P. et al., Kidney Int 2011; 79: 1051–1060 30 Sugarman A. et al., Kidney Int 1988; 34: 397–403 31 Zannad F. et al., Eur Heart J 2012; 33: 2782–2795 32 Rossignol P. et al., Circ Heart Fail 2014; 7: 51–58 33 Ito Y. et al.: Long-Term Effects of Spironolactone in Peritoneal Dialysis Patients. J Am Soc Nephrol 2013 34 Hausmann M.J. et al., Nephrol Dial Transplant 2002; 17: 2035–2036 35 Fenwick S. et al., Nephrol Dial Transplant 2003; 18: 1232; author reply 1232–1233 1 2 3 . n e u a h c s e i S n ) Egal wohi(r CHNELL. M FIZIENT, S F E , T N E T E P M O K EDMEDIA WWW.MEDMEDIA.AT PART OF MEDICAL OPINION NETWORK. FOCUS NEPHRO Script Interview: Fragen zur Praxis Interviewfragen: Dr. Marlies Antlanger und Dr. Johannes Kovarik, PhD Abteilung für Nephrologie und Dialyse, Universitätsklinik für Innere Medizin III, Medizinische Universität Wien Frage 1: Gibt es nach derzeitiger Studienlage noch Indikationen, die eine sog. duale RAS-Blockade bei PatientInnen mit chronischer Niereninsuffizienz ­rechtfertigen? Frage 2: Welchen Stellenwert hat ­gegenwärtig Aliskiren bei PatientInnen mit CKD? Frage 3: Sollen PatientInnen an der Hämooder Peritonealdialyse eine pharmakologische RAS-Blockade erhalten? Wenn ja: welche Patientengruppen und mit welchen Substanzen? Frage 4: Sollte eine Aldosteron-Blockade – gesetzt, eine Hyperkaliämie als Neben­ wirkung kann kontrolliert werden – bei allen proteinurischen CKD-PatientInnen ­zusätzlich zu einer bestehenden ­RAS-Blockade eingesetzt werden? Frage 5: Gelten für nierentransplantierte ­PatientInnen mit CKD die gleichen ­Empfehlungen für den Einsatz von ­RAS-Blockern? 16 Univ.-Prof. Dr. Andreas Vychytil Klinische Abteilung für Nephrologie und Dialyse, Universitätsklinik für Innere Medizin III, Medizinische ­Universität Wien Aufgrund mehrerer großer Studien, vor allem der ONTARGET-Studie, der ALTITUDEStudie (wurde abgebrochen) und der VA-NEPHRON-D-Studie, ist für die Mehrzahl der Patienten die duale RAS-Blockade nicht indiziert, da sie zu keinem zusätzlichen positiven Effekt, aber zu einer größeren Zahl an unerwünschten Ereignissen führt. Dies gilt vor allem für diabetische Patienten und jene mit großer Komorbidität. Die Verwendung einer solchen Kombination kommt also nur in Einzelfällen in Frage und muss dann immer individuell entschieden werden (z. B. bei nicht-diabetischen Patienten mit sehr großer Proteinurie trotz einfacher RAS-Blockade oder bei Hypertonikern, deren Blutdruck mit anderen Kombinationstherapien nicht suffizient eingestellt werden kann). Aliskiren ist ein effektives und an und für sich gut verträgliches Antihypertensivum mit langer Halbwertszeit, unter Berücksichtigung der aktuellen Studienlage aber anderen RASHemmern nicht überlegen. Die Datenlage ist für Aliskiren natürlich geringer als jene für ACEHemmer oder Angiotensin-Rezeptor-Blocker. Es gibt aus meiner Sicht aufgrund der derzeitigen Studien keine Indikation, von einem ACEHemmer oder Angiotensin-Rezeptor-Blocker auf Aliskiren umzustellen. Umgekehrt würde ich aber bei einem Patienten, der Aliskiren ohne weiteren RAS-Blocker einnimmt, diese Therapie weiter fortführen. Auch bei Dialysepatienten ist die RAS-Blockade ein Bestandteil der antihypertensiven Therapie. Es gibt allerdings keine gute Evidenz, dass in dieser Patientengruppe RAS-Hemmer das Überleben im Vergleich zu anderen antihypertensiven Substanzen verlängern. Eine rezente Metaanalyse verschiedener randomisierter Studien zeigt, dass bei Peritonealdialysepatienten ACE-Hemmer nicht das Überleben verlängern oder die Häufigkeit kardiovaskulärer Ereignisse reduzieren, aber wahrscheinlich einen günstigen Einfluss auf die Nierenrestfunktion haben. Da letztere sowohl bei Hämo- als auch bei Peritonealdialysepatienten ein unabhängiger Überlebensfaktor ist, ist die Verwendung dieser Substanzgruppe also durchaus bei Dialysepatienten gerechtfertigt. Nein, nicht bei allen proteinurischen CKDPatienten. Eine Aldosteron-Blockade ist aus meiner Sicht indiziert bei Patienten, die trotz RAS-Blockade eine Proteinurie von > 1 g/Tag aufweisen, vor allem, wenn die GFR > 30 ml/ min beträgt. Darüber hinaus sollten Aldosteron-Antagonisten großzügig bei Patienten Fotos: shutterstock.com, beigestellt Blockade des Renin-AngiotensinAldosteron-Systems bei chronischer Niereninsuffizienz FOCUS NEPHRO Script mit Herzinsuffizienz eingesetzt werden. Außerdem kann auch bei stärker eingeschränkter GFR eine Aldosteron-Blockade bei hypokaliämischen Patienten durchgeführt werden. Bei therapieresistenter Hypertonie trotz Einnahme einer antihypertensiven 3-fach-Kombinationstherapie hat die Gabe von Aldosteron-Antagonisten (auch ohne sicheren Nachweis eines M. Conn) einen zusätzlichen blutdrucksenkenden Effekt, wie zum Beispiel in der ASCOT-BPLA-Studie beschrieben wurde. Obwohl die Patienten in letzterer Studie ein durchschnittliches Kreatinin von 1,1–1,2 mg/ dl hatten, kann eine Aldosteron-Blockade in solchen Situationen auch bei CKD-Patienten versucht werden, sofern vorsichtig dosiert Prim. Univ.-Doz. Dr. Karl Lhotta Abteilung für Nephrologie und Dialyse, Akademisches Lehr­kranken­­ haus Feldkirch Nein, eine Indikation für doppelte RAS-Blockade gibt es wohl nicht mehr, insbesondere nicht für die diabetische Nephropathie. Weitere Studien zu dieser Therapie wird es wohl in Zukunft auch nicht mehr geben. Aliskiren hat als potenter und lang wirksamer RAS-Blocker nach wie vor seinen Stellenwert. Leider wurde dieses Medikament Prim. Univ.-Prof. Dr. Erich P ­ ohanka Fotos: shutterstock.com, beigestellt II. Medizinische ­Abteilung, AKH Linz Die duale Therapie hat bisher keine positiven Auswirkungen auf relevante klinische Endpunkte gezeigt, gleichzeitig ist das Risiko für eine renale Verschlechterung gestiegen. Eine Indikation kann allerdings für Patienten mit ausgeprägter Proteinurie gelten, bei denen wird und die Elektrolyte entsprechend überwacht werden. Unmittelbar nach Transplantation kann es schwierig sein, einen kurzen initialen Kreatinin-Anstieg nach Beginn einer RAS-Blockade bei noch nicht optimaler Transplantatfunktion ohne Biopsie von anderen Ursachen der Transplantatfunktionseinschränkung abzugrenzen. Hier muss der therapeutische Nutzen gegen potenzielle diagnostische Probleme abgewogen werden. In weiterer Folge kann aber eine RAS-Blockade auch bei Nierentransplantierten eingesetzt werden. Im Gegensatz zu früheren Arbeiten zeigt eine rezente randomisierte, placebokontrollierte Doppelblind-Studie aller- dings, dass eine Angiotensin-II-Blockade bei nierentransplantierten Patienten zwar sicher ist, aber keinen günstigen Einfluss auf das Transplantatüberleben oder einen kombinierten Endpunkt, der auch das Patientenüberleben inkludiert, hat. Eine im Februar 2014 publizierte Registeranalyse von fast 40.000 Patienten zeigt außerdem keinen signifikant günstigeren Einfluss einer ACE-Hemmer-/Angiotensin-Rezeptor-Blocker-Therapie im Vergleich zu anderen Antihypertensiva auf den kardiovaskulären Tod von nierentransplantierten Patienten. Somit sprechen die derzeitigen rezenten Daten nicht dafür, dass RAS-Hemmer bei transplantierten Patienten anderen Substanzen über die bloße Blutdrucksenkung hinaus überlegen sind. durch die unglückliche Studiengestaltung (Einsatz in Kombination mit anderen RAS-Blockern) gekillt. Daraus resultiert sicher eine gewisse Zurückhaltung im Einsatz dieser Substanz auch als Monotherapie, was wahrscheinlich nicht ganz gerechtfertigt ist. Bisher erhielten fast alle unsere hypertensiven Dialysepatienten eine RAS-Blockade in Kombination mit einem Betablocker. Bei Peritonealdialysepatienten scheint eine RAS-­Blockade die Restdiurese positiv zu beeinflussen. Auch die Ergebnisse der HDPAL-Studie (Hypertension in Hemodialysis Patients Treated with Atenolol or Lisinopril), die einen Vorteil für den Betablocker zeigten, sprechen nicht gegen eine Fortsetzung dieser Kombinations-Strategie. Wir be- vorzugen zur Therapie nicht-dialysable Substanzen, zum Beispiel Fosinopril oder Sartane. Es gibt keine Langzeitstudien, die einen güns­tigen Effekt dieser Kombination im Vergleich zu einfacher RAS-Blockade zeigen. Eine Hyperkaliämie ist unter dieser Kombination nie ganz auszuschließen, vor allem in Zusammenhang mit einer akuten Verschlechterung der Nierenfunktion. Die Studienlage zu diesem Thema ist etwas kontrovers, weshalb eine gewisse Zurückhaltung angebracht ist. RAS-Blocker sind bei uns nicht First-Line-Antihypertensiva bei nierentransplantierten Patienten. Eine RAS-Blockade scheint aber bei Vorliegen einer Proteinurie gerechtfertigt. das Ziel (Proteinurie unter 1 g/d bzw. bei nephrotischen Patienten eine Reduktion um die Hälfte oder zumindest auf < 3,5 g/d) nicht anders erreichbar ist. Dies mag insbesondere für Patienten mit IgA-Nephropathie gelten. Aliskiren hat einen Stellenwert als Reservesubstanz bei Unverträglichkeit von anderen Hemmern des RAS. Eine Kombinationstherapie würde ich nur bei Patienten versuchen, bei denen das therapeutische Ziel (Reduktion der Proteinurie bzw. des Blutdrucks, siehe oben) anders nicht erreichbar ist. Obwohl die Anwendung von Aliskiren bei einer GFR < 30 ml/ min nicht empfohlen wird, hat eine Studie mit Dialysepatienten gezeigt, dass die AUC in diesem Kollektiv nur geringfügig höher war (Elimination erfolgt über die Leber und Faeces). Bei entsprechenden Vorsichtsmaßnahmen wäre das eine Option für ausgewählte Fälle auch in dieser Gruppe. Problematisch sind vor allem Dialysepatienten mit Oligo- oder Anurie, die in der Regel auch ein Hyperkaliämie-Problem aufweisen. Hier ist die RAS-Blockade nicht die erste Wahl, kann aber bei schwer einstellbaren Patienten versucht werden. Auswirkungen auf die ˘ 17 FOCUS 18 Priv.-Doz. Dr. Matthias L­ orenz Dialysezentrum WienDonaustadt Meiner Meinung nach nicht. Der stärkere antiproteinurische Effekt wird mit mehr Nebenwirkungen erkauft (z. B. ONTARGET). Es konnte bis dato nicht gezeigt werden, dass klinische Endpunkte verbessert werden (COOPERATE wurde zurückgezogen). Aliskiren hat für mich derzeit einen geringen Stellenwert, da kein Benefit gegenüber ACE-Hemmern oder ARBs gezeigt werden konnte. Eine Kombination von Aliskiren mit ACE-Hemmern/ARBs führte in der ALTITUDEStudie zu keiner Verbesserung kardio-renaler Endpunkte, aber zu mehr Nebenwirkungen (v. a. Hyperkaliämie) und ist meiner Meinung nach daher abzulehnen. Mache ich derzeit schon noch. Ich verwende sowohl ACE-Hemmer als auch ARBs. Wahrscheinlich ist eine RAS-Blockade, wenn überhaupt, nur bei relevanter residualer Nierenfunktion sinnvoll. Auf der (Post-)ASN wurden noch nicht publizierte Daten präsentiert, die gegen einen Einsatz von ACE-Hemmern sprechen (schlechtere Outcomes als unter Atenolol). Ich warte gespannt auf die Publikation. Nein, derzeit (noch?) nicht. Es ist meines Wissens unklar, ob diese Therapie zu einer Progressionsverzögerung führt. Bei stabiler Transplantatfunktion würde ich das bejahen. Fotos: beigestellt Elektrolyte sollten bei Dialysepatienten ohnedies rasch auffallen. Für eine explizite Empfehlung reicht die langfristige Datenlage nicht aus. Wird dennoch ein Versuch zur Reduktion der Proteinurie unternommen, empfiehlt sich eine ausführliche Information der Patienten über eine diätetische Kaliumbeschränkung sowie über die möglichen Risiken einer zusätzlichen Schmerztherapie mit NSAR oder COX-2-Hemmern. Zu bedenken ist, dass Calcineurin-Inhibitoren selbst eine Hyperkaliämie bewirken können, sodass sich bei zusätzlicher RASBlockade das Risiko erhöht. Hinzu kommt, dass die systemische Anwendung von Cyclosporin die Serumkonzentration von Ali­ skiren erhöhen kann, sodass diese Kombination problematisch ist. Fachkurzinformation siehe Seite 32 NEPHRO Script FOCUS NEPHRO Script uu Auch bei diabetischer Nephropathie ist die Albuminurie ein wichtiger ­Prognosefaktor für kardiovaskuläre Ereignisse. uu Eine inkomplette Reduktion der Proteinurie und der Verlust der GFR trotz „optimaler“ antihypertensiver Medikation machen eine zusätzliche therapeutische Intervention ­dringend notwendig. uu Endothelin-Antagonisten als vermutlich potenteste Senker einer Albuminurie haben in klinischen Studien bei diabetischer Nephropathie zu einer markanten Reduktion der Proteinurie geführt. uu In den bisher verwendeten hohen Dosierungen traten jedoch eine hypotone Dehydratation bis hin zu akuter Herzinsuffizienz als Nebenwirkung auf. Somit muss bei Entwicklung und Einsatz von Endothelin-Antagonisten auf eine möglichst niedrige Dosierung und den Wasserund Elektrolythaushalt geachtet werden. Update 2014 Endothelin-Antagonisten bei diabetischer Nephropathie Fotos: beigestellt Fachkurzinformation siehe Seite 32 D ie diabetische Nephropathie ist ein persistierendes Problem in unserer Bevölkerung und weiterhin die Hauptursache für eine Nierenersatztherapie. Eine Proteinurie ist ein wichtiger Prädiktor für eine Verschlechterung der Niereninsuffizienz und das kardiovaskuläre Risiko. Nicht-medikamentöse Maßnahmen, insbesondere Meidung von Nikotinkonsum und Reduktion von Übergewicht, optimale Blutzuckerkontrolle und konsequente antihypertensive Therapie mit Zielwerten von < 140/90 mmHg sind die wesentlichen Maßnahmen. Alle Antihypertensiva einschließlich ACE-Hemmer oder Angiotensin-Rezeptor-Antagonisten sollten zum Erreichen der Zielwerte eingesetzt werden. Endothelin-Antagonisten haben in klinischen Studien bei diabetischer Nephropathie zu einer markanten Reduktion der Proteinurie geführt. Diese Substanzklasse hat jedoch noch keinen Durchbruch erreicht, weil in den bisher verwendeten hohen Dosierungen eine hypotone Dehydratation bis hin zu akuter Herzinsuffizienz als Nebenwirkung auftrat. Neuere experimentelle Daten weisen – wie bereits von uns früher postuliert – darauf hin, dass diese Substanzen in sehr viel niedrigeren Dosierungen besser verträglich und dennoch nephroprotektiv sind. Zudem erweitern rezente experimentelle Studien unseren Horizont für das Verständnis des verblüffend vielseitigen Aktionsraumes des Endothelin-Systems bei Säugetieren. Endothelin-Antagonisten sind bei der Therapie der pulmonal-arteriellen Hypertonie weltweit etabliert und unverzichtbar geworden. In der Nephrologie werden sie jedoch von der Pharmaindu- Univ.-Doz. Dr. René R. Wenzel Primarius der Abteilung für Innere Medizin, Allgemeines öffentliches Krankenhaus Zell am See, Akademisches Lehrkrankenhaus der Paracelsus Universitätsklinik Salzburg; Vorstandsmitglied der Österreichischen Gesellschaft für Hypertensiologie, Clinical Hypertension Specialist der European Society of Hypertension (ESH) strie zu Unrecht vernachlässigt, sind sie doch zweifelsohne eine weiterhin zukunftsträchtige additive Therapieform, wobei wir den Umgang mit Endothelin-Antagonisten, insbesondere hinsichtlich Dosierung und Nebenwirkungen, genauer ergründen müssen. Epidemiologie und Pathophysiologie der ­diabetischen Nephropathie Die diabetische Nephropathie wurde von dem britischen Arzt Clifford Wilson (1906–1997) und dem deutschen Arzt Paul Kimmelstiel (1900–1970) entdeckt und erstmals 1936 publiziert.24 Die Proteinurie sagt eine Verschlechterung der Nierenfunktion vorher und korreliert mit dessen Ausmaß. Eine klinisch manifeste Nephropathie als Folge einer glomerulären Schädigung tritt 15–25 Jahre nach Beginn eines Diabetes auf. In der Vergangenheit waren 25–35 % der unter 30-jährigen Patienten Typ-1-Diabetiker; die Prognose wurde in den folgenden Jahrzehnten immer besser37. Heute stellt der Typ-2-Diabetes ˘ 19 FOCUS NEPHRO Script Thrombophilie GFR Es gibt verschiedene Ausprägungen einer Eiweißausscheidung. Wir unterscheiden Mikro-, Makroalbuminurie, große Proteinurie und nephrotisches Syndrom (Abb. 1). Diese sind durch unterschiedlich starke Ausprägung der Eiweißausscheidung im Harn und der Zusammensetzung des Eiweißes im Harn gekennzeichnet. Mit der Stärke der Albuminurie bzw. Proteinurie korreliert auch die Abnahme der glomerulären Filtrationsrate (GFR) und damit der Nierenfunktion, gleichzeitig steigt das kardiovaskuläre Risiko (CV-Risiko)33. Bei sehr ausgeprägter Proteinurie gehen Eiweißmoleküle des Gerinnungssystems verloren, weswegen es zu einer Zunahme der Thrombophilie kommt, die Folge sind Thrombosen und Lungenembolien, wie wir sie insbesondere bei ausgeprägtem nephrotischen Syndrom fürchten4. Die Albuminurie ist ein Prognosefaktor für kardiovaskuläre Ereignisse, bei Hypertonie und Diabetes steigt das Risiko um das 1,6- bis 2-Fache für ein kardiovaskuläres Ereignis bei diesen Patienten (Myokardinfarkt, Schlaganfall, Herzinsuffizienz, Tod)20, 36. Sowohl bei diabetischer als auch bei nicht-diabetischer Nephropathie verbessert die Reduktion der Proteinurie das Risiko für kardiovaskuläre Ereignisse und auch die renale Prognose.13, 42 Neben den nicht-medikamentösen Maßnahmen (Nichtrauchen, 20 Mikroalbuminurie Albumin/Protein: 30–300 mg/d Makroalbuminurie/ Große Proteinurie nephrotisches Syndrom 300–3.500 mg/d > 3500 mg/d Nicht rauchen! Gewicht reduzieren! Eiweiß-arme Kost Blutdruck <140/90 mmHg Blutdruck <130/80 mmHg? ACE-Hemmer ODER AT1-Antagonist Aldosteron-Antagonist Renin-Antagonisten? Paricalcitol? Bardoxolone? u. a. Endothelin-Antagonisten? Abb. 1: Schematische Darstellung des Verhältnisses von Proteinurie einerseits und kardiovaskulärem und thrombophilem Risiko andererseits sowie die etablierten und möglichen Therapieansätze Gewicht reduzieren, eiweißarme Kost) sollte eine konsequente Blutdrucksenkung auf mindestens 140/90 mmHg, ggf. auch niedriger, erfolgen, ACE-Hemmer oder AT1-Rezeptor-Antagonisten sollten dabei eingesetzt werden. Aufgrund mehrerer Negativstudien sollte jedoch auf eine Kombination von ACE-Hemmern mit Angiotensin-Antagonisten verzichtet werden.18, 32 In einer rezenten Metaanalyse wurde nochmals der positive Effekt einer Blutdrucksenkung bei Patienten mit (leichtgradig) eingeschränkter Nierenfunktion auf die kardiovaskuläre Mortalität nachgewiesen, wobei keines der klassischen Antihypertensiva einschließlich der Hemmer des RAS einen Vorteil hatte6. Die viel zitierte strenge Kochsalzrestriktion ist gerade bei Diabetikern weiterhin umstritten und wird hier nicht weiter abgehandelt.14, 46 Aldosteron-Antagonisten haben in der Kombinationstherapie einen zusätzlichen Stellenwert und senken die Proteinurie um bis zu 800 mg/die, wobei deren Einsatz auf normale bis mäßig eingeschränkte Nierenfunktion beschränkt ist15. Der Vitamin-D-Rezeptor-Aktivator Paricalcitol senkt die Albuminurie, der Einfluss auf kardiovaskuläre Ereignisse ist aber nicht gesichert10, 11. Andere innovative Konzepte wie z. B. die direkte Hemmung von Renin (Aliskiren), eine Therapie mit dem Glykoaminoglykan Sulodexid oder dem Antioxidans Bardoxolon waren leider enttäuschend oder gar gefährlich. Rolle von Endothelin-Antagonisten Das Endothelin-System spielt eine wichtige pathophysiologische Rolle nicht nur bei kardiovaskulären, sondern auch bei renalen Erkrankungen.53, 55 Es reguliert zahlreiche renale Funktionen und kann über unterschiedliche Mechanismen eine Proteinurie auslösen.8, 45, 47 Endothelin interagiert interessanterweise sehr stark mit Angiotensin II, sodass auch die Wirkung von Angiotensin durch einen ETA-selektiven Endothelin-Antagonisten (wie z. B. BQ123 oder Darusentan) gehemmt werden kann.34, 35, 53 In den Nieren werden sowohl ETA- als auch ETB-Rezeptoren Fachkurzinformation siehe Seite 32 Proteinurie und Nierenfunktion CV-Risiko GPB.DYN 140204 aus nephrologischer Sicht das Hauptproblem dar. Hier entwickeln etwa je 2 % der Patienten eine Makroalbuminurie oder eine terminale Niereninsuffizienz.2 Die durch den Typ-2-Diabetes bedingte oder auch damit einhergehende Nephropathie ist weltweit mittlerweile einer der häufigsten Ursachen für eine Dialysepflichtigkeit und betrifft etwa 50 % der Nierenersatztherapien. Die International Diabetes Foundation sagt eine 75%ige Zunahme der Prävalenz des Diabetes Typ 2 voraus, so dass im Jahre 2025 weltweit geschätzte 324 Millionen Menschen Diabetiker würden. Somit würde der Bedarf für eine Nierenersatztherapie weiter steigen. Eine optimale Einstellung von Blutzucker und Blutdruck haben die renale Prognose in den letzten Jahrzehnten deutlich verbessert.52 Die Therapie der diabetischen Nephropathie ist aufgrund ihres schwer aufhaltbaren Progresses eine Herausforderung. Eine konsequente antihypertensive Therapie (siehe unten) verzögert die Progression sowohl bei Typ-1- als auch bei Typ-2-Diabetikern52; dennoch ist dieser therapeutische Ansatz begrenzt und unzureichend2, 58. Insbesondere das sog. „Late-Escape-Phänomen“, d. h. die Rekurrenz einer Proteinurie trotz Fortsetzung einer initial erfolgreichen antiproteinurischen Therapie mit einem Hemmer des Renin-Angiotensin-Systems (RAS), ist ein immer wieder beschriebenes Problem 58.Vor allem aber machen die inkomplette Reduktion der Proteinurie und der Verlust der GFR trotz sog. „optimaler Therapie“ eine zusätzliche therapeutische Intervention dringend notwendig. Endothelin-Antagonisten haben hier potenziell einen wichtigen Stellenwert.58 Daher wird die aktuelle Studienlage in diesem Artikel näher beleuchtet. FOCUS exprimiert; ETA-Rezeptoren sind überwiegend im Gefäßsystem nachweisbar, während ETB-Rezeptoren vor allem im tubulo-interstitiellen System, dem Gefäßendothel und dem Mesangium vorkommen.41 Endothelin-1 steigert Wachstum und wirkt zudem proinflammatorisch und ist zusätzlich für die Regulation der renalen Ausscheidung von Natrium, sauren Valenzen sowie Vasopressin-abhängig freiem Wasser verantwortlich.19, 26, 27, 48 Toxische Reize, wie z. B. Hypoxie, Hypertonie, Hyperglykämie oder Nephrotoxine führen zu einer raschen Freisetzung von Endothelin-1 aus dem Mesangium.5 Bei diabetischer Nephropathie ist das Endothelin-System überaktiv, Plasma- und Urinspiegel sind erhöht und korrelieren mit Schwere und Dauer der Erkrankung30, 39, 54, zudem steigert Insulin die renale Endothelin-Expression, was insbesondere bei Typ-2-Diabetikern mit Insulinresistenz und demzufolge erhöhten Insulinspiegeln relevant ist.21 Eine Hemmung des Endothelin-Systems durch Endothelin-Antagonisten verbessert den renalen Blutfluss, die GFR und hemmt die renale Fibrose, das vaskuläre und myokardiale Remodelling und die Progression einer Niereninsuffizienz.17, 55, 57 Wir haben im Jahre 2009 die weltweit erste klinische Studie mit einem Endothelin-Antagonisten publiziert, bei der wir bei 286 NEPHRO Script Patienten mit diabetischer Nephropathie und einer mittleren GFR von 79 ml/min und einer Albuminurie von 1,0–1,7 g/die die Wirkung des Endothelin-Antagonisten Avosentan in einer europäischen Multicenterstudie untersucht haben. Gegenüber Placebo führte Avosentan dosisabhängig zu einer massiven Reduktion der Proteinurie bei diesen Patienten, die Abnahme lag zwischen 29 und 45 %.56 Allerdings kam es bei höheren Dosierungen zu einer Zunahme der Ödemneigung, die der limitierende Faktor bei diesen Substanzen ist. Dieser Zusammenhang wurde in der ASCEND-Studie ein Jahr später, ebenfalls unter Verwendung von Avosentan, bestätigt.31 Auch hier kam es zu einer deutlichen Reduktion der Albumin­ urie. In der Patientengruppe, die eine hohe Dosierung von Avosentan erhielt, war jedoch eine vermehrte Neigung zu Ödemen und akuter Herzinsuffizienz nachzuweisen, weswegen die Studie sogar abgebrochen werden musste. In einer weiteren 2011 publizierten Studie wurde dann erstmals eine neue, noch stärker ETA-Rezeptor-selektive Substanz (Atrasentan) ebenfalls bei diabetischer Nephropathie getestet. Diese Substanz führte auch zu einer Reduktion der Albuminurie im Bereich von 21–35 %. Auch hier kam es, vor allem in der höchs­ ten Dosierung, zu einer deutlichen Ödemneigung.28 ˘ Epoprostenol GPB.DYN 140204 Fachkurzinformation siehe Seite 32 Antikoagulans bei der Nierenersatztherapie1, 2 anstatt Hepari n 3 21 FOCUS NEPHRO Script ■ Avosentan (SPEED II, median) ■ Avosentan (ASCEND, median) ■ Atrasentan (Kohan, geom. mean) 10 * UAER = Urinary Albumin Excretion Ratio 0 –10 –20 –30 –40 –50 –60 Placebo 5/–/0,25 10/–/0,75 25/25/1,75 Milligramm 50/50/– Ödeme/Überwässerung (%) 50 Stellenwert der Endothelin-Antagonisten in der Zukunft 40 30 20 10 0 Placebo 5/–/0,25 10/–/0,75 25/25/1,75 Milligramm 50/50/– Abb. 2: Vergleich von antiproteinurischer Wirkung und Nebenwirkungen in Abhängigkeit der Dosis des Endothelin-Antagonisten ­Avosentan bzw. Atrasentan in den bisher publizierten klinischen Studien bei diabetischer Nephropathie Das Endothelin-System: What’s new 2014? Zahlreiche neue Studien weiten unseren Horizont über die Fülle der Endothelinwirkung bei Säugetieren. So wurden kürzlich tier­ experimentell neue Endothelin-abhängige Pathways bei der Fib­ roblasten-Aktivierung51, Östrogen-ähnliche vasoprotektive Effekte, reizschwellensenkende und damit antiepileptische Effekte25, positive zerebroprotektive Wirkungen im Gehirn von diabetischen Tieren1 sowie hepatoprotektive Effekte bei Paracetamol-induzierter Leberschädigung durch Endothelin-Antagonisten beschrieben59. Endothelin scheint auch bei der Wirkung von Resistin und dessen Wirkung auf die Insulinresistenz von Adipozyten beteiligt.50 In einem experimentellen Maus-Modell hat der duale EndothelinAntagonist Bosentan eine mit Nortriptylin vergleichbare antidepressive Wirkung.40 Andererseits scheinen Endothelin-Antagonisten die Ausbildung von fazialen Teleangiektasien zu begünstigen.23 Bei der Angiotensin-II-induzierten Hypertrophie von Kardiomyozyten induziert Endothelin-1 eine Transaktivierung des Epidermal Growth Factor Receptor (EGFR), wobei dieser Effekt durch einen ETA-selektiven Antagonisten hemmbar ist9. In Kombination mit Atorvastatin potenziert der ETA-selektive Antagonist Darusentan signifikant die antiatherosklerotische Wirkung des Statins.49 Neue renale Effekte des Endothelin-Systems decken rezente Studien auf. Endothelin-Antagonisten reduzieren bei DOCA-Salzhypertensiven Ratten die renale Fibrose durch Hemmung des RhoA/Rho-Kinase.29 Endothelin-1 hemmt in vitro die PodozytenDifferenzierung und steigert den Podozyten-Verlust sowie die 22 Bildung von hyperplastischen Läsionen, ein Effekt, der von dem b-Arrestin und Snail-Signalweg abhängt und durch einen ETAselektiven Antagonisten (Sitaxentan) gehemmt werden kann.7 Die von uns bereits 2009 postulierte nephroprotektive Wirkung von Endothelin-Antagonisten bei sehr viel tieferen Dosen und gleichzeitig niedrigerer Nebenwirkungsneigung43, 44 wurde zumindest experimentell kürzlich bestätigt; in dieser Arbeit wurde Avosentan mit 1/10 der bisherigen Dosis verwendet. Die Proteinurie wurde markant reduziert, ohne dass es zu einer gesteigerten Ödemneigung oder Hämodilution kam.3 Was lernen wir aus den bisherigen Studien zur Add-on-Therapie bei Patienten mit diabetischer Nephropathie? Eine Zielwert-orientierte antihypertensive Therapie unter Einschluss eines Blockers des RAS ist derzeit unumstritten. Die Kombination mehrerer RAS-Blocker, d. h. ACE-Hemmer, Angiotensin-Antagonisten oder Renin-Antagonisten, ist aus heutiger Sicht obsolet. Andere Add-on-Therapien, wie z. B. Bardoxolon, haben sich nicht bewährt oder sind sogar potenziell gefährlich. Die Daten zeigen eindeutig, dass Endothelin-Antagonisten die vermutlich potentesten Senker einer Proteinurie sind. Allerdings hat auch diese Substanzklasse Nebenwirkungen, insbesondere die klinisch relevante Hyperhydratation bei hohen Dosierungen. Daher müssen wir lernen, Wirkung und Nebenwirkungen besser verstehen und damit adäquat kontrollieren zu können. Wenn man sich die bisherigen Studien betrachtet, fällt auf, dass die antiproteinurische Wirkung bereits bei sehr niedrigen Dosierungen, die gut von den Patienten vertragen werden, einsetzt, während hohe Dosierungen zu einer nicht so starken Senkung der Proteinurie führen, jedoch die Ödemneigung verstärken. Abbildung 2 zeigt eine Übersicht von antiproteinurischer Wirkung und Nebenwirkung (Hyperhydratation) bei den bisher publizierten klinischen Studien zur Wirkung von Endothelin-Antagonisten bei diabetischer Nephropathie.57 Interessant ist, dass bereits in diesen Studien die niedrigsten Dosierungen vergleichsweise wenig Nebenwirkung hatten, gleichzeitig war der nephroprotektive Effekt signifikant und klinisch eindrucksvoll. Wir wissen mittlerweile, dass für die Volumenretention die Hemmung von ETB-, aber auch ETA-Rezeptoren im Sammelrohr der Niere verantwortlich ist, wodurch es zu einer Kochsalz- und auch Wasser-Retention in der Niere kommt. Hierbei sind sowohl Vasopressin- als auch Angiotensin-Aldosteron-abhängige Mechanismen verantwortlich.19, 26, 47, 48 Somit muss bei Entwicklung und Einsatz von Endothelin-Antagonisten auf eine möglichst niedrige Dosierung und den Wasser- und Elektrolythaushalt geachtet werden. ■ Literatur beim Verfasser Conflict of Interest: René R. Wenzel hat Beraterhonorare und/oder Vortragshonorare erhalten von folgenden Firmen, die mit in diesem Artikel zitierten Produkten in Verbindung stehen: Abbott, Actelion, Fresenius, Menarini, MSD, Novartis, Speedel, Takeda. Foto: beigestellt Mediane/durchschn. relat. Veränderung der UAER* (%) 20 FOCUS NEPHRO Script uu Eine frühzeitige Behandlung der Hypertonie ist besonders bei diabetischen ­ atientInnen wichtig, um kardiovaskuläre Komplikationen zu vermeiden und auch P die Progression der Nierenerkrankung zu minimieren. uu Zielblutdruck bei DiabetikerInnen ohne Albuminurie: 140/90 mmHg, kein Benefit für eine deutlichere Blutdrucksenkung. uu Als antihypertensives Therapieregime ist die Kombination aus ACE-Hemmer/Angiotensin­ rezeptorblocker/Renininhibitor mit einem lang wirksamen Kalziumantagonisten (z. B. Amlo­ dipin) zu empfehlen. Prophylaxe kardiovaskulärer und nephrologischer Komplikationen Hypertonietherapie bei Diabetes mellitus ohne Nephropathie H ypertonie ist ein häufiges Problem bei PatientInnen mit Typ-2-Diabetes. Die „Hypertension in Diabetes Study“ (Journal of Hypertension 1993) zeigte in einer Serie von 3.500 frisch diagnostizierten Typ-2-Diabetes-PatientInnen, dass 39 % bereits hypertensiv waren. In ca. der Hälfte dieser PatientInnen fand sich die Blutdruckerhöhung bereits vor dem Einsetzen einer Mikroalbuminurie. Hypertonie ist stark assoziiert mit Adipositas und nicht unterwartet sind hypertensive Typ-2-DiabetikerInnen mit einem höheren Risiko für kardiovaskuläre Morbidität und Mortalität ausgestattet. Univ.-Prof. Dr. Alexander Rosenkranz Klinische Abteilung für Nephrologie, ­Medizinische Universität Graz Foto: beigestellt Pathogenese Zusätzlich zur Entwicklung der diabetischen Nephropathie sind zumindest drei Faktoren vorhanden, die noch eine Rolle spielen: Hyperinsulinismus, extrazelluläre Flüssigkeitsexpansion und erhöhte Gefäßsteifigkeit. Die hypertensive Antwort im Rahmen eines Hyperinsulinismus könnte durch die gleichzeitige Gewichtszunahme sowie die Aktivierung des Sympathikus mit nachfolgender renaler Natriumretention vergesellschaftet sein. Die Volumenexpansion kann sowohl durch Insulin als auch durch die hyperglykämieinduzierte Zunahme der filtrierten Glukose in Zusammenhang stehen. Die zusätzlich filtrierte Glukose wird im proximalen Tubulus über den Natrium-Glukose-Cotransporter reabsorbiert, was gleichzeitig in einen Anstieg der Natriumreab- sorption mündet. Daher ist eine Kochsalzbeladung mit einer Blutdruckerhöhung vergesellschaftet, ein Effekt, der durch Salzrestriktion reversibel ist. Die Gefäßsteifigkeit wird bei PatientInnen mit Diabetes als Konsequenz der erhöhten Proteinglykosylierung in Zusammenhang gebracht und im späteren Stadium mit einer verstärkten Atherosklerose. Grundlagen für die derzeitige Therapie Eine frühzeitige Behandlung der Hypertonie ist besonders bei diabetischen PatientInnen wichtig, um kardiovaskuläre Komplikationen zu vermeiden und auch die Progression der Nierenerkrankung zu minimieren. Bei PatientInnen mit Typ-2-Diabetes wird davon ausgegangen, dass eine strikte Blutdruckkontrolle einen größeren Benefit erzeugt als die Blutzuckerkontrolle (UKPDS Study, British Medical Journal 1998). Prinzipiell wird auf Grund der Studienlage davon ausgegangen, dass alle DiabetikerInnen wegen der erhöhten kardiovaskulären Komplikationen mit einem Blutdruck über 140/90 mmHg sofort mit antihypertensiver Therapie therapiert werden sollten (Buse et al., Circulation 2007; James et al., JAMA 2014; Mangier et al., Journal of Hypertension 2013). Evidenz für diese Therapie ergibt sich vor allem aus der UKPDS-, ADVANCE-, HOT- sowie rezent auch der ACCOMPLISH-Studie. In der UKPDS-Studie wurden 12.000 PatientInnen mit Typ-2-Diabetes eingeschlossen, bei denen ein Blutdruck von 144/82 mmHg ˘ 23 FOCUS NEPHRO Script Wahl des Antihypertensivums Bezüglich ACE-Hemmer- bzw. Angiotensinrezeptorblocker-Therapie gibt es eine Reihe randomisierter Studien im Vergleich mit einem Placebo bei PatientInnen mit erhöhtem kardiovaskulären Risiko mit einem systolischen Blutdruck als Ausgangswert von unter 140 mmHg, meistens unter 130 mmHg. Die meisten, aber nicht alle Studien demonstrierten ein verbessertes Outcome bei PatientInnen in der Gruppe mit aktiver Therapie, wobei in vielen Fällen der Benefit eher auf Seiten der Blutdrucksenkung gesehen wurde als basierend auf dem spezifischen Effekt der Angiotensininhibition (Yusuf et al., HOPE study, New England J of Med 2000; EUROPA study, Lancet 2003; Braunwald et al., New England J of Med 2004; TRANSCEND-Studie, The Lancet 2008). In der ALLHAT-Studie wurde festgehalten, dass DiabetikerInnen eine geringere Rate von Herzinsuffizienz unter einer Low-DoseTherapie mit Chlorthalidon im Vergleich zu Amlodipin und Li24 • Zielblutdruck < 140/90 mmHg. • Bei begleitender koronarer Herzerkrankung Vermeidung einer Blutdruck-erniedrigung unter 120/70 mmHg. • Kombination ACE-Hemmer/Angiotensinrezeptorblocker/Renininhibitor mit einem lang wirksamen Kalziumantagonisten (z. B. Amlodipin) ist zu empfehlen. • Eine doppelte RAAS-Blockade soll vermieden werden. • Diese Richtlinien gelten für PatientInnen ohne Albuminurie. sinopril aufwiesen. Dieser Effekt könnte zum Teil durch die erreichten Blutdruckwerte erklärt werden und zum anderen den Anteil von ca. 30 % an Afroamerikanern in dieser Studie, die auf einen ACE-Hemmer nicht adäquat reagieren. In der ACCOMPLISH-Studie, in der eine Kombination aus ACE-Hemmer mit Amlodipin (Kalziumantagonist) mit einem ACE-Hemmer und Hydrochlorothiazid-Kombination bei PatientInnen mit Typ2-Diabetes und kardiovaskulären Risikofaktoren verglichen wurde, war der Benefit auf Seiten der Kombination ACE-Hemmer/Kalziumantagonist. Bei der Gabe eines Betablockers sollte Carvedilol mit dem potenziellen Vorteil hinsichtlich der gyklämischen Kontrolle und der niedrigeren Rate der Entwicklung einer Albuminurie im Vergleich zu Metoprolol vorgezogen werden. Wie hoch ist der Zielblutdruck? Den Zielblutdruck bei DiabetikerInnen ohne Albuminurie stellen derzeit 140/90 mmHg dar, wohl basierend auf vor allem der ACCORD-Studie, die hier keinen Benefit für eine deutlichere Blutdrucksenkung gezeigt hat. Es wird insbesondere bei PatientInnen mit koronarer Herzerkrankung noch zusätzlich darauf hingewiesen, dass der Blutdruck nicht unter 120 mmHg gesenkt werden sollte, da es hier zu einer höheren Ereignisrate gekommen ist. Es ist in Einzelfällen zu entscheiden, ob ein niedrigerer Blutdruck angestrebt werden sollte, weil bisher in nur einer Studie, der ACCORD-Studie, gezeigt wurde, dass es bei einem Blutdruckziel von 120 mmHg zu einer kleinen Reduktion der Schlaganfallrate gekommen ist, (absoluter Benefit eine von 89 PatientInnen nach 5 Jahren!). Ein solches Ziel kann in hoch motivierten PatientInnen angestrebt werden, man sollte jedoch die in diesen Studien auch aufgetretenen Komplikationsraten, wie akutes Nierenversagen, Hypokaliämie etc. im Auge behalten. Eine doppelte RAAS-Blockade ist derzeit in dieser Indikation weiterhin obsolet. ■ Fotos: beigestellt versus 154/87 mmHg verglichen wurde. Die niedrigere Blutdruckgruppe schnitt hinsichtlich der Reduktion der Schlaganfälle und Mortalität besser ab als die Gruppe mit über 150 mmHg Blutdruck. Trotzdem war das Design der UKPDS-Studie nicht so angelegt, dass Blutdruckwerte unter 140/90 mmHg oder noch niedriger evaluiert wurden. Im ADVANCE-Trial, der einzigen großen placebokontrollierten, randomisierten Studie bei Typ2-DiabetikerInnen mit erhöhtem Blutdruck fand sich ein Benefit durch die Gabe von Perindopril und Indapamid durch die zusätzliche Blutdruckreduktion auf 135 versus 140 mmHg. In der Gruppe mit einem durchschnittlichen Blutdruck von 134 fanden sich makro- bzw. mikrovaskuläre Komplikationen in 15,5 %, versus 16,8 % in der Gruppe mit 140/76 mmHg Blutdruck, die vaskuläre Mortalität betrug 3,8 % versus 4,6 % und die Gesamtmortalität 7,3 % versus 8,5 %. Für eine Überraschung sorgte die ACCORD-Studie. Hier wurde bei Typ-2-DiabetikerInnen mit kardiovaskulärer Erkrankung und zusätzlich zwei Risikofaktoren für kardiovaskuläre Erkrankungen der Blutdruck in einer Gruppe auf 135 mmHg und in der anderen auf 120 mmHg gesenkt, wobei sich kein signifikanter Unterschied bezüglich des kardiovaskulären Outcomes zeigte. Prinzipiell ist festzuhalten, dass ein ACE-Hemmer oder Angiotensinrezeptorblocker als initiale Therapie bei hypertensiven Dia­ betikerInnen als erste Wahl anzusehen ist, unabhängig davon, ob eine Albuminurie besteht oder nicht. Ziel ist die Progressionshemmung des Fortschreitens der Niereninsuffizienz und Entwicklung einer diabetischen Nephropathie. Diabetes mellitus Typ 2 und chronische Niereninsuffizienz (CKD) HOT TOPIC NEPHRO Script uu Bei Patienten mit atherogener Dyslipidämie haben Fibrate deutliche kardiovaskuläre Risikoreduktionen erbracht. uu Speziell bei chronischer Niereninsuffizienz könnten Fibrate einen günstigen und möglicherweise unterschätzten Effekt auf die Krankheitsprogression sowie auf die kardio­ vaskuläre Morbidität und Mortalität haben. uu Als pleiotrope Effekte zeigen Fibrate spezielle mikrovaskulär protektive Eigenschaften, ­welche bei diabetischen Spätschäden günstige Wirkungen haben. uu Es gibt auch Hinweise auf einen möglichen antialbuminurischen Effekt von Fibraten, also einen Einfluss auf einen Risikofaktor der Progression einer diabetischen Nephropathie. Nierenprotektive Lipidtherapie Fibrate und chronische Niereninsuffizienz: eine unterschätzte therapeutische Option? L ipidanomalien bei chronischer Niereninsuffizienz (CKD) sind u. a. durch erhöhte Triglyzeridspiegel sowie erniedrigte HDLCholesterin-Konzentrationen gekennzeichnet, zudem ist nach letzten Erkenntnissen die Qualität des HDL bei CKD-Patienten massiv verändert. Eine Reihe von Therapieansätzen, um das hohe kardiovaskuläre Risiko von CKD-Patienten durch Beeinflussung atherogener Lipidprofile zu senken, wurde zwar in den letzten Jahren studiert, wobei zuletzt eine Therapie von insbesondere CKD-3- und CKD-4-Patienten mit Statinen leitliniengerecht eine Empfehlung durch KDIGO erhielt, dennoch war ein klarer Überlebensvorteil wie auch ein positiver Einfluss auf die Progression einer chronischen Niereninsuffizienz durch Statine in größeren Studien nicht erkennbar. Insbesondere die Substanzklasse der Fib­ rate könnte allerdings einen günstigen und möglicherweise unterschätzten Effekt auf die Progression der chronischen Niereninsuffizienz sowie auf die kardiovaskuläre Morbidität und Mortalität in dieser Patientengruppe ausüben. Fotos: beigestellt Aktuelle Einsatzgebiete von Fibraten Fibrate, allen voran das in der nephrologischen Praxis gegenwärtig am häufigsten verwendete und am besten verträgliche Fenofibrat, werden derzeit vor allem bei Typ-2-Diabetikern mit Hypertriglyzeridämie und niedrigem HDL als Zweitlinientherapie eingesetzt; Indikationen für den primären Einsatz eines Fibrats stellen die schwere Hypertriglyzeridämie mit oder ohne hohen Cholesterinspiegel dar sowie die gemischte Hyperlipidämie mit hohem Triglyzerid- (TG) und niederen HDL-Werten, wenn ein Statin kontraindiziert ist oder nicht vertragen wird. Gemfibrozil Dr. Johannes Werzowa Univ.-Prof. Dr. Marcus Säemann Innere Medizin III/Klinische Abteilung für Nephrologie & Dialyse, Medizinische Universität Wien ist zur Therapie der primären Hypercholesterinämie nur bei Unmöglichkeit eines Statingebrauchs zugelassen. In Kombination mit Statinen ist lediglich der Einsatz von Fenofibrat erlaubt, da die Kombination von Gemfibrozil mit Statinen ein stark erhöhtes Rhabdomyolyserisiko birgt (Kontraindikation). Eine derartige Kombination kommt vor allem für Patienten mit hohem kardio­ vaskulären Risiko in Frage, bei denen die Gabe eines Statins alleine nicht die erwünschte Besserung der Dyslipidämie bringt. Neben seinen lipidsenkenden Eigenschaften hat man in den letzten Jahren zusätzlich pleiotrope Effekte speziell von Fenofibrat bei Diabetikern erkannt, die höchstwahrscheinlich unabhängig von der Lipidsenkung sind. Hier ist insbesondere ein günstiger Einfluss auf die diabetische Retinopathie (signifikant weniger Laserkoagulationen) zu nennen sowie eine positive Beeinflussung peripherer mikrovaskulärer Komplikationen (z. B. weniger Amputationen). Der Mechanismus dieser pleiotropen Effekte ˘ 25 HOT TOPIC NEPHRO Script ist nicht restlos geklärt und dürfte im Zusammenhang mit dem komplexen Wirkmechanismus von Fenofibrat stehen. Lipidsenkender Mechanismus und pleiotrope Effekte Fibrate induzieren die Lipoproteinlipase durch Aktivierung der PPAR-α-Untereinheit (Peroxisome Proliferator-activated Receptor alpha), welche zu einer transkriptionellen Aktivierung zahlreicher Gene führt. Gewebe mit hoher mitochondrialer sowie β-Oxidationsaktivität wie braunes Fettgewebe, Leber, Niere, Herzund Skelettmuskulatur exprimieren in hohem Maße diesen nukleären Rezeptor. Die erhöhte Lipoproteinlipase-Aktivität in diesen Geweben stimuliert u. a. den Metabolismus TG-reicher Partikel inklusive Chylomikronen und VLDL sowie den reversen Cholesterintransport von HDL. Über die Beeinflussung der TGSpiegel werden vor allem das LDL und seine intermediären Partikel maßgeblich beeinflusst. Fibrate führen auch im Fastenzustand zu einer ca. 10–50-%igen TG- und zu einer ca. 8%igen LDLReduktion. Weiters erhöhen sie das HDL und haben auch einen günstigen Einfluss auf die HDL-Zusammensetzung. In den letzten Jahren wurde zudem auch klar, dass Fibrate eine potente antiinflammatorische Aktivität besitzen. Bei ausgeprägten Hypertriglyzeridämien (TG > 200 mg/dl) und gutem Ansprechen ist die kardiovaskuläre Risikosenkung durch Fibrate deutlicher als bei normalen TG-Spiegeln (relative RR von 27 % bis 65 % von harten kardiovaskulären Endpunkten). Damit erscheinen Fibrate zwar den Statinen unterlegen, bei denen die Risikoreduktion klar belegt ist, ein möglicherweise den Statinen überlegenes Wirkprofil bei CKD-Patienten ist aber durchaus möglich, es fehlen in dieser Patientenpopulation aber noch die entsprechenden Daten. Ein kausaler Zusammenhang zwischen Dyslipidämie und Progression einer chronischen, insbesondere einer diabetischen Nephropathie wird schon lange vermutet, bis hin zur Affektion des Nierenparenchyms durch modifizierte Lipide. So könnten auch die Effekte einer direkten PPAR-α-Aktivierung durch Wirkungen auf die renale Fettakkumulation, Lipotoxizität, renale Inflammation und/oder oxidativen Stress erklärbar sein. Darüber hinaus spielt PPAR-α im gesamten Nierenparenchym eine entscheidende Rolle für den Metabolismus und Energiehaushalt. Renale Wirkungen Wenige Studien haben sich bislang mit möglichen antialbuminurischen Effekten von Fibraten auseinandergesetzt, also einem Einfluss auf einen klaren Risikofaktor der Progression einer diabetischen Nephropathie. Die DIAS-Studie (Diabetes Atherosclerosis Intervention Study) hat 314 Typ-2-Diabetiker zwischen 40 und 65 Jahren mit moderater Dyslipoproteinämie und auch suboptimaler Blutzuckerkontrolle sowie geringer Albuminausscheidung mit oder ohne Fenofibrat studiert: dabei konnte selbst unter Blockade des Renin-Angiotensin26 Aldosteron-Systems (RAAS) eine signifikante Risikoreduktion hinsichtlich Albuminurie erreicht werden (8 vs. 18 %). An der FIELD-Studie (Fenofibrate Intervention and Event Lowering in Diabetes study) nahmen 9.795 Diabetiker ohne Statintherapie teil. Nach 5 Jahren konnte Fenofibrat nicht-fatale Myokardinfarkte und koronare Revakularisierungen signifikant reduzieren, während die Albuminurie um 24 vs. 11 % reduziert werden konnte, mit einer um 14 % geringeren Progression und 18 % stärkeren Albuminurie-Regression. Darüber hinaus war der eGFR-Verlust nach 5 Jahren mit Fenofibrat deutlich geringer (1,9 ml/min/1,73 m2) ausgeprägt als mit Placebo (6,9 ml/min/1,73 m2). Die ACCORD-Lipid-Studie randomisierte 2.765 Typ-2-Diabetiker zu Fenofibrat plus Simvastatin und 2.753 zu Placebo plus Simvastatin. Fenofibrat reduzierte sowohl die Entwicklung einer Mikroalbuminurie (Fenofibrat: 38,2 % vs. Placebo: 41,6 %; p = 0,01) wie auch einer Makroalbuminurie (Fenofibrat: 10,5 % vs. Placebo: 12,3 %; p = 0,03). Insgesamt war aber die Zahl an Patienten im CKD-3-Stadium mit ca. 5 % gering, die kardiovaskuläre Ereignisrate damit auch niedrig, womit allfällige Konklusionen für diese Patientenpopulation insgesamt auf schwachen Beinen stehen; ebenso war die Zahl der Patienten, welche terminal niereninsuffizient wurden, zu gering, um verlässliche Aussagen generieren zu können. Mehrere kleine Studien konnten einen deutlichen Effekt auf die Albuminurie bei Patienten mit hohen Triglyzerid-Werten feststellen, was die Hypothese unterstützt, dass die pharmakologische Therapie einer Hypertriglyzeridämie möglicherweise direkt eine Albuminurie günstig beeinflusst. Fibrat-mediierter Kreatininanstieg In den frühen Studien Ende der 1990er-Jahre fiel auf, dass es oftmals zu einer Erhöhung des Serumkreatinins unter Fibrattherapie gekommen war. Die tatsächlichen Implikationen dieses Kreatinin­ anstiegs konnten jedoch erst rezent aufgeklärt werden. In der sehr großangelegten FIELD-Studie konnte selbst nach 5 Jahren Fibrattherapie und im Mittel eineinhalb Monate nach Absetzen der Fib­ rattherapie eine Normalisierung des Serumkreatinins – oft sogar auf niedrigere Werte als im Kontrollarm –beobachtet werden. Ähnliche Befunde wurden auch im ACCORD-Lipid-Trial (Action to Control Cardiovascular Risk in Diabetes) gemacht, wo die Effekte von Fenofibrat bei 5.518 Typ-2-Diabetes-Patienten zusätzlich zu Simvastatin untersucht wurden, was den Schluss nahelegt, dass die Pathomechanismen des Kreatininanstiegs nichts mit einer morphologischen Schädigung der Niere durch Fenofibrat zu tun haben können. Desgleichen konnten auch Studien mittels Inulinclearance zeigen, dass Fibrate bei steigendem Serumkreatinin die GFR akut nicht beeinflussen. Der Nutzen der Fibrattherapie war zudem mit dem Ausmaß der Hypertriglyzeridämie korreliert; Patienten aus der ACCORD-Lipid-Studie, die kaum einen Kreatininanstieg nach Therapiebeginn aufwiesen, profitierten jedoch am meisten von einer Langzeittherapie mit Fibraten, während Patienten mit einem mehr als 20%igen Anstieg des Kreatinins sich ähnlich wie place- HOT TOPIC NEPHRO Script bobehandelte Patienten verhielten; leider waren auch bei ACCORD Lipid insgesamt zu wenige Teilnehmer > CKD 3 inkludiert, um hier solide Aussagen machen zu können. Interessanterweise war aber gerade in der Behandlungsgruppe mit Serumkreatininanstieg der kardiovaskuläre Nutzen am stärksten ausgeprägt, womit sogar über eine Art Surrogatmarkerfunktion dieses frühen Kreatininanstiegs für einen kardiovaskulären Schutz durch eine Fibrattherapie spekuliert wurde. Die Zahl der Patienten, welche letztlich terminal niereninsuffizient wurden, war insgesamt gering, aber numerisch geringer im Fibrat-behandelten Therapiearm. Leider bleibt der Pathomechanismus des Fibrat-mediierten Kreatininanstiegs bislang noch unaufgeklärt. Ausblick Aus der Vielzahl der verfügbaren Studien hat sich herauskristallisiert, dass bei einer atherogenen Dyslipidämie, gekennzeichnet durch niedriges HDL, erhöhte TG sowie atherogenes LDL – d. h. Lipoproteinpartikel, die kleiner und dichter sind –, Fibrate einheitlich eine deutliche kardiovaskuläre Risikoreduktionen erbracht haben. Insbesondere besitzen Fibrate spezielle mikrovaskulär protektive Eigenschaften, welche bei diabetischen Spätschäden günstige Wirkungen haben. Dennoch empfehlen gegenwärtige Guidelines als initiale Therapie bei Patienten mit hohem kardio­ vaskulärem Risiko inkl. CKD-Patienten zuerst Statine und erst in zweiter Linie Fibrate: die bislang gemachten Studien waren aber für Patienten mit fortgeschrittener Niereninsuffizienz klar underpowered, um verlässliche Aussagen treffen zu können. Gespannt sollten NephrologInnen allemal sein, insbesondere was kommende Publikationen zu den Langzeitbeobachtungen von FIELD und ACCORD Lipid (ACCORDION) berichten werden. Die verfügbaren Daten sollten dennoch insgesamt auch in der Nephrologie Fibrate als einen unverzichtbaren Teil eines modernen antidyslipidämischen Arsenals neben einem konventionellen Risikofaktormanagement für Patienten mit atherogener Dyslipid­ ämie und chronischer Niereninsuffizienz etablieren. ■ Literatur: - Ansquer J.C. et al.: Effect of fenofibrate on kidney function: a 6-week randomized crossover trial in healthy people. Am J Kidney Dis 2008; 51: 904–913 - Ansquer J.C. et al.: Fenofibrate reduces progression to microalbuminuria over 3 years in a placebo-controlled study in Type 2 diabetes: results from the Diabetes Atherosclerosis Intervention Study (DAIS). Am J Kidney Dis 2005; 45: 485–493 - Balakumar P. et al.,: PPAR alpha agonists a rational therapeutic strategy for preventing abnormalities of the diabetic kidney? Pharmaco Res 2012; 65: 430–436 - Chen Y. et al.: Therapeutic effects of PPARα agonists on diabetic retinopathy in Type 1 diabetes models. Diabetes 2013; 62 (1): 261–272 - Davis T. et al.: Effects of fenofibrate on renal function in patients with Type 2 diabetes mellitus: the Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) study. Diabetologia 2011; 54: 280–290 - Keech A.C. et al.: Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet 2007; 370: 1687–1697 - Mychaleckyj J.C. et al.: Reversibility of fenofibrate therapy-induced renal function impairment in ACCORD Type 2 diabetic participants. Diabetes Care 2012; 35: 1008–1014 - Rajamani K. et al.: Effect of fenofibrate on amputation events in people with Type 2 diabetes mellitus (FIELD study): a prespecified analysis of a randomised controlled trial. Lancet 2009; 373: 1780–1788 - Ting R.D. et al.: Benefits and safety of long-term fenofibrate therapy in people with Type 2 diabetes and renal impairment: the FIELD Study. Diabetes Care 2012; 35: 218–225 - Udani S.M., Bakris G.L.: Do fibrates truly preserve kidney function? Nat Rev Endocrinol 2011; 7: 130–131 1205161-(00)-21032014 Effiziente Lipidkontrolle* * Fachinformation Lipcor® 200 mg-Kapseln, Stand der Info 02/2013 FACHKURZINFORMATION: LIPCOR 200 mg – Kapseln: Qualitative und quantitative Zusammensetzung: Eine Kapsel enthält 200 mg Fenofibrat; Sonstige Bestandteile: Kapselinhalt: LactoseMonohydrat, Vorverkleisterte Stärke, Natriumdodecylsulfat, Crospovidon, Magnesiumstearat; Kapselhülle: Gelatine, Titandioxid (E 171), Eisenoxid gelb (E 172), Erythrosin (E 127); Pharmakotherapeutische Gruppe: Lipidmodifizierende Mittel/Cholesterin- und Triglyzeridsenkende Präparate/Fibrate, ATC-Code: C10AB05; Anwendungsgebiete: Lipcor 200 mg ist angezeigt als unterstützende Behandlung neben einer Diät oder anderen nicht-medikamentösen Therapien (z.B. sportlicher Betätigung, Gewichtsabnahme) für folgende Erkrankungen: - schwere Hypertriglyzeridämie mit oder ohne niedrige HDL-Cholesterinwerte; - gemischte Hyperlipidämie, wenn ein Statin kontraindiziert ist oder nicht vertragen wird; - bei gemischter Hyperlipidämie bei Patienten mit hohem kardiovaskulärem Risiko zusätzlich zu einem Statin, wenn Triglyzerid- und HDL-Cholesterinwerte nicht ausreichend kontrolliert werden können. Lipcor wird angewendet bei Erwachsenen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile, Leberinsuffizienz (einschließlich biliäre Zirrhose und nicht erklärbare andauernde Leberfunktionsstörungen z.B. andauernde Erhöhung der Serumtransaminasen), bekannte Gallenblasenerkrankung, Nierenfunktionsstörung (aufgrund des hohen Wirkstoffgehalts), chronische oder akute Pankreatitis mit Ausnahme einer akuten Pankreatitis aufgrund schwerer Hypertriglyzeridämie, bekannte photoallergische oder phototoxische Reaktionen unter der Behandlung mit Fibraten oder Ketoprofen. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig; Inhaber der Zulassung: Abbott Ges.m.b.H., 1230 Wien. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Mitteln sowie Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen (Stand der Info: 02/2013). ® inserat_173x110d.indd 1 21.03.14 17:40 27 FREIES THEMA NEPHRO Script Nebenschilddrüsen-Antagonist Paricalcitol (Zemplar®) Sekundärer Hyperparathyreoidismus und ­Nierenersatztherapie OA Dr. Clemens Wieser 1. Medizinische ­Abteilung, LKH Klagenfurt Zwei Fallberichte demonstrieren: Selbst bei schwer einzustellenden Hämo­ dialyse- oder ­Peritonealdialysepatienten, deren korrigierte Serum-Kalzium- und/oder -Phosphatspiegel über dem Zielbereich liegen, führt eine Therapie mit dem Nebenschilddrüsen-Antagonisten Paricalcitol zur anhaltenden Senkung der PTH-Spiegel in den Idealbereich bei gleichzeitig geringer Beeinflussung des Mineralstoffwechsels. Sevelamercarbonat/Calcitriol Lanthancarbonat/Paricalcitol 1 µ/d Lanthancarbonat/Paricalcitol 2 µ/d Intakt. PTH (ng/l) 636 CAPD (kontinuierliche ambulante Peritonealdialyse) HD 80 0 15. 9. 2011 28. 5. 2012 Abb. 1: Fall 1: PTH-Verlauf und Medikation Sevelamercarbonat/Calcitriol 3,45 2,62 Lanthancarbonat/Paricalcitol 1 µ/d Lanthancarbonat/Paricalcitol 2 µ/d Epikrise: Bei erhöhten PTH-Werten (695 ng/l) und derangiertem Kalzium-Phosphat-Haushalt beginnen wir neben einer effektiven ­Dialyse primär mit einer phosphatsenkenden Therapie und kombinieren mit einem aktiven Vit.-D3-Präparat. Bei nun steigenden Caund P-Werten und stagnierendem PTH (580 ng/l) wechseln wir auf den Phosphatbinder Lanthancarbonat und den NebenschilddrüsenAntagonist Paricalcitol 1 µg/Tag p. o. Bei vorerst nur zögerlichem Abfall des PTH (430 ng/l) wird die Dosis von Paricalcitol rasch bis auf 2 µg/Tag p. o. erhöht. Darunter sehen wir eine effektive und lang anhaltende Normalisierung des PTH (um 80 ng/l) (Abb. 1) und eine ausreichende Kontrolle des Ca-P-Haushalts (Abb. 2). Der Patient ist inzwischen erfolgreich transplantiert. Fall 2: Therapierefraktärer ­Hyperparathyreoidismus Beim zweiten Fall handelt es sich um einen nun 53-jährigen Patienten, der schon seit vielen Jahren in der Hämodialyse ist und der wegen seines Hyperparathyreoidismus schon mehrmals operativ behandelt werden musste. Obwohl szintigrafisch kein Nebenschilddrüsengewebe mehr nachweisbar war, wurde ein Hyperparathyreoidismus laborchemisch nachgewiesen. 2,55 1,45 Nephrologische Anamnese: 1997: HD 1 (chronische Glomerulonephritis) 3/2000: St. p. Nephrektomie bds. bei Nephrolithiasis 2000: NTX 1 2001: Abstoßung 11/2001: NTX-Explantation (Histo: chron. NTX-Abstoßung BANF 2) 2001: HD 2 Hy- 2,1 0,87 perparathyreoidismus (Z. n. Ektomie mit Auto-TX 2003 und 2006) 15. 5. 2008: NTX 2 2008: chron. Abstoßung 7/2009: HD 3 mmol/l ■ Kalzium ■ Phosphat 0 13. 9. 2011 Abb. 2: Fall 1: Ca-P-Haushalt und Medikation 28 Ca 1,8 mmol/l, P 2,03 mmol/l, PTH 695 ng/l • Medikation: keine 28. 5. 2012 Epikrise: Unter einer Medikation mit aktivem Vitamin D (Cal- citriol) und Intensivierung des Dialyseregimes (HDF, 3 x 5 Std. Fachkurzinformation siehe Seite 33 Ein 1961 geborener berufstätiger Mann kommt mit dem Vollbild einer Urämie zur Aufnahme. Anamnestisch ist eine arterielle Hypertonie bekannt, die aber nur zeitweise behandelt worden war. Der Patient, der beruflich sehr engagiert einen eigenen Betrieb leitet, wird am Aufnahmetag einer akuten Hämodialyse unterzogen, gleichzeitig wird ein PD-Katheter intraperitoneal implantiert und mit der Einschulung in die PD begonnen. Nach 14 Tagen kann auf die CAPD als alleinige NET umgestiegen werden. In der Nierenbiopsie zeigt sich das Bild einer terminalen Nephrosklerose durch eine hypertensive Nephropathie. Bei der Aufnahme zeigten sich folgende Daten: • Klinik: Urämie, Anämie, Juckreiz, Müdigkeit • Labor: BUN 159 mg%, Crea 18,56 mg%, Hb 5,9 g/dl, Entgeltliche Einschaltung Fall 1: Paricalcitol im Kontext Peritonealdialyse FREIES THEMA Cinacalcet 120 mg NEPHRO Script Cinacalcet 90 mg/­ Paricalcitol 1 Amp. i. v. Cinacalcet 120 mg 3,45 3,11 mmol/l Intakt. PTH (ng/l) 1.217 80 0 16. 5. 2011 Cinacalcet 90 mg/ ­Paricalcitol 1 Amp. i. v. ■ Kalzium ■ Phosphat 2,55 1,45 2,1 0,87 16. 5. 2012 0 18. 10. 2009 28. 5. 2012 Abb. 3: Fall 2: PTH-Verlauf und Medikation Abb. 4: Fall 2: Ca-P-Haushalt und Medikation Behandlungszeit) konnten keine befriedigenden Stoffwechselparameter (Ca 2,13 mmol/l, P 1,93 mmol/l, PTH 955 ng/l) erzielt werden, klinisch klagte der Patient zunehmend über heftige Knochenschmerzen und quälenden Juckreiz. Auch nach Zugabe von Cinacalcet (120 mg tgl. p. o.) konnte die Situation nicht beruhigt werden. Erst unter der Kombination Paricalcitol i. v. 5 µg/Dialyse und Cinacalcet 90 mg p. o. tgl. konnte eine effiziente und andauernde Stabilisierung des PTH (um 224 ng/l) und eine signifikante Besserung der Klinik erreicht werden. ■ Entgeltliche Einschaltung Fachkurzinformation siehe Seite 33 Expertenkommentar Ad Fall 1: Erst nach Switch auf Paricalcitol anhaltende PTH-Senkung bei geringer Beeinflussung des Mineralstoffwechsels Hier präsentiert sich ein 52-jähriger Patient im Vollbild des klassischen sekundären Hyperparathyreoidismus bei einer terminalen Niereninsuffizienz, d. h. Kalzium ist noch niedrig und PTH (um 700 pg/ml) sowie ebenfalls Phosphat im Steigen begriffen. Es wird lege artis die Therapie mit Calcitriol und einem nicht aluminiumhältigen Phosphatbinder gestartet, woraufhin das Kalzium in den Normalbereich steigt, jedoch die Hyperphosphatämie zunimmt. Bei nur zögerlichem Abfall des PTHs wird auf die Kombination Lanthanum­carbonat und Paricalcitol per os geswitcht und in weiterer Folge die Dosis auf 2 µg gesteigert. Darunter kommt es zu promptem Ansprechen im Sinne einer vorerst leicht überschießenden PTH-Senkung und vor allem aber zu einer ausgezeichneten und anhaltenden Phosphatsenkung bis in den idealen Bereich. Da der Patient an einer vaskulären Nephropathie infolge lang bestehender arterieller Hypertonie litt, ist anzunehmen, dass auch eine Linksventrikelhypertrophie mit eventuell schon eingeschränkter Funktion und eine Atherosklerose bestehen. Im kürzlich – quasi der PRIMO-Studie folgend – publizierten OPERA-Trial konnten positive Effekte von Paricalcitol auf die Linksventrikelmasse und -funktion ebenfalls nicht bewiesen werden (Wang et al., JASN 2014), auch wenn der Patient theoretisch aufgrund vieler experimenteller Analysen durch VDR-vermittelte Abschwächung der vorzeitigen Arterienalterung und der Herzhypertrophie profitieren könnte (Cozzolino et al., Nutr Metab Cardiovasc Dis 2013; Freundlich et al., Am J Hypertens 2013). Der vorgestellte Patient entschloss sich für die Peritonealdialyse. Hier resultiert möglicherweise aus der Therapie mit Paricalcitol ein weiterer Vorteil für den Patienten. Der Patient ist relativ jung, berufstätig und hat eventuell noch eine lange nephrologische Krankengeschichte vor sich. Auch wenn er inzwischen transplantiert wurde, wird er sich eventuell noch einmal für die Peritonealdialyse entscheiden müssen. Wir wissen, dass die Entgiftung über das Peritoneum ein Ablaufdatum hat. Studien zeigten auf, dass die Transition des peritonealen Mesotheliums vom Epithel zum Mesenchym für die Verdickung und daraus resultierende Abnahme der Permeabilität verantwortlich sein könnte. Paricalcitol könnte möglicherweise diese Fibrosierung des Mesotheliums, die unter anderem für das Nachlassen der Entgiftung über die Zeit verantwortlich ist, ausbremsen (Kang et al., Nephron Exp Nephrol 2014). Ad Fall 2: Individuelle Therapie mit hoher Paricalcitol-Dosis erfolgreich Bei diesem Patienten besteht eine lange nephrologische Krankengeschichte. Vor 17 Jahren wurde der Patient im Alter von Priv.-Doz.in 36 Jahren das erste Mal mit der Diagnose in Dr. ­Kyra Borchhardt „Dialysepflichtigkeit“ bei einer Glomerulonephritis konfrontiert. Bei St. p. 2-maDialyseinstitut ­Klagenfurt ligen frustranen Nierentransplantationen (jeweils weniger als 1 Jahr bescheiden funktionstüchtig) ist der Patient also bis auf wenige Monate ununterbrochen chronisch dialysepflichtig. Zusätzlich besteht keine Residual­ transplantatfunktion bei St. p. Eigennierennephrektomie und NTX-1-Ektomie. Das erklärt den ausgeprägten therapierefraktären Hyperparathyreoidismus, der trotz mehrerer chirurgischer Eingriffe bei mittlerweile negativem Scan für ein noch immer bestehendes Nebenschilddrüsenadenom in atypischer Lokalisation oder versprengtes autonomes Autotransplantatgewebe spricht. Der Patient hatte unter p. o. Therapie mit Calcitriol und Cinacalcet PTH-Werte knapp um 1.000 ng/l. Erst bei Switch auf Paricalcitol 5 µg i. v. 3 x pro Woche konnte PTH dauerhaft gesenkt werden. Und erst nach Ansprechen dieser Therapie konnte Cinacalcet von 120 mg auf 90 mg gesenkt werden. Man könnte meinen, hier würde es sich um einen einfachen Fall von Incompliance handeln. Doch dagegen sprechen die hohen i. v. Paricalcitol-Dosen, die notwendig sind, um PTH dauerhaft zu senken. Dagegen spricht auch, dass der Patient immerhin schon 2-mal für eine Nierentransplantation vorgeschlagen war. Eine kürzlich publizierte österreichisch-deutsche Studie, die die Gabe von i. v. Paricalcitol bei circa 1.300 prävalenten HD-Patienten untersuchte, unterstützt die These, dass es bei i. v. Verabreichung zu einer sehr guten Responderrate kommt (Biggar et al., Nephron Clin Pract 2014). Jedes Dialysezentrum kann wahrscheinlich von solchen schwierig einzustellenden Patienten berichten und hier wird auch die individuelle Therapieeinstellung jeweils nach der Benefit-Risiko-Abwägung verlaufen. Wichtig bleibt daher eine möglichst große Auswahl an einzusetzenden Therapeutika, damit der Nephrologe seine Patienten individuell und individualisiert – auch mit unterschiedlichen Kombinationstherapien – einstellen kann, denn dass eine Therapie allein allen hilft, ist spätestens seit EVOLVE und PRIMO nicht mehr zu beweisen (Moe S. M., Thadani R., Curr Opin Nephrol Hypert 2013). Literatur bei der Verfasserin 29 FREIES THEMA NEPHRO Script 10 Jahre Cinacalcet: eine fixe Säule in der sHPT-Therapie! 30 1 Amgen-Satellitensymposium „10 Jahre Mimpara®: Zurück in die Zukunft: Calcimimetika – PTH-Senkung oder mehr?“ 13. 3. 2014 im Rahmen der ÖGN-Wintertagung in Fuschl am See. Zusammenfassung des Vortrags von Univ.-Prof. Dr. Alexander Rosenkranz, Klinische Abteilung für Nephrologie, Universitätsklinik für Innere Medizin, MU Graz. www.medmedia.at/praes/cinacalcet/ Fachkurzinformation siehe Seite 33 L.AT.03.2014.0198 Mit Spannung wurden daher die Ergebnisse der randomisierten, Placebo-kontrollierten EVOLVE-Studie (Chertow, 2012) erwartet. 3.800 Dialyse-Patienten mit erhöhten Plasmaspiegeln an intaktem Parathormon (iPTH) über 300 pg/ml waren eingeschlossen, sie erhielten randomisiert zusätzlich zur Standardtherapie entweder Cinacalcet oder Placebo. Rosenkranz fasst zusammen: „In der Cinacalcet-Gruppe konnte das Mortalitätsrisiko bzw. das Risiko für ein erstes, nicht-tödliches kardiovaskuläres Ereignis um 7 % gegenüber Standardtherapie reduziert werden (ITT-Analyse, dieser Unterschied war statistisch nicht signifikant zur Placebogruppe).“ Werden diese Daten, so Rosenkranz, hinsichtlich des Alters und anderer Charakteristika adjustiert, „zeigt sich sogar eine nominell signifikante 12%ige Reduktion der Ereignisse.“ Zudem trat in der Gruppe mit Standardtherapie (plus Placebo) öfter ein schwerer, nicht-remittierender HPT auf. Dies führte häufig zu Parathyroid­ ektomie oder auch zur nicht-protokollgemäßen Verordnung von kommerziellem Cinacalcet, was die Studienergebnisse stark beeinflusste. Unter Cinacalcet wiederum konnte die Rate der Parathyroidektomien signifikant reduziert werden. „Natürlich müssen wir diese potenziellen Vorteile von Cinacalcet den möglichen Risiken und Nebenwirkungen gegenüberstellen“, resümiert Rosenkranz. „Trotzdem wird Cinacalcet bei einem signifikanten Anteil von Patienten ein fixer Bestandteil der sHPTTherapie bleiben, wenn wir weiter unsere Zielbereiche für PTH und Phosphat erreichen wollen!“ ■ Entgeltliche Einschaltung „Als wichtiger Surrogatmarker für die Mortalität bei Dialyse wurde in den letzten Jahren die vaskuläre Kalzifizierung in den Mittelpunkt gestellt“, betont Rosenkranz. Daher wurden die ADVANCE- und EVOLVE-Studien konzipiert, um den Einfluss von Cinacalcet plus niedrig dosiertem Vitamin D bei Dialysepatienten mit sHPT auf die Kalzifizierungsrate (ADVANCE) sowie auf die Gesamtmortalität bzw. die Rate kardiovaskulärer Ereignisse (EVOLVE) zu untersuchen. Die Ergebnisse der ADVANCEStudie (Raggi, 2011) erhärten die Hypothese, dass Cinacalcet in Kombination mit niedrig dosiertem Vitamin D das Fortschreiten der koronaren Kalzifizierung bei Dialysepatienten stärker verlangsamen kann als flexibel dosiertes Vitamin D allein. Der Einfluss von Cinacalcet auf die Mortalität von CKD-Patienten konnte bereits in einer prospektiven, aber observationellen Studie dargestellt werden: Unter der Kombination Cinacalcet – Vitamin D i. v. war die Gesamtmortalität um 27 % reduziert (Block, 2010). „Allerdings“, merkt Rosenkranz an, „diese grundsätzlich erfreulichen Daten müssen mit Vorsicht interpretiert werden.“ Denn eine observationelle Studie habe ihre methodischen Schwächen, so wies das Kollektiv in der Cinacalcet-Gruppe weniger Begleit­ Reduktion der Mortalität MN-AUT-AMG-229-2014-March-P Vaskuläre Kalzifizierung erkrankungen auf und auch die antihypertensive Therapie war nicht ausgewogen verteilt. Entgeltliche Einschaltung mit freundlicher Unterstützung der Firma AMGEN D ie Einführung des Kalzimimetikums Cinacalcet (Mimpara®, Fa. Amgen) vor zehn Jahren habe zweifelsohne eine deutliche Erweiterung der therapeutischen Möglichkeiten jenseits der Standardtherapie mit Vitamin D eröffnet. Denn Cinacalcet, das die Aktivität der Kalzium-Sensing-Rezeptoren an der Oberfläche der Nebenschilddrüsenzellen moduliert, war die erste kausale Therapiemöglichkeit bei sHPT. Unbestritten sei, dass Cinacalcet die Parathormon-, Calcium- und Phosphatspiegel positiv beeinflusst (Block, 2004; Lindberg, 2005; Quarles, 2003) – Kalzimimetika werden daher auch in den KDIGO®-Guidelines 2009 ausdrücklich empfohlen. Zudem zeigen Untersuchungen (Komaba, 2010), dass Cinacalcet die Hyperplasie der Nebenschilddrüse bei fortgeschrittenem sHPT wirksam kontrollieren kann (>30%ige Reduktion der Drüsengröße). Fachkurzinformation siehe Flappe „Der sekundäre Hyperparathyreoidismus (sHPT) ist eine klassische und schwerwiegende Komplikation bei chronisch niereninsuffizienten (CKD) Patienten“, erinnert Univ.-Prof. Dr. Alexander Rosenkranz, MU Graz, bei einem Vortrag1 Mitte März in Fuschl einleitend. „Denn sie trägt entscheidend zu Knochenerkrankungen, vaskulärer Kalzifizierung und letztlich zu erhöhter Mortalität bei diesen Hochrisikopatienten bei.“ FREIES THEMA NEPHRO Script Xarelto® (Rivaroxaban) Klinischer Alltag: DOAK und perioperatives ­Management D er Grund dafür ist, dass sie, so die Leitlinien1 der Europäischen Kardiologengesellschaft zum Thema, „bei deutlich verbesserter Sicherheit eine klare Nichtunterlegenheit im Vergleich zu Vitamin-K-Antagonisten hinsichtlich der Wirksamkeit aufweisen“ (d. h. z. B. im Falle von Rivaroxaban: Reduktion der Hirnblutungen und tödlichen Blutungen). Innerhalb der Substanzklasse der DOAK werden aufgrund fehlender direkter Vergleichsstudien keine konkreten Empfehlungen ausgesprochen, die Experten erinnern jedoch, verschiedene Patientencharakteristika bei der Auswahl zu berücksichtigen. L.AT.03.2014.0198 Fachkurzinformation siehe Seite 33 DOAK und Nierenfunktion: So sind die Einsatzmöglichkeiten der Entgeltliche Einschaltung Entgeltliche Einschaltung mit freundlicher Unterstützung der Firma AMGEN MN-AUT-AMG-229-2014-March-P Fachkurzinformation siehe Flappe Die allermeisten Patienten mit Vorhofflimmern werden oral antikoaguliert, um das Risiko für thrombo­embolische Ereignisse zu verringern. Bis vor Kurzem wurden in dieser Indikation vor allem Vitamin-K-Antagonisten eingesetzt. Die Zulassung der direkten oralen Antikoagulantien (DOAK) wie Rivaroxaban (Xarelto®) zur Schlaganfallprophylaxe bei nicht-valvulärem Vorhofflimmern verändert jedoch die klinische Praxis: Immer mehr Patienten werden auf diese neuen Substanzen eingestellt. einzelnen DOAK (früher auch als NOAK, neue orale Antikoagulanzien, bezeichnet) sowie ihre Dosierungen auch abhängig von der Nierenfunktion des Patienten. Innerhalb der Substanzklasse der DOAK gibt es große Unterschiede, bis zu welchem Grad einer Niereninsuffizienz ein DOAK überhaupt eingesetzt werden kann. Die jeweiligen Fachinformationen geben detaillierte Auskunft. Für Rivaroxaban beispielsweise gilt: Die Substanz kann – dosisadaptiert – bis zu einer Kreatininclearance von 15 ml/min verordnet werden. Andere DOAK sind beispielsweise bereits ab einer Kreatininclearance unter 30 ml/min kontraindiziert (Details siehe Beilage: Auszug aus EHRA Practical Guide). DOAK und Gerinnungsmonitoring: Ein regelmäßiges Gerinnungs- monitoring, wie für Vitamin-K-Antagonisten zwingend erforderlich, ist unter DOAK nicht vorgesehen. Wenn die Messung der Gerinnungswerte erforderlich sein sollte, ist jedenfalls das Labor zu informieren, dass der Patient mit einem DOAK behandelt wird. liegt beim perioperativen Management. Zunächst wird festgehalten, dass ein Bridging bei Patienten, die mit DOAK behandelt werden, nicht erforderlich ist. Der Zeitpunkt des Absetzens des DOAK muss jedoch gut geplant werden und ist vor allem vom Blutungsrisiko des Eingriffs, vom Thromboembolierisiko des Patienten und von seiner Nierenfunktion abhängig. Bei Eingriffen ohne klinisch relevantes Blutungsrisiko kann laut EHRA die Operation im Plasma-Talspiegel des jeweiligen DOAK durchgeführt werden. Bei einem DOAK wie Rivaroxaban, das nur 1-mal täglich verordnet wird, ist der Eingriff 18 bis 24* Stunden nach der letzten Einnahme anzusetzen. Bei Operationen mit geringem oder hohem Blutungsrisiko wird empfohlen, das DOAK 24 oder 48 Stunden vor dem Eingriff abzusetzen (Details siehe Heftbeilage); bei eingeschränkter Nierenfunktion ist dieses Zeitintervall zu verlängern. Bei einem akuten chirurgischen Eingriff ist abzuwägen, ob eine Verschiebung des Eingriffs um mehrere Stunden möglich ist. DOAK und postoperatives Management: Wann das DOAK nach dem Eingriff wieder eingenommen werden soll, ist wiederum abhängig vom postoperativen Blutungsrisiko, das dem Thromboembolierisiko des Patienten gegenübergestellt werden muss. In besonderen Fällen kann die vorübergehende Verabreichung eines niedermolekularen Heparins erwogen werden, wie im Practical Guide der EHRA ausgeführt wird. www.NOACforAF.eu: Weiterführende Details zum perioperativen Management unter DOAK aus der EHRA-Publikation stehen inzwischen auch in deutscher Sprache zur Verfügung. Sie sind über die Website www.noacforaf.eu abrufbar. ■ Camm A.J. et al., Eur Heart J 2012; 33: 2719–47 Heidbuchel H. et al., Europace 2013; 15: 625–51 1 DOAK und perioperatives Management: Hilfestellung für das Vor- 2 gehen im Falle eines chirurgischen Eingriffs unter DOAK bietet eine praxisbezogene Publikation der European Heart Rhythm Association (EHRA).2 Der Schwerpunkt dieser Praxisrichtlinie * Laut Fachinformation soll Rivaroxaban vor einem Eingriff zumindest 24 Stunden pausiert werden – d. h. wenn der Patient normalerweise Rivaroxaban am Morgen einnimmt und eine OP z. B. am Dienstag um 10 Uhr geplant ist, ist die letzte präoperative Einnahme am Montag möglich. 31 NEPHRO Script Amelior plus HCT 20 mg/5 mg/12,5 mg Filmtabletten, Amelior plus HCT 40 mg/5 mg/12,5 mg Filmtabletten, Amelior plus HCT 40 mg/10 mg/12,5 mg Filmtabletten, Amelior plus HCT 40 mg/5 mg/25 mg Filmtabletten, Amelior plus HCT 40 mg/10 mg/25 mg Filmtabletten. Qualitative und quantitative Zusammensetzung: Eine Filmtablette enthält 20 mg Olmesartanmedoxomil, 5 mg Amlodipin (als Amlodipinbesilat) und 12,5 mg Hydrochlorothiazid bzw. 40 mg Olmesartanmedoxomil, 5 mg Amlodipin (als Amlodipinbesilat) und 12,5 mg Hydrochlorothiazid bzw. 40 mg Olmesartanmedoxomil, 10 mg Amlodipin (als Amlodipinbesilat) und 12,5 mg Hydrochlorothiazid bzw. 40 mg Olmesartanmedoxomil, 5 mg Amlodipin (als Amlodipinbesilat) und 25 mg Hydrochlorothiazid bzw. 40 mg Olmesartanmedoxomil, 10 mg Amlodipin (als Amlodipinbesilat) und 25 mg Hydrochlorothiazid. Liste der sonstigen Bestandteile: Tablettenkern: vorverkleisterte Maisstärke, silizifierte mikrokristalline Cellulose (mikrokristalline Cellulose, hochdisperses wasserfreies Siliciumdioxid), Croscarmellose-Natrium, Magnesiumstearat. Filmüberzug: Poly(vinylalkohol), Macrogol 3350, Talkum, Titandioxid (E 171), Eisen(III)-oxid gelb (E 172), Eisen(III)-oxid rot (E 172) (nur in 20 mg /5 mg /12,5 mg, 40 mg /10 mg /12,5 mg, 40 mg /10 mg /25 mg Filmtabletten), Eisen(II, III)-oxid schwarz (E 172) (nur in 20 mg /5 mg /12,5 mg Filmtabletten). Anwendungsgebiete: Behandlung der essenziellen Hypertonie. Zusatztherapie: Amelior plus HCT ist indiziert bei erwachsenen Patienten, deren Blutdruck mit einer Kombination von Olmesartanmedoxomil und Amlodipin, eingenommen in Form einer Zweierkombination, nicht ausreichend kontrolliert werden kann. Substitutionstherapie: Amelior plus HCT ist indiziert zur Substitutionstherapie bei erwachsenen Patienten, deren Blutdruck mit einer Kombination von Olmesartanmedoxomil, Amlodipin und Hydrochlorothiazid, eingenommen in Form einer Zweierkombination (Olmesartanmedoxomil und Amlodipin oder Olmesartanmedoxomil und Hydrochlorothiazid) und eines Monopräparates (Hydrochlorothiazid oder Amlodipin), ausreichend kontrolliert wird. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe, gegen Dihydropyridinderivate oder gegen andere Sulfonamid-Derivate (da Hydrochlorothiazid ein Sulfonamid-Derivat ist) oder gegen einen der sonstigen Bestandteile. Stark eingeschränkte Nierenfunktion. Therapieresistente Hypokaliämie, Hyperkalzämie, Hyponatriämie und symptomatische Hyperurikämie. Stark eingeschränkte Leberfunktion, Cholestase und Gallenwegsobstruktionen. Zweites und drittes Schwangerschaftstrimenon. Amelior plus HCT ist, aufgrund des enthaltenen Amlodipins, auch kontraindiziert bei Patienten mit: Schock (inklusive kardiogenem Schock), Schwerer Hypotonie, Linksventrikulärer Abflussbehinderung (z. B. hochgradige Aortenstenose), Hämodynamisch instabiler Herzinsuffizienz nach einem akuten Myokardinfarkt. Pharmakotherapeutische Gruppe: Angiotensin-II-Antagonisten; andere Kombinationen; ATC-Code: C09DX03. Inhaber der Zulassung: Menarini International Operations Luxembourg S.A., 1, Avenue de la Gare, L-1611 Luxemburg, Luxemburg. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Weitere Angaben zu den Abschnitten Dosierung, Art und Dauer der Anwendung, Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Amelior plus HCT wird unter der Lizenz von Daiichi Sankyo Europe GmbH vermarktet. Stand der Information: April 2012. Candeblo 8 mg-Tabletten. Candeblo 16 mg-Tabletten. Candeblo 32 mg-Tabletten. Zusammensetzung: 1 Tablette enthält 8 mg Candesartan Cilexetil. 1 Tablette enthält 16 mg Candesartan Cilexetil. 1 Tablette enthält 32 mg Candesartan Cilexetil. Sonstige Bestandteile: 8 mg, 16 mg, 32 mg: Mannitol, Maisstärke, Eisenoxid rot (E172), Copovidon, Glycerol, Magnesiumstearat. 16 mg, 32 mg: mikrokristalline Cellulose Anwendungsgebiete: Candeblo ist angezeigt zur: Behandlung der essenziellen Hypertonie bei Erwachsenen. Behandlung von erwachsenen Patienten mit Herzinsuffizienz und eingeschränkter linksventrikulärer systolischer Funktion (linksventrikuläre Ejektionsfraktion ≤ 40%) zusätzlich zu einer Behandlung mit Angiotensin-Converting-Enzym (ACE)-Hemmern oder wenn ACE-Hemmer nicht toleriert werden. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Zweites und drittes Schwangerschaftstrimester. Schwere Einschränkung der Leberfunktion und/oder Cholestase. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Angiotensin-II-Rezeptor-Antagonist, rein, ATC-Code: C09CA06. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach. Verschreibungspflicht/ Apothekenpflicht: Rezept- und apothekenpflichtig. Packungsgrößen: 30 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! Candeblo plus 8 mg/12,5 mg-Tabletten. Candeblo plus 16 mg/12,5 mg-Tabletten. Candeblo plus 32 mg/12,5 mg-Tabletten. Candeblo plus 32 mg/25 mg-Tabletten. Zusammensetzung: 1 Tablette enthält 8 mg Candesartan Cilexetil und 12,5 mg Hydrochlorothiazid. 1 Tablette enthält 16 mg Candesartan Cilexetil und 12,5 mg Hydrochlorothiazid. 1 Tablette enthält 32 mg Candesartan Cilexetil und 12,5 mg Hydrochlorothiazid. 1 Tablette enthält 32 mg Candesartan Cilexetil und 25 mg Hydrochlorothiazid. Sonstige Bestandteile: Candeblo plus 8 mg/12,5 mg-, 16 mg/12,5 mg-, 32 mg/12,5 mg-, 32 mg/25 mg-Tabletten: Mannitol, Maisstärke, Copovidon, Glycerol, Magnesiumstearat. Candeblo plus 16 mg/12,5 mg-, 32 mg/12,5 mg-, 32 mg/25 mg-Tabletten: Eisenoxid gelb (E172). Candeblo plus 16 mg/12,5 mg-, 32 mg/25 mg-Tabletten: Eisenoxid rot (E172). Anwendungsgebiete: Candeblo plus ist angezeigt zur: •Behandlung der essenziellen Hypertonie bei erwachsenen Patienten, deren Blutdruck mit einer Candesartan Cilexetil- oder Hydrochlorothiazid-Monotherapie nicht optimal kontrolliert werden kann. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe, gegen Sulfonamid-abgeleitete Wirkstoffe oder einen der sonstigen Bestandteile. Hydrochlorothiazid ist ein Sulfonamid-abgeleiteter Wirkstoff. Zweites und drittes Schwangerschaftstrimester. Schwere Einschränkung der Nierenfunktion (Kreatinin-Clearance < 30 ml/min/1,73 m2 KO). Schwere Einschränkung der Leberfunktion und/oder Cholestase. Therapieresistente Hypokaliämie und Hyperkalzämie. Gicht. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Angiotensin-II-Antagonisten + Diuretika. ATC-Code: C09DA06. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach. Verschreibungspflicht/ Apothekenpflicht: Rezept- und apothekenpflichtig. Packungsgrößen: 30 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! Dynovas 0,5 mg (1,5 mg) Pulver und Lösungsmittel zur Herstellung einer Infusionslösung. Zusammensetzung: 1 Durchstechflasche enthält 0,531 mg (1,593 mg) Epoprostenol-Natrium, entsprechend 0,5 mg (1,5 mg) Epoprostenol. Jede Lösungsmittel-Durchstechflasche enthält 50 ml sterilen Glycinpuffer, mit einem Natriumgehalt von ca. 55 mg. Die Rekonstitution einer Durchstechflasche mit 0,5 mg (1,5 mg) Epoprostenol in 50 ml sterilem Puffer ergibt eine Konzentration von 10.000 Nanogramm (30.000 Nanogramm) pro ml. Hilfsstoffe: Enthält 0,05 mmol Natrium (1,15 mg) pro Durchstechflasche. Pulver zur Herstellung einer Infusionslösung: Mannitol, Glycin, Natriumchlorid, Natriumhydroxid (zur pH-Einstellung). Lösungsmittel: Glycin, Natriumchlorid, Natriumhydroxid (zur pH-Einstellung), Wasser für Injektionszwecke. Anwendungsgebiete: Hämodialyse: Dynovas ist indiziert bei Dialyse, wenn bei der Anwendung von Heparin ein hohes Risiko besteht, Blutungen auszulösen oder zu verschlimmern, oder wenn Heparin aus einem anderen Grund kontraindiziert ist. Primäre und Sekundäre Pulmonale Hypertonie: Dynovas ist auch indiziert zur intravenösen Langzeittherapie der Primären Pulmonalen Hypertonie (PPH) bei Patienten der Stadien III und IV gemäß der Klassifikation der New York Heart Association (NYHA), die nicht ausreichend auf eine konventionelle Therapie ansprechen sowie der Sekundären Pulmonalen Hypertonie (SPH) im Rahmen von Erkrankungen aus dem Formenkreis der Sklerodermie aufgrund intrinsischer präkapillärer Lungengefäßkrankheiten bei Patienten in den NYHA Stadien III und IV. Die Daten für die Langzeitanwendung sind begrenzt. Gegenanzeigen: Dynovas ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen das Arzneimittel. Dynovas ist kontraindiziert bei Patienten mit dekompensierter Herzinsuffizienz, die durch eine schwere links-ventrikuläre Dysfunktion verursacht wird. Dynovas darf bei Patienten, bei denen sich während der Kurzzeitdosisoptimierung ein Lungenödem gebildet hat, nicht angewendet werden. ATC-Code: B01AC09. Abgabe: Rezeptund apothekenpflichtig, wiederholte Abgabe verboten. Packungsgrößen: 1 Durchstechflasche mit 0,5 mg (1,5 mg) Epoprostenol und 1 Durchstechflasche (2 Durchstechflaschen) mit 50 ml sterilem Glycinpuffer. Kassenstatus: No Box. Zulassungsinhaber: Gebro Pharma GmbH, 6391 Fieberbrunn. Stand der Fachkurzinformation: 28.07.2011. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen mit anderen Mitteln, Schwangerschaft und Stillperiode sowie Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung siehe Austria-Codex-Fachinformation. [1] Lubin P., Intensiv 2001; 9(1): 15–22, DOI: 10.1055/s-2001–10474. [2] Druml, W., et al.; Intensiv News 4/2000, Supplement 1, 1–12. [3] wenn Heparin nicht verwendet werden kann (s. FI). Exforge HCT 5 mg/160 mg/12,5 mg Filmtabletten, Exforge HCT 5 mg/160 mg/25 mg Filmtabletten, Exforge HCT 10 mg/160 mg/12,5 mg Filmtabletten, Exforge HCT 10 mg/160 mg/25 mg Filmtabletten, Exforge HCT 10 mg/320 mg/25 mg Filmtabletten. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Exforge HCT 5 mg/160 mg/12,5 mg Filmtabletten: Jede Filmtablette enthält 5 mg Amlodipin (als Amlodipinbesilat), 160 mg Valsartan und 12,5 mg Hydrochlorothiazid. Exforge HCT 5 mg/160 mg/25 mg Filmtabletten Jede Filmtablette enthält 5 mg Amlodipin (als Amlodipinbesilat), 160 mg Valsartan und 25 mg Hydrochlorothiazid. Exforge HCT 10 mg/160 mg/12,5 mg Filmtabletten: Jede Filmtablette enthält 10 mg Amlodipin (als Amlodipinbesilat), 160 mg Valsartan und 12,5 mg Hydrochlorothiazid. Exforge HCT 10 mg/160 mg/25 mg Filmtabletten: Jede Filmtablette enthält 10 mg Amlodipin (als Amlodipinbesilat), 160 mg Valsartan und 25 mg Hydrochlorothiazid. Exforge HCT 10 mg/320 mg/25 mg Filmtabletten: Jede Filmtablette 32 FACHKURZINFORMATION enthält 10 mg Amlodipin (als Amlodipinbesilat), 320 mg Valsartan und 25 mg Hydrochlorothiazid. Liste der sonstigen Bestandteile: Exforge HCT 5 mg/160 mg/12,5 mg Filmtabletten: Tablettenkern: Mikrokristalline Cellulose, Crospovidon, Hochdisperses Siliziumdioxid, Magnesiumstearat. Überzug: Hypromellose, Titandioxid (E171), Macrogol 4000, Talkum. Exforge HCT 5 mg/160 mg/25 mg Filmtabletten: Tablettenkern: Mikrokristalline Cellulose, Crospovidon, Hochdisperses Siliziumdioxid, Magnesiumstearat. Überzug: Hypromellose, Macrogol 4000, Talkum, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172, gelb). Exforge HCT 10 mg/160 mg/12,5 mg Filmtabletten: Tablettenkern: Mikrokristalline Cellulose, Crospovidon, Hochdisperses Siliziumdioxid, Magnesiumstearat. Überzug: Hypromellose, Macrogol 4000, Talkum, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172, gelb), Eisen(III)-oxid (E172, rot). Exforge HCT 10 mg/160 mg/25 mg Filmtabletten: Tablettenkern: Mikrokristalline Cellulose, Crospovidon, Hochdisperses Siliziumdioxid, Magnesiumstearat. Überzug: Hypromellose, Macrogol 4000, Talkum, Eisen(III)hydroxid-oxid x H2O (E172, gelb). Exforge HCT 10 mg/320 mg/25 mg Filmtabletten: Tablettenkern: Mikrokristalline Cellulose, Crospovidon, Hochdisperses Siliziumdioxid, Magnesiumstearat. Überzug: Hypromellose, Macrogol 4000, Talkum, Eisen(III)-hydroxid-oxid x H2O (E172, gelb). Anwendungsgebiete: Behandlung der essenziellen Hypertonie als Ersatztherapie bei erwachsenen Patienten, deren Blutdruck durch die Kombination aus Amlodipin, Valsartan und Hydrochlorothiazid (HCT), die entweder in Form der drei einzelnen Komponenten oder als Zweierkombination und einer Einzelkomponente gegeben wurde, ausreichend kontrolliert ist. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe, andere Sulfonamidderivate, Dihydropyridinderivate oder einen der sonstigen Bestandteil. Zweites und drittes Schwangerschaftstrimester (siehe Abschnitte 4.4 und 4.6). Leberfunktionsstörung, biliäre Zirrhose oder Cholestase. Schwere Nierenfunktionsstörung (GFR <30 ml/min/1,73 m2), Anurie und Dialysepatienten. Gleichzeitige Anwendung von Angiotensin-Rezeptor-Antagonisten (ARB) – einschließlich Valsartan – oder Inhibitoren des Angiotensin-konvertierenden Enzyms (ACE-Hemmer) mit Aliskiren bei Patienten mit Diabetes mellitus oder Nierenfunktionsstörungen (GFR < 60 ml/min/1,73 m2) (siehe Abschnitte 4.4 und 4.5). Therapieresistente Hypokaliämie, Hyponatriämie, Hyperkalzämie und symptomatische Hyperurikämie. Schwere Hypotonie. Schock (einschließlich kardiogener Schock). Obstruktion des linksventrikulären Ausflusstrakts (z. B. hypertrophe obstruktive Kardiomyopathie und hochgradige Aortenstenose). Hämodynamisch instabile Herzinsuffizienz nach akutem Myokardinfarkt. Pharmakotherapeutische Gruppe: Angiotensin II Antagonist, rein (Valsartan), in Kombination mit Dihydropyridin-Derivaten (Amlodipin) und Thiazid-Diuretika (Hydrochlorothiazid), ATC Code: C09DX01 Valsartan, Amlodipin und Hydrochlorothiazid. INHABER DER ZULASSUNG: Novartis Europharm Limited, Wimblehurst Road, Horsham, West Sussex, RH12 5AB, Vereinigtes Königreich. Verschreibungspflicht/Apothekenpflicht. Rezept- und apothekenpflichtig. Informationen betreffend Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkung mit anderen Mitteln, Nebenwirkungen und Gewöhnungseffekte sind den veröffentlichten Fachinformationen zu entnehmen. Stand der Information: 11/2013. FERINJECT ® 50 mg Eisen/ml Injektionslösung oder Konzentrat zur Herstellung einer Infusionslösung. Zusammensetzung: Ein Milliliter Lösung enthält 50 mg Eisen in Form von Eisen(III)-Carboxymaltose. Jede 2-mlDurchstechflasche enthält 100 mg, jede 10-ml-Durchstechflasche 500 mg und jede 20-ml-Durchstechflasche 1000 mg Eisen in Form von Eisen(III)-Carboxymaltose. FERINJECT® enthält Natriumhydroxid. Ein Milliliter Lösung enthält bis zu 0,24 mmol (5,5 mg) Natrium, Salzsäure (zur Einstellung des pH-Werts) und Wasser für Injektionszwecke. Anwendungsgebiete: zur Behandlung von Eisenmangelzuständen, wenn orale Eisenpräparate unwirksam sind oder nicht angewendet werden können. Die Diagnose muss durch geeignete Laboranalysen bestätigt sein. Gegenanzeigen: bekannte Überempfindlichkeit gegen FERINJECT® oder einen der sonstigen Bestandteile; Anamnestisch bekannte schwerwiegende Überempfindlichkeitsreaktion gegen i.v. Eisenpräparate; nicht durch Eisenmangel bedingte Anämie, z.B. sonstige mikrozytische Anämie; Anhaltspunkte für eine Eisenüberladung oder Eisenverwertungsstörungen. Pharmakotherapeutische Gruppe: dreiwertiges Eisen, Parenteralia. ATC-Code: B03AC01. Inhaber der Zulassung: Vifor France SA 7-13, Bd Paul-Emile Victor, 92200 Neuilly-sur-Seine, Frankreich, rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen sowie Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen. Datum: Oktober 2013. ▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Fosrenol 500 mg / 750 mg / 1000 mg Kautabletten. Zusammensetzung: Eine Kautablette enthält Lanthancarbonat-Hydrat entsprechend 500 mg / 750 mg / 1000 mg Lanthan. Anwendungsgebiete: Fosrenol ist indiziert als Phosphat bindendes Mittel zur Kontrolle von Hyperphosphatämie bei Patienten mit chronischer Niereninsuffizienz, die eine Hämodialysebehandlung oder eine kontinuierliche, ambulante Peritonealdialyse (CAPD) erhalten. Fosrenol ist darüber hinaus indiziert bei nicht-dialysepflichtigen, erwachsenen Patienten mit chronischer Nierenerkrankung mit einem Serumphosphatspiegel ≥1,78 mmol/l, bei denen eine phosphatarme Ernährung alleine nicht ausreichend ist, um den Serumphosphatspiegel zu kontrollieren. Gegenanzeigen: Überempfindlichkeit gegenüber Lanthancarbonat-Hydrat oder einen der sonstigen Bestandteile. Hypophosphatämie. Hilfsstoffe: Dextrate (hydratisiert), hochdisperses wasserfreies Siliciumdioxid, Magnesiumstearat. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Gewöhnungeffekten entnehmen Sie bitte der veröffentlichten Fachinformation. ATC-Code: V03AE03. Zulassungsinhaber: Shire Pharmaceutical Contracts Ltd, Hampshire International Business Park, Chineham, Basingstoke, Hampshire, RG24 8EP, Vereinigtes Königreich. Vertrieb in Österreich: Sanova Pharma GesmbH, Haidestraße 4, 1110 Wien. Rezeptpflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Stand der Information: 21.03.2013. Irbepress-HCT 150/12,5 mg Filmtabletten. Irbepress-HCT 300/12,5 mg Filmtabletten. Irbepress-HCT 300/25 mg Filmtabletten. Zusammensetzung: 150/12,5 mg: Jede Filmtablette Irbepress-HCT 150 mg/12,5 mg enthält 150 mg Irbesartan und 12,5 mg Hydrochlorothiazid sowie 45 mg Lactose als Lactose-Monohydrat. 300/12,5 mg: Jede Filmtablette Irbepress-HCT 300 mg/12,5 mg enthält 300 mg Irbesartan und 12,5 mg Hydrochlorothiazid sowie 90 mg Lactose als Lactose-Monohydrat. 300/25 mg: Jede Filmtablette Irbepress-HCT 300 mg/25 mg enthält 300 mg Irbesartan und 25 mg Hydrochlorothiazid sowie 96,2 mg Lactose als Lactose-Monohydrat. Sonstige Bestandteile: Tablettenkern: Cellactose 80 (enthält 75 % Lactose-Monohydrat und 25 % Cellulosepulver). mikrokristalline Cellulose, Croscarmellose-Natrium, hochdisperses Siliciumdioxid, Magnesiumstearat. Filmüberzug: 150 mg/12.5 mg (Opadry OY-34948 - pink): Hypromellose, Macrogol 400, Titandioxid (E171), Eisenoxid rot (E172). 300 mg/12.5 mg (Opadry OY-34948 - pink): Hypromellose, Macrogol 400, Titandioxid (E171), Eisenoxid rot (E172). 300 mg/25 mg (Opadry II 31F34205 – pink-violett): Lactose-Monohydrat, Hypromellose, Macrogol 400, Titandioxid (E171), Eisenoxid rot (E172), Indigotin (E132), Eisenoxid schwarz (E172) Anwendungsgebiete: Zur Behandlung der essentiellen Hypertonie. Diese fixe Kombination ist indiziert bei erwachsenen Patienten, deren Blutdruck mit Irbesartan oder Hydrochlorothiazid allein nicht ausreichend gesenkt werden konnte. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe, einen der sonstigen Bestandteile oder gegen andere Sulfonamid-Derivate (Hydrochlorothiazid ist ein Sulfonamid-Derivat). Zweites und drittes Schwangerschaftstrimester. Stark eingeschränkte Nierenfunktion (Kreatininclearance < 30 ml/min). Therapieresistente Hypokaliämie, Hyperkalzämie. Stark eingeschränkte Leberfunktion, biliäre Leberzirrhose und Cholestase. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Angiotensin-II-Antagonisten und Diuretika. ATC-Code: C09DA04. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach. Verschreibungspflicht/ Apothekenpflicht: Rezept- und apothekenpflichtig. Packungsgrößen: 30 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! Irbepress 75 mg – Filmtabletten. Irbepress 150 mg – Filmtabletten. Irbepress 300 mg – Filmtabletten. Zusammensetzung: 75 mg: Jede Filmtablette Irbepress 75 mg enthält 75 mg Irbesartan. Jede Filmtablette Irbepress 75 mg enthält 16,03 mg Lactose. 150 mg: Jede Filmtablette Irbepress 150 mg enthält 150 mg Irbesartan. Jede Filmtablette Irbepress 150 mg enthält 32,06 mg Lactose. 300 mg: Jede Filmtablette Irbepress 300 mg enthält 300 mg Irbesartan. Jede Filmtablette Irbepress 300 mg enthält 64,125 mg Lactose. Sonstige Bestandteile: Tablettenkern: Cellactose 80 (enthält 75 % Lactose-Monohydrat und 25 % Cellulosepulver), Mikrokristalline Cellulose, Vorverkleisterte Maisstärke, Croscarmellose-Natrium, Hochdisperses Siliciumdioxid, Magnesiumstearat. Filmüberzug (Opadry YS-1 7003 weiß): Titandioxid (E171), Hypromellose, Macrogol 400, Polysorbat 80. Anwendungsgebiete: Irbesartan wird angewendet zur Behandlung der essentiellen Hypertonie. Es ist auch indiziert zur Behandlung der Nierenerkrankung bei Patienten mit Hypertonie und Typ-2-Diabetes mellitus als Teil einer antihypertensiven Behandlung. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 der Fachinformation genannten sonstigen Bestandteile. Zweites und drittes Schwangerschaftstrimester. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Angiotensin-II-Antagonisten, rein. ATC-Code: C09CA04. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach. Rezeptpflicht/ Apothekenpflicht: Rezept- und apothekenpflichtig. Packungsgrößen: 30 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! PHARMANEWS/WERBUNG NEPHRO Script Antihypertensive Therapie Irbepress®/Irbepress®-HCT – Premiere in Österreich Mit Irbepress® (Irbesartan) steht den österreichischen PatientInnen ein neues Sartan mit entscheidenden pharmakokinetischen Vorteilen zur Verfügung. Irbepress® weist mit bis zu 15 Stunden die längste Halbwertszeit aller IND-freien Sartane auf und verfügt über eine Bioverfügbarkeit von bis zu 80 %.1, 2 Irbepress® wird dual eliminiert (80 % Fäzes, 20 % Urin).1, 2, 3 Irbepress® ist ein nicht-kompetitiver AT1-Rezeptorantagonist (keine Prodrug)3, 4, bei einer leichten bis mäßigen Nieren- bzw. Leberinsuffizienz ist keine Dosisanpassung erforderlich.3 Mit dem Kassenpreis von 5,45 Euro – dies entspricht Behandlungskosten von weniger als 0,20 Euro täglich5 – steht den PatientInnen eine preiswerte, innovative Therapie zur Verfügung. Dosierungsempfehlungen: Die Anfangsdosis bei älteren Patienten (> 75 Jahre) bzw. bei Hämodialyse-Patienten beträgt 75 mg. Als Anfangs- und Erhaltungsdosis bei essenzieller Hypertonie bzw. als Anfangsdosis bei Hypertonikern mit Typ-2-Diabetes und Ne- Telmicard 40 mg-Tabletten. Telmicard 80 mg-Tabletten. Zusammensetzung: 40 mg: 1 Tablette enthält 40 mg Telmisartan. 80 mg: 1 Tablette enthält 80 mg Telmisartan. Sonstige Bestandteile: Natriumhydroxid, Povidon, Mannitol, Maisstärke, Carmellose-Calcium, Natriumstearylfumarat, Magnesiumstearat. Anwendungsgebiete: Hypertonie: Behandlung der essentiellen Hypertonie bei Erwachsenen. Kardiovaskuläre Prävention: Reduktion der kardiovaskulären Morbidität bei Erwachsenen mit manifester atherothrombotischer kardiovaskulärer Erkrankung (koronare Herzerkrankung, Schlaganfall oder periphere arterielle Verschlusskrankheit in der Vorgeschichte) oder Diabetes mellitus Typ 2 mit dokumentiertem Endorganschaden. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile, zweites und drittes Schwangerschaftsdrittel, obstruktive Gallenfunktionsstörungen, stark eingeschränkte Leberfunktion. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Angiotensin-II-Antagonisten, rein. ATC-Code: C09CA07. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach. Rezeptpflicht/ Apothekenpflicht: Rezept- und apothekenpflichtig. Packungsgrößen: 30 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! Xarelto 10 mg/15 mg/20 mg Filmtabletten (Vor Verschreibung bitte die Fachinformation beachten). ▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8. Qualitative und Quantitative Zusammensetzung: Wirkstoff: 10 mg/15 mg/20 mg Rivaroxaban. Sonstige Bestandteile: Tablettenkern: Mikrokristalline Cellulose, Croscarmellose-Natrium, Lactose-Monohydrat, Hypromellose, Natriumdodecylsulfat, Magnesiumstearat; Filmüberzug: Macrogol 3350, Hypromellose, Titandioxid (E 171), Eisen(III)-oxid (E 172). Sonstige Bestandteile mit bekannter Wirkung: Jede 10 mg/15 mg/20 mg Filmtablette enthält 26,51 mg/24,13 mg/ 21,76 mg Lactose (als Monohydrat). Pharmakotherapeutische Gruppe: Direkte Faktor-Xa-Inhibitoren, ATC-Code: B01AF01 Anwendungsgebiete: 10 mg: Zur Prophylaxe venöser Thromboembolien (VTE) bei erwachsenen Patienten nach elektiven Hüft- oder Kniegelenksersatzoperationen. 15 mg/20 mg: Prophylaxe von Schlaganfällen und systemischen Embolien bei erwachsenen Patienten mit nichtvalvulärem Vorhofflimmern und einem oder mehreren Risikofaktoren, wie kongestiver Herzinsuffizienz, Hypertonie, Alter ab 75 Jahren, Diabetes mellitus, Schlaganfall oder transitorischer ischämischer Attacke in der Anamnese. Behandlung von tiefen Venenthrombosen (TVT) und Lungenembolien (LE) sowie Prophylaxe von rezidivierenden TVT und LE bei Erwachsenen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile; akute, klinisch relevante Blutungen; Läsionen oder klinische Situationen mit einem signifikanten Risiko einer schweren Blutung; die gleichzeitige Anwendung von anderen Antikoagulanzien, außer bei der Umstellung der Antikoagulationstherapie auf oder von Rivaroxaban (siehe Abschnitt 4.2) oder wenn UFH in Dosen gegeben wird, die notwendig sind, um die Durchgängigkeit eines zentralvenösen oder arteriellen Katheters zu erhalten; Lebererkrankungen, die mit einer Koagulopathie und einem klinisch relevanten Blutungsrisiko, einschließlich zirrhotischer Patienten mit Child Pugh B und C, verbunden sind; Schwangerschaft u. Stillzeit. Warnhinweise und Vorsichtsmaßnahmen: Eine klinische Überwachung in Übereinstimmung mit der antikoagulatorischen Praxis wird während der gesamten Behandlungsdauer empfohlen. Die Gabe von Xarelto sollte bei Auftreten einer schweren Blutung unterbrochen werden. Mit zunehmendem Alter kann sich das Blutungsrisiko erhöhen. Nicht empfohlen: bei Patienten mit einer schweren Nierenfunktionseinschränkung (Kreatinin-Clearance < 15 ml/min); bei Patienten, die zeitgleich eine systemische Behandlung mit Wirkstoffen, die gleichzeitig stark CYP3A4 und P-gp inhibieren, z.B. Azol-Antimykotika oder HIV-Proteaseinhibitoren, erhalten; bei Patienten mit erhöhtem Blutungsrisiko; bei Patienten, die gleichzeitig starke CYP3A4 Induktoren erhalten, es sei denn der Patient wird engmaschig auf Anzeichen oder Symptome einer Thrombose überwacht; Nicht empfohlen aufgrund des Fehlens von Daten: bei Patienten unter 18 Jahren; bei Patienten, die zeitgleich mit Dronedaron behandelt werden; 10 mg: Patienten, die sich einer Operation nach Hüftfraktur unterzogen haben; 15 mg/20 mg: bei Patienten mit künstlichen Herzklappen; bei Patienten mit einer LE, die hämodynamisch instabil sind oder eine Thrombolyse oder pulmonale Embolektomie benötigen. Mit Vorsicht empfohlen: bei Patienten mit einer schweren Nierenfunktions- phropathie werden 150 mg empfohlen. Eine Tagesdosis von 300 mg gilt als Steigerungsdosis bei unzureichendem Ansprechen auf die 150-mg-Dosis bzw. als bevorzugte Erhaltungsdosis bei Hypertonikern mit Typ-2-Diabetes und Nephropathie.3 Ab 1. 3. 2014 wird auch Irbepress®-HCT in der grünen Box (IND-frei ) erhältlich sein.6 Ihr Ansprechpartner: MMag. Belinda Raback Tel.: +43 3136/82 577-270, Fax: +43 3136/82 577-250 E-Mail: [email protected], www.gl-pharma.at G.L. Pharma GmbH, Schlossplatz 1, 8502 Lannach Bas H.: Angiotensin-II-Rezeptorblocker und Organprotektion Vorteile jenseits der antihypertensiven Wirkung. Ars Medici Dossier III 2005; 27–30 2 Altmannsberger S.H.G. et al.: Pharmakologische Grundlagen: Wirkung der AT1Rezeptorantagonisten. Pharmazie in unserer Zeit. 30. Jahrgang 2001; Nr. 4: 296–302 3 Fachinformation Irbepress® (Stand 01/2014) 4 Oparil S.: Newly emerging pharmacologic differences in angiotensin II receptor blockers. Am J Hypertens 2000; 13: 18–24 5 WVZ 02/2014 6 geplante Veröffentlichung im WVZ 03/2014 1 störung (Kreatinin-Clearance 15 - 29 ml/min) oder mit einer Nierenfunktionsstörung, wenn gleichzeitig andere Arzneimittel eingenommen werden, die zu erhöhten Rivaroxaban Plasmaspiegeln führen; bei Patienten, die gleichzeitig auf die Gerinnung wirkende Arzneimittel erhalten, 10 mg: bei der Anwendung von neuraxialer Anästhesie oder Spinal/Epiduralanästhesie; 15 mg/20 mg: es gelten spezielle Dosisempfehlungen für Patienten mit einer mittelschweren oder schweren Nierenfunktionsstörung und im Fall von Patienten mit einer TVT/LE nur dann, deren abgeschätztes Blutungsrisiko das Risiko für eine rezidivierende TVT/LE überwiegt; bei Patienten mit dem Risiko einer ulzerativen gastrointestinalen Erkrankung kann eine prophylaktische Behandlung erwogen werden. Obwohl die Behandlung mit Rivaroxaban keine Routineüberwachung der Exposition erfordert, können die mit einem kalibrierten quantitativen Anti-Faktor Xa-Test bestimmten Rivaroxaban-Spiegel in Ausnahmesituationen hilfreich sein. Xarelto enthält Lactose. Nebenwirkungen: Häufig: Anämie, Schwindel, Kopfschmerzen, Augeneinblutungen, Hypotonie, Hämatome, Epistaxis, Hämoptyse, Zahnfleischbluten, gastrointestinale Blutung, gastrointestinale und abdominale Schmerzen, Dyspepsie, Übelkeit, Verstopfung, Durchfall, Erbrechen, Pruritus, Hautrötung, Ekchymose, kutane und subkutane Blutung, Schmerzen in den Extremitäten, Blutung im Urogenitaltrakt (einschließlich Hämaturie und Menorrhagie), Einschränkung der Nierenfunktion, Fieber, periphere Ödeme, verminderte Leistungsfähigkeit, Transaminasenanstieg, Blutung nach einem Eingriff (einschl. postoperativer Anämie und Wundblutung), Bluterguss, Wundsekretion. Gelegentlich: Thrombozythämie, allergische Reaktion, allergische Dermatitis, zerebrale und intrakranielle Blutungen, Synkope, Tachykardie, trockener Mund, Leberfunktionsstörung, Urtikaria, Hämarthros, sich unwohl fühlen, kutane und subkutane Blutung, Anstieg von Bilirubin, alkalischer Phosphatase, LDH, Lipase, Amylase und der GGT. Selten: Gelbsucht, Blutung in einen Muskel, lokale Ödeme, Anstieg von konjugiertem Bilirubin, vaskuläres Pseudoaneurysma. Nicht bekannt: Kompartmentsyndrom oder (akutes) Nierenversagen als Folge einer Blutung, Angioödem und allergisches Ödem. Inhaber der Zulassung: Bayer Pharma AG, D-13342 Berlin, Deutschland. Verschreibungs-/ Apothekenpflicht: Rezeptpflichtig (NR), apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen und Gewöhnungseffekten sind den veröffentlichten Fachinformationen zu entnehmen. Stand der Information: November 2013. Zemplar 5 Mikrogramm/ml – Injektionslösung. Zemplar 1 Mikrogramm Weichkapseln, Zemplar 2 Mikrogramm Weichkapseln. ZUSAMMENSETZUNG: Injektionslösung: Jeder ml der Injektionslösung enthält 5 μg Paricalcitol. Eine 1 ml Ampulle enthält 5 Mikrogramm Paricalcitol. Weichkapseln: 1 μg: Jede Weichkapsel enthält 1 μg Paricalcitol und 0,71 mg wasserfreies Ethanol. 2 μg: Jede Weichkapsel enthält 2 μg Paricalcitol und 1,42 mg wasserfreies Ethanol. ANWENDUNGSGEBIETE: Injektionslösung: Paricalcitol ist zur Prävention und Therapie eines sekundären Hyperparathyreoidismus bei Patienten mit chronischem Nierenversagen, die eine Hämodialyse benötigen, indiziert. Weichkapseln: indiziert zur Prävention und Therapie eines sekundären Hyperparathyreoidismus, assoziiert mit chronischer Niereninsuffizienz (chronische Nierenerkrankung (CKD) Stadien 3 und 4) und chronischem Nierenversagen (CKD Stadium 5) bei Patienten mit Hämodialyse oder Peritonealdialyse. GEGENANZEIGEN: Paricalcitol darf Patienten mit Anzeichen auf Vitamin D-Intoxikation, Hypercalcämie oder Überempfi ndlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels nicht verabreicht werden. SONSTIGE BESTANDTEILE: Injektionslösung: Ethanol (20 Vol. %), Propylenglykol, Wasser für Injektionszwecke. Weichkapseln: Kapselinhalt: Mittelkettige Triglyzeride, wasserfreies Ethanol, Butylhydroxytoluol. Kapselhülle: Gelatine, Glycerol, gereinigtes Wasser, Titandioxid (E 171). Farbstoff der 1 μg – Weichkapsel: schwarzes Eisenoxid (E 172). Farbstoffe der 2 μg – Weichkapsel: rotes Eisenoxid (E 172), gelbes Eisenoxid (E 172). Schwarze Drucktinte: Propylenglycol, Schwarzes Eisenoxid (E 172), Polyvinylacetatphthalat, Macrogol 400, konzentrierte Ammoniak-Lösung. ZULASSUNGSINHABER FÜR ÖSTERREICH: AbbVie GmbH, Perfektastraße 84A, 1230 Wien VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT: Rezeptund Apothekenpflichtig PHARMAKOTHERAPEUTISCHE GRUPPE: Andere Nebenschilddrüsen Antagonisten, ATC-Code: H05BX02. Informationen zu besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen und Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen. STAND DER INFORMATION: 02/2013. 33 Fachkurzinformation siehe Seite 32 Inserat-A4-Amelior+HCT-Druck.indd 1 17.08.2011 14:08:28 Uhr