LMU - Helmholtz Zentrum München
Werbung

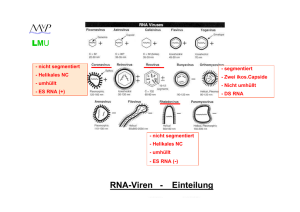
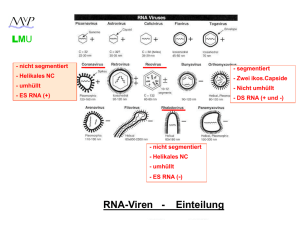
Picornaviren LMU - nicht segmentiert - segmentiert - Helikales NC - Zwei ikos.Capside - umhüllt - Nicht umhüllt - ES RNA (+) - DS RNA - nicht segmentiert - Helikales NC - umhüllt - ES RNA (-) RNA-Viren - Einteilung (+) Strang RNA-Viren LMU Picornaviridae: Enterovirus Rhinovirus Hepatovirus Aphthovirus Cardiovirus Parechovirus polio, coxsackie, echo human rhino hepatitis A foot-and-mouth disease; MKS encephalomyocarditis, mengo human parecho Caliciviridae: Norovirus norwalk-like, sapporo-like Hepatitis-E-likeviridae: Hepatitis-Evirus hepatitis E Togaviridae: Alphavirus Rubivirus sindbis, semliki-forest rubella Flaviviridae: Flavivirus Hepacivirus yellow fever, dengue, FSME hepatitis C Coronaviridae: Coronavirus human corona 229-E, SARS LMU Coronaviridae ein Molekül infektiöse RNA, etwa 16-21 kb (längstes RNA-Virus Genom) Virionen mit 80 – 160 nm Durchmesser lipidhaltige Hülle helikales Nukleokapsid Coronaviridae LMU Gattung Coronavirus: 4 Gruppen Coronaviridae LMU 5‘-cap 5'-methyliertes cap Polyadenyliertes 3’-Ende Strukturproteine am 3'-Ende kodiert Nicht-Strukturproteine (NS) am 5'-Ende ORF1 (a und b) nehmen 2/3 des Genoms ein Coronaviridae LMU Haarnadelschleife Leader-RNA 5‘-cap ORF1a ORF1b Haarnadelschleife induziert Leserastersprung (20-30 %) bei Translation Proteolytische Spaltung der NS-Proteine durch virale Proteasen Coronaviridae LMU template: (-) Strang Leader-RNA 5‘-cap 5‘-cap 5‘-cap 5‘-cap 5‘-cap 5‘-cap 5‘-cap Subgenomische mRNA’s für die Expression der Strukturproteine (“nested” mRNA’s) Priming via Leader-RNA Identisches 3’ Ende 5’ Cap und 3’ poly A Regulation z.T. via Anzahl der Leader-RNA Bindestellen Coronaviridae LMU Entry ? (+) (+) (+) (-) (+) (+) (+) (+) Budding ins ER Freisetzung via Golgi Coronaviridae (HCV-229E und -OC43) LMU • • Weltweite Verbreitung Bis zu 90 % der Erwachsenen haben Antikörper Pathogenese: - Tröpfcheninfektion - Vermehrung in Flimmerepithelzellen des oberen Respirationstraktes - andere Coronaviren auch Vermehrung in Darmepithelzellen • - Infektion beschränkt sich meist auf die Epithelien dieser Organe - Genetische Prädisposition für HCV-229 Empfänglichkeit (Chromosom 15) - Reinfektionen häufig / meist symptomlos • Coronaviridae (HCV-229E und -OC43) LMU • Saisonale Häufung im Winter (Februar / März): • • Klinik: - häufig inapparent - Inkubationszeit: 2 - 5 Tage - Erkrankungsdauer ca. 1 Woche - Schnupfen, Husten, Hals- und Kopfschmerzen, leichtes Fieber - Schwererer Verlauf bei Säuglingen und Kleinkindern: asthmatische Anfälle, Bronchitis (selten) und Pneumonien (selten) möglich • Harmloser Atemwegsinfekt ! Coronaviridae (SARS-CoV) LMU • Severe Acute Respiratory Syndrom-Virus Erstmaliges Auftreten im November 2002 in China Klinik: • - Inkubationszeit: 2 – 7 Tage - Plötzlich auftretendes, schnell steigendes, hohes Fieber (bis 38°C) - Atemnot, Muskel- und Kopfschmerzen - Entzündung beider Lungenflügel - Thrombozytopenie / Leukozytopenie - Letalität: ca. 11 % (?) Coronaviridae (SARS-CoV) • • Coronaviridae (SARS-CoV) LMU • • März / April / Mai 2003: Panik vor einer Epidemie !!! Coronaviridae (SARS-CoV) LMU Ca. 1000 Tote weltweit • Letzter Fall: Sommer 2003 (taiwanesischer Militärarzt) Genogruppen der Coronaviren: • • - Gruppe 1 und 2 bei Säugetieren - Gruppe 3 bei Vögeln - Gruppe 4 SARS-CoV ??? Coronaviridae (SARS-CoV) LMU Weitere Besonderheiten SARS-CoV : - Vermehrung in Vero Zellen (African Green Monkey Kidney) möglich im Gegensatz zu HCV 229E und -OC43 • - Tröpfchen- und Schmierinfektion möglich ! (weitere Übertragungswege ? Klimaanlage etc.) - Befall der unteren Atemwege (Lunge) und des Darms (viel Virus im Stuhl nachweisbar) • - Zoonose (Zibetkatze, Fledermaus, Frettchen, Marder ?) 03.05.2003 - (idw) Robert Koch-Institut Die in Deutschland ergriffenen Maßnahmen gegen das Schwere Akute Respiratorische Syndrom (SARS) sind wirksam. … Innerhalb Deutschlands hat es bislang keine Ansteckung gegeben. "Das zeigt, dass die schnelle Reaktion des Robert Koch-Instituts und die gute Zusammenarbeit mit den zuständigen Behörden der Bundesländer sowie den Gesundheitsämtern vor Ort auf der Grundlage des Infektionsschutzgesetzes in Deutschland eine größere Ausbreitung des internationalen SARS-Ausbruchs bisher verhindert hat", sagt Reinhard Kurth, Präsident des Robert Koch-Instituts. Picornaviren LMU - nicht segmentiert - segmentiert - Helikales NC - Zwei ikos.Capside - umhüllt - Nicht umhüllt - ES RNA (+) - DS RNA - nicht segmentiert - Helikales NC - umhüllt - ES RNA (-) RNA-Viren - Einteilung LMU Reoviridae DS- Strang RNA-Viren (segmentierte Genome) Rotavirus (11) Orthoreovirus (10) Orbivirus (10) Seadornavirus (12) Rotaviren (Gruppen: A,B,C,D,E,F,G) Reovirus (Serotypen GT 1-3) Orungovirus, Kemerovovirus Bannavirus (weitere 7 Gattungen bei Tieren und Pflanzen) Reoviridae: Reo- von respiratory, enteric, orphan: Zeitpunkt der Entdeckung (1959) konnte gezeigt werden, dass diese Viren den Respirations- und Gastrointestinaltrakt infizieren. Eine Assoziation mit Erkrankungen war jedoch nicht bekannt. Birnaviridae Avibirnavirus (2) Gumborovirus (Hühner) Aquabirnavirus (2) Infekt. Pankreasnekrose (Lachse) Entomobirnavirus (2) Drosophila-X-Virus LMU Reoviridae (Rotaviren) 11 Moleküle (Segmente) DS-RNA; 0,6 - 3 kb Nicht umhüllt Zwei ikosaedrische Kapside (inneres und äußeres) Dadurch: hohe Stabilität in der Umwelt (Flüsse, Abwässer) Dadurch: hohe pH Resistenz (3,5 – 10) Durchmesser: 70 - 80 nm LMU Reoviridae (Rotaviren) Genome organisation L M S - 11 Moleküle (Segmente) DS-RNA; Größe zwischen 0,6 - 3 kb - Cap-Struktur an allen 5’-Enden - Kein poly A am 3’-Ende; dafür: Cytidinreste - Konservierte Bereiche (7-10 bp) an beiden Enden (Replikation, Verpackung ?) - RNA abhängige RNA Polymerase ist Bestandteil des Virions ! - Reassortantenbildung bei Koinfektion Reoviridae (Rotaviren) LMU Replikation Reifes Virion Synthese der - Strang RNAs + Core Komplex + Strang RNAs + Strang RNAs b: - Rezeptorvermittelte Endozytose - Virion im Endosom - Abstreifen des äußeren Kapsids - Freisetzung ins Zytoplasma - Umlagerung des Kapsids - Aktivierung der RNA abhäng. RNA Polymerase - Transkription von (+) mRNAs ins Zytoplasma (nur – Strang wird abgelesen !) - = primäre Transkription c und d: - Synthese der Core-und Kapsidproteine im Zytoplasma und ER - Zytoplasmatische Einschlußkörperchen (Viroplasma) entstehen e und f: - Zusammenbau unreifer Virionen mit nur + Strang RNA (Reassortanten !) am ER - Synthese der – RNA Strangs (Doppelstrang) im reifenden Viruspartikel - = sekundäre Transkription - Budding ins ER (transiente Membran) - Weitere Reifung (Verlust der Membran) - Freisetzung nach Absterben der Zelle Reoviridae (Rotaviren) Ganzjähriges Vorkommen mit peak im Winter 30-50 % aller kindlichen Diarrhöen Durchseuchung: 90% (100%) im Alter von 3 (5) Jahren Ca. 60.000 Infektionen pro Jahr (Deutschland) Ca. 527.000 tote Kinder pro Jahr2004 (weltweit) Reoviridae (Rotaviren) Pathogenese - fäkal-orale Übertragung - Infektion der differenzierten Enterozyten des (Dünn-) Darmepithels - Erhöhung der Ca2+ Konzentration (NSP4 Enterotoxin?) - Zusammenbruch des Zytoskeletts - Schädigung der Enterozyten Durchfall, verminderte Nährstoff– und Wasseraufnahme nicht infiziert infiziert Geschwollen und vaskularisiert an der “villi”-Spitze Reoviridae (Rotaviren) Klinik (Rotavirus A) - Inkubationszeit: 1 - 3 Tage - Meist inapparent bei Neugeborenen und älteren Kindern - Apparent v.a. bei Kindern > 3 Monate und < 2 Jahre - Symptome (3 – 5 Tage): - Fieber - Erbrechen - Bauchschmerzen - Durchfall - Bei schweren Verläufen (40%): - Stationäre Behandlung im Krankenhaus erforderlich - Dehydration, Lethargie und Kreislaufversagen - Tödliche Verläufe selten in Industrieländern - Virusausscheidung bis 3 Tage nach Beschwerdefreiheit Reoviridae (Rotaviren) Rotavirus Impfstoffe: Rotarix: - attenuierter Lebendimpstoff - vom häufigsten Serotyp G1P abgeleitet - monovalent - starke Replikation im Darm - zwei Impfdosen (niedrig konzentriert) Rotateq (Rotashield): - rekombinanter Lebendimpfstoff auf Basis des bovinen Rotavirus (Stamm WC3) - polyvalent (5 Varianten mit 5 Antigenen der häufigsten humanpathogenen Rotavirus Serotypen) - schwächere Replikation im Darm - drei Impfdosen (hoch konzentriert) Zulassung (Deutschland) in 2006; ab 6. Lebenswoche Noch keine STIKO-Empfehlung 98% iger Schutz vor schweren Verläufen Reoviridae (Rotaviren) Diagnostik: Antigen-ELISA (aus Stuhlproben): - Mikrotiterplatte mit anti-Rotavirus Antikörper (kommerziell erhältlich) - Zugabe von Suspension der Stuhlprobe - Zugabe von POX konjugiertem anti-Rotavirus Antikörper - Substratzugabe und Farbreaktion PCR aus Stuhlproben Picornaviren LMU - nicht segmentiert - segmentiert - Helikales NC - Zwei ikos.Capside - umhüllt - Nicht umhüllt - ES RNA (+) - DS RNA - nicht segmentiert - Helikales NC - umhüllt - ES RNA (-) RNA-Viren - Einteilung LMU (-) strang RNA-Viren unsegmentiert ! (Mononegavirales) Rhabdoviridae Vesiculovirus Lyssavirus Vesicular stomatitis V. Rabies Virus Filoviridae Filovirus Marburg Virus Ebola Virus Paramyxoviridae Paramyxovirus Morbillivirus Pneumovirus Mumps, Parainfluenza Masernvirus RSV Bornaviridae Bornavirus Pferd, Schaf Paramyxoviren, Rhabdoviren, LMU Filoviren, Bornaviren Gemeinsame Eigenschaften: „Mononegavirales“ (-) Strang RNA-Genom RNA-abhängige RNA Polymerase ist Bestandteil des Virion Genom einzelsträngig, nicht segmentiert Virionen behüllt Helicale Nukleokapside Rhabdoviren LMU (-) Strang RNA,13-16 kb „bullet-shaped“, 70-80 nm ∅, 130-380 nm lang lipidhaltige Hülle, helikales Nukleokapsid Viele verschiedene Viren (befallen Tiere und Pflanzen) Rhabdoviren LMU (-) RNA (-) RNA Leader Region am 3’-Ende RNA abhängige RNA Polymerase (L): Bestandteil des Virion !!! Alle Proteine sind “Strukturproteine”: N (Nucleocapsid), NS (=P; phosph. Nucleocapsidprotein), M (Matrix), G (Glykolisiertes Membranprotein) und L (s.o.) Rhabdoviren LMU (-) RNA (+) RNA RNA Pol Initiation der (+) RNA-Synthese am 3’-Ende der (-) RNA Transkription einer kurzen leader RNA: kein 5’ cap / kein polyA Stop der Transkripton am Ende der leader RNA Neustart am Beginn des N-Proteins: jetzt: 5’ cap / poly A Rhabdoviren LMU (-) RNA (+) RNA RNA Pol Zwischen den einzelnen Genen befinden sich intergenische Regionen Die RNA Polymerase stoppt die Transkription, überliest die intergenische Region und nimmt ihre Arbeit am NS Protein wieder auf (Überspringen und Reinitiation) Fortsetzung über gesamtes Genom Rhabdoviren LMU RNA Pol (-) RNA (+) RNA Dieser Prozess ist nicht immer erfolgreich: Aufbau eines mRNA Gradienten Dadurch: [N] > [NS] > [M] > [G] > [P] > [L] Protein LMU Vesicular-Stomatitis-Virus (VSV) • Verbreitung ausschließlich auf amerikanischem Kontinent • Infektion von Pferden, Rindern, Schweinen, Menschen Zwei Serotypen: New Jersey und Indiana Übertragung: - durch Mücken und Fliegen • - durch Tierkontakte - (indirekt) durch z.B. Melkmaschinen Volkswirtschaftliche Schäden durch z.B. Rückgang der Milchleistung LMU • Vesicular-Stomatitis-Virus (VSV) Pathogenese: - Das Virus gelangt über kleine Verletzungen oder Arthropodenstiche in die Haut - Vermehrung im stratum spinosum - Ausbreitung lokal von Zelle zu Zelle Klinik: - Fieber • - “speicheln und lahmen” - aufgeplatze Vesikel (Bläschen) im Maul, Rüsselscheibe, Zitzen, Kronsaum - DD: Maul und Klauenseuche - Beim Menschen: transiente, milde Infektion mit grippeähnlichen Symptomen Vesicular-Stomatitis-Virus (VSV) LMU • VSV-G pseudotyping VSV-G • Vorteile: - stabileres lentivirales Partikel - Aufkonzentrierung (Zentrifugation) möglich - breiterer Zielzelltropismus LMU Rabies (Tollwut) • Weltweite (!) Verbreitung • Urbane Tollwut - v.a. durch streunende, herrenlose Hunde - Indien / Ostasien / Afrika / Südamerika Sylvatische Tollwut - v.a. durch Füchse, Wölfe, Dachse / Waschbären, Stinktiere • - Europa / Nordamerika Fälle pro Jahr (Mensch) - WHO: ca. 1600 - Dunkelziffer: 40.000 – 70.000 ??? Rabies (Tollwut) LMU Totimpfstoff für Menschen - Louis Pasteur (1882) - Passagierung des Virus in Kanninchen - zerriebenes und getrocknetes Rückenmark des Kanninchens (nicht mehr infektiös) - Erste Tollwutimpfung: Joseph Meister (1885) - Später: Phenolinaktivierung (Kanninchen) (Semple Impfstoff) - Bzw.: Ätherextraktion (Kanninchen) (Hempt Impfstoff / Entwicklungsländer) - Seit 1980: in vitro gezüchtete, abgetötete Tollwutviren Rabies (Tollwut) LMU Risikogebiete Rabies (Tollwut) LMU Tollwutgebiete weltweit LMU Rabies (Tollwut) Wildtollwut Rabies (Tollwut) LMU Lebendimpfstoff (attenuiertes Virus) für Wildtiere (früher verabreicht im Hühnerkopf) Deutschland ist Tollwutfrei !!! Rabies (Tollwut) LMU Fledermaustollwut in Deutschland (1982 - 2007) EBLV-1 und EBLV-2 (European Bat Lyssa Virus) Übertragung auf Mensch möglich ( tödlich *)! *5 Fälle in letzten 50 Jahren in Europa LMU Rabies (Tollwut) • Pathogenese - Beim Biss gelangt das Virus in Haut / Bindegewebe / Muskulatur - Initiale Replikation an der Bissstelle - Infektion der Nervenendigungen • - Axonale Wanderung (20 mm pro Tag !!!) zum Gehirn - Hauptreplikationsorte sind: Ammonshorn, Hippocampus und Hirnstamm - Encephalomyelitis (Gehirn und RM sind betroffen) – Zerstörung der Neurone - Nach der Vermehrung im Gehirn wandert das Virus axonal in die Augenbindehaut, Speichel- und Hautdrüsen und in periphere Organe - Produktion von infektiösen Viren (v.a. Speichel) Labordiagnose: - Tupfpräperate d. Hornhaut - Hautbiopsien (Nacken) Nachweis von Negri-Körperchen = eosinophile, zytoplasmatische Ablagerungen viraler Nucleoproteine LMU Transport des Endosoms ? LMU Rabies (Tollwut) • Klinik - Inkubationszeit: 5 Tage bis Jahre !!! (je nach Bissstelle !!!) • - Nach Auftreten der Symptome tödlich !!! - Etablierung der Infektion nach Hundebiss: ca. 15 % - Prodromalstadium (0-10 Tage): Ziehen und Brennen an der Bissstelle (Kopfschmerzen / Gelenksteife / Fieber) (Hyperaktivität / Hyperventilation / Lähmungserscheinungen) - Akute neurologische Phase (2-7 Tage): rasende Wut: Hydrophobie / Schluckkrämpfe / steigendes Fieber / Speichelfluss (stille Wut (in 20 % der Fälle): Lähmungen) - Koma (5-14 Tage) - Tod durch Atemstillstand Rabies (Tollwut) LMU Klinik Rabies (Tollwut) LMU Postexpositionsprophylaxe (PEP) Contributors Armin Baiker, Max-von-Pettenkofer Institut, LMU München Email: [email protected]