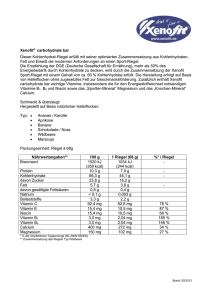
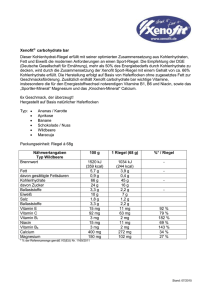
96e Vitamine und Spurenelemente – Mangel und
Werbung

Robert M. Russell, Paolo M. Suter 96e Vitamine und Spurenelemente – Mangel und Überschuss Für die deutsche Ausgabe Matthias Pirlich Vitamine und Spurenelemente sind notwendige Bestandteile der menschlichen Ernährung, da sie im menschlichen Körper entweder unzureichend oder überhaupt nicht synthetisiert werden. Nur kleine Mengen dieser Substanzen sind erforderlich, damit wesentliche biochemische Reaktionen ausgeführt werden können (z. B. in Form von Koenzymen oder prosthetischen Gruppen). Ein deutlicher Mangel an Vitaminen oder Spurenelementen ist aufgrund einer reichlichen, abwechslungsreichen und preisgünstigen Nahrungsversorgung sowie durch die Anreicherung von Nahrungsmitteln und den Einsatz von Nahrungsergänzungsmitteln in westlichen Ländern selten; dennoch können multiple Nährstoffmängel bei chronisch kranken oder alkoholabhängigen Personen auftreten. Nach einer Bypassoperation des Magens besteht ein hohes Risiko für zahlreiche Mangelzustände. Außerdem sind subklinische Mängel an Vitaminen und Spurenelementen recht verbreitet in der Normalbevölkerung, besonders bei älteren Personen, wie sich in Laboruntersuchungen zeigt. Allerdings nimmt die pathophysiologische und klinische Bedeutung der Toxizitäten von Nährstoffen zu, weil sie so breitflächig eingenommen werden. Von Hungersnot oder Katastrophen betroffene und vertriebene Bevölkerung und Flüchtlinge haben ein hohes Risiko für eine Protein-Energie-Mangelernährung, klassische Mikronährstoffmängel (Vitamin A, Eisen, Iod) sowie für Mangelzustände von Thiamin (Beriberi), Riboflavin, Vitamin C (Skorbut) und Niacin (Pellagra). Die Körperdepots von Vitaminen und Mineralien variieren erheblich. Die Speicher der Vitamine B12 und A etwa sind so groß, dass beim Erwachsenen selbst unter ein- oder mehrjährig unzureichender Aufnahme mit der Nahrung keine Mangelerscheinungen auftreten. Die Körperreserven von Folsäure und Thiamin können dagegen innerhalb von Wochen entleert sein, wenn diese Substanzen in der Nahrung fehlen. Therapeutische Maßnahmen können Vorräte essenzieller Nährstoffe im Körper erschöpfen; zum Beispiel gehen durch Hämodialyse wasserlösliche Vitamine verloren, die durch Supplemente ersetzt werden müssen. Vitamine und Spurenelemente stehen in mehrfacher Hinsicht mit Krankheiten in Verbindung: (1) Vitamin- und Mineralstoffmangel kann durch eine Krankheit verursacht werden, wie etwa eine Malabsorption; (2) sowohl ein Mangel als auch ein Überschuss an Vitaminen und Mineralien kann eine Krankheit auslösen (z. B. VitaminA-Intoxikation und Leberkrankheit) und (3) Vitamine und Mineralstoffe können hoch dosiert als Medikamente verwendet werden (z. B. Nicotinsäure bei Hypercholesterinämie). Die hämatologisch relevanten Vitamine und Mineralstoffe (Kap. 126, Kap. 128) werden in diesem Kapitel nur kurz gestreift oder übergangen, da sie an anderer Stelle besprochen werden. Gleiches gilt für die im Knochenmetabolismus bedeutsamen Vitamine und Mineralstoffe (Vitamin D, Kalzium, Phosphor; Magnesium; Kap. 423). VITAMINE Siehe auch Tabelle 96e-1 sowie Abbildungen 96e-1 und 96e-2. & THIAMIN (VITAMIN B1) Thiamin war das erste B-Vitamin, das identifiziert wurde. Deshalb wird es auch als Vitamin B1 bezeichnet. Thiamin wirkt mit bei der Decarboxylierung von α-Ketosäuren, wie Pyruvat, α-Ketoglutarat und verzweigtkettigen Aminosäuren, und trägt so zur Energiegewinnung bei. Außerdem ist Thiaminpyrophosphat als Koenzym einer Transketolasereaktion aktiv, welche die Umwandlung von Hexose- und Pentosephosphaten vermittelt. Ferner wurde postuliert, dass Thiamin eine Rolle bei der peripheren Nervenleitung spielt, obwohl die genauen chemischen Reaktionen, die dieser Funktion zugrunde liegen, unbekannt sind. Vorkommen in der Nahrung Die mittlere Thiaminaufnahme allein durch die Nahrung liegt in den USA bei 2 mg/d. In Deutschland beträgt die tägliche mediane Thiaminaufnahme bei Männern 1,6 mg und bei Frauen 1,2 mg. Hauptnahrungsquellen für Thiamin sind: Hefe, Innereien, Schweinefleisch, Hülsenfrüchte, Rindfleisch, Vollkornprodukte und Nüsse. Geschälter und polierter Reis und Getreide enthalten, wenn überhaupt, wenig Thiamin. Thiaminmangel kommt deshalb häufiger in Bevölkerungen vor, in denen Reis ein Hauptnahrungsmittel darstellt. Tee, Kaffee (koffeinhaltig und koffeinfrei), roher Fisch und Krustentiere enthalten Thiaminasen, die das Vitamin zerstören können. Daher kann ein übermäßiger Konsum von Tee oder Kaffee theoretisch die Thiaminspeicher reduzieren. Mangel Die weltweit häufigste Ursache für Thiaminmangel ist eine thiaminarme Ernährung. In westlichen Ländern sind die Hauptursachen für Thiaminmangel Alkoholismus und chronische Krankheiten wie Krebs. Bekannt ist, dass Alkohol direkt in die Thiaminabsorption und in die Thiaminpyrophosphatsynthese eingreift und die Harnexkretion erhöht. Thiamin sollte Patienten mit Alkoholismus immer verabreicht werden, weil die Wiederauffüllung der Kohlenhydratreserven ohne adäquate Thiaminzufuhr zu einem akuten Thiaminmangel mit Laktatazidose führen kann. Weitere Risikogruppen sind Frauen mit einer verlängerten Hyperemesis gravidarum, anorektische Patienten mit einem allgemein schlechten Ernährungsstatus, die parenterale Glukose erhalten, Patienten nach bariatrischen Bypassoperationen (bariatrischer Wernicke) und Patienten unter chronischer Diuretikatherapie (z. B. wegen Hypertonie oder Herzinsuffizienz) wegen erhöhter Thiaminverluste mit dem Urin. Mütterlicher Thiaminmangel kann zu kindlichem Beriberi bei Stillkindern führen. Ein Thiaminmangel führt im frühen Stadium zu Anorexie und unspezifischen Symptomen (z. B. Reizbarkeit, Verschlechterung des Kurzzeitgedächtnisses). Ein langfristiger Thiaminmangel verursacht Beriberi, welche klassischerweise als trockene oder feuchte Variante kategorisiert wird, auch wenn es dabei beträchtliche Überlappungen gibt. Bei beiden Formen von Beriberi können Patienten über Schmerz und Parästhesien klagen. Feuchte Beriberi äußert sich primär in kardiovaskulären Symptomen aufgrund eines beeinträchtigten Herzmuskelenergiestoffwechsels und Dysautonomie und kann nach 3 Monaten einer Thiaminmangelernährung auftreten. Die Patienten weisen ein vergrößertes Herz, Tachykardien, eine Herzinsuffizienz, periphere Ödeme sowie eine periphere Neuritis auf. Patienten mit trockener Beriberi zeigen eine symmetrisch periphere Neuropathie des motorischen und sensorischen Systems mit verminderten Reflexen. Die Neuropathie betrifft am deutlichsten die Beine, und die Patienten haben Schwierigkeiten, aus hockender Position aufzustehen. Alkoholiker mit chronischem Thiaminmangel können auch zentralnervöse Systemmanifestationen aufweisen, die als Wernicke-Enzephalopathie bekannt sind. Diese äußert sich durch horizontalen Nystagmus, Ophthalmoplegie (aufgrund der Schwäche eines oder mehrerer extraokulärer Muskeln), zerebelläre Ataxie und geistige Beeinträchtigung (Kap. 467). Kommt es zudem zum Gedächtnisverlust und einer konfabulatorischen Psychose, wird diese Form als Wernicke-Korsakow-Syndrom bezeichnet. Trotz typischer Klinik und Anamnese wird die Diagnose eines Wernicke-Korsakow-Syndroms immer wieder übersehen. Die Labordiagnose eines Thiaminmangels wird normalerweise aufgrund eines funktionellen Enzymessays der Transketolase-Aktivität vor und nach Zugabe von Thiaminpyrophosphat gestellt. Eine mehr als 25%ige Stimulierung (also ein Aktivitätskoeffizient von 1,25) durch den Zusatz des Thiaminpyrophosphats wird als pathologisch angesehen. Um einen Mangel festzustellen, können Thiamin oder seine phosphorylierten Ester in Serum oder Blut auch durch Hochdruckflüssigkeitschromatografie bestimmt werden (HPLC). 96e-1 Teil 6 Ernährung TABELLE 96e-1 Wesentliche klinische Symptome bei Vitaminmangelversorgung Vitamin Klinischer Befund Tagesdosis, die beim Erwachsenen Mangelsymptome auslöst Faktoren, die zum Mangelzustand beitragen Thiamin Beriberi: Neuropathie, Muskelschwäche und -auszehrung, Kardiomegalie, Ödem, Ophthalmoplegie, Konfabulation < 0,3 mg/1000 kcal Alkoholismus, Hyperemesis, Thiaminasen in der Nahrung Riboflavin Magentarote Zunge, anguläre Stomatitis, Seborrhö, Cheilosis < 0,6 mg Alkoholismus Niacin Pellagra: pigmentierter Ausschlag in den Sonnenlicht ausgesetzten Hautbereichen, tiefrote Zunge, Diarrhö, Apathie, Gedächtnisverlust, Orientierungsstörung < 9,0 Niacinäquivalente Alkoholismus, Vitamin-B6-Mangel, Riboflavinmangel, Typtophanmangel Vitamin B6 Seborrhö, Glossitis, Krämpfe, Neuropathie, Depression, Verwirrung, mikrozytäre Anämie < 0,2 mg Alkoholismus, Isoniazid Folat Megaloblastäre Anämie, atrophische Glossitis, Depression, erhöhter Homocysteinspiegel < 100 μg Alkoholismus, Sulfasalazin, Pyrimethamin, Triamteren Vitamin B12 Megaloblastäre Anämie, Verlust der Vibrations- und Lageempfindung, Gehstörung, Demenz, Impotenz, Verlust der Blasen- und Darmkontrolle, erhöhter Homocystein- und Methylmalonsäurespiegel < 1,0 μg Magenatrophie (perniziöse Anämie), Erkrankung des unteren Ileums, strikter Vegetarismus, Säuresuppression (z. B. Protonenpumpenhemmer), Metformin Vitamin C Skorbut: Petechien, Ekchymosen, gekräuseltes Haar, entzündetes und blutendes Zahnfleisch, Einblutungen in Gelenke, schlechte Wundheilung < 10 mg Rauchen, Alkoholismus Vitamin A Xerophthalmie, Nachtblindheit, Bitôt-Flecke, follikuläre Hyperkeratose, eingeschränkte Embryonalentwicklung, Immunstörungen < 300 μg Fettmalabsorption, Infektion, Masern, Alkoholismus, unzureichende Protein- und Energieaufnahme Vitamin D Rachitis: Skelettmissbildung, rachitischer Rosenkranz, krumme Beine; Osteomalazie < 2,0 μg Altern, ungenügende Sonnenlichtexposition, Fettmalabsorption, dunkel pigmentierte Haut Vitamin E Periphere Neuropathie, spinozerebelläre Ataxie, Skelettmuskelatrophie, Retinopathie Unbekannt ohne einen zusätzlichen Faktor Nur mit Fettmalabsorption oder bei genetisch bedingter Störung des Vitamin-E-Stoffwechsels oder -transports Vitamin K Erhöhte Prothrombinzeit, Blutungen < 10 μg Fettmalabsorption, Lebererkrankung, Antibiotikaeinnahme BEHANDLUNG: THIAMINMANGEL Bei akutem Thiaminmangel mit kardiovaskulären oder neurologischen Symptomen sollte Thiamin 3 × 200 mg/d intravenös gegeben werden, bis sich die akuten Symptome nicht weiter bessern; anschließend sollte Thiamin bis zur vollständigen Heilung oral in einer Dosis von 10 mg/d gegeben werden. Eine kardiovaskuläre Besserung tritt innerhalb von 24 Stunden auf wie auch ein Rückgang von Augenmuskelparesen. Andere Manifestationen lassen allmählich nach, obwohl die Psychose eines Wernicke-KorsakowSyndroms für einige Monate oder auch dauerhaft weiter bestehen kann. Gleichzeitig sollten auch andere Nährstoffmangelzustände behoben werden. Toxizität Obwohl über Anaphylaxien nach hohen intravenösen Thiamingaben berichtet worden ist, gibt es keine Mitteilungen über ungünstige Wirkungen hoher Mengen in der Nahrung oder in Nahrungsergänzungsmitteln. In den USA können thiaminhaltige Nahrungssupplemente in Dosierungen bis zu 50 mg/d rezeptfrei gekauft werden. & RIBOFLAVIN (VITAMIN B2) Riboflavin ist wichtig für den Stoffwechsel von Fett, Kohlenhydrat und Eiweiß, und zwar in seiner Rolle als respiratorisches Koenzym und Elektronendonator. Enzyme, die Flavinadenindinucleotid (FAD) oder Flavinmononucleotid (FMN) als prosthetische Gruppe enthalten, werden als Flavoenzyme bezeichnet (z. B. Succinatdehydrogenase, Monoaminoxidase, Glutathionreduktase). FAD ist ein Kofaktor der Methyltetrahydrofolat-Reduktase und moduliert darüber den Homocysteinmetabolismus. Das Vitamin spielt außerdem eine Rolle im Medikamenten- und Steroidmetabolismus einschließlich verschiedener Entgiftungsreaktionen. Obwohl man viel über die chemischen und enzymatischen Reaktionen des Riboflavins weiß, sind die klinischen Manifestationen des Riboflavinmangels unspezifisch und jenen anderer B-Vitaminmangelzustände ähnlich. Riboflavinmangel manifestiert sich vorwiegend 96e-2 durch Läsionen der Mundschleimhaut und der Haut. Neben den mukokutanen Läsionen sind korneale Vaskularisation, Anämien und Persönlichkeitsveränderungen bei Riboflavinmangel beschrieben worden. Mangel und Überschuss Zu einem Riboflavinmangel kommt es fast immer aufgrund von Nahrungsmangel. In den USA (und auch in Deutschland) sind Milch, andere Molkereiprodukte, Brot und Getreideprodukte die wichtigsten Nahrungsquellen für Riboflavin, obwohl mageres Fleisch, Fisch, Eier, Brokkoli und Hülsenfrüchte ebenfalls gute Lieferanten sind. Riboflavin ist extrem lichtempfindlich, und Milch sollte daher in Behältern gelagert werden, die vor Photodegradation schützen. Ein Riboflavinmangel kann im Labor durch Messung der Riboflavinkonzentration im Erythrozyten oder im Harn diagnostiziert werden oder durch Bestimmung der Erythrozyten-Glutathionreduktase-Aktivität vor und nach FAD-Zusatz. Weil die Resorptionskapazität für Riboflavin im Gastrointestinaltrakt limitiert ist (ungefähr 20 mg nach einer oral verabreichten Einzeldosis), ist eine Riboflavintoxizität nicht beschrieben worden. & NIACIN (VITAMIN B3) Der Begriff Niacin bezieht sich auf Nicotinsäure und Nicotinamid sowie ihre biologisch aktiven Derivate. Nicotinsäure und Nicotinamid dienen als Vorläufer der zwei Koenzyme Nicotinamidadenindinucleotid (NAD) und NAD-Phosphat (NADP), die für zahlreiche Oxidations- und Reduktionsreaktionen im Körper erforderlich sind. Außerdem sind NAD und NADP an der Adenindiphosphat-Ribose-Transferreaktion beteiligt, die bei der Reparatur der DNS und der Kalziummobilisierung eine Rolle spielen. Metabolismus und Bedarf Nicotinsäure und Nicotinamid werden gut im Magen und Dünndarm resorbiert. Die Niacinbioverfügbarkeit ist hoch in Bohnen, Milch, Fleisch und Eiern, in Getreide geringer. Seitdem Mehl mit „freiem“ Niacin (d. h. nicht der Koenzymform) angereichert wird, ist die Bioverfügbarkeit ausgezeichnet. In Deutschland findet keine Anreicherung von Mehl mit Vitaminen statt. Die Typenbezeichnung des Mehls Vitamine und Spurenelemente – Mangel und Überschuss Aktive Form bzw. Cofaktor Vitamin Thiamin (B1) N Coenzym für Spaltung von Kohlenstoff-Kohlenstoff-Bindungen; Aminosäure- und Kohlenhydratstoffwechsel Flavinmononukleotid (FMN) und Flavinadenindinukleotid (FAD) Cofaktor für Oxidations- und Reduktionsreaktionen sowie als prosthetische Gruppe kovalent an einige Enzyme gebunden CH3 N N S CH2CH2OH Riboflavin (B2) O N N N N O Ribityl Nicotinamid-adeninCoenzyme für dinukleotidphosphat Oxidations- und Reduktionsreaktio(NADP) und Nicotinadenindinukleotid (NAD) nen Niacin O C Hauptfunktion Thiaminpyrophosphat NH2 96e O + N H Vitamin B6 Pyridoxalphosphat CH2OH HO CH2OH Cofaktor für Enzyme des Aminosäurestoffwechsels N Folat O N H O N H2N N C CH2 COOH H N n CH CH2 CH2 N C O COOH N H Polyglutamatformen des Coenzym für den (5,6,7,8)-Tetrahydrofolats Ein-Kohlenstoffmit gebundenen Transport im Kohlenstoffeinheiten Nukleinsäure- und Aminosäurestoffwechsel CH CH2 CH2 C OH O Vitamin B12 CH2CH2CONH2 CONH2 HC CH3 3 CH2CH2CONH2 CH2 CH2CH2CONH2 H3C N N + H3C Co CONH2 N N CH3 CH2 CH3 NHCOCH2CH2 CH3 CH3 CH2CH2CONH2 CH2 CHCH3 CH3 N CH3 Coenzym der Methioninsynthase und der l-Methylmalonyl-CoAmutase – O O P O N Methylcobalamin, Adenosylcobalamin O HO O HOCH2 OH Cbl Abbildung 96e-1 Struktur und Hauptfunktionen einiger Vitamine, die mit Erkrankungen des Menschen in Verbindung stehen. (Fortsetzung siehe Abbildung 96e-2.) gibt allerdings Aufschluss über den Mikronährstoffgehalt des Mehls, so ist z. B. Mehl Typ 405 besonders fein vermahlen und enthält wenig Vitamine und Spurenelemente, wohingegen höhere Typen deutlich mehr Mikronährstoffe enthalten. In den USA übersteigt die durchschnittliche Niacinaufnahme die Empfehlungen (RDA, Recommended Dietary Allowance) beträchtlich. Die Nationale Verzehrsstudie II hat 2008 für Deutschland ähnliche Befunde erhoben: Die mediane Niacinzufuhr liegt in allen Altersgruppen deutliche über den DACHReferenzwerten. Eine Mangelversorgung besteht daher nicht. Da Niacin eine geringe Toxizität aufweist, wurden Hypervitaminosen durch übermäßige Aufnahme aus der Nahrung bisher nicht beschrieben. Die Aminosäure Tryptophan kann mit einer Effizienz von 60 : 1 (in Gewichtseinheiten) in Niacin umgewandelt werden. Deshalb wird die empfohlene Niacinzufuhr in Niacinäquivalenten ausgedrückt. Allerdings findet sich eine niedrigere Umwandlungseffizienz von Tryptophan zu Niacin, wenn ein Patient einen Vitamin-B6- oder einen Riboflavinmangel aufweist oder in Gegenwart von Isoniazid. Zu den Harnausscheidungsprodukten von Niacin zählen 2-Pyridon und 2Methylnicotinamid, deren Bestimmung zur Diagnose eines Niacinmangels herangezogen wird. 96e-3 Teil 6 Ernährung Aktive Form bzw. Cofaktor Vitamin Vitamin C O O C C C C OH OH C CH2OH Ascorbinsäure und Dehydroascorbinsäure Beteiligung als Redoxpartner in vielen biologischen Wasserstoffübertragenden und Oxidationsreaktionen Retinol, Retinal, Retinsäure Bildung von Rhodopsin (Sehfunktion) und Glykoproteinen (epitheliale Zellfunktion); auch Regulation der Gentranskription 1,25-Dihydroxy-7dehydrocholesterol Aufrechterhaltung des Kalzium- und Phosphatspiegels im Blut; antiproliferatives Hormon Tocopherole und Tocotrienole Antioxidanzien Vitamin-K-Hydrochinon Cofaktor für die posttranslationale Carboxylierung vieler Proteine, einschließlich essenzieller Gerinnungsfaktoren OH Vitamin A (β-Carotene) CH2OH (Retinol) Vitamin D Hauptfunktion OH CH2 HO OH Vitamin E O CH2[CH2 CH3 CH2 CH CH2]3H HO Vitamin K O R O Abbildung 96e-2 Struktur und Hauptfunktionen einiger Vitamine, die mit Erkrankungen des Menschen in Verbindung stehen. (Fortsetzung von Abbildung 96e-1.) Mangel Niacinmangel verursacht Pellagra, die hauptsächlich bei Personen auftritt, deren Ernährung auf Mais basiert, wie in Teilen von China, Afrika und Indien. In Nordamerika und Europa findet sich Pellagra vornehmlich unter Alkoholikern, bei Patienten mit angeborenen Defekten in der Darm- und Nierenabsorption von Tryptophan (Hartnup-Krankheit; Kap. 434e) sowie bei Patienten mit einem Karzinoidsyndrom (Kap. 113), bei dem Tryptophan vermehrt in Serotonin umgewandelt wird. Das Tuberkulostatikum Isoniazid ist ein strukturelles Analogon von Niacin und kann eine Pellagra auslösen. Bei Hungersnöten oder Vertreibung tritt Pellagra zum einen wegen des absoluten Niacinmangels auf, zum anderen aber auch durch einen Mangel an Mikronährstoffen, die für die Umwandlung von Tryptophan in Niacin benötigt werden (z. B. Eisen, Riboflavin und Pyridoxin). Zu den frühen Symptomen von Pellagra gehören Appetitverlust, eine generelle Schwäche und Reizbarkeit, Bauchschmerz und Erbrechen. Später entwickelt sich eine hellrote Glossitis, gefolgt von einem charakteristischen pigmentierten und abschilfernden Hautausschlag, besonders in den Hautbereichen, die dem Sonnenlicht ausgesetzt sind. Dieser Ausschlag – bekannt als „Casal-Kragen“, da er ringförmig im Nackenbereich auftritt – wird in fortgeschrittenen Fällen beobachtet. Auch eine Vaginitis und Ösophagitis können auftreten. Durchfall (zum Teil aufgrund der Proktitis, zum Teil aufgrund der Malabsorption), Depressionen, Anfälle und Demenz gehören ebenfalls zum Pellagra-Syndrom, das im angloamerikanischen Raum auch als „die vier Ds“ bezeichnet wird: Dermatitis, Durchfall und Demenz führen zum Tod (Death). 96e-4 BEHANDLUNG: PELLAGRA Die Behandlung einer Pellagra besteht darin, über 5 Tage eine orale Supplementierung mit 3 × 100–200 mg/d Nicotinamid oder Nicotinsäure vorzunehmen. Hohe Nicotinsäuregaben (2 g/d Nicotinsäure in retardierter Form) werden für die Behandlung erhöhter Cholesterin- und Triglyzeridspiegel und/oder erniedrigter HDLSpiegel eingesetzt (Kap. 421). Allerdings musste das Kombinationspräparat Nicotinsäure/Laropiprant am 21.01.2013 wegen schwerwiegender Nebenwirkungen vom Markt genommen werden. Toxizität Ein Prostaglandin-vermitteltes Hitzegefühl wird über eine Bindung des Vitamins an einen G-Protein-gekoppelten Rezeptor vermittelt und kann bereits bei einer täglich verabreichten niedrigen Dosierung von 30 mg Niacin entweder als Nahrungsergänzung oder als Therapie einer Dyslipidämie beobachtet werden. Ein Beleg für eine toxische Wirkung von Niacin aus Nahrungsquellen liegt allerdings nicht vor. Die Flushsymptomatik beginnt grundsätzlich im Gesicht und kann begleitet sein von Hauttrockenheit, Juckreiz, Parästhesien und Kopfschmerzen. Eine Prämedikation mit Nikotinsäure in Kombination mit Laropiprant, einem selektiven Prostaglandin-D2-Rezeptor-1-Antagonisten, oder mit Aspirin kann diese Symptome lindern. Der Flush unterliegt einer Tachyphylaxie und bessert sich oft mit der Zeit. Bei ähnlichen Niacindosierungen können auch Übelkeit, Erbrechen und Bauchschmerz auftreten. Eine hepatische Toxizität ist die dramatischste toxische Reaktion, die durch retardiertes Niacin verursacht wird. Sie kann sich als Gelbsucht mit erhöhten Aspartat-Aminotrans- Vitamine und Spurenelemente – Mangel und Überschuss ferase(AST)- und Alanin-Aminotransferase-Werten (ALT) zeigen. Einige Fälle einer fulminant verlaufenden Hepatitis, die sogar eine Lebertransplantation erforderlich machten, sind bei Dosierungen von 3–9 g/d beobachtet worden. Andere toxische Reaktionen offenbaren sich als Glukoseintoleranz, Hyperurikämie, Makulaödem und Makulazysten. Die Kombination von Nikotinsäurepräparaten zur Behandlung der Dyslipidämie mit 3-Hydroxy-3-Methylglutaryl-Coenzym-A(HMG-CoA)-Reduktasehemmern kann das Risiko für eine Rhabdomyolyse erhöhen. Die Obergrenze für die tägliche Niacineinnahme ist bei 35 mg gesetzt worden. Allerdings betrifft diese Obergrenze nicht therapeutische Anwendungen von Niacin. & PYRIDOXIN (VITAMIN B6) Der Begriff Vitamin B6 bezieht sich auf eine Familie von Verbindungen, die Pyridoxin, Pyridoxal, Pyridoxamin sowie ihre 5’-Phosphatderivate einschließen. 5’-Pyridoxalphosphat (PLP) ist ein Kofaktor für mehr als 100 Enzyme, die mit dem Aminosäurestoffwechsel verbunden sind. Vitamin B6 ist auch an der Häm- und der Neurotransmittersynthese beteiligt sowie beim Metabolismus von Glykogen, Lipiden, Steroiden, Sphingoidbasen und mehreren Vitaminen einschließlich der Umwandlung von Tryptophan in Niacin. Vorkommen in der Nahrung Pflanzen enthalten Vitamin B6 in Form von Pyridoxin, während in tierischem Gewebe 5’-Pyridoxalphosphat und Pyridoxaminphosphat vorkommen. Das Vitamin B6 aus Pflanzen ist weniger bioverfügbar als das aus tierischem Gewebe. Reich an Vitamin B6 sind: Hülsenfrüchte, Nüsse, Weizenkleie und Fleisch, wenngleich das Vitamin auch in allen anderen Lebensmittelgruppen zu finden ist. Mangel Symptome eines Vitamin-B6-Mangels zeigen sich als Epithelveränderungen, wie sie auch beim Mangel an anderen B-Vitaminen häufig sind. Bei einem schwerwiegenden Vitamin-B6-Mangel kommen weiterhin periphere Neuropathie, anomales Elektroenzephalogramm (EEG) und Persönlichkeitsveränderungen einschließlich Depression und Verwirrung hinzu. Bei Kleinkindern wurde über Durchfall, Krampfanfälle und Anämie berichtet. Eine mikrozytäre, hypochrome Anämie wird durch eine verminderte Hämoglobinsynthese ausgelöst, weil das erste Enzym (Aminolävulinsäuresynthase), das an der Hämbiosynthese beteiligt ist, das PLP als Kofaktor erfordert (Kap. 126). In einigen Fallberichten wurde auch über eine Plättchenfunktionsstörung berichtet. Da Vitamin B6 bei der Umwandlung von Homocystein in Cystathionin notwendig ist, kann ein chronisch geringgradiger Vitamin-B6-Mangel zu einem erhöhten Homocysteinspiegel im Blut führen und das Risiko für kardiovaskuläre Erkrankungen erhöhen (Kap. 291e und 434e). Unabhängig vom Homocystein sind niedrige Spiegel an zirkulierendem Vitamin B6 mit Entzündungsreaktionen und erhöhtem C-reaktivem Protein assoziiert. Bestimmte Medikamente wie Isoniazid, L-Dopa, Penicillamin und Cycloserin interagieren über Carbonylgruppen mit PLP. Pyridoxin sollte daher gleichzeitig gegeben werden. Ein erhöhtes Verhältnis von AST (oder SGOT) zu ALT (oder SGPT) in der Leber von Alkoholkranken spiegelt die relative Vitamin-B6-Abhängigkeit der ALT wider. Vitamin-B6-abhängige Syndrome, die pharmakologische Dosierungen von Vitamin B6 erfordern, sind selten. Zu ihnen gehören der Cystathionin-β-Synthase-Mangel, pyridoxinabhängige Anämien (in erster Linie Sideroblastenanämien) und die Gyrusatrophie mit chorioretinaler Degeneration, die durch eine verminderte Aktivität des mitochondrialen Enzyms Ornithin-Aminotransferase verursacht wird. In diesen Situationen ist eine orale Behandlung mit 100–200 mg/d Vitamin B6 erforderlich. Hohe Dosierungen von Vitamin B6 wurden zur Therapie des Karpaltunnelsyndroms verwendet, gegen prämenstruelle Beschwerden, Schizophrenie, Autismus und diabetische Neuropathie, aber ein überzeugender Effekt ließ sich nicht feststellen. Die Labordiagnose eines Vitamin-B6-Mangels wird im Allgemeinen bei einem niedrigen Plasmawert des PLP gestellt (< 20 nmol/l). Die Behandlung eines Vitamin-B6-Mangels erfolgt mit 50 mg am Tag. Höhere Tagesdosen von 100–200 mg sind angezeigt, wenn der Vitamin-B6-Mangel mit einer medikamentösen Behandlung zusammenhängt. Vitamin B6 sollte nicht gleichzeitig mit L-Dopa verabreicht werden, weil beide miteinander interferieren. 96e Toxizität Die sichere Obergrenze für Vitamin B6 ist auf 100 mg/d festgesetzt worden, obwohl keine nachteiligen Wirkungen bei hoher Zufuhr über Nahrungsmittel bekannt sind. Wenn eine Toxizität auftritt, löst diese eine schwerwiegende sensible Neuropathie aus, die den Patienten gehunfähig macht. Auch wurde über einige Fälle mit Lichtempfindlichkeit und Dermatitis berichtet. & FOLAT, VITAMIN B12 Siehe Kapitel 128. & VITAMIN C Sowohl Ascorbinsäure als auch ihr Oxidationsprodukt Dehydroascorbinsäure sind biologisch aktiv. Zum Wirkungsspektrum des Vitamins gehören antioxidative Aktivität, verbesserte Resorption von NichtHäm-Eisen, die Carnitinbiosynthese und die Umwandlung von Dopamin in Noradrenalin und die Synthese verschiedener Peptid-Hormone. Vitamin C ist auch für den Bindegewebsstoffwechsel und das Cross-linking (Prolin-Hydroxylierung) wichtig und ist zudem ein Bestandteil vieler fremdstoffmetabolisierender Enzymsysteme, besonders des mischfunktionellen Oxidasesystems. Resorption und Vorkommen in der Nahrung Vitamin C wird nahezu vollständig resorbiert, wenn weniger als 100 mg in einer Einzeldosis verabreicht werden. Beträgt die Dosis jedoch über ein Gramm, werden nur 50 % oder weniger resorbiert. Bei größeren Einnahmemengen kommt es zu erhöhtem Abbau und gesteigerter fäkaler und renaler Ausscheidung von Vitamin C. Gute Nahrungsquellen für Vitamin C sind Zitrusfrüchte, grünes Gemüse (besonders Brokkoli), Tomaten und Kartoffeln. Der Verzehr von fünf Portionen Obst und Gemüse pro Tag liefert Vitamin C im Überfluss gemäß den Zufuhrempfehlungen der DGE von etwa 100 mg/d (RDA in den USA: 90 mg/d für Männer und 75 mg/d für Frauen. Ungefähr 40 % der US-Bevölkerung nehmen Vitamin C als Nahrungsergänzung zu sich, wobei „natürliche Formen“ von Vitamin C nicht besser bioverfügbar sind als synthetische Formen. Rauchen, Hämodialyse, Schwangerschaft und Stress (z. B. Infektion, Trauma) steigern offenbar den Vitamin-C-Bedarf. Mangel Vitamin-C-Mangel verursacht Skorbut. In den USA tritt dies in erster Linie bei armen und älteren Menschen sowie bei Alkoholikern auf, die < 10 mg Vitamin C am Tag zu sich nehmen. Vitamin-C-Mangel wird auch bei Personen beobachtet, die sich makrobiotisch ernähren, sowie bei jungen Erwachsenen mit sehr unausgewogener Ernährung. In Deutschland tritt ein manifester Vitamin-C-Mangel nur in Einzelfällen auf. Die mediane Vitamin-C-Zufuhr liegt deutlich über den DACH-Referenzwerten, die allerdings von 32 % der Männer und 29 % der Frauen nicht erreicht werden. Ein erhöhtes Risiko für erniedrigte Vitamin-C-Spiegel wiesen allerdings ältere Männer und Raucher auf (Heseker et al. 1992). Zusätzlich zu einer allgemeinen Erschöpfung äußern sich Skorbutsymptome in erster Linie in einer beeinträchtigten Bildung des reifen Bindegewebes, wobei es zu Hautblutungen (Petechien, Ekchymosen, perifollikulären Hämorrhagien), entzündetem und blutendem Zahnfleisch sowie Einblutungen in die Gelenke, in den Peritonealraum, das Perikard und die Nebennieren kommen kann. Bei Kindern kann ein Vitamin-C-Mangel das Knochenwachstum beeinträchtigen. Die Labordiagnose eines Vitamin-C-Mangels wird gestellt auf der Basis erniedrigter Plasma- oder Leukozytenwerte. Die Gabe von Vitamin C (200 mg/d) verbessert die Skorbutsymptomatik innerhalb einiger Tage. Eine hoch dosierte Vitamin-C-Supplementierung (z. B. 1–2 g/d) kann möglicherweise Dauer und Symptome von Infektionen der oberen Atemwege geringfügig vermindern. Es gibt auch Berichte, dass Vitamin-C-Supplementierung beim Chédiak-Higashi-Syndrom (Kap. 80) sowie bei der Osteogenesis imperfecta (Kap. 427) vorteilhaft ist. Von einem hohen Gehalt an Vitamin C in der Nahrung wird auch behauptet, das Auftreten von bestimmten Krebsarten, besonders von Ösophagus- und Magenkrebs, könne gesenkt werden. Träfe dies zu, dann dürfte diese Wirkung darauf beruhen, dass Vitamin C die Umwandlung von Nitriten und sekundären Aminen in karzinogene Nitrosamine verhindern kann. Allerdings fand eine Interventionsstudie in China keinerlei protektive Wirkung des Vitamins C. Die parenterale Gabe von Ascorbinsäure soll angeblich für die Behandlung fortgeschrittener Krebserkrankungen eine Bedeutung haben. 96e-5 Teil 6 Ernährung Toxizität Eine Einzeldosis von mehr als 2 g Vitamin C kann zu Bauchschmerz, Durchfall und Übelkeit führen. Da Vitamin C zu Oxalat metabolisiert werden kann, wurde von chronisch hoch dosierten Vitamin-C-Supplementierungen eine erhöhte Prävalenz von Nierensteinen befürchtet. Dies ließ sich jedoch in mehreren Studien nicht bestätigen, außer bei Patienten, die bereits eine vorbestehende Nierenerkrankung aufwiesen. Daher ist es ratsam, Patienten mit Nierensteinen in der Anamnese zu empfehlen, keine überhöhten Vitamin-C-Dosen zu sich zu nehmen. Ein weiteres potenzielles, aber ebenfalls bislang ungeprüftes Risiko besteht in einer Überversorgung mit Eisen und Eisentoxizität bei dauerhaft hoher Vitamin-C-Aufnahme. Hohe Dosen von Vitamin C können bei Patienten mit Glukose-6-Phosphat-Dehydrogenase-Mangel eine Hämolyse auslösen. Zudem können Dosen von mehr als 1 g/d falsch negative Guajak-Reaktionen bewirken sowie mit Tests für die Bestimmung der Harnglukose interferieren. Außerdem können hohe Dosierungen die Wirkung bestimmter Medikamente beeinträchtigen (z. B. Bortezomib bei Myelompatienten). & BIOTIN Biotin ist ein wasserlösliches Vitamin, das eine wichtige Rolle bei Genexpression, Glukoneogenese und Fettsäuresynthese spielt und als CO2-Carrier auf der Oberfläche sowohl zytoplasmatischer als auch mitochondrialer Carboxylasen dient. Das Vitamin ist auch im Katabolismus von bestimmten Aminosäuren (z. B. Leucin) sowie über die Biotynilierung von Histon bei der Genregulation aktiv. Hervorragende Nahrungsquellen von Biotin sind Leber, Soja und andere Bohnen, Hefe und Eigelb. Eiklar enthält das Protein Avidin, das das Vitamin stark bindet und seine Bioverfügbarkeit reduziert. Ein Biotinmangel aufgrund zu geringer Zufuhr mit der Nahrung ist selten, meist beruht der Mangel auf angeborenen Störungen im Metabolismus. Biotinmangel ließ sich herbeiführen durch experimentelle Ernährung mit Eiklar und findet sich bei Patienten mit Kurzdarm, die parenteral eine Biotin-freie Ernährung erhielten. Bei Erwachsenen führt ein Biotinmangel zu geistigen Veränderungen (Depression, Halluzinationen), zu Parästhesien, Anorexie und Übelkeit. Ein sich schälender, seborrhoischer und erythematöser Ausschlag kann um Augen, Nase und Mund und ebenso an den Extremitäten auftreten. Bei Säuglingen bewirkt ein Biotinmangel Hypotonie, Lethargie und Apathie. Außerdem kann der Säugling eine Alopezie und einen charakteristischen Ausschlag entwickeln, der auch die Ohren einschließt. Die Labordiagnose eines Biotinmangels kann aufgrund einer verminderten Harnkonzentration von Biotin (oder seinen Metaboliten), einer erhöhten Urinexkretion von 3-Hydroxyisovaleriansäure nach einer LeucinProbe oder der reduzierten Aktivität biotinabhängiger Enzyme in den Lymphozyten (z. B. Propionyl-CoA-Ccarboxylase) gestellt werden. Die Behandlung erfordert pharmakologisch wirksame Dosen von Biotin von bis zu 10 mg/d. Eine toxische Wirkung ist nicht bekannt. & PANTOTHENSÄURE Pantothensäure ist ein Bestandteil des Koenzyms A und des Phosphopantetheins, die in den Stoffwechsel der Fettsäuren, die Synthese von Cholesterin und Steroidhormonen sowie allen Verbindungen aus Isoprenoid-Einheiten eingebunden sind. Außerdem ist die Pantothensäure bei der Acetylierung von Proteinen beteiligt. Das Vitamin wird mit dem Urin ausgeschieden, und die Labordiagnose eines Mangels stützt sich auf eine niedrige Vitaminkonzentration im Urin. Das Vitamin kommt in der Nahrung ubiquitär vor. Leber, Hefe, Eigelb, Vollkorn und Gemüse sind besonders gute Quellen. Ein Pantothensäuremangel ist beim Menschen nur durch experimentelle Pantothensäure-Mangel-Diäten demonstriert worden oder durch die Gabe eines spezifischen Pantothensäure-Antagonisten. Die Symptome eines Pantothensäuremangels sind unbestimmt und manifestieren sich unter anderem als gastrointestinale Störungen, Depression, Muskelkrämpfe, Parästhesien, Ataxie und Hypoglykämie. Vermutet wird, dass das Burning-Feet-Syndrom bei Kriegsgefangenen im zweiten Weltkrieg durch einen Pantothensäuremangel verursacht wurde. Über eine Toxizität dieses Vitamins wurde bislang nicht berichtet. & CHOLIN Cholin ist ein Vorläufer von Acetylcholin, Phospholipiden und Betain. Cholin ist notwendig für die strukturelle Integrität der Zellmembranen, die cholinerge Neurotransmission, den Fett- und Cholesterinmetabolismus, den Methyl-Gruppen-Stoffwechsel und die transmem- 96e-6 branöse Signaltransduktion. Kürzlich wurde die Einnahmeempfehlung in den USA auf 550 mg/d für erwachsene Männer und auf 425 mg/d für erwachsene Frauen festgelegt, obwohl bestimmte genetische Polymorphismen den individuellen Bedarf an Cholin erhöhen können. Eine Zufuhrempfehlung für die Länder des deutschen Sprachraums existiert nicht. Cholin wird für einen „bedingt essenziellen“ Nährstoff gehalten, dessen De-novo-Synthese in der Leber zwar stattfindet, unter bestimmten Stressbedingungen (z. B. alkoholbedingte Lebererkrankungen) den erhöhten Umsatz aber nicht abdeckt. Die benötigte Zufuhr an Cholin hängt vom Status anderer Methyl-Gruppen-Donatoren (Folsäure, Vitamin B12 und Methionin) ab und kann daher deutlich variieren. Cholin ist in der Nahrung in der Form des Lecithins (Phosphatidylcholin) weit verbreitet (z. B. in Eigelb, Weizenkeimen, Innereien und Milch). Ein Cholinmangel ist bei cholinfrei parenteral ernährten Patienten aufgetreten. Ein Mangel führt zu einer Leberverfettung, erhöhten Serumtransaminasen sowie zu Skelettmuskelschäden mit hohen Kreatinphosphokinase-Werten. Die Diagnose des Cholinmangels wird aufgrund niedriger Plasmawerte gestellt, obwohl auch unspezifische Faktoren (z. B. starke körperliche Betätigung) den Plasmaspiegel absenken können. Die Toxizität von Cholin zeigt sich durch niedrigen Blutdruck, cholinerg ausgelöstes Schwitzen, Durchfall, Speichelfluss und einen fischigen Körpergeruch. Die Obergrenze der Cholinzufuhr wird mit 3,5 g/d angegeben. Therapeutisch wird Cholin eingesetzt bei Patienten mit Demenz und Patienten mit einem hohen Risiko für kardiovaskuläre Krankheiten aufgrund seiner Fähigkeit, den Cholesterinund Homocysteinspiegel zu senken. Jedoch muss ein derartiger Nutzen noch belegt werden. Cholin- und Betain-reduzierte Diäten haben einen therapeutischen Stellenwert bei der Trimethylaminurie (Fischgeruch-Syndrom). & FLAVONOIDE Als Flavonoide wird eine große Gruppe von Polyphenolen bezeichnet, die als Geschmacks-, Geruchs- und Farbstoffe von Obst und Gemüse dienen. Zu bedeutenden Gruppen von Nahrungsflavonoiden gehören die Anthocyanidine in Beerenfrüchten, die Catechine in grünem Tee und Schokolade, Flavonole (wie Quercetin) in Brokkoli, Kohl, Lauch, Zwiebeln sowie in der Schale von Trauben und Äpfeln sowie die Isoflavone (z. B. Genistein) in Hülsenfrüchten. Isoflavone haben eine niedrige Bioverfügbarkeit und werden teilweise bereits durch die Darmflora metabolisiert. Die Zufuhr an Flavonoiden mit der Nahrung wird auf 10–100 mg/d geschätzt, wobei diese Zahl sicherlich zu niedrig angegeben ist, da eine genaue Kenntnis über den Gehalt an Flavonoiden in vielen unserer Nahrungsmittel noch aussteht. Verschiedene Flavonoide weisen eine antioxidative Aktivität auf und können zelluläre Signalwege beeinflussen. In epidemiologischen Beobachtungsstudien sowie in kleineren klinischen Untersuchungen an Menschen und in Tierversuchen zeigte sich eine Bedeutung der Flavonoide in der Prävention verschiedener chronischer Erkrankungen, einschließlich neurodegenerativer Krankheiten, Diabetes und Osteoporose. Die endgültige Bedeutung und der Nutzen der einzelnen Bestandteile bei Erkrankungen des Menschen müssen aber noch durch weitere Studien geklärt werden. & VITAMIN A Streng genommen bezieht sich die Bezeichnung Vitamin A auf Retinol. Allerdings sind die oxidierten Metaboliten Retinal und Retinsäure ebenfalls biologisch aktive Verbindungen. Der Ausdruck Retinoide beinhaltet alle Moleküle (einschließlich synthetischer Moleküle), die sich, chemisch betrachtet, vom Retinol ableiten. Retinal (11-cis) ist die essenzielle Form des Vitamins A, die für den Sehvorgang benötigt wird, während die Retinsäure für eine normale Morphogenese, normales Wachstum und die Zelldifferenzierung erforderlich ist. Retinsäure hat keine Funktion beim Sehvorgang und im Gegensatz zu Retinol ist sie nicht an der Reproduktion beteiligt. Vitamin A spielt auch eine Rolle bei der Eisenverwertung, der humoralen Immunität, der T-Zell-vermittelten Immunität, der natürlichen Killerzellenaktivität und der Phagozytose. Vitamin A ist kommerziell wegen der dadurch erhöhten Stabilität in veresterter Form verfügbar (z. B. als Acetat oder Palmitat). In der Natur kommen mehr als 600 Carotinoide vor, von denen etwa 50 zu Vitamin A metabolisiert werden können. Beta-Carotin ist das in der Nahrung vorherrschende Carotinoid mit Provitamin-AAktivität. Beim Menschen werden bedeutende Anteile von Carotinoiden intakt resorbiert und in Leber und Fettgewebe gespeichert. Äqui- Vitamine und Spurenelemente – Mangel und Überschuss valent zu 1 μg Retinol sind schätzungsweise 12 μg oder mehr (Bereich 4–27 µg) des Beta-Carotins in der Nahrung beziehungsweise 24 μg oder mehr von anderen Carotinoiden mit Provitamin-A-Aktivität (z. B. Cryptoxanthin oder Alpha-Carotin). Die Vitamin-A-Äquivalenz eines Beta-Carotin-Supplements in Ölsuspension beträgt 2 : 1. Metabolismus Die Leber enthält etwa 90 % der Vitamin-A-Reserven und sezerniert Vitamin A in Form von Retinol, und zwar gebunden an Retinol-bindendes Protein. Danach interagiert dieser Proteinkomplex mit einem zweiten Eiweiß, dem Transthyretin. Dieser trimolekulare Komplex hat die Aufgabe, die glomeruläre Filtration des Vitamins A in der Niere zu verhindern, den Körper vor der Toxizität des Retinols zu schützen und dem Retinol die zelluläre Aufnahme über spezifische Zelloberflächenrezeptoren zu ermöglichen, die Retinol-bindendes Protein erkennen. Eine gewisse Menge an Vitamin A gelangt in periphere Zellen, auch wenn es nicht an Retinol-bindendes Protein geknüpft ist. Nach Aufnahme von Retinol in die Zelle wird es an eine Reihe von zellulären Retinol-bindenden Proteinen gekoppelt, die das Sequestrieren und den Transport übernehmen, sowie als Koliganden für enzymatische Reaktionen agieren. Bestimmte Zellen enthalten auch Retinsäure-bindende Proteine, die die gleiche sequestrierende Aufgabe und Transportfunktion für Retinsäure in den Zellkern besitzen und den Metabolismus ermöglichen. Retinsäure ist ein Ligand für verschiedene Rezeptoren im Zellkern, die als Transkriptionsfaktoren agieren. Zwei Rezeptorfamilien (RARund RXR-Rezeptoren) sind aktiv in der Retinoid-vermittelten Gentranskription. Retinoidrezeptoren regulieren die Transkription, indem sie in Zielgenen als dimere Komplexe an bestimmte DNS-Stellen binden, die Retinsäure-Response-Elemente in Ziel-Genen (Kap. 400e). Die Rezeptoren können nach erfolgter Ligandenbindung die Genexpression sowohl stimulieren als auch unterdrücken. RAR bindet alltrans-Retinsäure und 9-cis-Retinsäure, wohingegen RXR ausschließlich 9-cis-Retinsäure bindet. Die Retinrezeptoren spielen eine wichtige Rolle bei der Kontrolle der Zellproliferation und -differenzierung. Retinsäure ist bei der Behandlung der promyelozytischen Leukämie nützlich (Kap. 132) und findet auch Anwendung in der Behandlung der zystischen Akne, denn sie hemmt die Keratinisierung, vermindert die Talgsekretion und verändert möglicherweise die entzündliche Reaktion (Kap. 71). RXRs dimeriseren mit anderen Zellkernrezeptoren, um als Koregulatoren von Genen zu dienen, die auf Retinoide, Schilddrüsenhormon und Calcitriol ansprechen. RXR-Agonisten führen experimentell eine Insulinempfindlichkeit herbei, vielleicht weil RXR ein Kofaktor für die Peroxisomen-Proliferator-aktivierten Rezeptoren (PPAR) ist, die ihrerseits Zielpunkte der Thiazolidindion-Medikamente wie Rosiglitazon und Troglitazon sind (Kap. 418). Aufgrund eines ungünstigen Nutzen-Risiko-Profils wurde Troglitazon in Deutschland nicht zugelassen und Rosiglitazon vom Markt genommen. In Deutschland ist daher nur noch Pioglitazon verfügbar, das nach Empfehlung des Gemeinsamen Bundesausschusses 2011 allerdings nur in begründeten Ausnahmefällen bei Typ-2-Diabetikern verordnungsfähig ist. Vorkommen in der Nahrung Das Retinol-Aktivitäts-Äquivalent (RAE) wird verwendet, um den Vitamin-A-Gehalt der Nahrung auszudrücken. Ein RAE ist definiert als 1 µg Retinol (0,003491 mmol), 12 μg Beta-Carotin bzw. 24 μg anderer Carotinoide mit Provitamin-A-Aktivität. In der älteren Literatur wurden Vitamin-A-Werte häufig durch internationale Einheiten (IU) ausgedrückt, wobei 1 RAE etwa 3,33 IU Retinol und 20 IU Beta-Carotin entspricht. In der heutigen wissenschaftlichen Literatur finden diese Einheiten jedoch keine Verwendung mehr. Leber, Fisch und Ei sind ausgezeichnete Nahrungsquellen für Vitamin A. Als Gemüsequellen für Provitamin-A-Carotinoide kommen dunkelgrüne und stark gefärbte Früchte und Gemüse infrage. Moderates Kochen des Gemüses verstärkt die Freisetzung der Carotinoide für die Aufnahme im Darm. Durch Fett am Essen kann die Carotinoidresorption zusätzlich verstärkt werden. Kinder sind besonders anfällig für einen Vitamin-A-Mangel, weil weder die Muttermilch noch die Kuhmilch ausreichend Vitamin A liefert, um einen Mangel zu verhindern. In Entwicklungsländern ist eine anhaltende Unterversorgung mit Nahrung der häufigste Grund für einen Vitamin-AMangel, der durch Infektionen noch verstärkt werden kann. In der frühen Kindheit resultiert ein niedriger Vitamin-A-Spiegel aus einer 96e inadäquaten Zufuhr an Nahrungsmitteln tierischer Herkunft und Speiseölen, die kostspielig sind, sowie der saisonalen Nichterhältlichkeit von Gemüse und Früchten sowie einem Mangel an gefertigten Nahrungsprodukten. Ein gleichzeitiger Zinkmangel kann die Vitamin-A-Mobilisierung aus den Leberdepots behindern. Alkohol beeinflusst die Umwandlung von Retinol in Retinal im Auge durch eine Konkurrenz um die Alkohol-(Retinol-)Dehydrogenase. Medikamente, die die Absorption des Vitamins A beeinflussen, beinhalten Mineralöl, Neomycin und Cholestyramin. Mangel Vitamin-A-Mangel ist in Gebieten endemisch, in denen eine anhaltend schlechte Nahrungsversorgung der Bevölkerung besteht, besonders in Südasien, in Afrika südlich der Sahara, in einigen Teilen Lateinamerikas und in der Westpazifikregion einschließlich Teilen von China. Der Vitamin-A-Spiegel wird üblicherweise durch die Messung des Serum-Retinols (Normalwert 1,05– 3,50 μmol/l bzw. 30–100 μg/dl) oder des „Blood Spot“-Retinols oder mittels Testung der Dunkeladaptation bestimmt. Stabile Isotopenmessung oder die invasive Leberbiopsie erlauben eine Schätzung der Vitamin-A-Körperreserven. Basierend auf einem erniedrigten Serumretinol (< 0,70 μmol/l bzw. 20 μg/dl) gibt es > 90 Mio. Kinder im Vorschulalter mit einem Vitamin-A-Mangel, von denen > 4 Mio. eine Augenbeteiligung in Form der Xerophthalmie haben. Dies beinhaltet auch mildere Ausprägungen mit Nachtblindheit und konjunktivaler Xerose mit Bitot-Flecken (weißen Flecken aus keratinisiertem Epithel auf der Sklera), aber auch die seltenen Hornhautgeschwüre und -nekrosen, die zur Erblindung führen können. Die Keratomalazie (die Aufweichung der Kornea) hat eine korneale Vernarbung zur Folge, die bei mehr als 250.000 Kindern jährlich zur Erblindung und bei 4– 25 % zum Tode führt. Vitamin-A-Mangel geht in allen Stadien mit einer erhöhten Sterblichkeit durch Diarrhö, Dysenterie, Masern, Malaria und Atemwegserkrankungen einher. Vitamin-A-Mangel kann die Barrierefunktionen der Epithelien beeinträchtigen und das angeborene und erworbene Immunsystem schwächen. Eine Vitamin-ASupplementierung kann die Kindersterblichkeit in Prävalenzgebieten deutlich reduzieren (im Durchschnitt um 23–34 %). Etwa 10 % der Schwangeren in unterernährten Gebieten erleiden anamnestisch eine Nachtblindheit in der zweiten Hälfte der Schwangerschaft, und dieser moderate Vitamin-A-Mangel ist mit einem erhöhten Risiko einer mütterlichen Infektion und Sterblichkeit verbunden. Die für Deutschland vorliegenden Daten zur Aufnahme von Vitamin A aus der Nationalen Verzehrsstudie II (2008) zeigen, dass die mediane Zufuhr an Vitamin A deutlich über den DACH-Referenzwerten liegt und nur 15 % der Männer und 10 % der Frauen die Empfehlungen für eine bedarfsgerechte Zufuhr nicht erreichen. Andererseits ist bei einem Teil der Bevölkerung durch Nahrungssupplemente von einer erhöhten Zufuhr auszugehen. Da die therapeutische Breite von Vitamin A eng ist, sollte der Bedarf aus natürlichen Quellen gedeckt und von einer Anreicherung von Nahrungsmitteln abgesehen werden. BEHANDLUNG: VITAMIN-A-MANGEL Bei Auftreten einer Augenmanifestation im Sinne einer Xerophthalmie sollte mit 60 mg Vitamin A (in einer öligen Lösung als Weichgelatinekapsel) behandelt werden. Die gleiche Dosis wird einen und 14 Tage später wiederholt. Für Säuglinge zwischen 6 und 11 Monaten sollte die Dosis auf die Hälfte reduziert werden. Mütter mit Nachtblindheit oder Bitot-Flecken sollten entweder 3 mg/d Vitamin A oder 2 × 7,5 mg/Woche erhalten. Dieses Therapieregime ist effizient und kostengünstig und besser verfügbar als Injektionslösungen mit Vitamin A. Eine übliche Vorgehensweise zur Prävention ist die Gabe von Vitamin A in Hochrisikogebieten alle 4–6 Monate an Kleinkinder und Säuglinge (sowohl HIV-positive als auch HIV-negative). Kinder im Alter zwischen 6 und 11 Monaten sollten 30 mg Vitamin A erhalten und Kinder im Alter von 12–59 Monaten 60 mg. Aus unbekannten Gründen konnte die präventive Gabe von Vitamin A in Hochrisikogebieten die Morbidität und die Mortalität von Säuglingen im Alter von 1–5 Monaten nicht reduzieren. Ein unkomplizierter Vitamin-A-Mangel tritt in Industrieländern nur sehr selten auf. Eine Hochrisikogruppe stellen Kinder 96e-7 Teil 6 Ernährung mit einem extrem niedrigen Geburtsgewicht (< 1000 g) dar, bei denen ein Vitamin-A-Mangel anzunehmen ist und die für insgesamt 4 Wochen 3 × 1500 μg/Woche (oder RAE) Vitamin A erhalten sollten. Schwere Masernerkrankungen können zu einem sekundären Vitamin-A-Mangel führen. Kinder, die mit Masern stationär aufgenommen wurden, sollten an zwei aufeinander folgenden Tagen eine Dosis von jeweils 60 mg Vitamin A erhalten. Am häufigsten tritt Vitamin-A-Mangel bei Patienten mit einer Malabsorption auf (z. B. Sprue oder Kurzdarmsyndrom), die eine pathologische Dunkeladaptation oder Symptome der Nachtblindheit, aber ohne andere Augenveränderungen aufweisen. Typischerweise werden diese Patienten für einen Monat mit 15 mg/d einer wässrigen Vitamin-A-Suspension behandelt. Dieser Therapie wird dann eine niedrigere Erhaltungsdosis mit genau der Menge an Vitamin A angeschlossen, die sich aus dem Monitoring des SerumRetinols ergibt. Es gibt keine spezifischen Mangelzeichen oder Symptome, die aus einem Carotinoidmangel resultieren. Es wurde postuliert, dass Beta-Carotin eine wirksame Prävention gegen Krebs sein könnte, weil zahlreiche epidemiologische Studien eine Beziehung gezeigt hatten zwischen einer Ernährung mit hohem Beta-Carotin-Anteil und einer niedrigeren Inzidenz von Krebsarten des Atmungs- und Verdauungssystems. Allerdings erbrachten Interventionsstudien an Rauchern mit hohen Beta-Carotin-Dosen eher eine Häufung von Lungenkrebs, verglichen mit der jeweiligen placebobehandelten Gruppe. Carotinoide ohne Provitamin-A-Funktion wie Lutein und Zeaxanthin werden als Schutz vor einer Makuladegeneration empfohlen, und eine großangelegte Interventionsstudie konnte nur bei niedrigem Luteinspiegel einen Nutzen belegen. Dem Nicht-Provitamin-A-Carotinoid Lycopin wird eine Schutzfunktion gegenüber Prostatakrebs zugeschrieben. Die Wirksamkeit dieser Agenzien ist jedoch bislang nicht durch Interventionsstudien bewiesen, und die Mechanismen, die diesen biologischen Effekten zugrunde liegen, sind unbekannt. Zuchtverfahren für Pflanzen, die den Provitamin-A-Gehalt von Grundnahrungsmitteln erhöhen, können die Vitamin-A-Versorgung der einkommensschwachen Länder verbessern. Ein vor kurzem durch genetische Modifikation entwickelter Reis (Golden Rice) weist zudem einen verbesserten Konversionsquotienten von Beta-Carotin zu Vitamin A von etwa 3 : 1 auf. Toxizität Die akute Toxizität von Vitamin A wurde zuerst in der Arktis bei Forschungsreisenden nach dem Verzehr von Eisbärenleber beobachtet, gleichfalls nach Aufnahme von 150 mg Vitamin A durch Erwachsene und von 100 mg durch Kinder. Die akute Toxizität manifestiert sich durch einen gesteigerten intrakraniellen Druck, Schwindel, Diplopie, ein Anschwellen der Fontanellen bei Kindern, Anfälle sowie eine exfoliative Dermatitis. Dieser Zustand kann zum Tode führen. Bei Kindern, die gemäß oben stehendem Protokoll auf einen Vitamin-AMangel behandelt wurden, traten in 2 % der Fälle eine Vorwölbung der Fontanellen und transiente Übelkeit sowie Kopfschmerzen in 5 % der Fälle auf. Eine chronische Vitamin-A-Intoxikation ist in Industrieländern besorgniserregend und wurde bei Personen beobachtet, die 15 mg/d (Erwachsene) beziehungsweise 6 mg/d (Kinder) Vitamin A über mehrere Monate aufnahmen. Als Manifestationen finden sich trockene Haut, Cheilosis, Glossitis, Erbrechen, Alopezie, Entmineralisierung des Knochens sowie Skelettschmerzen, Hyperkalzämie, Lymphknotenvergrößerung, Hyperlipidämie, Amenorrhö und Merkmale eines Pseudotumor cerebri mit gesteigertem intrakraniellem Druck und Papillenödem. Außerdem kann im Ergebnis chronischer Vitamin-A-Vergiftung eine Leberfibrose mit portaler Hypertension sowie Knochendemineralisation auftreten. Wenn Vitamin A exzessiv von Schwangeren aufgenommen wird, kann es zu spontanen Schwangerschaftsabbrüchen kommen oder es können beim Kind angeborene Missbildungen wie kraniofaziale Abnormitäten und Herzklappenerkrankungen auftreten. In der Schwangerschaft sollte die tägliche Vitamin-A-Dosis daher 3 mg nicht übersteigen. Auch die kommerziell erhältlichen Retinoidderivate sind toxisch, einschließlich der 13-cisRetinsäure, die mit angeborenen Fehlbildungen in Verbindung gebracht wurde. Daher sollte bei Frauen, die 13-cis-Retinsäure genommen haben, die Empfängnisverhütung wenigstens über 1 Jahr fortgesetzt werden, möglicherweise auch länger. 96e-8 Bei unterernährten Kindern wird die altersabhängige Gabe von Vitamin A (30–60 mg) in Zyklen von 2 Jahren erwogen, um die unspezifischen Wirkungen von Impfungen zu verstärken. Allerdings gibt es aus unbekannten Gründen eine negative Auswirkung auf die Mortalität von unvollständig geimpften Mädchen. Hohe Dosen von Carotinoiden führen nicht zu toxischen Symptomen, sollten aber von Rauchern aufgrund eines gesteigerten Lungenkrebsrisikos vermieden werden. Mit sehr hohen Beta-Carotin-Dosen (etwa 200 mg/d) lassen sich die Hautausschläge bei erythropoetischer Protoporphyrie verhindern und behandeln. Allerdings kann es zu einer Carotinämie, also einer charakteristischen Gelbfärbung der Haut (besonders der Handflächen und Fußsohlen), aber nicht der Skleren, nach einer regelmäßigen täglichen Aufnahme von mehr als 30 mg Beta-Carotin kommen. Hypothyreote Patienten sind für die Entwicklung einer Carotinämie besonders anfällig aufgrund der unvollständigen Aufspaltung von Carotin zu Vitamin A. Eine Carotinreduktion in der Ernährung lässt die Gelbfärbung der Haut und die Carotinämie innerhalb eines Zeitraums von 30–60 Tagen verschwinden. & VITAMIN D Der Metabolismus des fettlöslichen Vitamins D wird in Kapitel 423 ausführlich besprochen. Die biologischen Wirkungen werden von Vitamin-D-Rezeptoren vermittelt, die in den meisten Geweben vorkommen, sodass Vitamin D vermutlich auf fast alle Zellsysteme und Organe wirkt (z. B. Immunzellen, Gehirn, Mamma, Kolon und Prostata) und klassische endokrine Wirkungen auf den Kalziumstoffwechsel und die Knochengesundheit hat. Vermutlich dient Vitamin D zur Aufrechterhaltung der normalen Funktion vieler nicht skelettaler Gewebe, wie Muskeln (einschließlich Herzmuskeln), Immunfunktion und Entzündungsreaktionen sowie Zellproliferation und Differenzierung. Studien haben gezeigt, dass es als Begleittherapie zur Behandlung von Tuberkulose, Psoriasis, multipler Sklerose sowie zur Vorbeugung bestimmter Krebserkrankungen nützlich sein kann. Vitamin-DMangel kann das Risiko von Typ-1-Diabetes mellitus, Herz-KreislaufErkrankungen (Insulinresistenz, Bluthochdruck oder Low-grade-Entzündungen) sowie von Gehirnfunktionsstörungen (z. B. Depression) erhöhen. Allerdings wurde die Bedeutung der physiologischen Rolle von Vitamin D bei diesen nicht skelettalen Erkrankungen noch nicht genau geklärt. Eine wichtige Vitamin-D-Quelle ist seine Synthese in der Haut unter Einfluss von UV-B-Strahlen (Wellenlänge 290–315 nm). Abgesehen von Fisch enthalten Lebensmittel (sofern nicht künstlich angereichert) nur wenig Vitamin D. Vitamin D2 (Ergocalciferol) stammt aus Pflanzenquellen und ist die chemische Form, die in vielen Nahrungsergänzungsmitteln genutzt wird. Mangel Der Vitamin-D-Status wird durch die Messung von 25-DihydroxyVitamin D (25[OH]2-Vitamin D) im Serum ermittelt. Es gibt aber keine einheitliche Testmethode und keinen Konsens zum optimalen Serumspiegel. Der optimale Serumspiegel hängt vom vorliegenden oder vermuteten Krankheitsbild ab. Anhand von epidemiologischen und experimentellen Daten reicht ein 25(OH)2-Vitamin-D-Spiegel von > 20 ng/ml (≥ 50 nmol/l; zur Umrechnung von ng/ml in nmol/l mit 2,496 multiplizieren) für eine gute Knochengesundheit aus. Einige Experten befürworten höhere Serumspiegel (z. B. > 30 ng/ml) für andere wünschenswerte Vitamin-D-Wirkungen. Bei gesunden Männern und prämenopausalen Frauen reicht die Evidenz für die Empfehlung einer kombinierten Supplementation von Vitamin D und Kalzium als primärer Präventionsstrategie zur Reduktion der Frakturinzidenz nicht aus. Risikofaktoren des Vitamin-D-Mangels sind hohes Alter, mangelnde Sonneneinstrahlung, dunkle Haut (vor allem bei Menschen in nördlichen Breiten), eine Fettmalabsorption und Fettleibigkeit. Rachitis ist die klassische Erkrankung des Vitamin-D-Mangels. Mangelerscheinungen sind Muskelschmerzen, Schwäche und Knochenschmerzen. Einige dieser Effekte sind unabhängig von der Kalziumaufnahme. Vor kurzem hat die US National Academy of Science festgestellt, dass die meisten Nordamerikaner ausreichend Vitamin D zu sich nehmen (RDA = 15 μg/d oder 600 IU/d; Kap. 95e). Für die Bundesrepublik Deutschland liegen aus dem Ernährungssurvey 1998 Daten vor, die ein Risiko eines klinisch manifesten Mangels an Vitamin D vor allem für Schwangere, Stillende, Säuglinge und Kleinkinder sowie Vitamine und Spurenelemente – Mangel und Überschuss ältere Menschen nachweisen, wenn diese nur wenig dem Sonnenlicht exponiert sind. Daten der Nationalen Verzehrsstudie II zeigen, dass die empfohlene Zufuhr in allen Altersgruppen bei beiden Geschlechtern im Median deutlich unterschritten wird. Bei Menschen über 70 Jahre beträgt die RDA 20 μg/d (800 IU/d). Bei Menschen mit Risikofaktoren für einen Vitamin-D-Mangel sollte die Aufnahme von angereicherten Lebensmitteln sowie eine suberythemale Sonneneinstrahlung gefördert werden. Kann keine ausreichende Zufuhr erreicht werden, sollten vor allem während der Wintermonate Vitamin-DPräparate eingenommen werden. Vitamin-D-Mangel kann durch die orale Verabreichung von 50.000 IE/Woche für 6–8 Wochen, gefolgt von einer Erhaltungsdosis von 800 IU/d (100 μg/d) aus der Nahrung und Nahrungsergänzungsmitteln nach Erreichen des normalen Plasmaspiegels behandelt werden. Die physiologische Wirkung von Vitamin D2 und D3 ist identisch, wenn sie über längere Zeit eingenommen werden. Toxizität Die obere Aufnahmegrenze wurde mit 4000 IU/d festgelegt. Entgegen früherer Annahmen ist eine akute Vitamin-D-Intoxikation selten und entsteht meist durch die unkontrollierte und übermäßige Einnahme von Nahrungsergänzungsmitteln oder die fehlerhafte Anreicherung von Lebensmitteln. Typisch für eine Intoxikation sind hohe Plasmakonzentrationen von 1,25(OH)2-Vitamin D und Kalzium. Obligatorisch ist hier das Absetzen von Vitamin D und Kalzium, und eventuell erfolgt eine Behandlung der Hyperkalzämie. & VITAMIN E Vitamin E ist der Sammelbegriff für alle Stereoisomeren des α-Tocopherols und Tocotrienols, obwohl nur die 2R-Tocopherole für den Menschen notwendig sind. Vitamin E agiert als ein kettenabbrechendes Antioxidans und ist ein effizienter Pyroxylradikalfänger, der Lowdensity-Lipoproteine (LDL) und mehrfach ungesättigte Fettsäuren in Membranen vor einer Oxidation schützt. Ein Netz weiterer Antioxidanzien (z. B. Vitamin C und Glutathion) und Enzyme hält Vitamin E in einem reduzierten Zustand. Vitamin E hemmt auch die Prostaglandinsynthese und die Aktivitäten der Proteinkinase C und Phospholipase A2. Resorption und Metabolismus Nach der Resorption wird Vitamin E aus den Chylomikronen von der Leber aufgenommen, und ein hepatisches α-Tocopherol-Transportprotein vermittelt den intrazellulären Vitamin-E-Transport und die Inkorporation in Very-low-density-Lipoproteine (VLDL). Das Transportprotein hat eine besondere Affinität zum RRR-Isomer des α-Tocopherols. Deshalb besitzt dieses natürliche Isomer die höchste biologische Aktivität. Bedarf Vitamin E ist in zahlreichen Lebensmitteln enthalten, besonders reichlich in Sonnenblumenöl, Distelöl und Weizenkeimöl. α-Tocotrienole finden sich ausgeprägt in Soja- und Maiskeimöl. Vitamin E findet sich auch in Fleisch, in Nüssen und Getreide und in kleineren Mengen auch in Obst und Gemüse. Vitamin-E-Tabletten mit Dosen von 50–1000 mg werden in den USA von etwa 10 % der Bevölkerung eingenommen. Die RDA für Vitamin E liegt bei 15 mg/d (34,9 μmol bzw. 22,5 IU) für Erwachsene. Eine Ernährung, die reich an mehrfach ungesättigten Fettsäuren ist, kann einen etwas höheren Bedarf an Vitamin E erfordern. Ein Ernährungsmangel an Vitamin E existiert nicht. Ein Vitamin-EMangel wird nur bei schwerwiegenden und lang anhaltenden malabsorptiven Krankheiten gesehen, wie zum Beispiel bei der Zöliakie, nach Dünndarmresektion oder bariatrischen Operationen. Kinder mit Mukoviszidose oder anhaltender Cholestase können einen Vitamin-EMangel entwickeln, charakterisiert durch Areflexie und hämolytische Anämie. Kinder mit Abetalipoproteinämie können Vitamin E nicht resorbieren oder transportieren, sodass sie ziemlich rasch in einen Mangelzustand geraten. Eine familiäre Form von isoliertem VitaminE-Mangel kommt ebenfalls vor. Dabei besteht ein Defekt im α-Tocopherol-Transportprotein. Ein Vitamin-E-Mangel verursacht eine axonale Degeneration der großen myelinisierten Axone und führt zu Symptomen in der posterioren Wirbelsäule sowie im Kleinhirn. Eine periphere Neuropathie wird anfangs durch eine Areflexie charakterisiert, die sich weiterentwickelt in einen ataktischen Gang, sowie durch 96e ein vermindertes Vibrations- und Lageempfinden. Ophthalmoplegie, Myopathie der Skelettmuskulatur und Retinopathia pigmentosa können ebenfalls durch einen Vitamin-E-Mangel verursacht sein. Bei Vitamin-E- und Selenmangel besteht eine erhöhte Mutationsrate von Viren und somit verstärkte Virulenz. Die Labordiagnose des Vitamin-EMangels richtet sich am niedrigen Blutspiegel von α-Tocopherol aus (< 5 μg/ml oder < 0,8 mg α-Tocopherol pro Gramm Gesamtlipide). Biochemische Untersuchungen zur Versorgung mit Vitamin E in der Bundesrepublik geben keine Hinweise für das Vorliegen von Mangelzuständen, obwohl nach den Daten der Nationalen Verzehrsstudie II (2008) knapp die Hälfte aller Männer und Frauen die empfohlene Zufuhr der DACH-Referenzwerte nicht erreicht (Quelle: http:// www.bfr.bund.de). BEHANDLUNG: VITAMIN-E-MANGEL Ein symptomatischer Vitamin-E-Mangel sollte mit 800–1200 mg/d α-Tocopherol behandelt werden. Patienten mit Abetalipoproteinämie können sogar einen Bedarf von 5000–7000 mg/d aufweisen. Kinder mit symptomatischem Vitamin-E-Mangel sollten oral mit 400 mg/d in wässriger Suspension behandelt werden. Alternativ können 2 mg/kg/d intramuskulär verabreicht werden. Vitamin E in hohen Dosierungen kann vor einer oxidativ verursachten retrolentalen Fibroplasie und bronchopulmonalen Dysplasien sowie vor schweren intraventrikulären Blutungen bei Frühgeburten schützen. Vitamin E soll die sexuelle Leistung steigern, zur Behandlung einer Claudicatio intermittens dienen sowie den Alterungsprozess verlangsamen, aber Beweise für diese Eigenschaften stehen aus. In Kombination mit anderen Antioxidanzien kann Vitamin E einer Makuladegeneration vorbeugen. Hohe Vitamin-E-Dosen (60– 800 mg/d) zeigten in kontrollierten Studien eine Verbesserung von Immunparametern sowie ein vermindertes Auftreten von Erkältungskrankheiten bei Pflegeheimbewohnern, aber eine präventive Wirksamkeit bei kardiovaskulären Erkrankungen oder Krebs hat sich in Interventionsstudien nicht nachweisen lassen. Dagegen zeigte sich bei Dosen von mehr als 400 mg/d sogar eine erhöhte Sterblichkeit. Toxizität Alle Formen von Vitamin E werden resorbiert und können zur Toxizität beitragen. Allerdings scheint das Risiko für eine Toxizität bei normaler Leberfunktion gering zu sein. Hohe Dosen von Vitamin E (> 800 mg/d) können die Plättchenaggregation reduzieren und mit dem Vitamin-K-Metabolismus interferieren. Sie sind deshalb bei Patienten, die Cumarine und Thrombozytenaggregationshemmer (wie Aspirin und Clopidogrel) einnehmen, kontraindiziert. Über Übelkeit, Flatulenz und Durchfall wurde bei Dosierungen von mehr als 1 g/d berichtet. & VITAMIN K Es gibt zwei natürliche Formen des Vitamins K: Vitamin K I, auch als Phyllochinon bezeichnet, das aus pflanzlichen und tierischen Quellen stammt, sowie Vitamin K II oder Menachinon, das von der Darmflora synthetisiert wird und sich in hepatischem Gewebe findet. Phyllochinon kann in einigen Organen in Menachinon umgewandelt werden. Vitamin K ist für die posttranslationale Carboxylierung der Glutaminsäure notwendig, die wiederum die Kalziumbindung an γ-carboxylierte Proteine ermöglicht, wie bei Prothrombin (Faktor II), den Faktoren VII, IX und X, Protein C, Protein S und Knochenproteinen (Osteocalcin) sowie Proteinen der glatten Muskulatur von Gefäßen (z. B. Matrix-gla-Proteine). Die Bedeutung von Vitamin K für die Knochenmineralisation ist allerdings nicht bekannt. Cumarine hemmen die gamma-Carboxylierung, indem sie die Umwandlung von Vitamin K in seine aktive Hydrochinonform behindern. Vorkommen in der Nahrung Vitamin K kommt im grünen Blattgemüse vor, wie Grünkohl und Spinat, aber auch in Margarine und Leber finden sich beträchtliche Mengen. Vitamin K kommt in pflanzlichen Ölen vor, besonders reichlich in Oliven-, Raps- und Sojaöl. Bei Amerikanern liegt die durchschnittliche Aufnahme schätzungsweise bei 100 μg/d. 96e-9 Teil 6 Ernährung Mangel Die Symptome eines Vitamin-K-Mangels äußern sich primär in Hämorrhagien. Neugeborene sind besonders empfindlich wegen niedrigerer Fettdepots, niedrigem Vitamin-K-Gehalt der Muttermilch, Sterilität des kindlichen Darmtrakts, Leberunreife und verminderten Plazentatransports. Sowohl intrakraniale als auch gastrointestinale und Hautblutungen können bei Säuglingen mit Vitamin-K-Mangel 1–7 Tage nach Geburt auftreten. Daher wird Vitamin K den Neugeborenen derzeit (0,5–1 mg i.m.) prophylaktisch nach der Geburt gegeben. In Deutschland erhalten Neugeborene eine Vitamin-K-Prophylaxe mit 2 mg oral zur U1 direkt nach der Geburt, zur U2 am 3.– 10. Lebenstag und zur U3 in der 4.–6. Lebenswoche. Ein Vitamin-K-Mangel wird bei Erwachsenen mit chronischer Dünndarmerkrankung (z. B. Zöliakie, Crohn-Krankheit), bei Obstruktionen des Gallentraktes oder nach Dünndarm-Resektion gesehen. Breitspektrumantibiotika können durch eine Reduktion von Darmbakterien, die Menachinon synthetisieren, sowie durch eine Hemmung des Vitamin-K-Metabolismus einen Vitamin-K-Mangel auslösen. Unter Cumarintherapie kann das Antiadiposum Orlistat gegen Fettleibigkeit durch eine Vitamin-K-Malresorption zu INR-Veränderungen führen. Die Diagnose eines Vitamin-K-Defizits wird normalerweise aufgrund einer erhöhten Prothrombinzeit oder erniedrigter Gerinnungsfaktoren gestellt. Vitamin K kann auch direkt durch HPLC bestimmt werden. Die Behandlung eines Vitamin-K-Mangels erfolgt durch eine parenterale Gabe von 10 mg. Bei Patienten mit chronischer Malabsorption können oral 1–2 mg/d gegeben werden oder parenteral 1–2 mg/Woche. Patienten mit Lebererkrankung können eine verzögerte Prothrombinzeit entweder infolge der Zerstörung von Leberzellen oder eines Vitamin-K-Mangels aufweisen. Wenn eine verzögerte Prothrombinzeit nicht auf eine Vitamin-K-Therapie anspricht, kann darauf geschlossen werden, dass sie nicht durch einen Vitamin-K-Mangel ausgelöst wurde. Toxizität Eine Toxizität durch mit der Nahrung aufgenommene Phyllochinone und Menachinone wurde bislang nicht beschrieben. Hohe Dosen von Vitamin K können die Wirkung von oralen Antikoagulanzien beeinträchtigen. Bei der parenteralen Gabe von Vitamin K wurden schwere anaphylaktische Reaktionen beschrieben. MINERALSTOFFE Siehe auch Tab. 96e-2. & KALZIUM Siehe Kapitel 423. & ZINK Zink ist ein integraler Bestandteil von vielen Metalloenzymen im Körper. Es ist an der Synthese und der Stabilisierung von Proteinen, DNS und RNS beteiligt und spielt eine strukturelle Rolle in Ribosomen und Membranen. Zink ist notwendig für die Bindung von Steroidhormonrezeptoren und einigen anderen Transkriptionsfaktoren an die DNS. Es ist absolut notwendig für eine normale Spermatogenese, das fötale Wachstum und die embryonale Entwicklung. Resorption Die Zinkresorption aus der Nahrung wird von Phytaten, Ballaststoffen, Oxalaten, Eisen und Kupfer sowie von bestimmten Medikamenten wie Penicillamin, Natriumvalproat und Ethambutol gehemmt. Fleisch, Meeresfrüchte, Nüsse und Hülsenfrüchte sind gute Quellen von bioverfügbarem Zink, während Zink aus Getreide für die Resorption nur in geringerem Maße verfügbar ist. Mangel Ein leichter Zinkmangel ist bei vielen Krankheiten beschrieben, darunter Diabetes mellitus, AIDS, Zirrhose, Alkoholismus, entzündliche Darmerkrankung, Malabsorptionssyndrom und Sichelzellanämie. Unter diesen Krankheiten kann ein leichter chronischer Zinkmangel das Wachstum von Kindern beeinträchtigen, die Geschmacksempfindung vermindern (Hypogeusie) und die Immunabwehr beeinträchtigen. Schwerwiegender chronischer Zinkmangel ist als eine Ursache von Hypogonadismus und Zwergwuchs in einigen Ländern des Nahen Ostens beschrieben worden. Bei diesen 96e-10 Kindern ist hypopigmentiertes Haar ein weiterer Teil des Syndroms. Die Acrodermatitis enteropathica ist eine durch Abnormitäten in der Zinkabsorption charakterisierte, seltene autosomal rezessive Störung. Klinische Manifestationen sind Durchfall, Alopezie, Muskelmakulierung, Depression, Reizbarkeit und ein Ausschlag, der Gliedmaßen, Gesicht und das Perineum betrifft. Der Ausschlag wird als blasenförmig und pustulär verkrustet mit Schuppenbildung und Erythem charakterisiert. Gelegentlich haben Patienten mit einer Wilson-Krankheit einen Zinkmangel infolge einer Penicillamintherapie entwickelt (Kap. 429). Zinkmangel tritt in Entwicklungsländern häufig auf und ist meist mit anderen Mikronährstoffmängeln vergesellschaftet (z. B. Eisen). Zink (20 mg/d) kann als effektive Begleittherapie bei Durchfall und Pneumonien von Kindern im Alter über 6 Monaten eingesetzt werden. Die Diagnose eines Zinkmangels wird normalerweise anhand eines Serumzinkwertes von unter 12 μmol/l (< 70 μg/dl) getroffen. Schwangerschaft und Kontrazeptiva können eine leichte Absenkung der Zinkwerte verursachen, und eine Hypalbuminämie jeglicher Ursache kann zu einer Hypozinkämie führen. In akuten Stresssituationen kann Zink aus dem Serum in das Gewebe umverteilt werden. Zinkmangel kann mit 2 × 60 mg/d elementarem Zink oral (bezogen auf die aufzunehmende Menge des Elements) behandelt werden. Von Zinkgluconat-Tabletten (13 mg Zink alle 2 h während des Wachseins) wurde – allerdings mit widersprüchlichen Ergebnissen – berichtet, dass sie die Dauer und die Symptome einer gewöhnlichen Erkältung beim Erwachsenen mindern. Toxizität Eine akute Zinktoxizität nach oraler Aufnahme verursacht Übelkeit, Erbrechen und Fieber. Aufsteigender zinkhaltiger Dampf beim Schweißen kann ebenfalls toxisch sein und Fieber, respiratorische Insuffizienz, übermäßigen Speichelfluss, Schweißausbrüche und Kopfschmerz verursachen. Chronisch hohe Dosen von Zink können das Immunsystem negativ beeinflussen und eine hypochrome Anämie auslösen als Folge eines Kupfermangels. Intranasale Zinkpräparate sollten nicht gegeben werden, da sie zu irreversiblen Schäden der Nasenschleimhaut und Anosmie führen können. & KUPFER Kupfer ist ein integraler Bestandteil zahlreicher Enzymsysteme, darunter Aminooxidasen, Ferrooxidasen (Coeruloplasmin), Cytochromc-Oxidase, Superoxiddismutase und Dopaminhydroxylase. Kupfer ist ebenfalls ein Bestandteil des Ferroproteins, eines Transportproteins, welches am basolateralen Transport des Eisens während der Resorption durch den Enterozyten beteiligt ist. Als solches spielt Kupfer eine Rolle im Eisenstoffwechsel, in der Melaninsynthese, in der Energiebereitstellung, in der Neurotransmittersynthese und bei der Funktion des Zentralnervensystems sowie der Synthese und dem Cross-linking von Elastin und Kollagen sowie beim Abfangen von Superoxidradikalen. Nahrungsquellen des Kupfers sind Meeresfrüchte, Leber, Nüsse, Hülsenfrüchte, Kleie und Organfleisch. Mangel Ein ernährungsbedingter Kupfermangel ist relativ selten, beobachtet wurde er allerdings bei Frühgeborenen, die mit Milchnahrungen gefüttert wurden, und bei Säuglingen mit Malabsorption (Tab. 96e-2). Eine Kupfermangelanämie (die refraktär gegenüber der therapeutischen Gabe von Eisen ist) wurde bei Patienten mit malabsorptiven Krankheiten und bei nephrotischem Syndrom gesehen. Auch kann sie auftreten bei Patienten mit Wilson-Krankheit, die dauerhaft oral mit hohen Zinkdosen behandelt wurden, was die Kupferabsorption behindert. Menkes Kraushaarsyndrom ist eine X-chromosomal vererbte Störung des Kupfermetabolismus, die mit geistiger Retardierung, Hypocuprämie und einer verminderten Zirkulation von Coeruloplasmin einhergeht (Kap. 427). Die Krankheit wird durch Mutationen im am Kupfertransport beteiligten ATP7A-Gen verursacht. Kinder mit dieser Krankheit versterben oft an einem dissezierenden Aneurysma oder einem Herzriss im Alter bis zu 5 Jahren. Die Acoeruloplasminämie ist eine seltene autosomal rezessiv vererbte Erkrankung, die durch eine Eisenüberladung des Gewebes, mentalen Verfall, mikrozytäre Anämie und niedrige Serumspiegel für Eisen und Kupfer charakterisiert wird. Die Diagnose eines Kupfermangels wird normalerweise anhand erniedrigter Serumwerte von Kupfer (< 65 μg/dl) und Coeruloplasmin Vitamine und Spurenelemente – Mangel und Überschuss 96e TABELLE 96e-2 Mangel und Toxizität von Mineralstoffen Element Mangel Toxizität Tolerierbare Obergrenze der Aufnahme mit der Nahrung Bor Keine biologische Funktion bekannt Entwicklungsstörungen, Sterilität des Mannes, Hodenatrophie 20 mg/d (extrapoliert aus Tierversuchen) Kalzium Reduzierte Knochenmasse, Osteoporose Niereninsuffizienz (Milch-Alkali-Syndrom), Nierensteine, herabgesetzte Eisenresorption, Thiaziddiuretika Kupfer Anämie, Wachstumsverzögerung, gestörte Keratini- Übelkeit, Erbrechen, Diarrhö, Leberinsuffizienz, Tremor, sierung und Pigmentierung der Haare, Hypothermie, geistiger Abbau, hämolytische Anämie, Nierenfunktionsstödegenerative Veränderungen im Elastin der Aorta, rungen Osteopenie, geistiger Abbau Chrom Verminderte Glukosetoleranz Berufliche Exposition: Niereninsuffizienz, Dermatitis, Lungen- Nicht bekannt krebs Fluorid Erhöhtes Kariesrisiko Fluorose der Zähne und Knochen, Osteosklerose 10 mg/d (Fluorose) Iod Vergrößerte Schilddrüse, herabgesetzter T4-Spiegel Schilddrüsenfunktionsstörung, Akne-ähnlicher Ausschlag 1100 µg/d (Schilddrüsenfunktionsstörung) Eisen Abnormalitäten im Muskel, Koilonychie, Pica, Anämie, verminderte Leistungsfähigkeit, verminderte geistige Entwicklung, vorzeitige Wehen, erhöhte perinatale mütterliche Mortalität Gastrointestinale Störungen (Übelkeit, Erbrechen, Diarrhö, Verstopfung), Eisenüberladung mit Organschäden, akute systemische Toxizität, erhöhte Suszeptibilität für Malaria, erhöhtes Risiko bei bestimmten chronischen Krankheiten (z. B. Diabetes) 45 mg/d elementaren Eisens (gastrointestinale Störungen) Mangan Störung von Wachstum, Skelettentwicklung, Reproduktion, Fett- und Kohlenhydratstoffwechsel; Ausschlag am Oberkörper Generalisiert: Neurotoxizität, Parkinson-ähnliche Symptome 11 mg/d (Neurotoxizität) Molybdän Schwere neurologische Störungen Störung der Reproduktion und der fötalen Entwicklung 2 mg/d (extrapoliert aus Tierversuchen) Selen Kardiomyopathie, dekompensierte Herzinsuffizienz, Degeneration der quer gestreiften Muskulatur Generalisiert: Alopezie, Übelkeit, Erbrechen, anomale Nägel, emotionale Labilität, periphere Neuropathie, Mattigkeit, Knoblauchgeruch im Atem, Dermatitis 400 μg/d (Veränderungen an Haar und Nägeln) 2500 mg/d (Milch-Alkali-Syndrom) 10 mg/d (Lebertoxizität) Berufliche Exposition: Enzephalitis-ähnliches Syndrom, Parkinson-ähnliches Syndrom, Psychose, Pneumokoniose Berufliche Exposition: Karzinome in Lunge und Nase, Lebernekrosen, Lungenentzündung Phosphor Rachitis (Osteomalazie), proximale Muskelschwäche, Hyperphosphatämie Rhabdomyolyse, Parästhesie, Ataxie, Anfälle, Verwirrtheit, Herzinsuffizienz, Hämolyse, Azidose 4000 mg/d Phosphat Zink Wachstumsverzögerung, verminderter Geschmack und Geruch, Alopezie, Dermatitis, Diarrhö, immunologische Funktionsstörung, Gedeihstörungen, Gonadenatrophie, angeborene Fehlbildungen 40 mg/d (gestörter Kupfermetabolismus) Generalisiert: verminderte Kupferresorption, Gastritis, Schweißausbruch, Fieber, Übelkeit, Erbrechen Berufliche Exposition: Atemstörungen, Lungenfibrose (< 20 mg/dl) erhoben. Der Kupferserumwert kann sich in der Schwangerschaft oder während einer Stresssituation erhöhen, da Coeruloplasmin zu den Akutphaseproteinen gehört und 90 % des zirkulierenden Kupfers an Coeruloplasmin gebunden sind. Toxizität Zu einer Kupfervergiftung kommt es normalerweise nur versehentlich (Tab. 96e-2). In schweren Fällen kann Nierenversagen, Leberausfall und Koma auftreten. Bei der Wilson-Krankheit führen Mutationen im kupfertransportierenden Gen ATP7B zu einer Kupferanhäufung in Leber und Gehirn, die aufgrund eines verminderten Coeruloplasminspiegels mit niedrigen oder niedrig normalen Blutwerten einhergeht (Kap. 429). & SELEN Selen, in der Form von Selenocystein, ist ein Bestandteil des Enzyms Glutathionperoxidase, das dazu dient, Protein, Zellmembranen, Lipide und Nukleinsäuren vor oxidativen Molekülen zu schützen. In diesem Zusammenhang wird Selen derzeit intensiv als chemopräventives Agens gegen bestimmte Krebserkrankungen wie das Prostatakarzinom untersucht. Selenocystein kommt auch in Deiodinaseenzymen vor, die die Deiodierung von Thyroxin zu Triiodthyronin vermitteln (Kap. 405). Nahrungsselen findet sich reichlich in Meeresfrüchten, Muskelfleisch und Getreide, obwohl der Selengehalt des Getreides von der Bodenkonzentration bestimmt wird. Länder mit niedrigen Selen-Bodenkonzentrationen sind Teile von Skandinavien, China und Neuseeland. Die Keshan-Krankheit ist eine endemische Kardiomyopathie, die bei Kindern und jungen Frauen in Regionen von China beobachtet wurde, wo die Selenaufnahme über die Nahrung sehr niedrig ist (< 20 µg/d). Das gemeinsame Vorkommen eines Iod- und Selenmangels kann die klinischen Manifestationen des Kretinismus verstärken. Eine anhaltende Zufuhr von hohen Dosen Selens führt zur so genannten Selenose, die durch brüchige und ausfallende Haare und Nägel charakterisiert wird sowie durch knoblauchartigen Mundgeruch, Hautausschlag, Myopathie, Reizbarkeit und andere Veränderungen des Nervensystems. & CHROM Chrom potenziert die Wirkung von Insulin bei Patienten mit beeinträchtigter Glukosetoleranz, vermutlich durch eine Steigerung von insulinrezeptorvermittelten Signalen, wenngleich sein Nutzen bei der Behandlung des Typ-2-Diabetes noch unsicher ist. Außerdem wurde bei einigen Patienten über eine Verbesserung der Blutfettprofile berichtet. Der Nutzen von Chrom-Supplementen für die Muskelbildung ist nicht belegt. Reiche Nahrungsquellen für Chrom sind Hefe, Fleisch und Getreideprodukte. Chrom im dreiwertigen Zustand findet sich in Nahrungsergänzungsmitteln und ist im Wesentlichen nicht toxisch. Sechswertiges Chrom, ein beim Schweißen von Edelstahl anfallendes Produkt, gilt allerdings als ein bekanntes Lungenkarzinogen, das auch Leber, Niere und das Zentralenervensystem schädigen kann. & MAGNESIUM Siehe Kapitel 423. & FLUORID, MANGAN UND ULTRA-SPURENELEMENTE Eine essenzielle Funktion von Fluor wurde für den Menschen bislang nicht beschrieben, obwohl es der Strukturerhaltung von Zähnen und Knochen dient. Eine Fluorose beim Erwachsenen äußert sich in fle- 96e-11 Teil 6 Ernährung ckigen und enthärteten Defekten in Zahnschmelz und in spröden Knochen (Skelettfluorose). Auch ein Mangan- und Molybdänmangel wurden bei Patienten mit seltenen genetischen Abnormitäten sowie bei einigen Patienten, die über einen längeren Zeitraum parenteral ernährt wurden, beschrieben. Mehrere manganspezifische Enzyme ließen sich identifizieren (z. B. Mangansuperoxiddismutase). Manganmangel kann den Knochen demineralisieren, das Wachstum verlangsamen und zu Ataxie, zu Störungen im Kohlenhydrat- und Fettstoffwechsel und Krämpfen führen. Als Ultra-Spurenelemente werden die Elemente bezeichnet, deren täglicher Bedarf unterhalb von 1 mg liegt. Die für Deutschland verbindlichen DACH-Empfehlungen nehmen eine andere Einteilung vor. Hiernach sind Spurenelemente solche, deren Gehalt im Gewebe unter 50 ppm (also unter 50 μg/g Feuchtgewicht) liegt und deren Bedarf beim Menschen die Menge von 50 mg am Tag unterschreitet. Als Ultra-Spurenelemente werden alle anderen Elemente bezeichnet, deren Essenzialität tierexperimentell geprüft wurde, ohne dass allerdings ihre Funktionen im Körper bekannt sind. Zu den Ultra-Spurenelementen rechnet man Aluminium, Antimon, Arsen, Barium, Blei, Bor, Brom, Cadmium, Caesium, Germanium, Lithium, Quecksilber, Rubidium, Samarium, Silizium, Strontium, Thallium, Titan, Vanadium, Wismut und Wolfram. Dass sie essenziell sein könnten, ist für die 96e-12 meisten dieser Elemente nicht belegt, obwohl Selen, Chrom und Iod zum Beispiel eindeutig lebensnotwendig sind (Kap. 405). Molybdän ist für die Aktivität der Sulfit- und Xanthinoxidase erforderlich, und ein Molybdänmangel kann zu Skelett- und Hirndefekten führen. WEITERFÜHRENDE LITERATUR BIESALSKI HK et al: Water, electrolytes, vitamins and trace elements – Guidelines on Parenteral Nutrition, Chapter 7. GMS German Medical Science 7:Doc 21, 2009 DEUTSCHE GESELLSCHAFT FÜR ERNÄHRUNG, ÖSTERREICHISCHE GESELLSCHAFT FÜR ERNÄHRUNG, SCHWEIZERISCHE GESELLSCHAFT FÜR ERNÄHRUNGSFORSCHUNG, SCHWEIZERISCHE VEREINIGUNG FÜR ERNÄHRUNG (Hrsg.): Referenzwerte für die Nährstoffzufuhr, 2. Aufl., 1. Ausgabe. UmschauVerlag, Frankfurt a. M., 2015 HESEKER H et al: Vitaminversorgung Erwachsener in der Bundesrepublik Deutschland. In: Kübler W et al (Hrsg.): Vera Schriftenreihe, Bd. IV, Wissenschaftlicher Fachverlag Dr. Fleck, Niederkleen, 1992 MAX RUBNER-INSTITUT (MRI): Nationale Verzehrsstudie II, Ergebnisbericht, Teil 2. 2008 MENSINK G et al: Was essen wir heute? Ernährungsverhalten in Deutschland. Robert Koch-Institut Berlin, 2002