Der Carnot`sche Kreisprozess
Werbung

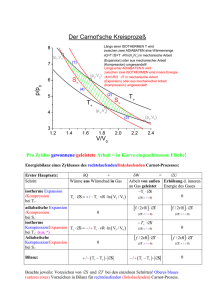
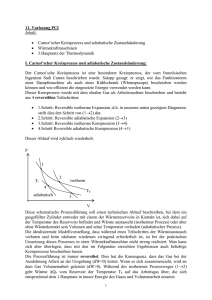
1 Der Carnot'sche Kreisprozess Man spricht von einem Kreisprozess, wenn ein thermodynamisches System verschiedene Zustände durchläuft, bevor es schließlich wieder in seinen ursprünglichen Zustand zurückkehrt. Während dieses Kreisprozesses, kann ein System Arbeit verrichten und als Wärmemotor fungieren. Der 1824 von Nicolas Sadi Carnot vorgestellte Zyklus setzt sich aus vier thermodynamischen Zustandsänderungen zusammen. Zwar ist er nur einer von vielen möglichen Prozessen, aber er ist der effizienteste, wenn es darum geht eine gewisse Menge an Wärmeenergie in Arbeit umzuwandeln. Es gibt keinen anderen Zyklus mit extremen Temperaturen, welcher dieselben Isotherme wie der Carnot'sche Kreisprozess hat und einen höheren Wirkungsgrad aufweist. Er beschreibt somit einen idealen Wärmemotor. Alle Wärmemotoren stellen nur eine sehr unvollkommene Nachbildung dieses idealen und theoretischen Kreisprozesses dar. Dementsprechend kann kein Wärmemotor ihn perfekt reproduzieren. Die Bedeutung des Prozesses ist dennoch fundamental für das Verständnis der Funktionsweise dieser Maschinen, denn er weist das Ziel, das man anstreben sollte. Um einen Wärmemotor, egal ob mit Dampf, Verbrennung, heißer Luft o.ä. angetrieben, zum Laufen zu bringen, benötigt man zwei Wärmereservoirs mit unterschiedlichen Temperaturen T1 und T2. Das Fluid des Wärmemotors sei in diesem Fall ein ideales Gas, besser gesagt ein theoretisches Gas, gebildet aus sich bewegenden, punktförmigen Teilchen, die miteinander interagieren und dem Gesetz pV=RT folgen (gültig für eine Menge des Gases, wobei p der Druck, V das Volumen, T die absolute Temperatur und R die allgemeine Gaskonstante ist). Das Verhalten von realem Gas unterscheidet sich bei den in Wärmemotoren auftretenden Temperaturen und Druckverhältnissen nicht signifikant von dem eines idealen Gases. Grafik einfügen aus dem englischen Text: [Graf] Dieser Graph zeigt, dass die Isothermen in dem P-V-Diagramm gleichseitige Hyperbeln sind. Der Carnot'sche Kreisprozess wird in dem Diagramm wiedergegeben und besteht, wie auch die folgende Abbildung zeigt, aus vier unterschiedlichen Phasen: zwei isothermen Phasen, in denen die Temperatur von T1 und T2 konstant bleibt, sowie zwei adiabatischen Phasen, in denen kein Wärmeaustausch zwischen dem System und der Umgebung statt findet. Grafiken einfügen: 1. isotherme Expansionsphase A-B 2. adiabatische Expansionsphase B-C 3. isotherme Kompressionsphase C-D 4. adiabatische Kompressionsphase D-A Ein idealer Carnot'scher Motor besteht aus einem von einem beweglichen Kolben umschlossenen Zylinder. Während der adiabatischen Phasen muss der Zylinder völlig wärmeisoliert sein, während bei den isothermen Vorgängen ein Wärmeaustausch mit den Wärmereservoirs möglich ist. Grafik einfügen 2 Isotherme Expansion A-B Der Zylinder wird in Verbindung mit der Temperaturquelle T1 platziert. Das Gas nimmt die Wärmeenergiemenge Q1 von der heißeren Quelle T1 auf, was zu einer Vergrößerung seines Volumens und zu einer Druckverminderung führt. Der Kolben bewegt sich aufwärts und gibt Energie ab. Durch den Einfluss der Wärmequelle wird der Tendenz des Gases, an Temperatur zu verlieren, entgegengewirkt und somit bleibt die Temperatur konstant (isotherme Phase). In diesem Fall ist die Arbeit LA-B, die von der Maschine während der A-B Phase geliefert wird identisch mit der Wärme Q1, welche vom Reservoir bei der Temperatur T1 abgegeben wird. Adiabatische Expansion B-C Der Zylinder ist nun von der Umgebung isoliert und ein Wärmeaustausch mit dem Reservoir der Temperatur T1 ist nicht länger möglich. Ein adiabatischer Vorgang findet statt: sich weiterhin ausdehnend, kühlt das Gas auf die Temperatur T 2 ab und liefert, unter Einbußen seiner inneren Energie, Arbeit nach außen. Die von der Maschine bereit gestellte Arbeit ist LB-C= C(T1-T2), wobei C der spezifischen Wärme des Fluids bei einem konstanten Volumen entspricht. Isotherme Kommpression C-D Der Zylinder steht in Verbindung mit der Wärmequelle der Temperatur T2, wobei diese geringer ist als T1. Nun senkt der Kolben sich. Obwohl das Gas komprimiert wird, erhitzt es sich nicht, denn es gibt die Wärmemenge Q2 an die Quelle zurück. Die für den Motor zur Verfügung gestellte Leistung LC-D entspricht der Wärme Q2, welche mit der Temperatur T2, an das Reservoir abgegeben wird. Adiabatische Kompression D-A Der Zylinder ist erneut wärmeisoliert. Durch die von außen geleistete Arbeit wird das Gas komprimiert und dies wiederum vergrößert die innere Energie des Gases. Die Temperatur erhöht sich von T2 auf T1 und man kehrt zum Beginn des Kreislaufes zurück. Die verrichtete Arbeit ist LD-A=C (T1-T2). Mit dem Ergebnis dieses Kreisprozesses kann man demonstrieren, dass es möglich ist, Energie zu erhalten und das System auf seine ursprünglichen Zustand zurück zu versetzen, sofern man einen idealen Carnot’schen Motor, ein perfektes Fluid und zwei unterschiedlich temperierte Quellen besitzt. Die verfügbare Energie ergibt sich aus der Differenz zwischen der Energie, welche die Maschine an die Umgebung abgibt und der Energie, welche der Maschine während des Kreislaufes von außen zugeführt wird. Der Wirkungsgrad ŋ des Carnot’schen Motors wird definiert als das Verhältnis zwischen gelieferter Arbeit des Motors und bereitgestellter Wärme des Reservoirs mit der höchsten Temperatur: ŋ = (LA-B + LB-C – LC-D – LD-A )/ Q1 Da LB-C gleich ist mit LD-A, LA-B= Q1 und LC-D = Q2 und da in isothermen Prozessen gilt Q1/ T1 = Q2/ T2, wird der Wirkungsgrad zu ŋ =(T1-T2)/ T1 Das fundamentale Charakteristikum des Carnot’schen Motors ist, dass er nicht von dem verwendeten Fluid abhängig ist (z.B. Gas oder Dampf) sondern von dem Temperaturunterschied der beiden Quellen zwischen denen der Wärmeaustausch 3 stattfindet. Letztlich könnte der hypothetische Wirkungsgrad von 100% nur erreicht werden, wenn T2 dem absoluten Nullpunkt (0 K) entspräche; etwas, das sich unmöglich erreichen lässt. Der Wirkungsgrad des Carnot’schen Motors ist daher stets geringer als 1. ´ Es ist weiterhin interessant, dass der Wirkungsgrad des Carnot’schen Kreisprozesses, bei gleich bleibender Temperaturdifferenz (mit ∆T= T1-T2) umso größer ist, je kleiner die Werte T1 und T2 sind. Der Wärmemotor kann ebenso als Kühlschrank fungieren, sofern man den Zyklus umstellt. In diesem Fall zieht das System Wärme Q2 von der Quelle mit der geringeren Temperatur T2 (Kühlfach) und liefert Wärme Q1 an die Quelle mit der höheren Temperatur T1 (Außenumgebung). Da Q1> Q2, muss sämtliche zusätzliche Energie, die für die Quelle T1 geliefert werden soll, von außen in das System zugeführt werden, um als Kühlschrank funktionieren zu können.