BIOLOGIE – Bau eines Oligopeptid- Modells
Werbung

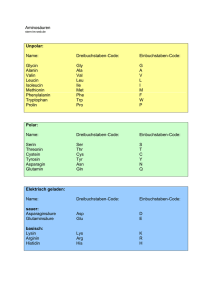
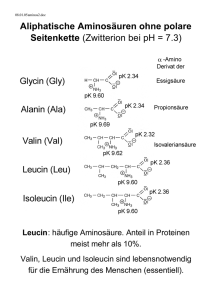
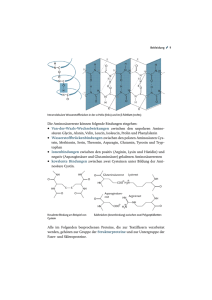
Datum: Name: Klasse: BIOLOGIE – Bau eines Oligopeptid- Modells: Oxytocin Oxytocin ist ein Hormon. Hormone sind Signalmoleküle, die von speziellen Drüsen ins Blut abgegeben werden. Auf diese Weise werden sie im ganzen Körper verteilt. Im Zielorgan lösen sie dann eine bestimmte Reaktion aus. Einige Hormone sind chemisch veränderte Aminosäuren (z.B. Adrenalin), andere sind Lipide (z.B. Geschlechtshormone) oder Peptide. Oxytocin gehört zur letzten Gruppe. Es besteht aus neun Aminosäuren und ist daher ein Nonapeptid. In dieser Lerneinheit produziert die Klasse eine Kunststoffmodell eines Oxytocin-Moleküls. Dies wird in zwei Schritten durchgeführt: 1. Jede/r Schüler/in macht ein Aminosäure-Modell und erforscht dessen Struktur. 2. Aminosäuren werden zu einer Kette verbunden. Zeichne die Strukturformel der Aminosäure Alanin in die linke Box und markiere den konstanten Teil. Zeichne die allgemeine Struktur einer Aminosäure in die rechte Box. Ersetze dazu die Methylgruppe von Alanin durch den Buchstaben «R» (Seitenkette, AS-Rest, R-Gruppe). Alanin = 2-Aminopropansäure Allgemeine Struktur = 2-Amino-2-(R)-ethansäure Bei der Peptidsynthese wird die Aminogruppe einer Aminosäure mit der Carboxylgruppe (Säuregruppe) einer anderen verbunden. Diese Art der Bindung heisst Peptidbindung. So verbunden bilden die konstanten Teile der AS das Rückgrat eines Peptids bzw. Proteins. Bezüglich der C- und N-Atome des Rückgrates sind zwei Punkte sehr wichtig: 1. Die bindenden Elektronen des C-Atoms der Carboxylgruppe und des N-Atoms der Aminogruppe bilden jeweils sp2-Hybride. Das heisst, drei Orbitale formen ein flaches Dreieck mit Winkeln von ca. 120° und die restlichen Bindungselektronen sind delokalisiert (wie in Benzol). (Markierter Bereich in Fig. 1) 2. Die bindenden Elektronen des zweiten C-Atoms bilden sp3 -Hybride. Das heisst, alle vier Orbitale bilden ein Tetrader mit Winkeln von ca. 109°. Wichtig dabei ist, dass die vier Ecken eines Tetraeders auf zwei Arten angeordnet sein können, die nicht kongruent sondern spiegelsymmetrisch sind. Diese Art der Stereoisomerie zeigt Chiralität (Händigkeit, vom griechischen Wort cheir = Hand). Der Fachbegriff für derartige Isomere heisst Enantiomere, wobei eines die L-Form und das andere die D-Form aufweist. (Fig. 2) Protein sind ausschliesslich aus L-Aminosäuren aufgebaut. Dies muss beim Bau des Proteinmodells unbedingt beachtet werden. Fig. 1 Kantonsschule Kreuzlingen, Klaus Hensler Fig. 2 Bio10_OxytocinModel_ARBBLATTdtsch.doc – 7.2.07 Kantonsschule Kreuzlingen, Klaus Hensler, Mär. 10 Bau der Modelle C (sp3) C (sp2) O (Einzel-/Doppelbindungen) N (sp2) S P H Verbin- Marker der für den AS-Rest 1. Bau der Aminosäure-Grundstruktur: Jede Gruppe (zwei Personen) baut den konstanten Teil einer Aminosäure, wobei die Position der Seitenkette (AS-Rest) durch die kleine, grüne Kugel mit langem Verbinder markiert wird. Unbedingt darauf achten, dass die L-Form gemacht wird. 2. Knüpfen einer Peptidbindung: Eine Person entfernt das –OH der Carboxylgruppe von seiner/ihrer AS, die andere Person ein H der Aminogruppe. Nun werden die beiden AS verknüpft und OH wird mit H zu Wasser verbunden. Ihr habt nun ein Dipeptid «synthetisiert» indem AS durch eine Peptidbindung verknüpft wurden. Weil dabei Wasser entsteht, heisst eine solche Reaktion Kondensationsreaktion. • Findet nun heraus welche Konformationen möglich sind, d.h. auf welche Art und Weise die verschiedenen Molekülteile relativ zueinander verdreht werden können. • Beachte, dass das Dipeptid 2 verschiedene Enden hat: das Corboxylende und das Aminoende. • Zeichne die Strukturformel einer Peptidbindung! 3. Fertigstellung der Aminosäure: Löst die Aminosäuren wieder voneinander, spaltet das H2 O-Molekül und fügt die OH-Gruppe bzw. das H wieder ein. Solch eine Reaktion heisst Hydrolyse, weil dazu Wasser gespalten wird. Ersetze nun den grünen Platzhalter durch die richtige Seitenkette, wie sie auf der nächsten Seite dargestellt wird. Welche Aminosäuren von jeder Gruppe hergestellt werden ist der Tabelle unten zu entnehmen. Die Nummern werden zuvor zugeteilt. 4. Peptidsynthese: Nun kann Oxytocin «synthetisiert» werden, indem die AS entsprechend der Primärstruktur über Peptidbindungen verknüpft werden. NH2 – Glycin – Leucin – Prolin – Cystein – Asparagin – Glutamin – Isoleucin – Tyrosin – Cystein – COOH Dann wird eine S–S-Brücke zwischen den Cysteinen geknüpft und versucht die richtige Tertiärstruktur näherungsweise einzurichten. Gruppe AS1 AS2 1 Glycin Tyrosin 2 Leucin 3 Gruppe AS1 AS2 7 Isoleucin Prolin Glutamin 8 Tyrosin Glycin Prolin Cystein 9 Cystein Asparagin 4 Cystein Leucin 10 Leucin Glutamin 5 Asparagin Cystein 11 Cystein Asparagin 6 Glutamin Isoleucin 12 Glycin Glutamin Hausarbeit 1. Wo wird Oxytocin beim Menschen produziert? 2. Welches ist/sind die Funktionen/en von Oxytocin beim Menschen? Kantonsschule Kreuzlingen, Klaus Hensler Bio10_OxytocinModel_ARBBLATTdtsch.doc – 7.2.07