Zytogenetik - biomed
Werbung

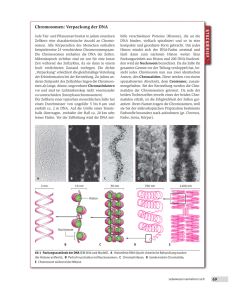
biomed_Heft_0506 16.11.2006 11:25 Uhr Seite 13 wissenschaft & praxis Zytogenetik Die Zytogenetik umfasst die mikroskopische Untersuchung von Zahl und Struktur der Chromosomen und deren Abweichungen sowie den Prozess der Zellteilung an sich. Sie ist die häufigste Laboruntersuchung in der Humangenetik und ein Grundpfeiler in der pädiatrischen und onkologischen Diagnostik. Karyogramm der Größe nach angeordnet, sodass der Karyotyp bestimmt werden kann. Der Karyotyp beschreibt den Chromosomensatz eines Individuums, also die Gesamtzahl aller Chromosomen in der Zelle. Die Anzahl und die Form der Chromosomen in jeder Zelle eines Menschliche Chromosomen wurden das erste Mal 1874 von Arnold und 1881 von Fleming beobachtet. Es dauerte dann jedoch noch etwa wissenschaft 70 Jahre, bis durch einen Präparationsfehler & praxis zufällig ein Zugang zu einer mikroskopisch klaren Darstellung des menschlichen Chromosomensatzes gefunden wurde. Historische Meilensteine 1952 beschrieb Hsu den menschlichen Chromosomensatz mit 48 Chromosomen. Trotz der falschen Chromosomenzahl war diese Publikation von großer Bedeutung. Hsu hatte sozusagen durch einen „Unfall“ entdeckt, dass hypotone Lösungen die behandelten Zellen anschwellen und platzen ließen. 1956 korrigierten Tjio und Levan die Chromosomenzahl auf den richtigen Wert von 46. Es dauerte nur drei Jahre, bis verschiedene Gruppen die Überzahl oder das Fehlen eines Chromosoms als Ursache für einige genetische Syndrome beschrieben. Was sind Chromosomen? Chromosomen verdanken ihren Namen der Eigenschaft, dass sie sich durch Farbstoffe gut anfärben lassen (griechisch: chroma = Farbe, soma = Körperchen). Ein Chromosom ist die Organisationsstruktur der DNA mancher eukaryontischer Organismen. Es ist ein langer, kontinuierlicher DNA-Doppelstrang, der um eine Vielzahl von Histonen (Kernproteinen) herumgewickelt und mehrfach zu einer kompakten Form spiralisiert werden kann. Chromosomen unterliegen einem typischen Formenwandel: n Während der Zellteilung existieren sie als mikroskopisch sichtbare „Transportform“. Sie bestehen morphologisch aus jeweils zwei Längsstrukturen, den Chromatiden, die am Zentromer zusammengehalten werden. n Während der Ruhephase des Zellkerns (Interphase) lösen sie ihre Struktur auf, die DNA liegt als nicht sichtbare „Funktionsform“ vor. Karyogramm Um die Anzahl der diploiden Chromosomen eines Lebewesens festzustellen, werden sie während der Metaphase im Reagenzglas mit Colchizin, einem Spindelgift, arretiert, sodass sie nicht mehr zu den Zellpolen gezogen werden können. Danach werden die Zellen angefärbt, fotografiert und in einem Organismus sind artspezifisch. Der Mensch besitzt im diploiden Zustand 46 Chromosomen (23 Paare). 22 Paare sind bei Mann und Frau gleich (Autosomen). Das 23. Paar besteht beim Mann aus einem X- und einem Y-Chromosom und bei der Frau aus zwei X-Chromosomen (Gonosomen = Geschlechtschromosomen). Darstellung der Chromosomen Zur Chromosomenanalyse beim Menschen ist grundsätzlich jedes Untersuchungsmaterial geeignet, das Mitosen enthält oder bei dem man die Mitose anregen kann. Von Bedeutung ist auch die Zugänglichkeit. Peripheres Blut ist das am meisten verwendete Untersuchungsmaterial, um den konstitutionellen (angeborenen) Karyotyp zu ermitteln. Lymphozyten eignen sich am besten zur Chromosomendarstellung, weil die Entnahme von venösem Blut einfach und die Mitoseausbeute bei der Kultivierung sehr gut ist. In der Praxis erfolgen die meisten Chromosomenpräparationen aus folgenden Materialien: n Pränataldiagnostik: n Nabelschnurblut (Lymphozyten) n Fruchtwasser (Amnionzellen) n Chorionzotten n Postnataldiagnostik: n peripheres Blut (Lymphozyten) n Hautstanze (Fibroblasten) n Tumorzytogenetik: n Knochenmark (Lymphozyten und Vorstufen) Periphere Lymphozyten teilen sich im gesunden Menschen normalerweise nicht, da sie sich in der G0-Phase befinden. Durch die Zugabe von Phytohämagglutinin ins Kulturmedi- 13 biomed_Heft_0506 14 16.11.2006 11:25 Uhr Seite 14 wissenschaft & praxis um können sie jedoch artifiziell zur Teilung angeregt werden und vermehren sich dann in der Regel in 72-Stunden-Kulturen zu einer für die Präparation genügenden Zelldichte. Die wesentlichen Schritte im Einzelnen Ansatz einer Chromosomenkultur: Das Kulturmedium für eine Chromosomenkultur enthält neben dem RPMI 1640 Medium fötales Kälberserum und LGlutamin, die in vivo für eine physiologische Umgebung sorgen, sowie Penicillin/Streptomycin zur Vermeidung von Kontaminationen und Natriumbicarbonat als pH-Stabilisator. Phytohämagglutinin (PHA), ein so genanntes Mitogen, das aus der roten Nierenbohne gewonnen wird, ermöglicht die Zellteilung unter Kulturbedingungen. Wenn T-Lymphozyten dem PHA ausgesetzt werden, reagieren sie darauf wie sie es auch innerhalb des Körpers auf eine artfremde Substanz tun würden. Die reifen T-Zellen entdifferenzieren zu einer T-lymphoblastischen Zelle. In dieser Form ist die T-Zelle in der Lage, Mitosen zu bilden, um DNA aufzubauen. derungsmethode ist die Bänderung mit Trypsin und Giemsa. Nach Inkubation der Chromosomen in einer Trypsinlösung (Trypsinierung) erfolgt die Inkubation mit Giemsa-Lösung. Der Farbstoff wird nach der Denaturierung des Chromatins in die DNA eingebaut. Die Bandenstruktur basiert auf Unterschieden in der Längsstruktur des Chromatins. Jedes Band ist vom nächsten durch seine Basenzusammensetzung, die Chromatininformation, die Dichte der Gene, seine repetitiven Sequenzen und den Zeitpunkt der Replikation unterschieden. GTG-Bänder – 46,XX Standardfärbung – 46,XX Chromosomen Harvesting („Ernten der Chromosomen“): n Nach etwa 72 Stunden bei 37°C in einem CO2-Brutschrank erfolgt die Zugabe von Colcemid , ein synthetisches Analog zu Colchizin (Alkaloid der Herbstzeitlose). Colcemid verursacht das Absterben der Spindelfasern, wodurch das Auseinanderweichen der Schwester-Chromatiden verhindert wird und arretiert die Chromosomen in der Metaphase. Dieser Schritt wird „Stoppen des Wachstums“ bzw. „Unterbrechen“ genannt n Die hypotone Behandlung der Zellen erfolgt üblicherweise mit 37°C warmer, 0,075 molaren KCl. Die hypotone Lösung erhöht das Zellvolumen durch den Effekt der Osmose. Wasser fließt durch die Zellmembran in das Innere der Zelle, um den unterschiedlichen Salzgehalt von Zelle und Umgebung auszugleichen. Ein größeres Volumen bedeutet für die Chromosomen, dass sie mehr Platz haben und sich besser ausbreiten können. Zudem quillt das Chromatin und wird dadurch besser sichtbar gemacht. n Die Fixierung des Materials erfolgt mit einem Gemisch aus Eisessig und Methanol im Verhältnis 1:3 („Fixativ“), das eisgekühlt verwendet wird. Die Fixierung ist ein Konservierungsprozess. Dabei senkt das Fixativ den pH-Wert der Zelle und denaturiert sie. Anschließend wird die Zelle dehydriert, das Wasser im Zellinneren entfernt und durch Methanol ersetzt, Proteine und DNA verändert. Die Zellmembran und das Chromatin werden gehärtet und die Chromosomen für die nachfolgende Bänderungsprozedur präpariert. Zusätzlich hat das Gemisch einen lysierenden Effekt auf die Erythrozyten und die Debris. n CBG-Bänder (C-Bänder mit Barium und Giemsa): Mit Hilfe der C-Bänder wird das zentromernahe Heterochromatin aller Chromosomen angefärbt. Besonders deutlich tritt dies am perizentrischen Heterochromatinblock der Chromosomen 1, 9 und 16 sowie am distalen Heterochromatinblock des Y-Chromosoms zu Tage. Die C-Bänder resultieren daraus, dass aus den C-Bandennegativen Regionen durch eine HCl-Behandlung mehr DNA und Proteine herausgelöst werden. Das Heterochromatin (C-Banden-positiv) ist mit Proteinen dichter gepackt und enthält darüber hinaus noch spezielle NichtHistonproteine. Durch die stärkere Proteinbindung wird die DNA in den C-Banden-positiven Regionen langsamer depuriniert. Ein Verlust von DNA und Protein ist dann erschwert, deshalb färben sich diese Bereiche mit Giemsa dunkel an. n QFQ-Bänder (Quinacrin-Bänderung): Die Bänderung mit dem Fluoreszenz-Farbstoff Quinacrin war 1970 die erste Bänderungsfärbung, die eine individuelle Unterscheidung der Chromosomen ermöglichte. Mit der Q-Bänderung leuchten bestimmte polymorphe Regionen (perizentromerische Regionen an den Chromosomen 3 und 4, perizentromerische und Satellitenregionen der akrozentrischen Chromosomen, Heterochromatinblock in Yq) hell auf. Die helle Fluoreszenz findet sich dabei in DNA-Abschnitten mit AT-reichen Basenpaaren. Das kommt daher, weil AT-reiche DNA die Quinacrin-Fluoreszenz steigert, GC-reiche DNA sie dagegen vermindert („quencht“). Ansonsten spielen bei dieser Färbemethoden: n Standardfärbung: Mit Hilfe des Farbstoffes Giemsa wird die DNA aller Chromosomen einheitlich angefärbt. Dadurch wird die Zahl der Chromosomen feststellbar und numerische Veränderungen (Aberrationen) können erkannt werden. Außerdem kann man die Chromosomen anhand ihrer Größe und der Lage des Zentromers in sieben Gruppen einteilen. Eine individuelle Unterscheidung der Chromosomen ist allerdings nicht möglich. n GTG-Bänder (G-Bänder mit Trypsin-Giemsa): Die in der Praxis am häufigsten angewandte Bän- CBG-Bänder – 46,XY QFQ-Bänder – 46,XY biomed_Heft_0506 16.11.2006 11:25 Uhr Seite 15 wissenschaft & praxis Färbung aber auch die Variation der Basenzusammensetzung entlang der gesamten Länge des Chromosoms und DNA-Protein-Wechselwirkungen eine Rolle. n Weitere Färbungen: n R-Bänder (reverse Bänderung) n SCE-Bänder (Sister Chromatide Exchange) n NOR-Bänder (Silberfärbung) Chromosomenaberrationen Chromosomenstörungen (Chromosomenaberrationen) sind beim Menschen keine Seltenheit. Etwa 20 % aller Konzeptionen haben Chromosomenanomalien, jedoch wird der größte Teil der Embryonen bzw. Feten spontan abortiert. Veränderungen, die die Anzahl der Chromosomen betreffen, werden als numerische Chromosomenaberrationen bezeichnet. Sie verursachen bei dem/der TrägerIn von wenigen Ausnahmen abgesehen schwere gesundheitliche Schädigungen. Beispiele sind die Trisomien, die bekannteste davon ist die Trisomie 21, das Down-Syndrom. Hier liegt das Chromosom Nr. 21 in dreifacher Ausführung vor. Häufige Befunde betreffen fehlende oder überzählige Geschlechtschromosomen. Beim Turner-Syndrom fehlt neben dem vorhandenen X-Chromosom ein zweites X- oder ein Y-Chromosom, beim Klinefelter-Syndrom sind zwei X-Chromosomen und zusätzlich ein Y-Chromosom vorhanden. Ist die Struktur der Chromosomen verändert, so spricht man von strukturellen Chromosomenaberrationen. Schwere Folgen haben Veränderungen, bei denen Chromosomenmaterial verloren gegangen ist (= Deletion) oder verdoppelt wurde (= Duplikation). Die Umkehr eines Chromosomenabschnittes innerhalb eines Chromosoms (= Inversion) oder ein Austausch von Chromosomenstücken zwischen zwei Chromosomen (= Translokation) hat in der Regel nur dann Folgen, wenn bei diesem Vorgang wichtiges genetisches Material verloren ging oder verdoppelt wurde. Inversionen und Translokationen können über Generationen vererbt werden. Werden sie in einer pränatalen Diagnose gefunden, sind sie dann als harmlos zu betrachten, wenn bereits ein Elternteil TrägerIn der gleichen Chromosomenaberration ist. n Quellen: Tariverdian G., Buselmaier W: Humangenetik. 3. Auflage, Springer-Verlag, 2004 http://de.wikipedia.org/wiki/Chromosom http://www.zum.de/Faecher/Bio/SA/stoff12/chromosomen.htm http://www.genetica-ag.ch/zytogenetik/ zytogenetik_allgemeines.html http://www.mta-verband.at/zytogenetikforum/default.htm Gabriela Kronberger Biomedizinische Analytikerin Klinische Genetik St. Johanns-Spital Salzburg E-Mail: [email protected] Ort der Zusammenarbeit Das Kantonsspital Baden bietet als Kompetenzzentrum umfassende medizinische Versorgung für über 250 000 Menschen. Es arbeitet eng mit Hausärzten, Spitälernund weiteren Gesundheitsinstitutionen im Ostaargau zusammen. An unserem Institut für Radiologie der Kantonsspital Baden AG suchen wir per sofort oder nach Vereinbarung eine neue Teamleitung MRI im Bereich Magnetresonanztomographie. Wir bieten Ihnen einen interessanten Aufgabenbereich mit einem breiten Untersuchungsspektrum an einem 1.5 T Avanto-Systems mit TIM (Siemens). Zusätzlich verfügt das Institut über das gesamte Spektrum der konventionellen digitalen Radiologie, digitale Mammographie, Computertomographie, Ultraschalldiagnostik mit Interventionen, Osteodensitometrie nach DEXA, Durchleuchtung und interventionelle Angiographie und Cardangiographie. Derzeit integrieren wir ein digitales Bildspeicherarchiv. Als Fachfrau/Fachmann verfügen Sie über eine abgeschlossene MTRA-Ausbildung mit ausgewiesener Berufserfahrung, speziell im Bereich MRI. Sie suchen die Herausforderung im Bereich Teamführung und haben evtl. schon erste Führungserfahrungen gesammelt. Selbständig und eigenverantwortlich sind Sie fähig, einen Aufgabenbereich zu organisieren und bei der Ausbildung der MTRA-Auszubildenden mitzuhelfen. Sie gewährleisten die Sicherstellung des Informationsflusses innerhalb des Teams und arbeiten dabei eng mit der Institutsleitung zusammen. Kommunikation sehen Sie als Ihre persönliche Stärke und Sie sind bereit, bei Bedarf an Pikett-, Nacht- und Wochenenddiensten teilzunehmen. Wir bieten Ihnen moderne und angenehme Arbeitsplätze mit einem jungen, engagierten Team. Eine sorgfältige Einarbeitung und Förderung Ihrer persönlichen Weiterbildung sind für uns selbstverständlich. Frau Margarete Römpler, Leitende Fachfrau für MTRA/QMB, erteilt Ihnen gerne weitere Auskünfte unter Tel. +41 (0)56 486 3820. Ihre schriftliche Bewerbung senden Sie bitte an: Frau Ursula Sandmeier, Abt. Personal & Recht, Kantonsspital Baden AG, CH-5404 Baden. Kantonsspital Baden 15