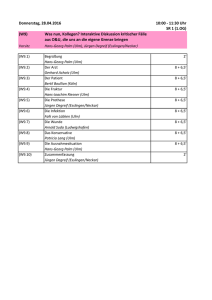
Diss_Dauenhauer - oparu
Werbung

Universität Ulm Universitätsklinik für Dermatologie und Allergologie Ulm Ärztliche Direktorin: Prof. Dr. med. Karin Scharffetter-Kochanek Versorgung epithelialer Hauttumore am Ulmer Hauttumorzentrum: eine Bestandsaufnahme DISSERTATION zur Erlangung des Doktorgrades der Zahnmedizin der Medizinischen Fakultät der Universität Ulm vorgelegt von Philippe Gaston Dauenhauer geb. in Ulm 2014 Amtierender Dekan: Prof. Dr. T. Wirth 1. Berichterstatter: PD Dr. L.-A. Schneider 2. Berichterstatter: Prof. Dr. R. Luthardt Tag der Promotion: 28.04.2016 Meinen Eltern gewidmet Inhaltsverzeichnis ABKÜRZUNGSVERZEICHNIS ............................................................................. VI 1. EINLEITUNG - MALIGNE EPITHELIALE HAUTTUMOREN ............................ 1 1.1 Epitheliale Hauttumore: gesellschaftliche Bedeutung ................................ 1 1.2 Pathogenese ................................................................................................... 4 1.3 Klinik, Histologie und Therapie ..................................................................... 6 1.3.1 Basalzellkarzinom ...................................................................................... 6 1.3.1.1 klinisches Bild und Histologie ............................................................... 6 1.3.1.2 Sonderformen des Basalzellkarzinoms ................................................ 8 1.3.1.3 Diagnose und Differenzialdiagnosen ................................................... 8 1.3.2 Plattenepithelkarzinom ............................................................................... 9 1.3.2.1 klinisches Bild und Histologie ............................................................... 9 1.3.2.2 Diagnose, Stadieneinteilung und Differenzialdiagnosen .................... 10 1.3.3 Therapieansätze bei epithelialen Hauttumoren (BCC und SCC) ............. 12 1.3.4 Nachsorge von epithelialen Hauttumoren ................................................ 14 1.4 Versorgungsstruktur der Hauttumore in Süddeutschland ....................... 15 1.4.1 strukturelle Aspekte der Patientenversorgung ...................................... 15 1.4.2 epitheliale Hauttumore am Krebszentrum Ulm ..................................... 16 1.5 Fragestellung ................................................................................................ 17 2. MATERIAL UND METHODEN......................................................................... 18 2.1 Studiendesign und Patienteneinteilung ..................................................... 18 2.2 Datenrecherche ............................................................................................ 19 2.3 Recherche im EDV-System des Klinikums ................................................ 20 2.4 Datenauswertung und statistische Analyse .............................................. 20 3. ERGEBNISSE .................................................................................................. 21 3.1 Absolute Tumorfallzahlen des Kollektivs ................................................... 21 3.2 Patientenbezogene Ergebnisse .................................................................. 25 3.2.1 Geschlechterverteilung der Patienten ................................................... 25 3.2.2 Altersverteilung der Patienten ............................................................... 26 3.2.3 Body Mass Index (BMI) ......................................................................... 27 3.2.4 Lokalisation der epithelialen Hauttumoren ............................................ 27 3.2.5 Klassifikation der Plattenephitelkarzinome nach Tumorstadien ............ 34 3.3 Chirurgische Therapie der Hauttumoren.................................................... 35 3.4 Komplikationen ............................................................................................ 37 3.5 Operative und konservative Behandlungsverfahren ................................ 38 3.6 Rezidivtumoren im Patientenstamm ........................................................... 39 3.7 Ergebnisse der Patientenbefragung ........................................................... 40 3.7.1 Sonnenexpositionen ............................................................................. 40 3.7.2 Berufliche Sonnenexposition ................................................................ 40 3.7.3 Sonnenexposition in der Freizeit ........................................................... 42 3.7.4 Sonnenbrände in der Kindheit und seit der Diagnose ........................... 44 3.7.5 Prävention von Hauttumoren ................................................................ 45 3.7.6 Aufteilung nach Hauttyp, durch Selbsteinschätzung der Patienten ...... 46 3.7.7 Dermatologische Tumoren in der Anamnese vor der Diagnosestellung des Zweittumors ............................................................................................ 48 3.7.8 Hauttumorvorerkrankungen in der Familie ............................................ 48 3.7.9 Zufriedenheit mit der Behandlung ......................................................... 49 4. DISKUSSION ................................................................................................... 51 4.1 Patienten- und versorgungszentrierte Analyse ......................................... 51 4.1.1 Epidemiologische Daten und allgemeine Ergebnisse ........................... 51 4.1.2 Analyse des Patientenkontingents ........................................................ 52 4.1.3 Krankheitsbezogene Analyse ............................................................... 53 4.1.4 Versorgungsbezogene Analyse ............................................................ 55 4.2 Analyse der Patientenbefragung ................................................................ 58 4.3 Beantwortung der Leitfragen ...................................................................... 61 5. ZUSAMMENFASSUNG ................................................................................... 63 6. LITERATURVERZEICHNIS ............................................................................. 64 ANHANG.............................................................................................................. 71 Tabellenverzeichnis ........................................................................................... 71 Abbildungsverzeichnis ...................................................................................... 72 In der Tumordatenbank enthaltene Parameter ................................................ 74 Fragebögen der Studienteilnehmer .................................................................. 84 Eidesstattliche Erklärung .................................................................................. 93 Danksagung ........................................................................................................ 94 Lebenslauf .......................................................................................................... 95 VI Abkürzungsverzeichnis Abkürzungsverzeichnis Abb. Abbildung BCC Basalzellkarzinom BMI Body Mass Index Ca Carcinom CCCU Comprehensive Cancer Center Ulm CIS Carcinoma in-situ cm Zentimeter CT Computertomografie C44 Internationale statistische Klassifikation der epithelialen Tumoren DDG Deutsche Dermatologische Gesellschaft EbM Evidenz-basierte Medizin HTZ Hauttumorzentrum IARC International Agency for Research on Cancer ICD International Classification of Diseases kg Kilogramm KI Konfidenz-Intervall LK Lymphknoten LSF Lichtschutzfaktor m Männlich min Minuten mm Millimeter MRT Magnetresonanztomografie n negativ NMSC Nonmelanoma Skin Cancer OPS Operationen- und Prozedurenschlüssel PDT Photodynamische Therapie PE Probeentnahme SCC Plattenepithelkarzinom Pos positiv RKI Robert-Koch-Institut VII Abkürzungsverzeichnis SAP Systeme, Anwendungen und Produkte in der Datenverarbeitung, SAP GmbH SCC spinozelluläre Karzinome SED Standard Erythema Dose Tab. Tabelle TD Tumordicke Tis Tumor in situ UICC Union Internationale Contre le Cancer UV Ultraviolet w weiblich WHO World Health Organization z.B. zum Beispiel 1 1. Einleitung – Maligne epitheliale Tumoren 1. Einleitung - Maligne epitheliale Hauttumoren 1.1 Epitheliale Hauttumore: gesellschaftliche Bedeutung Die Gruppe der epithelialen Hauttumore wird im ICD-System unter der Kennung C44 klassifiziert und differenziert sich nach der betroffenen Region in zehn Subtypen. Am häufigsten sind die Lippenhaut (C44.0), die Haut des Augenlides (C44.1), die Ohrhaut (C44.2), Teile der Gesichtshaut (C44.3), die behaarte Kopfhaut, die Haut des Halses (jeweils C44.4) und die Haut des Rumpfes (C44.5) betroffen (DIMDI 2013). Als Hauptentitäten der epithelialen Hauttumoren gelten die Basalzellkarzinome (BCC, auch Basaliome) und die Plattenepithelkarzinome (PEC, auch spinozelluläre Karzinome SCC), die beide über 90 Prozent der epithelialen Hauttumoren ausmachen. Als weitere Tumore dieser Gruppe kann u.a. das Merkelzellkarzinom benannt werden. In Abgrenzung zu den Melanomen („schwarzer Hautkrebs“) werden epitheliale Hauttumoren im populärwissenschaftlichen Sprachgebrauch auch als „weißer Hautkrebs“ bezeichnet. Im englischsprachigen Schrifttum wird für die epithelialen Tumoren der Begriff “Nonmelanoma Skin Cancer“ (NMSC) verwendet. Die beiden Haupttumorarten entstehen in der Epidermis, wobei 80 Prozent auf die BCC und 20 Prozent auf die SCC entfallen. Während die BCC ohne klinische in situ-Vorstufen entstehen, durchlaufen die SCC eine schrittweise Progression von der in situ-Stufe zum vollen Karzinom. Vor allem auf dem Boden von präinvasiven Vorstufen wie z.B. den aktinischen Keratosen entstehen auf der Haut Plattenepithelkarzinome. Auch wenn beide Hauttumorarten lokal destruierend wachsen, unterscheiden sie sich hinsichtlich ihrer Genese. Da Plattenepithelkarzinome metastasieren können, Basalzellkarzinome aber faktisch nicht, ist die Mortalitätsrate der BCC deutlich geringerer. Auch bei den SCC metastasieren durchschnittlich nur 5 Prozent aller Fälle, mit jedoch erheblichen Auswirkungen auf die Mortalität. Die 5-Jahres-Überlebensrate liegt dann bei 25 bis 50 Prozent (Breuninger et al. 2008), während sie ohne Metastasierung (abhängig vom Entstehungsort) deutlich höher ist. Die Metastasierung erfolgt dabei lymphogen und hämatogen abhängig von Lage und Invasionstiefe des Tumors. 2 1. Einleitung – Maligne epitheliale Tumoren Die Inzidenz der epithelialen Hauttumoren nimmt in der weißen Bevölkerung weltweit deutlich zu (Trakatelli et al. 2007). Angesichts der hohen Inzidenz und den hieraus resultierenden Behandlungskosten stellen sie für das Gesundheitssystem eine Herausforderung dar (Blaeser-Kiel 2008, Diepgen 2010). Gemäß den aktuellen Inzidenzzahlen des Krebsregisters Schleswig-Holstein aus dem Jahr 2007 und der auf der Berliner Hautkrebs-Screening-Pressekonferenz 2010 vorgestellten Hochrechnungen über die registrierten Hautkrebserkrankungen in der Bundesrepublik Deutschland treten aktuell insgesamt 170.888 epitheliale Neuerkrankungen pro Jahr auf (vgl. Tabelle 1). Die Inzidenz beträgt damit in Deutschland 209 Fälle pro 100.000 Einwohner (Katalinic 2010). In Ulm werden pro Jahr etwa 840 epitheliale Hauttumore bei ca. 420 Patienten behandelt. Da die Inzidenz im gesamten Einzugsgebiet des Ulmer Hauttumorzentrums (ca. 2,5 Mio. Menschen) 5.200 beträgt, werden hier etwa 8 Prozent aller Tumorfälle versorgt. Bei jedem der am HTZ versorgten Patienten werden durchschnittlich 2 Tumore therapiert. Tabelle 1: jährliche Hautkrebs-Inzidenz, Hochrechnungen für Deutschland (Katalinic 2010) Art Gesamt Männer Frauen Basalzellkarzinom 116.875 58.241 58.634 Spinozelluläres Karzinom Hautkrebs gesamt 54.013 27.651 26.362 170.888 85.892 84.996 Die Inzidenz des BCC nahm in den letzten Jahrzehnten nicht nur weltweit zu, sondern stieg besonders in den westlichen Industrienationen an, vermutlich da in jenen Ländern eine überdurchschnittlich hoher Bevölkerungsanteil an hellhäutigen Menschen anzutreffen ist (Brewster et al. 2007, Hoey et al. 2007). In Gebieten mit stärkerer Sonneneinstrahlung, wie z.B. in den USA, wird die Inzidenz in der weißen Population auf etwa 200 bis 400 Neuerkrankungen pro 100.000 Einwohner und Jahr geschätzt (Miller u. Weinstock 1994). Aufgrund von bevölkerungsbezogenen Studien wird die jährliche Neuerkrankungsrate pro 100.000 Einwohner in manchen Regionen Australiens auf bis zu 2.000 geschätzt (Diepgen u. Mahler 2002). 3 1. Einleitung – Maligne epitheliale Tumoren Im Durchschnitt werden die meisten Basalzellkarzinome im 60. Lebensjahr diagnostiziert. Aber in den letzten Jahren zeigt sich eine Tendenz zu einer früheren Manifestation. Gerade auch bei jungen Frauen zeichnet sich tendenziell ein immer größer werdendes Erkrankungsrisiko ab (de Vries et al. 2004). Das Plattenepithelkarzinom ist nach dem Basalzellkarzinom der zweithäufigste epitheliale Hauttumor. Die Prävalenz des Plattenepithelkarzinoms ist wie beim Basalzellkarzinom vor allem in der hellhäutigen Bevölkerung sehr hoch. Aufgrund einer signifikanten Korrelation zwischen dem Vorkommen eines Plattenepithelkarzinoms und dem Wohnort in Bezug auf den geographischen Breitengrad sind weltweit bei den Inzidenzraten der Plattenepithelkarzinome große Schwankungen festzustellen. Daher ist die Prävalenz des Plattenepithelkarzinoms vor allem in den Staaten hoch, die sich in der Nähe des Erdäquators befinden. Die Inzidenz steigt dort seit den 1960er Jahren kontinuierlich um 3 bis 8 Prozent pro Jahr an (Diepgen 2010a). Die altersadjustierte Inzidenz der SCC liegt in der weißen amerikanischen Bevölkerung jährlich bei 100 bis 150 Neuerkrankungen pro 100.000 Personen (Alam u. Ratner 2001). In Australien wird durch die äquatornahe Sonnenlicht-Exposition eine exorbitante Inzidenzrate von 1000 Neuerkrankungen pro 100.000 Einwohner angenommen (Buettner u. Raasch 1998; Staples et al. 2006). Im Gegensatz hierzu konnte in den nördlich vom Äquator liegenden Gegenden wie z.B. im Osten von Schottland eine deutliche geringere Inzidenz von 35 pro 100.000 Einwohner festgestellt werden (Brewster et al. 2007). In Deutschland betrug die Inzidenz gemäß den Untersuchungen des Berliner Hautkrebs-Screenings im Jahre 2010 bei rund 65 Fällen pro 100.000 Einwohner (Katalinic 2010). Plattenepithelkarzinome treten bei Männern zwei- bis fünfmal häufiger auf als bei Frauen, wie beim BCC sind v.a. hellhäutige Menschen betroffen (Terhorst 2005). Da das Durchschnittsalter der betroffenen Personen bei 70 Jahren liegt, ist eine deutliche Häufigkeitszunahme der Spinaliome mit steigendem Alter festzustellen. 90 Prozent aller diagnostizierten Plattenepithelkarzinome befinden sich im Gesichtsbereich (Breuninger et al. 2008). 4 1. Einleitung – Maligne epitheliale Tumoren 1.2 Pathogenese Bei der Entstehung von epithelialen Hauttumoren spielt vor allem die UV-LichtExposition eine Rolle. Untermauert wird dies durch die (im Vergleich zu Deutschland) 10mal höhere UV-Licht-Intensität, der die weiße australische Bevölkerung ausgesetzt ist (Diepgen u. Mahler 2002). Insbesondere der UVB-Anteil des Sonnenlichts ist für die Entstehung von tumorauslösenden DNA-Mutationen bedeutsam (Reifenberger u. Schön 2003, Hafner 2002; Bauer et al. 2011). Bezüglich der UV-Strahlung ist beim Plattenepithelkarzinom die kumulative Strahlungsdosis die Größe, welche für die Entstehung korrelativ verantwortlich zu sein scheint, während beim Basalzellkarzinom das Krankheitsrisiko bei intermittierender und intensiver UV-Exposition stärker ansteigt als bei kontinuierlicher UV-Exposition (Zanetti et al. 2006). Vor allem beim BCC spielt daher bei der pathologischen Entstehung vor allem die sporadische Sonnenexposition in der Kindheit/Jugend eine große Rolle (Diepgen 2010a; Kaufmann et al. 2010). Neben der UV-Strahlung sind chronische Entzündungen der Haut, Narben und epitheliale Hamartome wie Naevi sebacei mit ursächlich für die Entstehung von epithelialen Hauttumoren (Hamm et al. 2011; Wiedemeyer et al. 2008; Plötz el al. 2012). Durch eine langfristige medikamentöse Immunsuppression besteht ebenfalls ein erhöhtes Risiko auf der Epidermis neben anderen epithelialen Präkanzerosen und verschiedenen Hauttumoren auch Basalzellkarzinome entstehen zu lassen (Stockfleth 2009). Multiple Basalzellkarzinome können auch im Rahmen monogener Erbkrankheiten, wie dem autosomal-dominant erblichen nävoiden Basalzellkarzinomsyndrom (Gorlin-Goltz-Syndrom mit einem Defekt des DNA-Reparaturmechanismus) auftreten. Außerdem können genetische Erbkrankheiten wie z.B. Xeroderma pigmentosum oder Albinismus mit einem erhöhtem Risiko für die Entstehung von epithelialen Tumoren in Verbindung gebracht werden (Hauschild et al. 2008; Kaufmann et al. 2010; Reifenberger 2010). Aber auch chemische Karzinogene wie Arsen, Teer, Tabakrauch und Psoralen begünstigen die Entstehung von Basalzellkarzinomen. Weitaus seltener können epitheliale Hauttumoren nach jahrzehntelanger Latenz aufgrund ionisierender Strahlung entstehen. (Diepgen u. Mahler 2002; Moll 2010). Wurde ein Basalzellkarzinom diagnostiziert, besteht gegenüber der Normalbevöl- 5 1. Einleitung – Maligne epitheliale Tumoren kerung ein 10-fach höheres Risiko, an einem weiteren Basalzellkarzinom zu erkranken (Marcil u. Stern 2000). Die molekulare Pathogenese der Entstehung von SCC durch UV-Strahlung ist umfangreich charakterisiert worden. Innerhalb der Keratinozyten verursacht die UVStrahlung beim p53-Tumorsuppressorgen Mutationen, aus denen ein Funktionsverlust resultiert. Die induzierte Immunsuppression verhindert dabei die Reparatur dieser Schäden. Kommt es zu einer erneuten UV-Belastung, entsteht aus dem vorgeschädigtem Hautareal eine unkontrollierte Zellproliferation, die sich klinisch als in-situ-Karzinom manifestiert. Durch kontinuierliche Vermehrung der neoplastischen Keratinozyten kann letztendlich dann aus der in-situ-Läsion ein invasives Plattenepithelkarzinom entstehen (Alam u. Ratner 2001). Somit spielt die chronische Sonnenlicht-Exposition bei der Ätiopathogenese des spinozellulären Karzinoms die wichtigste Rolle unter den Einzelrisikofaktoren. Wie auch bei den BCC begünstigen des Weiteren die bekannten Noxen Arsen, Teerbestandteile, Mineralöle und ionisierende Strahlung die Entwicklung von SCC. Darüber hinaus wird die Gefahr einer Tumorentstehung durch die gleichzeitige Einwirkung gegenüber UV-Licht und Benzpyrenen wesentlich verstärkt. (Terhorst 2005, Diepgen 2010a). Menschen, die nach einer Organtransplantation oder durch eine maligne Erkrankung eine iatrogen verursachte, induzierte Immunsuppression erhalten, sind einer größeren Gefahr ausgesetzt, an einem Plattenepithelkarzinom zu erkranken (Breuninger et al. 2008). Auch zeichnet sich bei diesen Patienten ein deutlich aggressiverer, früher metastasierender Krankheitsverlauf ab (Rassner 2008a). Weiterhin besteht eine Assoziation zwischen Plattenepithelkarzinomen und verschiedenen humanen Papilloma-Viren (St Guily et al. 2011). Humane Papilloma-Viren, insbesondere Typ 16 und 18 sind neben dem Zervix-Karzinom auch mit der Entstehung von SCC assoziiert (Kempf 2008). 6 1. Einleitung – Maligne epitheliale Tumoren 1.3 Klinik, Histologie und Therapie 1.3.1 Basalzellkarzinom 1.3.1.1 klinisches Bild und Histologie Die stark sonnenexponierten Körperregionen sind charakteristischerweise die Prädilektionsstellen eines Basalzellkarzinoms. Am häufigsten tritt der maligne epitheliale Hauttumor in 80 Prozent der Fälle am Kopf und Hals auf, gefolgt vom Rumpf (15 Prozent), Armen und Beinen (5 Prozent). Auch an ungewöhnlichen Lokalisationsstellen wie z.B. den Achselhöhlen, den Genitalien, den Handflächen und den Fußsohlen treten Basalzellkarzinome klinisch in Erscheinung. Studien belegen, dass vor allem an Körperstellen, die nicht chronisch dem Sonnenlicht ausgesetzt sind, die Inzidenz der Basalzellkarzinome rasant zunimmt (de Vries et al. 2004, Ruben et al. 2005). Der noduläre Typ eines Basalzellkarzinoms ist die klassische Variante, die sich klinisch am häufigsten präsentiert. Diese perlmutartigen Papeln mit überlagernden Teleangiektasien bilden einen scharfen Randsaum, welcher eine krustenartige oder auch ulzerierende Fläche begrenzt. Die Oberfläche eines superfiziellen Basalioms erscheint dagegen als ein schuppiger erythematöser Fleck oder als Plaque. Basalzellkarzinome können Melanin enthalten, was die Tumore entsprechend pigmentiert erscheinen lässt. Das sklerodermiforme, fibrosierende oder auch infiltrative Basalzellkarzinom zeichnet sich durch weißliche narbenähnliche Plaques mit unscharfen Rändern aus, die meist schwer abzugrenzen sind. Sklerodermiforme Basalkarzinome sind bei Diagnose klinisch zumeist weit fortgeschritten (Rubin et al. 2005). Mit Ulzerationen und Erosionen präsentieren sich makroskopisch fortgeschrittene Basaliome, welche durch ihr destruktives Wachstum tieferliegende knorpelige und knöcherne Strukturen zerstören können. Da Basaliome lokal infiltrieren und fast nie eine Metastasierungspotenz besitzen, werden sie den semimaligen Tumoren der Haut zugeordnet. Weltweit sind nur 300 Metastasierungsfälle bekannt. Die Metastasen treten bevorzugt bei Primärtumoren im Gesicht oder im Ohrbereich auf (Snow et al. 1994). Aufgrund mehrerer unterschiedlicher Differenzierungsmuster bei der Entstehung eines Basalzellkarzinoms werden die spezifischen histologischen Subtypisierungen in der WHO wie folgt klassifiziert (Heenan et al. 1996): 7 1. Einleitung – Maligne epitheliale Tumoren - noduläres Basalzellkarzinom (Subtypen: solid, zystisch, adenoid) - multifokales superfizielles Basalzellkarzinom (Rumpfhauttyp) - infiltratives Basalzellkarzinom (Subtypen: morpheaartig, sklerosierend, nicht sklerosierend, desmoplastisch) - pigmentiertes Basalzellkarzinom - fibroepitheliales Basalzellkarzinom - Basalzellkarzinom mit adnexoider Differenzierung (Subtypen: follikulär, ekkrin) - keratotisches Basalzellkarzinom - Basalzellkarzinom beim Basalzellnävussyndrom (Gorlin-Goltz-Syndrom) - mikronoduläres Basalzellkarzinom Untereinander sind die einzelnen Subtypen häufig als Mischformen anzutreffen (Sexton et al. 1990), können aber auch mit einem Plattenepithelkarzinom zu einem sogenannten Kollisionstumor verschmelzen (Breuninger et al. 2005a). Erst durch eine feingewebliche Untersuchung kann in den meisten Fällen die Diagnose gesichert werden. Liegt aufgrund des morphologischen Variantenreichtums eine schwierige Abgrenzung des Tumors vor, so ist eine immunhistologische Färbung hilfreich, da die basalen Zellen der Epidermisschicht auf ihrem Zytoskelett die Zytokeratine CK5 und CK14 exprimiert haben (Kaufmann et al. 2010). Klar unterschieden werden können die BCC und SCC dabei durch den Tumorzellmarker Ber-EP 4 (Beer et al. 2000). Histogenetisch stammen die Basalzellkarzinome von den Zellen der Basalzellschicht oder der äußeren Wurzelscheide der Haarfollikel ab. Die basaloid differenzierten Zellverbände enthalten chromatindichte Kerne, die von dermalem Stroma umgeben sind. Ein artifizieller Retraktionspalt zwischen dem Stroma und dem neoplatischen Epithel ist für ein Basalzellkarzinom mikroskopisch charakterisierend. Beim nodulären Typ ist im peripheren Bereich eine palisadenförmige Anordnung der Tumorzellen anzutreffen, während sich bei einem sklerodermiformen Basalzellkarzinom histologisch eine Proliferation von schmalen Tumorzellsträngen zeigt, die von einem dichten, fibroblastenreichen Stroma umgeben ist. In den Tumorzellen und dem Stroma des pigmentierten Basalioms sind Melanineinlagerungen erkennbar (Breuninger et al. 2008; Rassner 2008b; Brill u. Kaufmann 2010). 8 1. Einleitung – Maligne epitheliale Tumoren 1.3.1.2 Sonderformen des Basalzellkarzinoms Zu den Sonderformen gehören die vor allem bei den älteren Patienten auftretenden fibroepitheliomatösen Tumoren (Pinkus-Tumor) und das infundibulozystische Basalzellkarzinom. Zu den beiden oben erwähnten Sonderformen zählt auch das metatypische Basalzellkarzinom. Dieser entdifferenzierte Tumor besitzt ein aggressives Wachstum mit der Fähigkeit zur Metastasierung. Üblicherweise sind solche speziellen Typisierungen ebenfalls erst durch eine feingewebliche Untersuchung festzustellen. 1.3.1.3 Diagnose und Differenzialdiagnosen In der Regel wird die Verdachtsdiagnose eines Basalzellkarzinoms klinisch gestellt. Aufgrund des morphologischen Variantenreichtums ist die klinische Differenzialdiagnose des BCC mannigfaltig. Tabelle 2 gibt einen Überblick über die häufigsten Differenzialdiagnosen eines Basalzellkarzinoms. Tabelle 2: Differenzialdiagnosen eines Basalzellkarzinoms der Haut, aufgeteilt nach benignen, malignen und präkanzerösen dermalen Veränderungen (nach Breuninger 2010a) Benigne Neoplasien Talgdrüsenhyperplasie Kleine Zyste Dermaler Nävuszellnävus Fibrom Lokales entzündliches Infiltrat Maligne Neoplasien Plattenepithelkarzinom Melanom Merkel-Zell-Karzinom Lymphom Hautmetastase innerer Tumoren Präkanzerosen Morbus Bowen Aktinische Keratose Psoriasis (beim superfiziellen Typ) Mykose (beim superfiziellen Typ) Weil Basalzellkarzinome in der Praxis oft verschiedenen anderen (gutartigen) Dermatosen ähneln (z.B. Psoriasis, wie in Tabelle 2 dargestellt), werden sie klinisch manchmal nicht früh genug erkannt, sondern erst dann, wenn charakteristische morphologische Veränderungen auftreten. Daher ist bei Verdacht eine frühe Sicherung der Diagnose immer anzustreben. Die als häufigste in Erwägung gezogene Differenzialdiagnose bei den malignen Hautveränderungen, vor allem beim knotig-ulzerierten Basalzellkarzinom, ist das 9 1. Einleitung – Maligne epitheliale Tumoren Plattenepithelkarzinom. Das sklerodermiforme Basalzellkarzinom stellt die größte diagnostische Herausforderung dar, da es erst im späten Stadium von narbigen Läsionen und von der Sklerodermie differentialdiagnostisch unterschieden werden kann. Beim klinischen Anhalt für eine tiefe Infiltration eines destruierenden Basalzellkarzinoms oder durch eine sehr selten vorkommende Metastasierung können zur weiteren Ausbreitungsdiagnostik bildgebende Verfahren wie Computeroder Magnetresonanztomografie notwendig werden (Rassner 2008b; Breuninger 2010a; Brill u. Kaufmann 2010; Kaufmann et al. 2010). 1.3.2 Plattenepithelkarzinom 1.3.2.1 klinisches Bild und Histologie Plattenepithelkarzinome entstehen auf dem Boden von in-situ-Karzinomen, wie aktinischen Keratosen oder Morbus Bowen, sowie auf alten Narben, Radiodermen und lange bestehenden Ulzera. Letztlich bestimmen diese Faktoren dann das klinische Erscheinungsbild der spinozellulären Karzinome. Die Haut trägt meist einen verrukösen oder papillomatösen Tumor mit einer Hornauflagerung oder mit einer eingesunkenen Ulzeration. Beim Plattenepithelkarzinom besteht eine histologische Veränderung der normal geschichteten Architektur der Epidermis, weiterhin ist die Entwicklung zellulärer Atypien charakteristisch. Bleibt die intraepitheliale Neoplasie in diesem herdförmigen Stadium und wird die Basalmembran nicht durchbrochen, liegt ein Carcinoma in-situ (CIS) im nicht-invasiven Stadium vor. Verändert sich bei diesem CIS die gesamte Epidermis, wird das Stadium als Morbus Bowen bezeichnet. Wird dann im Weiteren die Basalmembran durchbrochen, ist ein frühinvasives Karzinom entstanden. Kommt es zu einer weiteren neoplastischen Progression, resultiert letztendlich ein invasives Plattenepithelkarzinom. Beim SCC findet in der Dermis wie bei der natürlichen Zelldifferenzierung ein Verhornungsprozess statt, bei dem sich sogenannte Hornperlen bilden. Histopathologisch finden sich in den neoplastischen Zellen ausgeprägte Zellpleomorphien, Hyperchromasien sowie Mitosen, in der Umgebung des Karzinoms ist darüber hinaus ein lymphozytäres und plasmazellreiches Infiltrat erkennbar (Breuninger et al. 2008; Rassner 2008a; Brill u. Kaufmann 2010; Diepgen et al. 2010b). 10 1. Einleitung – Maligne epitheliale Tumoren 1.3.2.2 Diagnose, Stadieneinteilung und Differenzialdiagnosen Die Vorgehensweise der klinischen Diagnostik entspricht weitgehend derjenigen des Basalzellkarzinoms. Auch hier ist eine vollständige Anamnese und körperliche Untersuchung unabdingbar. In der Regel ist immer eine histopathologische Sicherung notwendig, da klinisch keine sichere Differenzierung zwischen in-situKarzinomen und frühinvasiven spinozellulären Karzinomen möglich ist (Böer u. Steinkraus 2010). Da das Plattenepithelkarzinom ein Metastasierungsrisiko besitzt, sollte die klinische Untersuchung die Palpation des lokalen Lymphstromgebiets beinhalten (Alam u. Ratner 2001). Ab einer histologischen Tumordichte von vertikal > 2mm ist eine Lymphknotensonographie zur Erfassung einer Lymphknotenmetastasierung empfehlenswert. Liegt eine destruierende und infiltrierende Variante vor, ist eine apparative Diagnostik mit CT oder MRT, sowie bei Verdacht auf Fernmetastasierung eine organspezifische Untersuchung zusätzlich notwendig (Breuninger et al. 2008; Arbeitskreis Dermatologie). Zur Klassifikation des Plattenepithelkarzinoms hat sich das in Tabelle 3 dargestellte TNM-System etabliert. Tabelle 3: TNM-Klassifikation für das Plattenepithelkarzinom der Haut (Wittekind et al. 2002) TNMKlassifikation Tx T0 Tis T1 T2 T3 T4 NX N0 N1 MX M0 M1 Tumormerkmale Es kann keine Aussage zur Ausdehnung des Primärtumors getroffen werden Kein Anhalt für Primärtumor Carcinoma in situ Tumor ist seiner größter Ausdehnung ≤2cm Tumor ist größer als >2 cm, aber nicht mehr als ≤5 cm in größter Ausdehnung Tumor ist größer als >5cm in seiner größten Ausdehnung Tumor infiltriert extradermale Strukturen Regionäre Lymphknoten sind nicht beurteilbar Keine regionären Lymphknotenmetastasen Regionäre Lymphknotenmetastasen Vorliegen von Fernmetastasen können nicht beurteilt werden Keine Fernmetastasen Fernmetastasen 11 1. Einleitung – Maligne epitheliale Tumoren Da das TNM-System für Plattenepithelkarzinome nur einen ungefähren Anhaltspunkt für das Risiko einer Metastasierung widerspiegelt, ist diese rein klinisch konzeptierte Klassifikation durch zusätzliche histopathologische Parameter ergänzt worden. Mit Hilfe der histopathologischen Aufbereitung werden die Parameter postoperativ nach der pTNM-Kategorie eingestuft. Ausgehend vom TNM-System wurde 2002 die klinische UICC-Stadieneinteilung konzipiert. (Wittekind et al. 2002, Breuninger et al. 2005a, Breuninger 2010b, Petter und Haustein 2001). Tabelle 4: UICC-Stadieneinteilung von Plattenepithelkarzinomen (Wittekind et al. 2002) (Tis= Carcinoma in situ; T1=Tumor ≤2cm; T2= 2cm <Tumor≤5cm; T3= Tumor >5cm; T4= Tumor infiltriert extradermale Strukturen; N0= keine Lymphknotenmetastasen; N1= Lymphknotenmetastasen; M0= keine Fernmetastasen; M1= Fernmetastasen) Stadium Primärtumor Lymphknoten Fernmetastasen 0 Tis N0 M0 I T1 N0 M0 II T2 N0 M0 T3 N0 M0 T4 N0 M0 Jedes T N1 M0 Jedes T Jedes N M1 III IV Bei der UICC-Stadieneinteilung (vgl. Tabelle 4) werden die Stadien der TNMKlassifikation zu fünf Subgruppen zusammengefasst. Für die behandelnden Ärzte ist die UICC-Einteilung von Vorteil, da sich prägnant alle signifikanten Merkmale der SCC-Klassifikation berücksichtigen und gewichtet darstellen lassen. So werden z.B. Fälle mit diagnostizierten Fernmetastasen (als M1 definiert) unabhängig vom Stadium des Haupttumors dem schwersten Stadium IV zugeordnet. Zur Einschätzung des Metastasierungsrisikos ist die Tumordicke von Relevanz. 12 1. Einleitung – Maligne epitheliale Tumoren Wie in Tabelle 5 dargestellt, metastasieren Neoplasien, die eine Tumordicke von weniger als zwei Millimetern aufweisen, in der Regel nicht. Das Risiko steigt mit zunehmender Tumordicke. Übersteigt diese eine histologische Tumordichte von vertikal sechs Millimetern, besteht ein Metastasierungsrisiko von 16 Prozent (Brantsch et al. 2008). Tabelle 5: Korrelation der Tumordicke mit dem Metastasierungsrisiko bei Hautkrebs (Brantsch et al. 2008) Risiko Seltenes Risiko Geringeres Risiko Hohes Risiko Tumordicke (mm) <2 2- 6 >6 Metastasierungsrisiko (%) 0 4 16 Festzuhalten bleibt, dass aktuell eine Klassifizierungsvielfalt zur Einteilung der SCC-Subgruppen besteht. Das TNM-System stellt dabei die formelle Tumorklassifikation dar. Beim für den Praxisalltag besser geeigneten UICC-System erfolgt die Klassifizierung anhand von klinischen Stadien. 1.3.3 Therapieansätze bei epithelialen Hauttumoren (BCC und SCC) Das Therapieziel bei der Behandlung von epithelialen Hauttumoren ist die Heilung durch eine vollständige Tumorentfernung mit anschließender Rehabilitation unter Berücksichtigung der Erhaltung der Körperfunktion und Ästhetik des Patienten (Rubin 2005). Bei Basalzellkarzinomen und Plattenepithelkarzinomen existiert eine Vielzahl von verschiedenen chirurgischen und nicht-chirurgischen Therapieansätzen. Klinisch richtet sich das therapeutische Vorgehen nach dem histologischen Subtyp. Auch die Größe des Tumors sowie die Lokalisation spielen bei der Wahl des geeigneten Therapiekonzepts eine wichtige Rolle. Da viele Patienten neben der eigentlichen Tumorerkrankung als multimorbid eingestuft werden müssen (z.B. Bluthochdruck, Diabetes mellitus oder zurückliegender Myokardinfarkt), muss die Befindlichkeit des Patienten bei der Therapiewahl berücksichtigt werden (Barbezat et al. 2008). Die Standardtherapie der epithelialen Neoplasien ist die schnittrandkontrollierte Chirurgie mit dem Ziel, den Tumor „im Gesunden“ vollständig zu entfernen (Rassner 2008b). Durch die Technik wird gegenüber einer Exzision mit herkömmlicher 13 1. Einleitung – Maligne epitheliale Tumoren Histologie in rund 90 Prozent der Fälle eine dauerhafte Heilung erzielt (Rowe et al. 1992), während die Heilungsrate bei der konventionellen Chirurgie deutlich geringer ist (Häfner et al. 2013). Besonders bei komplexeren und rezidiv-gefährdeten Neoplasien ist diese chirurgische Vorgehensweise aufgrund der größeren Heilungschance unverzichtbar (Boulinguez et al. 2004). Kleinflächige Basalzellkarzinome und Plattenepithelkarzinome, die klinisch eine histologische Tumordichte von vertikal weniger als ein Millimeter aufweisen und dadurch ein geringeres Metastasierungsrisiko besitzen, können mit Elektrodesikkation, Kürettage, Exzision oder durch die Kryochirurgie entfernt werden (Johnson et al. 1992, Adam et al. 2005). Kurative nicht-chirurgische Ansätze beinhalten Strahlentherapie sowie topische und photodynamische Therapieformen. Die Strahlentherapie ist eine wichtige Alternativtherapie für Patienten besonders bei primärer Inoperabilität sowie bei Tumoren, die aufgrund ihrer Lokalisation schwer chirurgisch zu behandeln sind. Postoperativ kann die Strahlentherapie ebenfalls bei einer makroskopischen R2Resektion oder einer mikroskopischen R1-Resektion eine adjuvante Therapieoption darstellen (Adam et al. 2005, Breuninger 2010b). Eine weitere Therapiemöglichkeit ist die Kryochirurgie. Diese Methode ist bei einer Feldkanzerisierung, bei frühinvasiven Tumoren sowie als palliativer Therapieansatz bei inoperablen und multimorbiden Patienten erfolgreich einsetzbar, jedoch ist die Anwendung bei tief destruierenden und schwierig abgrenzbaren Tumoren nicht geeignet (Karrer 2010). Die Heilungsrate der Kryochirurgie liegt bei 78 Prozent (Sebastian und Stein 1997), wobei vor allem zur Behandlung solitärer Basalzellkarzinome genügend Daten vorhanden sind, während bisher kaum Erfahrungen bei der Behandlung von invasiven Plattenepithelkarzinomen bestehen (DDG 2008). Im Gegensatz hierzu erzielt die photodynamische Therapie (PDT) mit Methy-5Aminolävulinsäure beim oberflächigen und nodulären Basalzellkarzinom mit 91 Prozent einen hohen Behandlungserfolg. Auch die kosmetischen Ergebnisse der PDT sind gut (Rhodes et al. 2004), allerdings ist die PDT zur Behandlung des Plattenepithelkarzinoms in Deutschland nicht zugelassen (Babilas et al. 2005). Durch die photodynamische Reaktion ist nur eine begrenzte Eindringungstiefe von zwei bis drei Millimetern möglich, dementsprechend können tief invasiv wachsen- 14 1. Einleitung – Maligne epitheliale Tumoren de epitheliale Hauttumoren nicht ausreichend therapiert werden. Deshalb weist dieses Verfahren eine hohe Rezidivrate bei Plattenepithelkarzinomen auf (Adam et al. 2005, Karrer 2010). Seit 2012 besteht darüber hinaus die Möglichkeit, inoperable BCC mittels oral verabreichter zielgerichteter Therapie (über den HedgehogPathway-Hemmer Vismodegib) zu behandeln (Sekulic et al. 2012). Für die Versorgung von kleinen, oberflächlichen Basaliomen wird außerdem auch der Arzneistoff Imiquimod verwendet, der bei Auftragung auf die Haut die Krebszellen nicht zerstört, sondern das Immunsystem aktiviert (Plötz et al. 2012). Festzuhalten bleibt, dass chirurgische Maßnahmen anderen Therapieansätzen primär vorzuziehen sind. Nur bei primärer Inoperabilität oder bei Vorliegen einer Feldkanzerose mit multiplem Nebeneinander machen Kombinationen aus verschiedenen Therapien Sinn. Die PDT ist nur zur Behandlung von BCC zugelassen. 1.3.4 Nachsorge von epithelialen Hauttumoren Die Plattenepithel- und Basalzellkarzinome besitzen durch das breitgefächerte und moderne Behandlungsfeld eine hohe Heilungschance (Alam u. Ratner 2001, Adam et al. 2005). Trotzdem ist eine Tumornachsorge vonnöten. Nach der Behandlung des ersten Tumors besteht ein 30 %iges Risiko für ein Zweitkarzinom innerhalb der ersten fünf Jahre (Frankel et al. 1992). Mit zunehmender Größe steigt das Risiko einer Metastasierung um das Dreifache an (Rowe et al. 1992) und die Langzeitprognose verschlechtert sich (Kwa et al. 1992). Aus diesem Grund ist eine engmaschige Nachsorgeuntersuchung mit einer klinischen Untersuchung alle drei Monate in den ersten drei Jahren indiziert (Guther 2011). Im Anschluss an das dritte Jahr ist eine halbjährliche Kontroll-Untersuchung bis zum fünften Jahr ausreichend (Glover et al. 1994, Hein 2010). 15 1. Einleitung – Maligne epitheliale Tumoren 1.4 Versorgungsstruktur der Hauttumore in Süddeutschland 1.4.1 strukturelle Aspekte der Patientenversorgung Das Erreichen einer optimalen Versorgungsqualität von epithelialen Hauttumoren ist nicht nur aus der Patientenperspektive von Relevanz, sondern auch aus Sicht des Gesundheitssystems anzustreben. Auch in Deutschland hat sich die Maxime der Evidenzbasierten Medizin (EbM) durchgesetzt, ebenso kann sich die Versorgungsforschung immer stärker etablieren. Mittels der EbM sollen die individuellen ärztlichen Behandlungsentscheidungen auf eine wissenschaftliche Grundlage gestellt werden, da zwischen den Erkenntnissen der medizinischen Wissenschaft und der Anwendung des Wissens oft eine erhebliche Kluft besteht, die u.a. aus der Menge des in den unterschiedlichen Fachgebieten zur Verfügung stehenden Wissens resultiert (Sackett et al. 1997). Der Fokus der Versorgungsforschung liegt auf der Patientenorientierung und der Vermeidung von Über-, Unter- und Fehlversorgung, wobei ein (zusätzlicher) Nutzen (Effectiveness) wichtiger als die bloße Wirksamkeit (Efficacy) ist. Während die EbM bestrebt ist, Wirksamkeit unter Studienbedingungen nachzuweisen, versucht die Versorgungsforschung, den Nutzen in patientenorientierter Perspektive unter Alltagsbedingungen zu evaluieren (Glaeske 2012; Pfaff 2003). Im Kontext der Evidenzbasierten Medizin und der Versorgungsforschung wird auch zunehmend die Versorgung von Patienten mit epithelialen Hauttumoren organisiert, die einerseits den Patienten einen möglichst hohen Nutzen bringen und andererseits aus Sicht des Gesundheitssystems durch die Vermeidung von Fehlbehandlung gleichzeitig Kosten einsparen soll. Um die Versorgung von Krebspatienten zu verbessern, wurde von der Bundesregierung 2008 der Nationale Krebsplan initiiert, dessen Schwerpunkte auf vier Handlungsfeldern liegen (BMG 2012): 1. Weiterentwicklung der Krebsfrüherkennung 2. Weiterentwicklung der onkologischen Versorgungsstrukturen und der Qualitätssicherung 3. Sicherstellung einer effizienten onkologischen Behandlung (Schwerpunkt zunächst auf onkologischer Arzneimitteltherapie) 4. Stärkung der Patientenorientierung. 16 1. Einleitung – Maligne epitheliale Tumoren Zur Umsetzung der Handlungsfelder wurden u.a. onkologische Zentren geschaffen, um die Versorgungsqualität zu verbessern, eine einheitliche evidenzbasierte Versorgung zu gewährleisten und patientenorientierte Behandlungsansätze durchzusetzen. Im südwestdeutschen Raum befinden sich aktuell vier zertifizierte Hautkrebszentren, die auf die Versorgung und Behandlung u.a. der epithelialen Hauttumoren spezialisiert sind und den Südwesten und Osten von BadenWürttemberg und Schwaben versorgen: - Zentrum für Dermatoonkologie in Tübingen - Hauttumorzentrum Ulm - Hauttumorzentrum Klinikum Augsburg - Hauttumorzentrum Universitätsklinikum Freiburg Die vier Zentren versorgen dabei jeweils ihren eigenen Sektor. 1.4.2 epitheliale Hauttumore am Krebszentrum Ulm Das Hauttumorzentrum Ulm (HTZ) gehört zur Universitätsklinik für Dermatologie und Allergologie und stellt eine Säule des interdisziplinären Tumorzentrums Ulm (CCCU) dar. Das HTZ Ulm wurde 2010 neu gegründet. Das Einzugsgebiet des Hauttumorzentrums Ulm ist groß, da der beidseitige Grenzbereich von Baden-Württemberg und Bayern zwischen Schwäbisch Hall und Lindau am Bodensee mit abgedeckt wird. Die Bevölkerungszahl des Einzugsgebietes beträgt ca. 2,5 Millionen (Universitätsklinikum Ulm 2014). Pro Jahr werden am HTZ in Ulm ca. 420 epitheliale Hauttumoren (C44.x), 144 Primärfälle mit malignem Melanom (C43.x) und 15 Fälle mit bösartigen Neubildungen im sonstigen Bindegewebe und anderen Weichteilgewebepartien (C49.x), sowie eine große Anzahl von in-situ-Tumoren versorgt. Pro Jahr werden im HTZ damit ca. 800 Hauttumorfälle behandelt. 17 1. Einleitung – Maligne epitheliale Tumoren 1.5 Fragestellung Ziel dieser Querschnittstudie im Rahmen der Versorgungsforschung ist es, anhand eines Patientenjahrgangs das klinische Management und damit die Versorgungsqualität von epithelialen Hauttumoren im Hauttumorzentrum Ulm (HTZ) zu analysieren. Durch die retrospektive Studie des Patientenjahrganges 2010 sollen versorgungsrelevante Kenngrößen herausgearbeitet werden. Die gewonnenen Daten dienen damit der Verbesserung der Qualität der klinischen Betreuung im Hauttumorzentrum Ulm in Hinblick auf die operative und konservative Behandlung, das Management der Komplikationen im klinischen Alltag und die Abwicklung der Nachsorgeuntersuchungen. Mithilfe dieser Resultate kann die Strategie für das HTZ Ulm organisatorisch weiterentwickelt werden, um bei rasant steigender Zunahme der epithelialen Hauttumore im Kontext des demographischen Wandels dem klinischen Versorgungsauftrag effektiv und kostengerecht weiter nachkommen zu können. Konkret sollen mit den in dieser Studie erhobenen Daten folgende Fragen beantwortet werden: 1. Welche epidemiologischen Besonderheiten zeigte das behandelte Patientenkollektiv des HTZ Ulm im Jahre 2010? 2. Welches Expositionsverhalten bezüglich bekannter Risikofaktoren zeigte das Patientenkollektiv des HTZ, v.a. in Bezug auf die UV-Exposition? Wie hoch war die Compliance der Patienten mit den therapeutischen Maßnahmen insbesondere in Bezug auf die bekannten Risikofaktoren? 3. Welche topographischen Besonderheiten ergaben sich hinsichtlich der epithelialen Hauttumoren? 4. Welche Therapieansätze wurden verwendet? Was ergab die die Analyse der operativen Versorgung? 5. Wie hoch war die Komplikationsrate während der Therapie und welche Komplikationen traten auf? 6. Welche Aussagen lassen sich bezüglich der Patientenzufriedenheit treffen? 18 2. Material und Methoden 2. Material und Methoden 2.1 Studiendesign und Patienteneinteilung Um die Fragestellungen beantworten zu können, wurde ein retrospektives Querschnittskonzept gewählt und ein Fragebogen generiert, der an alle Patienten der Fallgruppe versandt wurde. Die rücklaufenden Fragebögen konnten anschließend analysiert werden. Das Studiendesign wurde im Vorfeld durch die Ethikkommission der Universität Ulm mit positivem Votum geprüft. Entsprechend der beratenden Funktion der Ethikkommission haben berufsethische und berufsrechtliche Beurteilungen über die Patientenaufklärung, aber auch Bewertungen über die Ausfertigung des Fragebogens stattgefunden. Die Hinweise der Kommission wurden beachtet und umgesetzt. Für den Datensatz wurden sämtliche Patientenfälle ausgewählt, die im Jahr 2010 im Hauttumorzentrum Ulm wegen der Erkrankung eines epithelialen Hauttumors behandelt wurden. Für den Querschnitt wurden nur die Patientenfälle berücksichtigt, bei denen die Diagnose histologisch gesichert wurde. Insgesamt wurden in die Studie 416 Patienten eingeschlossen, davon 189 Frauen und 227 Männer. Da 49,8 Prozent der Patienten unter mehreren Tumoren litten, ergab sich aus diesem Kollektiv eine Gesamtzahl von n=835, die am HTZ 2010 versorgt wurden. Diese 835 Tumorfälle wurden insgesamt 486 Behandlungsfällen zugeteilt. In knapp 2/3 der Fälle wurde die histologische Sicherung innerhalb der Universitätsklinik Ulm festgestellt, 1/3 der Patienten kam mit auswärts gestellter Diagnose (vgl. Abbildung 1). Tumorsicherung PE 152; 31% im Haus Auswärts 333; 69% Abbildung 1: Tumorsicherung im Kollektiv: Ort der Probenentnahme (PE) und der Histologische Sicherung, n=486 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 19 2. Material und Methoden 2.2 Datenrecherche Alle Fälle mit histopathologisch gesicherten epithelialen Hauttumoren sind im HTZ Ulm nach der international gültigen ICD-Einteilung (International Classification of Diseases, 10. Revision) mit C.44x erfasst worden. Mithilfe einer Diagnosesuche wurden aus dem SAP-Software-System des Klinikums sämtliche C44.0 bis C44.9 codierten Tumorfälle, die im Verlauf des Jahres 2010 codiert wurden, festgestellt. Mithilfe der Patienten-Identifikationsnummern konnten daraufhin die persönlichen Daten sowie der Aufenthaltszeitraum der Patienten ermittelt werden. Anhand der Patientenakten und der Arztbriefe wurden dann alle klinisch relevanten Daten in eine Tumordatenbank eingepflegt. Parallel dazu wurde ein spezieller Patienten-Fragebogen entwickelt, der Aufschluss über die fehlenden relevanten Informationen zur Krankheitsgeschichte liefern sollte. Durch die Krankenakte konnte die Postanschrift der jeweiligen behandelten Patienten ausfindig gemacht werden. Zweck des Fragebogens war es, die variablen Risikofaktoren wie Sonnenexposition, berufliche Risikofaktoren und Patientenzufriedenheit abzufragen. Zusätzlich zum entwickelten Fragebogen wurden ein Aufklärungsbogen sowie eine Einwilligungserklärung zur Verwendung der anonymisierten Daten an die betreffenden Patienten verschickt. Für die Fragebogenanalyse wurden in der Studie ausschließlich die Patienten berücksichtigt, die entweder durch den postalischen Fragebogen oder bei ihrer ambulanten Erstuntersuchung eine signierte Einwilligungserklärung abgegeben haben. Zahlreiche Patienten, die unklare Angaben auf dem Fragebogen abgegeben hatten, wurden zusätzlich telefonisch kontaktiert, um eine Klärung der Sachverhalte zu erreichen. Der Fragebogenrücklauf lag bei 49,5 Prozent, da n=206 der 416 befragten Hauttumorpatienten des Jahrgangs 2010 eine Rückmeldung gaben und Daten lieferten. 20 2. Material und Methoden 2.3 Recherche im EDV-System des Klinikums Das Universitätsklinikum Ulm verwendet als Krankenhausinformationssystem die SAP Health Care Software mit den Komponenten ISH Med. Release 604, Level 19. Um die Daten der Patienten für die Studie zu ermitteln, konnte mit Hilfe dieser Software eine Aufstellung erstellt werden, die eine zeitliche chronologische Reihenfolge der behandelten Hauttumorfälle im Jahr 2010 beinhaltete. Durch eine im Vorfeld klar definierte festgelegte Datenmaske sowie durch einen Definitionenkatalog konnten die Daten dementsprechend zu jedem Parameter genormt werden. Mit den SAP-erstellten Patientendaten konnte eine Excel-Datenbank generiert werden, die mit Hilfe der Patientenakten manuell ausgefüllt wurde. Die Datenauswertung und die graphische Aufarbeitung erfolgte mit Excel und Adobe Illustrator CS 5. Die statistische Analyse wurde mit dem Programm MEDAS unter Hinzuziehung des Instituts für Epidemiologie und Medizinische Biometrie am Universitätsklinikum Ulm durchgeführt. Die Datenmaske und der Definitionskatalog befinden sich im Anhang. Ebenso befindet sich im Anhang der versandte Fragebogen. 2.4 Datenauswertung und statistische Analyse Die statistische Analyse erfolgte in Excel 2010, nachdem alle für die Leitfragen relevanten Daten anonymisiert übertragen wurden. In Excel wurden auch sämtliche Abbildungen erstellt, welche aus der Häufigkeitsanalyse resultierten. Zur Beschreibung der Ergebnisse dieser retrospektiven, deskriptiv projektierten Studie wurden Prozentsätze der Patientenzahlen berechnet. Für kontinuierliche Parameter (Patientenalter, BMI oder Latenzzeit) wurden jeweils die Mittelwerte mit Standardabweichung ermittelt und aufgrund fehlender Normalverteilung die Konfidenzintervalle angegeben, mittels der die Güte eines Schätzwertes beurteilt werden kann. 21 3. Ergebnisse 3. Ergebnisse 3.1 Absolute Tumorfallzahlen des Kollektivs Im Rahmen der Recherche dieser Studie konnte ermittelt werden, dass in 2010 835 epitheliale Hauttumore im HTZ versorgt wurden, die sich auf insgesamt 416 Patienten verteilten. Wie in Abbildung 2 ersichtlich, sind 277 neue Patienten (= 67 Prozent des Gesamtkollektivs) im Jahre 2010 mit einem Tumor registriert worden, 139 waren Nachsorgepatienten. Abbildung 2 zeigt die Aufteilung des Gesamtkollektivs in Nachsorgepatienten und Primärfälle. HTZ-Patientenkontingent im Jahre 2010 139; 33% Nachsorgepatient Patient mit neuem Tumor 277; 67% Abbildung 2: Aufteilung der Patienten nach Primärfall und Nachsorge, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Bei zahlreichen Patienten wurden gleichzeitig mehrere maligne Neuerscheinungen diagnostiziert, die damit unter den Begriff der Feldkanzerose fallen. Von den 416 Patienten des Gesamtkollektivs wurden bei insgesamt 170 Feldkanzerisierungen identifiziert, die mit mehreren C.44-Codes deklariert wurden (Abbildung 3). 22 3. Ergebnisse Feldkanzerierungsrate 170; 41% Patienten mit Feldkanzerierung 246; 59% Patienten ohne Feldkanzerierung Abbildung 3: Feldkanzerierungsrate im Gesamtkollektiv, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Neben 67 Tumoren, die im Rahmen von Nachsorgeuntersuchungen bei 46 Patienten neu entdeckt werden konnten, wurden bei den 277 neuen Patienten insgesamt 413 epitheliale Hauttumore identifiziert. Die Gesamtzahl der 2010 neu entdeckten Tumore lag damit bei 480 Primärfällen (PF). Bei den n=139 Nachsorgepatienten betrug die Anzahl der zu kontrollierenden Neoplasien insgesamt 422. Damit waren 84 Prozent (n=355) bei n=93 Patienten postoperativ in der Nachsorgeuntersuchung ohne Befund, bei den übrigen 16 Prozent (n=67) wurde ein pathologische Hautveränderung an einer anderen Stelle festgestellt. Aufgrund der Komplexität ist das Gesamtkollektiv noch einmal in Tabelle 6 dargestellt. Tabelle 6: statistische Zusammensetzung des Gesamtkollektivs Primärfälle Primärfälle bei Nachsorge entdeckt Bei Nachsorge ohne neuen Befund Gesamt Tumorzahlen des Kollektivs gesamt 413 480 PF 67 Patienten des Kollektivs gesamt 277 46 139 93 355 835 416 23 3. Ergebnisse Wie in Abbildung 4 dargestellt, litt ein Großteil der Patienten (n=340, 82 Prozent) an ein bis zwei epithelialen Tumorherden, bei 57 Patienten wurden zeitgleich drei bis fünf Mehrfachtumoren diagnostiziert. In 19 Fällen (4 Prozent) lagen mehr als 5 Tumore vor. Aufteilung der Patienten nach Anzahl der Tumoren 19; 4% 57; 14% 1-2 Tumoren 3-5 Tumoren >5 Tumoren 340; 82% Abbildung 4: Mehrfachtumoren; n=835 Tumore auf n=416 Patienten mit epithelialen Hauttumoren aufgeteilt (Universitätsklinikum Ulm 2010) Die Aufteilung der 835 Einzeltumore in die jeweiligen Entitäten ergab 510 Basaliome, 278 Spinaliome und 47 andere epitheliale Tumore (vgl. Abbildung 5). Aufteilung der Gesamttumorentitäten 47; 6% Basalzellkarzinome 278; 33% Plattenepithelkarzinome 510; 61% andere epith. Tumoren Abbildung 5: Aufteilung der n=835 epithelialen Hauttumoren auf die jeweiligen Entitäten bei n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 24 3. Ergebnisse Bei 351 Patienten wurde lediglich ein Tumortyp diagnostiziert (84,3 Prozent der Patienten), 60 Personen (14,4 Prozent der Patienten) erkrankten an zwei Tumoren, fünf Patienten wiesen drei verschiedene Tumorentitäten auf (Abbildung 6). 500 450 5 60 absolute Häufigkeit 400 350 Fälle mit 3 verschiedenen Tumorvarianten 300 250 200 Fälle mit zwei verschiedenen Tumorvarianten 351 150 Fälle mit einer Tumorvariante 100 50 0 Abbildung 6: Aufteilung der Patienten nach der Anzahl der Tumorvarianten, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Von den 351 Patienten, bei denen jeweils nur eine Tumorvariante festgestellt wurde, litten die meisten (214 Patienten) unter einem Basalzellkarzinom (51,4 Prozent). Bei 119 Patienten (28,6 Prozent) wurde ein Plattenepithelkarzinom und bei 18 Patienten (4,3 Prozent) eine andere Art der epithelialen Neubildung diagnostiziert. Insgesamt 15,7 Prozent der Patienten hatten zwei oder mehr Tumore gleichzeitig, davon trat am häufigsten eine Kombination aus dem Basallzellkarzinom und dem Plattenepithelkarzinom auf (11,3 Prozent der Patienten). Die genaue Verteilung nach Entitäten ist in Tabelle 7 dargestellt. Tabelle 7: Konfiguration der Tumortypen insgesamt, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) (+= Tumortyp vorhanden; -= Tumortyp nicht vorhanden) Tumortyp Basaliome Spinaliome + – – + + + – – + – + – + + Andere epith. Tumoren – – + – + + + n % 214 119 18 47 4 5 9 51.4 % 28.6 % 4.3 % 11.3 % 1.0 % 1.2 % 2.2 % 25 3. Ergebnisse 3.2 Patientenbezogene Ergebnisse 3.2.1 Geschlechterverteilung der Patienten In der Geschlechterverteilung überwogen die Männer mit n=227 (54,6 Prozent) gegenüber den Frauen mit n=189, was 45,4 Prozent des Gesamtkollektivs entsprach (vgl. Abbildung 7). Geschlechtsverteilung Männer Frauen 189; 45,4% 227; 54,6% Abbildung 7: Geschlechtsverteilung des gesamten Kollektivs, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Beim Fragebogenrücklauf beantworteten 121 der 227 männlichen Patienten (53 Prozent), aber nur 85 der 189 Patientinnen (45 Prozent) den Fragebogen, wie in Abbildung 8 dargestellt. Geschlechterverteilung bei Patienten mit ausgefüllten Fragebögen männlich weiblich 85; 41% 121; 59% Abbildung 8: Geschlechtsverteilung der Patienten mit beantworteten Fragebögen, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 26 3. Ergebnisse 3.2.2 Altersverteilung der Patienten Diese Studie umfasste n= 416 Patienten im Alter von 15 bis 95 Jahren (vollendete Lebensjahre). Das mittlere Alter der Hautkrebspatienten betrug 71,6 ± 12,5 Jahre, der Altersmedian lag bei 72,4 Jahren mit einem 68%igen-KI-Wert von 59,7 bis 84,4 Jahren. Das Durchschnittsalter und der Median der Männer lagen bei rund 71 Jahren. Bei den Frauen lag das Durchschnittsalter mit 72 Jahren bei einem Median von 73 etwas höher. Mit 27,9 Jahren war der jüngste männliche Patient und mit 94,3 Jahren der älteste männliche Erkrankte in der Studie vertreten. Die jüngste Patientin war 15,1 Jahre und die älteste Patientin 95,8 Jahre alt. Generell überwog der Anteil der männlichen Patienten. Erst ab einem Alter von 80 Jahren kippte das Geschlechterverhältnis aufgrund der unterschiedlichen Lebenserwartung. Dennoch war der Altersunterschied der Geschlechter nicht signifikant. Anzahl 55 % 13% 50 12% 45 11% 40 10% 9% 35 8% 30 7% 25 6% 20 5% 15 4% 3% 10 5 2% 1% 0 0% Geschlecht mw mw mw mwmw mw mw mw mw mw mw mw mw mw mw mw mw Geschl(V6)= 1 2 1212 1272 1 33 2 36-39 1 2 40-44 1 2 45-49 1 2 50-54 1 2 55-59 1 2 60-64 1 2 65-69 1 2 70-74 1 2 75-79 1 2 80-84 1 2 85-89 1 2 90-94 12 1 2 Alter 15 95 (V1430)< 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 Abbildung 9: Alter der Patienten. Jede Säule stellt Anzahl und Prozentsatz der Patienten in der genannten Altersgruppe dar und ist nach Geschlecht unterteilt, m = männlich (blau), w = weiblich (rot), n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 27 3. Ergebnisse In Abbildung 9 ist erkennbar, dass die Balkenverteilung der Männer aus einer pyramidenähnlichen Anordnung besteht, deren deutlich abgehobene Spitze im Bereich der Altersgruppe 70-74 Jahre einen Gesamtanteil von rund 13 Prozent einnimmt. Hingegen besteht die nach Altersgruppen verteilte Häufigkeit der Frauen aus einer kontinuierlich ansteigenden Balkenkonstellation, die bis zu ihrem Maximum exponentiell verläuft, dann aber abbricht. Der Zenit dieser Konstellation wird erst in der Altersgruppe 80-84 Jahre und damit etwa 10 Jahre nach den männlichen Patienten erreicht. Auffallend ist, dass in den ersten drei Dekaden (0-30 Jahren) und in den letzten beiden Dekaden (80-100 Jahre) der Anteil der Frauen annähernd überwiegt. 3.2.3 Body Mass Index (BMI) Bei 201 der 416 Patienten waren Größe und Gewicht protokolliert, so dass der BMI und die Körperoberfläche berechnet werden konnten. Die Körpergröße einer Patientin mit Amputation beider Beine wurde mit 165 cm näherungsweise angegeben. Der BMI-Mittelwert des gesamten Patientenkollektivs betrug 26,723 kg/m² und lag damit leicht über dem Bundesdurchschnitt der Gesamtbevölkerung. Das Statistische Bundesamt ermittelte im Jahr 2005 für die deutsche Gesamtbevölkerung einen Durchschnittswert von 24,7 kg/m² (für Frauen) und 26,1 kg/m² für Männer (Bayerisches Staatsministerium der Justiz und für Verbraucherschutz 2013). Damit waren die Patienten des Gesamtkollektivs etwas dicker als die der Durchschnittsbevölkerung. 3.2.4 Lokalisation der epithelialen Hauttumoren Die Differenzierung zwischen den einzelnen Tumorlokalisationen mit den entsprechenden Körperoberflächen wurde anhand Kodierungen vorgenommen (siehe Tabelle 8). der ICD-10-WHO-Diagnose- 28 3. Ergebnisse Tabelle 8: ICD-10-Kodierung C44.- Sonstige bösartige Neubildungen der Haut (Hensen et al. 2011) C44.0 C44.1 C44.2 C44.3 C44.4 C44.5 C44.6 C44.7 C44.8 C44.9 Lippenhaut Augenlid Ohr und äußerer Gehörgang Gesicht Hals und Kopfhaut Rumpf/Perianalhaut obere Extremität untere Extremität mehrere Teilbereiche überlappend nicht näher bezeichnet Wie in Abbildung 10 dargestellt, wurden die 835 einzelnen epithelialen Hauttumoren des gesamten Patientenkollektivs zur Übersicht der Häufigkeitsverteilung in die entsprechenden Codiergruppen übertragen. Abbildung 10: Anzahl der Tumoren verteilt auf die einzelnen Diagnoseschlüssel, n=835 Gesamttumoren bei n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) (C44.0=Lippenhaut; C44.1=Augenlid; C44.2=Ohr; C44.3=Gesicht; C44.4=Hals, Kopfhaut; C44.5=Rumpf, Perinanal; C44.6=Obere Extremität; C44.7=Untere Extremität; C44.8=Überlappend; C44.9= Unklar) 29 3. Ergebnisse Bezüglich der Hauptlokalisation verteilen sich die Tumore über den gesamten Körper. Klare Prädilektionsstellen befinden sich in den sonnenexponierten Arealen der Haut, v.a. in der Kopf-Hals-Region. 73,2 Prozent aller epithelialen Hauttumore lagen in dieser Region, wovon mit 49,8 Prozent der Gesichtsbereich knapp die Hälfte in Anspruch nahm, gefolgt vom Kopfhautbereich samt Halsregion mit 10,9 Prozent, dem Hautbereich des Ohres mit 7,2 Prozent, der Lippenhaut mit 2,8 Prozent und dem Augenlid mit 2,5 Prozent. Die übrigen knapp 30 Prozent der Tumore verteilten sich auf den restlichen Körper, womit die weniger dem UV-Licht ausgesetzten Hautbereiche nachweislich eine deutlich geringere Tumorhäufigkeit aufwiesen (Rücken- und Brustbereich: 12,1 Prozent, die Haut der oberen Extremität: 8,1 Prozent; die Haut der unteren Extremität: 4,9 Prozent). Bei der Auswertung der Daten konnte bei neun Tumoren (1,1 Prozent) nicht die exakte Lokalisation anhand der Untersuchungsberichte ermittelt werden. Bei fünf Hauttumoren (0,6 Prozent) erstreckte sich der vom Tumor befallene Bereich über zwei verschiedene Codierungen der WHO-Einteilung. Bei der Einteilung in die jeweiligen Hauptbereiche (Kopf-Hals-Region, Rumpfbereich, untere/obere Extremitäten), konnten deutliche geschlechtsspezifische Unterschiede festgestellt werden, da der Anteil der männlichen Patienten in allen drei Gruppen überwog. Mit Hilfe der folgenden Graphikzeichnungen (Abbildung 11 bis Abbildung 15) soll vom gesamten Patientenkollektiv die Häufigkeitsverteilung der einzelnen epithelialen Hauttumorvarianten topographisch hervorgehoben werden. In der frontalen Ansicht der graphischen Darstellung zeigt sich bei den Basaliomen eine Prädilektion überwiegend im Mittelgesichtsbereich. Die betroffenen Areale befinden sich überwiegend im Nasen-, Schläfen-, Augen-, Glabella/Stirn- und prä/retroaurikulären Bereich. Neben dem Hauptvorkommen in der zentrofacialen Region entwickelte sich bei zahlreichen Patienten ein gesteigertes Vorkommen in der Schulterregion, sowie im Brust- und Rückenbereich. Im Gegensatz hierzu sind die Plattenepithelkarzinome aufgrund der stärkeren UVLicht-Abhängigkeit eher auf den klassischen „Sonnenterrassen“ der Haut, wie z.B. der Ohrhelix, der Unterlippe, der oberen Stirnhälfte und dem Kapillitium anzutreffen. Diese Erkenntnis ist in den seitlichen En-face-Graphiken (Abbildung 12 und Abbildung 13) darstellt. 30 3. Ergebnisse Eine weitere auffallende und charakteristische Lokalisation der Plattenepithelkarzinome befindet sich an den Handrücken und im Genitalbereich. Der Rumpf- und der Gesichtsbereich stellen die überwiegenden Prädilektionsbereiche des Bowen-Karzinoms dar, während die Merkel-Zell-Karzinome ähnlich den Plattenepithelkarzinomen den Kopfbereich und die Extremitäten und damit die UVLicht exponierten Hautbereiche als Primärlokalisationen bevorzugen. Ein ähnliches Verteilungsmuster zeigte sich auch bei den Keratoakanthomen. Im Gesamtkollektiv ließ sich ein ekkrines Porokarzinom an der unteren Extremität feststellen. 31 3. Ergebnisse Abbildung 11: Topographische Verteilung – linkes Seitenprofil (L= links aus Sicht des Patienten) Abbildung 12: Topographische Verteilung – Frontansicht (R= rechts aus Sicht des Patienten, L= links aus Sicht des Patienten) 32 3. Ergebnisse Abbildung 13: Topographische Verteilung – rechtes Seitenprofil (R= rechts aus Sicht des Patienten) Abbildung 14: Topographische Verteilung – Körperhinterseite (L= links aus Sicht des Patienten, R= rechts aus Sicht des Patienten) 33 3. Ergebnisse Abbildung 15: Topographische Verteilung – Körpervorderseite (R= rechts aus Sicht des Patienten, L= links aus Sicht des Patienten) 34 3. Ergebnisse 3.2.5 Klassifikation der Plattenephitelkarzinome nach Tumorstadien Um ein umfassendes Gesamtbild des zu versorgenden Patientenkollektivs zu bekommen, wurden bei der Datenerfassung der Plattenepithelkarzinom-Patienten das klinische Stadium dieses epithelialen Hauttumors miterfasst und analysiert, wobei sowohl die Nachsorgepatienten, als auch die Patienten, die im Jahr 2010 an einem solchen Tumor neu erkrankten, Berücksichtigung fanden. Insgesamt wurden in 2010 835 epitheliale Hauttumoren bei 416 Patienten behandelt (davon 480 neu lokalisierte), von denen insgesamt n=180 an einem SCC erkrankt waren (davon n=119 ausschließlich an einem SCC und n=61 an einer SCCKombination, vgl. Tabelle 7). Wie in Abbildung 16 dargestellt, lag bei 80 Prozent (n=144) der n=180 SCCPatienten das klinische Stadium I vor. 6 Prozent (n=10) befanden sich in Stadium II. 4 Prozent (n=7) wurden dem III. und 1 Prozent (n=1) dem IV. Stadium zugeordnet. In 10 Prozent der Fälle (n=18) konnte kein Stadium ermittelt werden. Klinisches Stadium der Plattenepithelkarzinome 90% 80% Anzahl Patienten 80% 70% 60% 50% 40% 30% 20% 10% 10% 6% 4% 1% II III IV 0% I unbekannt Stadium Abbildung 16: Anzahl der Patienten mit klinischem Stadium der gesamten Plattenepithelkarzinome, n=180 Patienten von gesamt n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) (I= frühes Stadium mit kleinem Primärtumor, keinen Lymphknotenmetastasen und keinen Fernmetastasen; II= frühes Stadium mit größerem Primärtumor, keinen , keinen Lymphknotenmetastasen und keinen Fernmetastasen; III=fortgeschrittenes Stadium mit großem Primärtumor, Lymphknotenmetastasen und keinen Fernmetastasen; IV=spätes Tumorstadium mit großem Primärtumor, sowie Lymphknoten- und Fernmetastasen) 35 3. Ergebnisse Von den 180 betroffenen Personen einschließlich der Nachsorge-Patienten, die an einem Plattenepithelkarzinom erkrankt waren, wurden bei acht Patienten Lymphknoten teils diagnostisch, teils therapeutisch exzidiert. Unter den 180 Patienten befanden sich 107 Primärfälle, 86 davon im klinischen Stadium I, fünf in Stadium II, drei in Stadium III und einer in Stadium IV. 3.3 Chirurgische Therapie der Hauttumoren Von den n=416 Patienten des Gesamtkollektivs erhielten 42 keinen chirurgischen Eingriff. Die restlichen 374 Patienten wurden operativ versorgt, somit lag der Anteil der operativ behandelten Patienten bei fast 90 Prozent. Da der operative Aufwand je nach gegebenem Tumor unterschiedlich ausfällt, wurden OP-Statistiken erstellt. Wie in Tabelle 9 dargestellt, zeigten diese zunächst, dass von den 416 Patienten in 2010 10 Prozent (n=42 Patienten) nicht operiert, sondern konservativ behandelt wurden. Bei weiteren 60 Prozent (n=249 Patienten) wurde der Tumor mit einer Operation versorgt. In 19 Prozent der Fälle (n=80 Patienten) waren zwei OPs notwendig und bei 11 Prozent der Patienten (n=45 Patienten) sogar drei und mehr Exzisionen, bis der Tumor vollständig entfernt war. Dies war mit einem erheblichen organisatorischen Mehraufwand wie z.B. Änderungen der wöchentlichen Operationsplanung sowie zusätzlichen Terminvergaben verbunden. Tabelle 9: Anteil der Patienten des Gesamtkollektivs, die operativ behandelt wurden (1,2,3 oder mehr als 3 OPs) sowie Anteil der Patienten mit konservativer Behandlung, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) (OP= Operation) gesamt operiert, davon… 1 OP 2 OPs 3+ OPs konservativ behandelt Patienten 416 374 249 80 45 42 Die operative Entfernung von epithelialen Hauttumoren kann je nach Größe, Lage und Komplexität des Tumors unterschiedlich erfolgen. Mittels der genauen OPCodierung im SAP-System konnten alle operativ entfernten Tumore in Bezug auf 36 3. Ergebnisse die gewählte Exzisionstechnik näher charakterisiert werden. Dies ergab, dass von allen in 2010 operierten Patienten 78 Prozent mittels des radikalen Ansatzes und die restlichen 22 Prozent durch eine lokale Exzision versorgt wurden (vgl. Abbildung 17). Grundsätzlich werden größere Tumore radikal exzidiert, während kleinere Tumore mittels lokaler Exzision versorgt werden. Statistik der Tumorexzisionsverfahren 82; 22% Operation mit radikalem Ansatz = analoge (radikale) Exzision 5-895.xx 292; 78% Operation ohne radikalem Ansatz = lokale Exzision 5-894.xx Abbildung 17: Aufteilung der Operationen aus dem Jahr 2010 nach radikalem Ansatz (n=374, da vom Gesamtkollektiv 42 Patienten nicht operiert wurden, bei n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010)) Die weitere Analyse ergab, dass in 68 Prozent der operierten Primärfälle eine histologische Randkontrolle erfolgte, um eine weitere Streuung ausschließen zu können. Wenn im Wundrand in situ noch Anteile einer aktinischen Keratose nachweisbar waren (R1), wurde durch die photodynamische Therapie oder kryochirurgisch nachbehandelt und klinisch engmaschig weiter kontrolliert. Die Wertigkeit dieser Nachsorge müsste durch eine weitere Studie statistisch belegt und nachuntersucht werden. Im Patientenkollektiv betrug die R1-Rate knapp 18 Prozent (n=86 Behandlungsfälle). 37 3. Ergebnisse 3.4 Komplikationen Die OP-Komplikationen wurden im Kollektiv der Primärfälle analysiert (316 Behandlungsfälle bei n=292 Primärpatienten). Insgesamt kam es bei 36 Patienten, also 11 Prozent zu Komplikationen. Komplikationen traten entweder einzeln oder kombiniert auf. Bei den 36 Patienten sind insgesamt 48 verschiedene Komplikationen gezählt worden. Wie in Tabelle 10 dargestellt, konnten anhand der ICD-10Klassifikation die einzelnen Kodierungen der Komplikationsmöglichkeiten aufgeschlüsselt werden (Hensen et al. 2011). Tabelle 10: ICD-10-Klassifikation der möglichen operativen Komplikationen (Hensen et al. 2011) T81.0 Blutung und Hämatom nach einem Eingriff, anderenorts nicht klassifiziert Schock während oder als Folge eines Eingriffes Versehentliche Stich- oder Risswunde während eines Eingriffs Dehiszenz oder Ruptur einer Operationswunde Infektion nach einem Eingriff Sonstige Komplikationen bei Eingriffen (Wundheilungsstörung) T81.1 T81.2 T81.3 T81.4 T81.8 Am häufigsten traten Blutungen auf (insgesamt 30 Fälle), gefolgt von Infektionen (12 Fälle) und nicht näher beschriebenen Komplikationen (in fünf Fällen). In einem Fall kam es zu einer Dehiszenz der Wunde. Iatrogene Komplikationen, wie z.B. versehentliche Stich- oder Risswunden, wurden 2010 nicht registriert. Abbildung 18 bietet im Folgenden eine graphische Darstellung der Häufigkeitsverteilung der einzelnen Komplikationen. Anzahl Komplikationen Komplikationsarten 35 30 25 20 15 10 5 0 30 12 5 0 T81.0 T81.1 0 1 T81.2 T81.3 T81.4 T81.8 Komplikationstypus Abbildung 18: Aufteilung der verschiedenen Komplikationsarten. Insgesamt kam es in 2010 bei den Primärpatienten bei n=316 Behandlungsfällen zu 48 Komplikationen. Bezogen auf n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) (T81.0=Blutung/Hämatom, anderorts nicht klassifiziert; T81.1=Schock; T81.2=versehentliche Stich- oder Risswunde; T81.3=Dehiszenz/ Ruptur; T81.4=Infektion; T81.8=sonstige Komplikation) 38 3. Ergebnisse 3.5 Operative und konservative Behandlungsverfahren Vom Gesamtkollektiv (n=416 Patienten) erhielten manche Patienten mehrere Behandlungsverfahren parallel, weshalb in 2010 insgesamt 486 Behandlungsfälle verzeichnet wurden. Abbildung 19 zeigt die genaue Verteilung der Therapieverfahren im Gesamten. Ersichtlich ist, dass 63 Prozent der Fälle (n=303) ausschließlich operativ behandelt wurden, während 37 Prozent der Behandlungsfälle entweder ausschließlich konservativ oder kombiniert operativ und konservativ versorgt wurden. Verteilung der Therapieverfahren im Gesamten (bei n=416 Patienten mit n=486 Behandlungsfällen) PDT +/- OP 133; 27% Kryo +/- OP Radiatio +/- OP Chemo +/- OP 303; 63% 26; 5% Laser +/- OP 18; 4% 3; 1% OP ohne zusätzliche Therapie 2; 0% Abbildung 19: verwendete Therapieformen im Gesamtkollektiv, n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) OP=Operation; PDT=photodynamische Therapie; Kryo=Kryochirurgie; Radiatio=Strahlentherapie; Chemo= Chemotherapie; Laser=Lasertherapie) Dabei wurde am häufigsten die photodynamische Therapie angewendet (27 Prozent), gefolgt von der Kryochirurgie (5 Prozent) und der adjuvanten Bestrahlung (4 Prozent). Zu einer Chemotherapie kam es in 1 Prozent der Behandlungsfälle, ebenso zu einer Laserbehandlung. 39 3. Ergebnisse 3.6 Rezidivtumoren im Patientenstamm Im Rahmen der vorliegenden Untersuchung war insbesondere die Rezidivrate bei den Tumorpatienten von Interesse. Häufigkeit von Rezidivtumoren im Patienten-Stamm in 2010 30 28 Anzahl Patienten 25 20 15 10 8 7 5 2 1 0 1 2 3 4 5 und >5 Anzahl Rezidive Abbildung 20: Häufigkeitsverteilung der Rezidivtumoren im Nachsorgekollektiv der Gesamtpopulation, n=46 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Bei 46 der 139 Patienten des Nachsorgekollektivs trat ein Rezidiv-Tumor auf. Bezogen auf das Gesamtkollektiv (n=416) entwickelten also knapp 11 Prozent der Patienten Rezidive. Da in 2010 insgesamt 835 Tumore versorgt wurden, betrug die Rezidivrate bezogen auf die Gesamttumorzahl 5,5 Prozent. In Abbildung 20 ist die Häufigkeitsverteilung der Rezidive dargestellt. In den meisten Fällen (n=28) trat lediglich ein Rezidiv auf, bei 8 Patienten wurden jedoch auch mehr als fünf Rezidiv-Tumore lokalisiert. 40 3. Ergebnisse 3.7 Ergebnisse der Patientenbefragung 3.7.1 Sonnenexpositionen Um die Versorgungsqualität der epithelialen Hauttumoren am HTZ in Ulm zu erfassen, wurden nach Durchsicht der Patientenakten Patientenbefragungen durchgeführt. Da in ätiologischer Sicht bei der Entstehung von epithelialen Hauttumoren vor allem UV-Licht-Expositionen eine Rolle spielen, interessierte uns der Umgang unseres Patientenstammes mit dieser Noxe. Dabei wurde getrennt erfragt, ob sich die Patienten aus beruflichen Gründen oder in ihrer Freizeit in der Sonne aufhielten. Da sich viele ältere im Ruhestand befindliche Personen im Patientenkollektiv befanden, wurde weiterhin untersucht, ob die Patienten in früheren Jahren häufig einer UV-Licht-Exposition ausgesetzt waren. Auch wurden die Patienten befragt, ob sie in den letzten Jahren öfters einen Sonnenurlaub unternommen oder regelmäßig Solarien aufgesucht hatten. Da die Rücklaufquote der Fragebögen knapp 50 Prozent betrug, beträgt die Grundgesamtheit der Patientenbefragung n=206. 3.7.2 Berufliche Sonnenexposition Bezogen auf die berufliche Sonnenexposition wurden die Patienten befragt, ob sie sich durch Ihren Beruf viel im Freien aufhalten müssen. Da sich viele Patienten zum Zeitpunkt der Befragung schon im Ruhestand befanden, wurde speziell auch nach ihrer ehemaligen Berufsausübung befragt. Wie in Abbildung 21 dargestellt, gaben ca. 57 Prozent (n=117) der Patienten an, keiner berufsbedingten Sonnenexposition ausgesetzt zu sein bzw. jemals gewesen zu sein. 28 Prozent (n=58) wiesen darauf hin, sich aus beruflichen Gründen viel in der Sonne aufzuhalten, 15 Prozent (n=31) beantworteten die Frage nicht. Deutliche Unterschiede zeigten sich in der Geschlechterverteilung: Nur 40 Prozent der männlichen, aber 80 Prozent der weiblichen Patienten gaben an, keiner berufsbedingten Sonnenexposition ausgesetzt gewesen zu sein. 41 3. Ergebnisse Berufliche Sonnenexposition 31; 15% 58; 28% ja nein unbekannt 117; 57% Abbildung 21: Zahl der Patienten mit beruflicher Sonnenexposition, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Abbildung 22 zeigt genauer, welche Berufe diejenigen Patienten ausübten, die eine berufliche Exposition bejaht hatten. Von den insgesamt 58 Personen mit beruflicher Sonnenexposition waren am meisten die Landwirte (31 Prozent) der Sonnenstrahlung ausgesetzt, gefolgt von Bauarbeitern (14 Prozent) und Zimmermännern (5 Prozent). 36 Prozent gaben trotz Bejahung einer beruflichen Sonnenexposition leider keine genauere Berufsbezeichnung an. Berufe mit hoher UV-Exposition 1; 2% 1; 2% 1; 2% 1; 2% 2; 3% 2; 3% Flaschner Landschaftsarchitekt Maurermeister 3; 5% Schreiner 21; 36% Gärtner 8; 14% Straßenwärter Zimmerer Bauarbeiter 18; 31% Landwirt ohne Berufsbezeichnung Abbildung 22: Häufigkeitsverteilung der Berufe mit UV- Exposition, n=58 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 42 3. Ergebnisse 3.7.3 Sonnenexposition in der Freizeit Um neben der beruflichen auch die private UV-Exposition als Risikofaktor für Hauttumore zu erfassen, wurde erfragt, ob sich die Patienten aktuell oder früher in ihrer Freizeit häufiger in der Sonne aufhielten und wie viele Sonnenurlaube pro Jahr durchschnittlich verbracht wurden. Wie in Abbildung 23 dargestellt, gab mehr als die Hälfte des Kollektivs (n=114, also 55 Prozent) an, sich privat regelmäßig in der Sonne aufzuhalten. regelmäßige Sonnenexposition in der Freizeit 114 120 absolute Häufigkeit 100 80 60 50 42 40 20 0 Generell nicht viel im Freien früher viel im Freien, jetzt aber nicht mehr viel im Freien Häufigkeit/ Art der Sonnenexposition Abbildung 23: Häufigkeitsverteilung der Patienten mit regelmäßiger Sonnenexposition in der Freizeit, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Knapp ein Viertel der Patienten (24 Prozent) gab an, sich in früheren Lebensjahren privat häufig in der Sonne aufgehalten haben. Nur 42 Personen (20%) verwiesen darauf, sich generell nicht oder kaum in der Sonne aufzuhalten. Zusätzlich wurden die Patienten nach der Anzahl ihrer Strand- und Bergurlaube pro Jahr befragt, sowie danach, ob sie regelmäßig Sonnenstudios aufsuchen. Hierbei ergab sich folgendes Bild (Abbildung 24): 43 3. Ergebnisse Risikofaktor UV-Exposition 50 50 48 45 absolute Häufigkeit 40 35 30 Strandurlaub 26 Bergurlaub 25 Sonnenstudio 20 15 10 0 0 4 4 5 einer pro Jahr 5 1 0 zwei oder mehr 5 fehlende Angabe 0 0 Sonnenstudio Häufigkeit Urlaub mit Sonnenexposition Abbildung 24: Urlaub mit Sonnenexposition und Besuch von Sonnenstudios, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Fast die Hälfte der n=206 Patienten gab an, einmal im Jahr einen Berg- oder einen Strandurlaub zu machen (n=98, also 48 Prozent, davon n=50 Strandurlaube und n=48 Bergurlaube). 26 befragte Patienten (13 Prozent) vermerkten, sogar zwei und mehr Sonnenurlaube pro Jahr zu verbringen. Der regelmäßige Besuch eines Sonnenstudios wurde lediglich von 2 Prozent (n=5) der befragten Personen bejaht. Werden alle befragten Personen zusammengefasst, die in ihrer Freizeit einer UV-Licht-Exposition ausgesetzt sind, so sind 143 Menschen betroffen. Dies entspricht in etwa 70 Prozent der Befragten, die eine private Exposition in der Freizeit bejahten. 44 3. Ergebnisse 3.7.4 Sonnenbrände in der Kindheit und seit der Diagnose Da Sonnenbrände in der Kindheit das Risiko einer späteren Hautkrebserkrankung erhöhen, wurden die Patienten nach entsprechenden Ereignissen befragt. Wie in Abbildung 25 dargestellt, gaben n=38 Patienten (19 Prozent) an, in der Kindheit keine Sonnenbrände gehabt zu haben (bzw. sich nicht an entsprechende Ereignisse erinnern zu können), während 81 Prozent der Befragten (n=168) Sonnenbrände in der Kindheit bejahten. Sonnenbrände in der Kindheit 4; 2% 38; 19% keine Sonnenbrände sehr wenige Sonnenbrände 87; 42% viele Sonnenbrände keine Angabe 77; 37% Abbildung 25: Sonnenbrände in der Kindheit, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 77 Befragte (37 Prozent) gaben an, sehr wenige Sonnenbrände in der Kindheit gehabt zu haben. An viele Sonnenbrände in der Kindheit konnten sich 42 Prozent (n=87) der Patienten erinnern. Es zeigt sich, dass ein Großteil der befragten Patienten in der Kindheit Sonnenbrandereignisse erlebte, was die grundsätzliche Annahme bestätigt, dass Sonnenbrände in späteren Lebensjahre Hauttumoren verursachen können. Wie in Abbildung 26 ersichtlich, traten bei 80 Prozent der Patienten (n=167) nach Diagnosestellung keine Sonnenbrände mehr auf, während sich 20 Prozent weiterhin der direkten Sonnenausstrahlung aussetzten. Drei Patienten gaben sogar an, sich seit der Diagnose mehr als fünf Sonnenbrände zugezogen zu haben. 45 3. Ergebnisse Sonnenbrände seit Diagnose 3; 2% 11; 5% 14; 7% keine 13; 6% 1 bis 2 2 bis 5 mehr als 5 keine Angabe 167; 80% Abbildung 26: Sonnenbrände seit Diagnose, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 3.7.5 Prävention von Hauttumoren 69 Prozent (n=142) der befragten Patienten verwenden seit der Diagnose regelmäßig Sonnenschutzprodukte, zumeist (n=92, also 67 Prozent) Sonnencremes mit einem Lichtschutzfaktor 50. Keinen Sonnenschutz verwenden nach wie vor 31 Prozent (n=63) der 206 Befragten, wie in Abbildung 27 dargestellt. Verwendung von Sonnencremes seit der Diagnose 1; 0% keinen Sonnenschutz 63; 31% 92; 45% Regelmäßigen Sonnenschutz mit niedrigem LSF Regelmäßigen Sonnenschutz mit hohem LSF (50+) 50; 24% keine Angabe Abbildung 27: Compliance „Verwendung von Sonnencremes“, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) (LSF=Lichtschutzfaktor) 46 3. Ergebnisse Die Latenzzeit von der Eigenwahrnehmung der Hautveränderung bis zur Arztkonsultation kann im Mittel auf 2,76 ± 7,85 Jahre mit einem Median von 0,37 Jahren (68%-KI = 0 bis 3 Jahre) geschätzt werden. Abbildung 28 präsentiert die Häufigkeitsverteilung der Latenzzeit. 34 Prozent der Befragten (n=69) konsultierten innerhalb von 3 bis 12 Monaten nach Selbstwahrnehmung einen Arzt, insgesamt fiel der Tumor knapp 80 Prozent der Patienten selbst auf. 42 Patienten (knapp 20 Prozent) hatten in der Selbstwahrnehmung keinen Tumor entdeckt, sie wurden aufgrund anderer Beschwerden in der Klinik vorstellig. Anzahl der befragten Patienten Latenzzeit bis zur Arztkonsultation 80 70 60 50 40 30 20 10 0 69 42 28 24 13 23 7 Latenzzeit Abbildung 28: Latenzzeit von der Erstwahrnehmung der Hautveränderung bis zum klinischen Erstkontakt, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 3.7.6 Aufteilung nach Hauttyp, durch Selbsteinschätzung der Patienten Da helle Haut bei der Ätiologie von epithelialen Hauttumoren eine wichtige Rolle spielt, wurden die Patienten nach ihrer persönlichen Einschätzung hinsichtlich ihres Hauttyps befragt. Sie konnten anhand eines bekannten Schemas nach Fitzpatrick zwischen vier verschiedenen Hauttypen wählen. Hauttyp I ist durch rötliche Haare, eine sehr helle Haut und Sommersprossen charakterisiert. Personen, die dem Hauttyp II zugeordnet werden können, zeichnen sich durch blonde Haare und blau-grüne Augenfarbe aus. Während Menschen vom Hauttyp III zumeist dunkelblonde bzw. braune Haare haben, ist der Hauttyp IV durch eine dunkle Haar- und Hautfarbe gekennzeichnet. Je heller die Haut- und 47 3. Ergebnisse Haarfarbe, desto höher ist die Sonnenbrandgefahr. Während Menschen vom Hauttyp I bereits nach fünf bis zehn Minuten direkter Sonnenexposition einen Sonnenbrand erleiden und kaum über Bräunungspotential verfügen, beträgt die Eigenschutzzeit bei Personen vom Hauttyp IV mehr als vierzig Minuten (Fitz- patrick 1975). Anhand der Auswertung durch den Erhebungsbogen konnte festgestellt werden, dass sich 58 Prozent des gesamten Patientenkollektivs als besonders lichtempfindlich einschätzten, wie in Abbildung 29 dargestellt (Typ I und II). Insgesamt ordneten sich 16 Prozent (n=33) der befragten Patienten dem Hauttyp I zu. 42 Prozent schätzen sich als dem Hauttyp II zugehörig ein (n=86). 26 Prozent der Patienten gaben an, weniger lichtempfindlich zu sein und bezeichneten sich selbst als Hauttyp III, knapp 15 Prozent würden sich als Hauttyp IV charakterisieren, der damit am wenigsten vertreten ist. Es zeigt sich, dass sich knapp 40 Prozent dem III. oder IV. Hauttyp zugehörig einschätzen, was deutlich unter dem Wert liegt, der in Mitteleuropa erwartet werden kann (Fitzpatrick 1975). Es schätzten sich also mehr Patienten als lichtempfindlich ein als tatsächlich lichtempfindlich waren. Aufteilung des Hauttyps durch Selbsteinschätzung der Patienten 3; 1,46% 30; 14,56% 33; 16,01% Hauttyp I Hauttyp II Hauttyp III 54; 26,21% 86;41,75% Hauttyp IV unbekannt Abbildung 29: Verteilung der verschiedenen Hauttypen nach Selbsteinschätzung, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 48 3. Ergebnisse 3.7.7 Dermatologische Tumoren in der Anamnese vor der Diagnosestellung des Zweittumors Da Patienten, die im Lauf ihres Lebens schon einmal an einem epithelialen Hauttumor erkrankt waren, statistisch mit einer erhöhten Wahrscheinlichkeit erneut erkranken, wurde im Rahmen der Patientenbefragung untersucht, ob schon einmal dermatologische Tumoren aufgetreten sind. In 2010 entwickelten 46 Patienten des Nachsorgekollektivs und damit ca. 11 Prozent des Gesamtkollektivs (n=416) Rezidiv-Tumoren. Hingegen ergab die Befragung, dass 27 Prozent (n=55) im Lauf ihres Lebens schon einmal die Diagnose Hautkrebs erhielten (Abbildung 30). 139 der befragten Patienten waren in ihrer Vorgeschichte nicht an Hautkrebs erkrankt (67 Prozent). Dermatologische Tumoren in der Anamnese 12; 6% 55; 27% ja nein keine Angabe 139; 67% Abbildung 30: Hauttumor in der Vorgeschichte, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 3.7.8 Hauttumorvorerkrankungen in der Familie Da auch genetische Faktoren bei der Entwicklung von epithelialen Hauttumoren eine Rolle spielen, wurde familienanamnestisch ermittelt, ob Hautkrebsvorerkrankungen in der Familie der Patienten bestanden. 49 3. Ergebnisse Aufteilung der Patienten nach Hauttumorvorerkrankungen in der Familie 4,37 % 17,26 % Hauttumor in der Familie Kein Hauttumor in der Familie keine Angabe 82,74 % Abbildung 31: positive Familienanamnese, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) Wie in Abbildung 31 ersichtlich, konnten bei einem Großteil des Patientenkollektivs (n=163 Patienten, also 83 Prozent) keinerlei Hautkrebsvorerkrankungen innerhalb der Familie identifiziert werden. Bei 17 Prozent (n=34) ist ein Fall von Hautkrebs in der Familie bekannt. 4 Prozent der Befragten (n=9) machten keine Angaben. 3.7.9 Zufriedenheit mit der Behandlung Da die Behandlungsqualität letztendlich auch von der Einschätzung der behandelten Patienten abhängt, wurden die Teilnehmer der Studie nach ihrer Zufriedenheit mit der Behandlung am HTZ Ulm befragt. Das Ergebnis der Befragung zeigt Abbildung 32. 50 3. Ergebnisse Zufriedenheit mit der Behandlung 8; 4% 5; 2% 6; 3% Ja Ja und Nein Nein Frage nicht beantwortet 187; 91% Abbildung 32: Patientenzufriedenheit, n=206 Patienten von n=416 Patienten mit epithelialen Hauttumoren (Universitätsklinikum Ulm 2010) 91 Prozent der befragten Patienten waren mit der medizinischen Behandlung und dem allgemeinen Ablauf in der Klinik zufrieden (n=187). 51 4. Diskussion 4. Diskussion 4.1 Patienten- und versorgungszentrierte Analyse 4.1.1 Epidemiologische Daten und allgemeine Ergebnisse Die vorliegende Arbeit hat zum Ziel, versorgungsrelevante Kennzahlen zu generieren. Hierzu wurde das Patientengut genau analysiert. Es zeigte sich, dass im Untersuchungszeitraum 416 Patienten mit insgesamt 835 epithelialen Hauttumoren versorgt wurden, während die Inzidenz des gesamten Einzugsgebiets 5.200 beträgt. Die epidemiologischen Daten zeigen damit (und dies ist ein Novum), dass für einen definierten Bevölkerungssektor von 2,5 Millionen Einwohnern in BadenWürttemberg und Bayern, die vom HTZ Ulm versorgt werden, ca. 8 Prozent aller Tumorpatienten vom Hauttumorzentrum selbst bearbeitet werden. Da die Patienten durchschnittlich 2 Tumore aufwiesen (und Mehrfachkanzerierungen i.d.R. direkt an die Zentren überweisen werden) kann der Anteil der im Hauttumorzentrum bearbeiteten Gesamttumorlast mit ca. 16 Prozent angegeben werden. Die restlichen 84 Prozent werden im Bereich der niedergelassenen Versorgung abgedeckt. Dies sind wichtige Kennzahlen, die so in Deutschland noch nicht erhoben und so erstmals für ein Bundesland generiert wurden. Unsere Analysen basieren auf den Literaturangaben von Katalinic (2000) zur Inzidenz in Deutschland, die vom Krebsregister Schleswig Holstein gut untermauert sind. Wir gehen davon aus, dass die Berechnungen daher auch für Süddeutschland valide sind, wenngleich es hier (mangels Krebsregister für Süddeutschland) keinen direkten epidemiologischen Zahlenvergleich gibt. 52 4. Diskussion 4.1.2 Analyse des Patientenkontingents Die Analyse des Kontingents im HTZ Ulm ergibt, dass die Patienten mit epithelialen Hauttumoren älter sind als es die Durchschnittsinzidenz in der Bevölkerung erwarten ließe. Das Durchschnittsalter lag bei 71,9 Jahren (bei den Männern) bzw. 73,4 Jahren (bei den Frauen) und damit ca. zwei Jahre über den Werten der Literatur, in der für das Diagnosejahr 2007 als Median 70 Jahre (bei den Männern) bzw. 71 Jahre (bei den Frauen) ermittelt wurde (Pritzkuleit 2010). Da nur 0,5 Prozent der Patienten 30 Jahre oder jünger waren, konnte der in der Literatur beschriebene Trend hin zu einem niedrigeren Erkrankungsalter aufgrund verändertem Freizeitverhalten für das vorliegende Patientenkollektiv nicht bestätigt werden (de Vries et al. 2004; Skellett et al. 2012). Im vorliegenden Patientenkollektiv war der Männeranteil gegenüber dem Anteil an Frauen um 10 Prozent erhöht, was auch in der Literatur beschrieben wird (Diepgen 2010). Ein möglicher Grund für die geschlechtsspezifische Verschiebung könnte die vermehrte Ausübung von Berufen sein, die einer stärkeren beruflichen Sonnenexposition ausgesetzt sind (Fartasch et al. 2012). Die hierfür in Frage kommenden Berufe (z.B. Bauarbeiter, Landarbeiter oder Zimmermann) werden zumeist von Männern ausgeübt (Knuschke et al. 2007; Breitbart et al. 2004). Bei rund einem Drittel unserer Patienten konnte eine berufliche UV-Exposition festgestellt werden, wobei es sich fast ausschließlich um Männer handelte. Der mittlere Body-Maß-Index Wert (BMI) für das gesamte Patientenkontingent in der vorliegenden Studie betrug 26,7 kg/m². Nach Definition der WHO besteht ab 25 kg/m² Übergewicht, wobei die Werte zwischen 25-29,9 kg/m² in der Gewichtsklassendefinition als Präadipositas bezeichnet und mit einem erhöhten Risiko für Begleiterkrankungen assoziiert werden. Im Vergleich zur Durchschnittsbevölkerung war das Patientenkollektiv also leicht übergewichtig (BMI-Durchschnitt Deutschland: Frauen 24,7 kg/m²; Männer 26,1 kg/m²) (Bayerisches Staatsministerium der Justiz und für Verbraucherschutz 2013). Grundsätzlich wird der BMI (in Abhängigkeit von Geschlecht, Tumorvariante und ethnischer Herkunft) mit einem erhöhten Risiko für Melanome in Verbindung gebracht (Renehan et al. 2008). 53 4. Diskussion 4.1.3 Krankheitsbezogene Analyse Die Patienten des untersuchten Patientenkollektivs müssen Analysen zufolge als krank eingestuft werden, da in einem Drittel der Fälle eine Feldkanzerose vorlag. Das Patientengut im HTZ Ulm ist also selektioniert und weist Kennzeichen einer komplexeren Tumorstruktur auf (höheres Alter und multiple Tumoren). Bezüglich der topographischen Verteilungsanalyse ergibt sich die gleiche Verteilung wie in der Literatur: BCC und SCC sind überwiegend (zu 75 Prozent) in der Gesichtregion anzutreffen (Brewster et al. 2007, Skellett et al. 2011, Dubas und Ingraffea 2013, de Vries et al. 2004, Kaufmann et al. 2010). Insbesondere das Basalzellkarzinom lag im Patientengut vorwiegend im Mittelgesicht, wovon besonders der Bereich der Nase betroffen war. Insgesamt traten die Basaliome jedoch nicht nur an lichtexponierten Körperstellen auf, sondern auch an weniger UVbelasteten Arealen, wie z.B. im Schulter- und Brustbereich sowie am Rücken. Dagegen gestaltete sich die Diskrepanz der topographischen Verteilung bei den Plattenepithelkarzinomen auffallender. Die SCC fanden sich auffallend an der Unterlippe, Kopfglatze, am Kapillium und genital. Allerdings traten die epithelialen Hauttumoren im Patientengut (ebenfalls in Übereinstimmung mit der Literatur) auch zu 25 Prozent an wenig ultraviolett-belasteten Körperstellen in Erscheinung (Diepgen 2010a). Möglicherweise spielte hierbei vor allem die in der Freizeit erfolgte UV-Exposition eine Rolle, bei welcher (z.B. am Strand oder im Solarium) in der Regel versucht wird, alle Körperregionen zu bräunen. Die vorliegende Studie bestätigt, dass Basalzellkarzinome an manchen chronisch sonnenexponierten Hautstellen (z.B. den Handrücken) sehr selten vorkommen. Die Ursache dieses Phänomens bleibt vorerst ungeklärt (Reifenberger u. Ruzicka 2005). Der hohe Tumoranteil im Gesicht unterstreicht die Bedeutung einer gesichtsorientierten Versorgung innerhalb der Hauttumorversorgung, die interdisziplinär durchgeführt werden muss, da die kosmetischen Ansprüche der Patienten für die rekonstruktive plastische Gesichtschirurgie eine zusätzliche Herausforderung darstellen (Rubin et al. 2005). Das Verhältnis von Basalzell- zu Plattenepithelkarzinomen betrug etwa 2:1, während gemäß der Literatur ein Verhältnis von 4:1 erwartet worden wäre. Daraus 54 4. Diskussion kann abgeleitet werden, dass Tumore, die metastasieren können, eher an ein Zentrum überwiesen werden. Von mehreren epithelialen Neoplasien war nahezu die Hälfte der 416 Patienten des Gesamtkollektivs betroffen, das sich in Primär- und Nachsorgefälle aufteilte. Die Analyse der Tumorzahlen und Patientenzahlen ergab einen Durchschnitt von 1,5 Tumoren pro Patient im Gesamtkontingent. Die hohe Anzahl an Feldkanzerosen verursacht dabei grundsätzlich einen OPtechnischen Mehraufwand, der im DRG-System nicht abgebildet ist. Bei Fallpauschalen wird unabhängig von der zu operierenden Tumorzahl das gleiche Entgelt vergütet, bei mehreren Tumoren macht das Krankenhaus daher in finanzieller Hinsicht eher Verluste. Bei mehr als drei Tumoren ist für die Operateure mit einem größeren Planungsaufwand zu rechnen. Ferner konnte festgestellt werden, dass zwei Drittel der Patienten mit neu identifizierten Tumoren (=Primärfälle) registriert wurden und ein Drittel der Nachsorge entstammt, was deren Bedeutung unterstreicht. Grundsätzlich muss in der Versorgung von Patienten mit epithelialen Hauttumoren bei jedem fünften Nachsorgepatient mit einem erhöhten Aufwand durch Organisation einer neuen OP gerechnet werden, was ebenfalls die Erkenntnisse der Literatur bestätigen (Marcil u. Stern 2000). Die SCC-Patienten waren im HTZ Ulm klinisch etwas anders verteilt, als es z.B. anhand vorliegender Daten aus dem Krebsregister in Schleswig-Holstein zu erwarten wäre. Hier waren knapp 97 Prozent der SCC-Fälle dem Stadium I zugeteilt (Pritzkuleit et al. 2010), während die Auswertung der Tumorstadien in Ulm für das Stadium I einen Anteil von 80 Prozent ergab. Allerdings konnte in 11 Prozent der Fälle des hier untersuchten Patientenkollektivs kein genaues Stadium ermittelt werden. Tendenziell befanden sich aber auch in Ulm fast 90 Prozent der Patienten in den Stadien I und II und nur sehr wenige in den metastasierenden Stadien III und IV, womit sich das SCC-Patientengut am Zentrum hinsichtlich der Metastasierungsrate nicht von der unterschied, die epidemiologisch in der Gesamtbevölkerung zu erwarten wäre. 55 4. Diskussion 4.1.4 Versorgungsbezogene Analyse Die operative Entfernung mit einer histologischen Absicherung ist die Standardvorgehensweise bei der Therapie eines epithelialen Hauttumors (Reifenberger u. Ruzicka 2005; Rassner 2008a), was auch im HTZ Ulm so gehandhabt wird. Fast 90 Prozent der Fälle wurden operativ versorgt. Zwei Drittel der operierten Patienten konnten mit einer einzigen Exzision versorgt werden. Ziel war immer, möglichst den gesamten Tumor zu entfernen. Bei einem Drittel waren mehrere Exzisionen notwendig, z.B. aufgrund von Mehrfeldkanzerierungen. Die vorliegenden Untersuchungsergebnisse weisen daher darauf hin, dass höchstens 80 Prozent der Patienten mit epithelialen Hauttumoren nach erfolgter Operation als geheilt angesehen werden können, während 20 bis 35 Prozent aufwendige Fälle darstellen, die unter z.T. hohem organisatorischen und finanziellem Mehraufwand weiter versorgt werden müssen. In etwa jeder fünfte Patient benötigte eine Nachresektion, die bei durchschnittlicher Operationszeit Kosten von ca. 600 Euro verursacht (Stoffels et al. 2014). 10 Prozent der 316 Operationsfälle stellten komplexe Tumore mit mehr als drei Exzisionen dar, die sehr aufwendig und kostenintensiv sind, zumal sie zeitnah erfolgen müssen. Unzureichende oder verspätete Therapien führen zu einer Verdoppelung des operativen Defekts und damit zu einer verstärkten Vernarbung (Eide et al. 2005). Auch der Anteil der Patienten, die mehr als drei Exzisionen benötigten, verdeutlicht die Komplexität der im Zentrum versorgten Fälle. Drei Viertel der Tumore wurden aufgrund ihrer Größe als radikale Exzision codiert, der Rest bestand aus kleineren Tumoren, die lokal exzidiert werden konnten. In der Mehrzahl der Fälle (68 Prozent) musste eine mikrographisch kontrollierte Chirurgie unter großem operativem Aufwand angewendet werden. Wird in diesen Fällen auf die Randschnittkontrolle mit Sicherheitsabstand verzichtet, ist mit einem erhöhten Rezidivrisiko zu rechnen (Breuninger 2010a; Breuninger 2010b). Die mikrographisch kontrollierte Chirurgie ist vor allem bei “high-risk“-Tumoren der konventionellen Chirurgie vorzuziehen. Das HTZ Ulm folgt offenbar in den meisten Fällen dieser Vorgehensweise (Leibovitch et al. 2005). Bei 4/10 der Fälle des Patientenguts wurden zusätzlich oder ausschließlich konservative Therapien durchgeführt. Die Untersuchung zeigt also, dass bei den Pati- 56 4. Diskussion enten neben der Operation häufig auch konservative Methoden zum Einsatz kommen, wobei in Ulm vor allem die PDT eine Rolle spielte. Weitere zusätzliche Therapien fanden in Schleswig-Holstein nur in 3,6 Prozent der Fälle statt (Pritzkuleit et al. 2010), im vorliegenden Patientenkollektiv kamen Zusatztherapien daher deutlich häufiger zum Einsatz als im Bundesdurchschnitt. Auch hier kann als Ursache angeführt werden, dass im HTZ eher die komplexeren Fälle therapiert werden, wohingegen im Register aus Schleswig-Holstein auch die Patienten aus der ambulanten Versorgung enthalten sind, die den größten Teil der Gesamttumorlast darstellen. Da im vorliegenden Kontingent viele Tumore eine geringe Dicke aufweisen, erklärt sich der vermehrte Einsatz der PDT, deren Heilungserfolg bei dickeren Tumoren eingeschränkt ist (Breuninger 2010a). Da die Kryochirurgie nur in ausgewählten Behandlungsfällen zusätzlich zur operativen Therapie eine echte Option ist, ist der verringerte Einsatz dieser Methode im HTZ erklärbar. Der Einsatz dieser Alternative ist überwiegend bei inoperablen oder immunsupprimierten Personen gerechtfertigt (Karrer 2010). Dennoch zeigt sich, dass die operative Therapie von malignen epithelialen Hauttumoren auch im HTZ die geeignetste Therapieform darstellt. Trotz des hohen operativen Aufwands gelang eine vollständige Tumorentfernung jedoch nicht immer, da die Rate an Tumoren mit schnittrandständiger Resektion fast 18 Prozent betrug. Die R1-Rate ist damit als hoch einzuschätzen, was ebenfalls als Beleg dafür gewertet werden kann, dass in den Zentren eher komplexe, behandlungsintensive Tumorfälle versorgt werden. Die Analyse der Komplikationen der Therapien ist eine weitere wesentliche Kenngröße, welche die Qualität eines Zentrums definiert. Dabei war ersichtlich, dass lediglich bei 12 Prozent der operierten Primärfälle Komplikationen auftraten (v.a. Blutungs- und Wundheilungskomplikationen). Festgestellt werden konnte, dass die Wundinfekte offenbar nicht immer stringent codiert wurden, da die Wundheilungsinfektrate mit 3,8 Prozent sehr niedrig war. Offenbar werden viele Wundheilungsinfekte als Wundheilungsstörung (T.81.8) codiert. Werden beide zusammengezählt, entspricht dies der in der Literatur angegebenen Wundinfektrate. Die Fehlcodierung zeigt sich auch indirekt an der Verwendungshäufigkeit von Antibiotika. In 2010 erhielten 16 Patienten (5,5 Prozent) eine antibiotische Therapie aufgrund eines Wundinfekts, obwohl die offizielle Wundinfektionsrate lediglich 3,8 Prozent betrug. 57 4. Diskussion Die Blutungskomplikationsrate zeigt wiederum, dass bei den Patienten Nachblutungen als Komplikation relevant sind. Ob dies durch eine Blutgerinnungsstörungs-Therapie bedingt war (z.B. Marcumar), müsste im Einzelfall genauer aufgeschlüsselt werden. Das Tumoraufkommen in Ulm rekrutiert sich in erheblichem Maße aus Primärfällen. Die Analyse des Patientenguts zeigt aber weiterhin, dass die Nachsorge ihre Bedeutung hat, wie dies auch in der Literatur gezeigt wird (Guther 2011). Rund ein Drittel der Fälle rekrutiert das HTZ Ulm aus dem eigenen Nachsorgekontingent, was ebenfalls als Qualitätsmerkmal eines Zentrums gewertet werden kann. Die hohe Rezidivrate zeigt die Notwendigkeit von Nachsorgeuntersuchungen vor allem im ersten Jahr, der im HTZ Ulm eine hohe Bedeutung zugemessen wird. In diesem Zusammenhang sollte v.a. die mikrographisch kontrollierte Chirurgie verstärkt zum Einsatz kommen, da besonders diese Operationsart die Lokalrezidivrate zu senken vermag (Thissen et al.1999; Szeimies et al. 2005; Ridky 2007). Grundsätzliches Ziel der Versorgung muss sein, auch in Patientenkollektiven mit verzweigten Feldkanzerierungen (wie im vorliegenden Fall) die Quote der Tumorfreiheit deutlich zu steigern. 58 4. Diskussion 4.2 Analyse der Patientenbefragung In einem zweiten Block der Studie wurden die Patienten bezüglich ihrer persönlichen Risikofaktoren und ihres Verhaltens zu diesen Risikofaktoren analysiert. Hierzu wurde eine fragebogenbasierte, retrospektive Analysetechnik verwendet, die sich bereits in vielen anderen Studien bewährt hat. Die Analyse ergab, dass ein erheblicher Prozentsatz der Patienten am HTZ Ulm sowohl eine berufliche als auch eine in der Freizeit erworbene Exposition aufweist. Die berufliche Exposition ist bisher in dieser Form in einem vergleichbarem Kontingent noch nicht gezeigt worden und ist gerade vor dem Hintergrund der neu eingeführten Berufskrankheit Hautkrebs eine bedeutsame Kennzahl, welche die Wichtigkeit der Erfassung entsprechender Fälle unterstreicht, um künftig Versorgungsressourcen bereitstellen zu können. Seit Jahren ist jedoch grundsätzlich bekannt, dass UV-Strahlung Hautkrebserkrankungen verursachen kann. Anhand einer Untersuchung der IARC (International Agency for Research on Cancer) wird bei Arbeiten im Freien (Outdoor Workers) die UV-Dosis zwei- bis dreifach höher geschätzt als bei Beschäftigten in Innenräumen, den sog. Indoor Workers (IARC 1992). In einer deutschen Studie wurde die Sonnenlicht-Belastung von Landwirten gegenüber Indoor-Beschäftigten als 260-fach höher angegeben, was sich deutlich im vorliegenden Patientenkollektiv niederschlug. Eine sogar um 470 Prozent höhere UV-Licht-Belastung gegenüber den nicht UV-Licht belasteten Berufsgruppen wurde für Bauarbeiter berechnet (Knuschke et al. 2007). Grundsätzlich kann nicht nur die natürliche, sondern auch die künstlich erzeugte UV-Licht-Belastung die Entstehung von epithelialen Hauttumoren bedingen. So gelten z.B. Schweißer als hochexponiert, da künstlich erzeugtes UV-Licht je nach Schweißverfahren eine höhere UV-Belastung erzeugt als das Sonnenlicht (Diepgen 2010a). Festgehalten werden kann, dass bei knapp 1/3 der Patienten als Risikofaktor eine beruflich bedingte UV-Exposition vorlag, konkordant zum vorherrschenden ländlichen Versorgungsraum des HTZ. Die Freizeitbelastung in einer süddeutschen Region mit 400 bis 800 Höhenmetern und mehr wird ebenfalls im Patientengut als charakteristisches Merkmal unterstrichen und ist damit vermutlich ein lokal bedingter Risikofaktor in Süddeutschland, der allerdings nicht generell für das gesamte Bundesgebiet gelten kann. Die im Studienkollektiv nachgewiesene privat erworbene UV-Exposition wird in der Lite- 59 4. Diskussion ratur bestätigt, in der nachgewiesen wurde, dass Nordeuropäer, die ihren Urlaub in Florida verbrachten, sich einer doppelt so hohen UV-Belastung aussetzten als diejenigen, welche ihren Urlaub in der Heimat verbrachten (Diffey 2008). Für die Patienten im Einzugsbiet des HTZ ist bedeutsam, dass für den süddeutschen Raum viele Sonnenstunden charakteristisch sind (durchschnittlich 167 Tage pro Jahr). Grundsätzlich kann der regelmäßige ungeschützte Aufenthalt in der Sonne die UV-Belastung um mehr als 200 Prozent erhöhen (Diepgen 2010a). Festzuhalten bleibt daher, dass bei 50 Prozent der untersuchten Patienten auch der Risikofaktor einer privat erworbenen UV-Exposition vorlag, was auf die Notwendigkeit hinweist, in der Bevölkerung entsprechende Präventionsmaßnahmen zu verstärken. Übermäßige solare oder künstliche UV- Lichtexpositionen in der Freizeit erhöhen das Risiko, in späteren Lebensjahren an einem Hauttumor zu erkranken (Breitbart et al. 2010; Blaeser-Kiel 2008). Die weitere Analyse der internen Risikofaktoren ergibt, dass die meisten Patienten sich hinsichtlich der Verwendung von Sonnenschutz nach der Diagnose anders verhalten. Seit der Diagnose trat bei 81 Prozent der Patienten kein Sonnenbrand mehr auf. Bemerkenswerterweise zeigte sich 1/8 des Kollektivs trotz Diagnose uneinsichtig und setzte sich weiter dem hohen UV-Risiko eines Sonnenbrandes aus, was die Bedeutung von entsprechenden Aufklärungsmaßnahmen unterstreicht (Primärprävention). In Australien führten entsprechende Kampagnen zur Abnahme von Sonnenbränden in der Bevölkerung (Marks 1994; Marks 1995). Schutzmaßnahmen (z.B. Sonnenschutzcremes) werden immerhin von 70 Prozent der befragten Patienten angewendet. 1/3 misst diesen Maßnahmen trotz Diagnose weiterhin keine Bedeutung zu, obwohl dem Sonnenschutz als prophylaktische Maßnahme gegenüber der Induktion von epithelialen Neoplasien eine bedeutende Rolle zukommt (Steenvoorden u. Beijersbergen van Henegouwen 1999; Mang u. Krutmann 2003). Studien belegen, dass die Compliance für die Benutzung von Sonnenschutzmitteln durch Aufklärungskampagnen gesteigert werden kann (Hill et al. 1993). Inwiefern die 30 Prozent der sich bisher resistent verhaltenden Patienten der Studie von einer notwendigen Verhaltensänderung überzeugt werden können, bleibt jedoch unklar. 60 4. Diskussion Ferner ist ersichtlich, dass die Patienten häufig sehr lange warten bis ein Arzt konsultiert wird, obwohl ein hoher Prozentsatz von ihnen den Tumor selbst bemerkt hat, was ebenfalls neu ist und bisher nicht gezeigt werden konnte. Bezüglich der Prognose ist aber vor allem der Faktor Früherkennung von Bedeutung. Je früher epitheliale Hauttumore entdeckt werden, desto günstiger ist in der Regel der klinische Verlauf (Spieth 2013). Die Patienten wurden im Rahmen ihrer Selbsteinschätzung ebenfalls nach ihrem Hauttyp gefragt, was bereits in früheren Doktorarbeiten praktiziert wurde und Rückschlüsse bzgl. des eigenen Risikoverhaltens zulässt. Während sich Melanom-Patienten gemäß der Umfrage einer anderen Arbeit als hautunempfindlicher einschätzten als dies nach Fitzpatrick (1975) zu erwarten gewesen wäre (Neckermann 2011), ergab die Befragung im vorliegenden Patientenkollektiv gegensätzliche Ergebnisse. Hier schätzten sich mehr Patienten als lichtempfindlich ein, als sie es nach Fitzpatrick tatsächlich waren und sie verhielten sich deshalb bzgl. der privaten UV-Exposition vermutlich vorsichtiger. Hier wären weitere Studien zur Untersuchung dieses Risikofaktors vonnöten, wenngleich der Hauttyp nach Fitzpatrick als risikobestimmender Faktor in der neueren Literatur kritisch gesehen wird (Ravnbak 2010). Offenbar können bei Zuhilfenahme des Modells große Unsicherheiten in der Einstufung sowohl für die Patienten als auch für die Experten entstehen, weswegen neuerdings auch vom Bundesamt für Strahlenschutz ein modifizierter Fragebogen empfohlen wird (Tacke u. Dietrich 2010). Bestätigt werden konnte bei der Analyse des am HTZ Ulm versorgten Patientengutes auch die Bedeutung der familiären und eigenen Vorbelastung. Allgemein entwickeln „belastete“ Patienten mit Krebsereignissen in der Vergangenheit häufiger Tumoren als „unbelastete“ Patienten, ebenso wie Menschen, bei denen bereits Familienangehörige erkrankt waren (Cantwell et al. 2009; Frankel et al. 1992). Die Auswertung ergab, dass ein Viertel der Patienten bereits früher an Hauttumoren erkrankt war, was den allgemeinen Forschungsstand der Literatur bestätigt. Knapp 20 Prozent der Befragten wies darüber hinaus eine positive Familienanamnese bezüglich der Erkrankung von Angehörigen auf. Die hohe Anzahl von Patienten mit Vorerkrankung und familiärer Disposition unterstreicht die Bedeutung beider Risikofaktoren. Abschließend wurden die Patienten nach ihrer Zufriedenheit mit der Behandlung befragt. Wie schon in einer vorherigen Befragung gezeigt werden konnte, hat sich 61 4. Diskussion diese Qualitätskennzahl positiv entwickelt, da 91 Prozent der befragten Patienten mit der medizinischen Behandlung am HTZ Ulm zufrieden waren. In dieser Hinsicht hat sich das HTZ Ulm offenbar verbessert, da die Patientenzufriedenheit bei den 2008 befragten Melanom-Patienten geringer war (Neckermann 2011). 4.3 Beantwortung der Leitfragen 1. Welche epidemiologischen Besonderheiten zeigte das selektionierte Patientenkollektiv der Hautklinik Ulm im Jahr 2010? Jeder zweite der über 400 Patienten war von mehreren epithelialen Neoplasien betroffen, wobei sich das Kontingent in 2/3 Primär- und 1/3 Nachsorgefälle aufteilte. Die häufigsten Tumore waren Basalzellkarzinome. Im Patientenkollektiv waren mehr Männer waren als Frauen erkrankt. Das Durchschnittsalter des Ulmer Patientenkollektivs lag bei 71,5 Jahren und die Patienten waren im Bundesvergleich präadipös. 2. Welches Expositionsverhalten bezüglich bekannter Risikofaktoren zeigte das Patientenkollektiv des HTZ, v.a. im Bezug auf die UV-Exposition? Wie hoch war die Compliance der Patienten mit den therapeutischen Maßnahmen insbesondere in Bezug auf die bekannten Risikofaktoren? Etwa 1/3 der Befragten bejahte eine arbeitsbedingte UV-Exposition, mehr als die Hälfte der Patienten gab an, sich in der Freizeit häufig in übermäßiger Weise UV-Strahlung auszusetzen, wobei der Anteil der regelmäßigen Sonnenstudiobesucher erfreulicherweise gering war. Knapp 60 Prozent der Patienten (und damit deutlich mehr als erwartet) ordneten sich den besonders anfälligen Hauttypen I und II zu und erfüllten damit die Kriterien eines dritten Risikofaktors. Neben den therapeutischen Maßnahmen muss die Compliance als optimierungsbedürftig bezeichnet werden, da 30 Prozent der Patienten auf die Verwendung von Sonnenschutzprodukten verzichteten und 15 Prozent neue Sonnenbrände in Kauf nahmen. 62 4. Diskussion 3. Welche topographischen Besonderheiten ergaben sich hinsichtlich der Lokalisation der epithelialen Hauttumoren? Das Verteilungsmuster deckt sich mit den Erkenntnissen der Literatur und zeigt klar die bevorzugte Lokalisation im Kopf-, Hals- und Gesichtsbereich. Generell waren die chronisch weniger UV-belichteten Körperoberflächen, wie z.B. im Rumpfbereich oder die oberen und unteren Extremitäten nur in etwa 1/4 der Fälle betroffen. 4. Welche Therapieansätze wurden verwendet? Was ergab die Analyse der operativen Versorgung? Im untersuchten Patientenkollektiv wurden 9/10 aller Behandlungsfälle operativ versorgt, davon zwei Drittel mit einer OP, ein Drittel mit zwei bis fünf Eingriffen und 1/10 mit mehr als fünf Prozeduren. Fast drei Viertel der Tumore wurden mittels radikaler Exzision entfernt. Bei der postoperativen Nachuntersuchung auf Tumorfreiheit wurden in 82 Prozent der Fälle bei der histologischen Kontrolle keine kanzerogenen Anteile mehr im Exzidat nachgewiesen. Vom gesamten Kollektiv wurden 37 Prozent der Patienten auch konservativ behandelt, wie z.B. mittels der PDT, die am HTZ Ulm die am häufigsten zusätzlich angewendete Therapie darstellt. 5. Wie hoch war die Komplikationsrate während der Therapie und welche Komplikationen traten auf? Im Jahre 2010 sind von den 316 Operationsfällen der 292 Primärpatienten insgesamt 37 Komplikationen aufgetreten, davon teilweise mehrere pro Patient. Neben der Nachblutung ist die Wundinfektion in 3,8 Prozent der Behandlungsfälle als zweithäufigste Komplikation aufgetreten. Die Rate ist sehr niedrig, da Wundinfekte teilweise offenbar mit anderen Codes codiert wurden. 6. Welche Aussagen lassen sich bezüglich der Patientenzufriedenheit treffen? 91 Prozent der befragten Patienten waren mit der medizinischen Behandlung und mit dem allgemeinen Ablauf in der Klinik zufrieden. Der Anteil der mit der Versorgung zufriedenen Patienten ist im Vergleich zum Zeitraum 2004 bis 2008 angestiegen. 63 5. Zusammenfassung 5. Zusammenfassung Die vorliegende retrospektive Studie diente einerseits der Erfassung der epithelialen Hauttumoren, die im Jahre 2010 am Hauttumorzentrum (HTZ) in Ulm versorgt wurden und anderseits der Generierung von Qualitätskennzahlen. Insgesamt wurden 835 Tumore bei 416 Patienten behandelt, davon 277 Primärpatienten mit 413 zu behandelnden Tumoren. Dazu wurden die Patientenakten ausgewertet und eine Patientenbefragung durchgeführt. Die dabei ermittelte Rezidivrate unterstreicht die Notwendigkeit von Nachsorgemaßnahmen. Grundsätzlich wurde festgestellt, dass die Verteilung der Tumorfälle innerhalb des Kollektivs aufgrund der für ein HTZ typischen Komplexität nicht mit den Durchschnittswerten der nationalen Krebsregister übereinstimmte. Bestätigt wurden die grundsätzlichen Annahmen bezüglich der topographischen Verteilung, da der überwiegende Turmoranteil des Studienkollektivs im Mittelgesichtsbereich lokalisiert war. Fast alle Patienten wurden operativ versorgt, die meisten davon mit schnittrandkontrollierten Verfahren. Im Rahmen der Patientenbefragung konnte die signifikante Bedeutung der Risikofaktoren Exposition mit Ultraviolettem Licht (UV), Hauttyp und genetische Disposition bestätigt werden. 1/3 des Patientenkollektivs wies eine arbeitsbedingte UVExposition auf, etwa die Hälfte gab an, sich privat häufig im Übermaß in der Sonne aufzuhalten. Mehr als die Hälfte der Patienten konnte den besonders empfindlichen Hauttypen I und II zugeordnet werden, 1/5 hatte eine positive Familienanamnese. Die Studie konnte zeigen, dass 20 Prozent der operierten epithelialen Tumoren zufällig entdeckt wurden. Knapp 80 Prozent der Patienten bemerkten den Tumor zwar selbst, konsultierten im Durchschnitt aber erst nach fast drei Jahren einen Arzt. Daraus resultierte die Notwendigkeit eines aufwendigeren operativen Vorgehens, welches bei einer zeitnahen Diagnosestellung vermieden worden wäre. Notwendig erscheinen Maßnahmen der Patientenaufklärung, um die Tumore künftig möglichst in einem früheren Stadium mit einer geringeren Latenzzeit zwischen Erkennung und Operation zu erfassen. Erfreulicherweise waren 91 Prozent des untersuchten Kollektivs mit der Behandlung am HTZ zufrieden. 64 6. Literaturverzeichnis 6. Literaturverzeichnis 1. Alam M, Ratner D: Cutaneous squamous-cell carcinoma. N Engl J Med 344: 975983 (2001) 2. Arbeitskreis Dermatologie der DDG im Internet: Plattenepithelkarzinom der Haut einschließlich des Unterlippenrotes und der Augenlider (Spinaliom, Stachelzellkarzinom), URL: http://www.derma.de/de/daten/leitlinien/leitlinien/plattenepithelkarzinom/ (Stand: 30.12.2013) 3. Babilas P, Karrer S, Sidoroff A, Landthaler M, Szeimies RM: Photodynamic therapy in dermatology--an update. Photodermatol Photoimmunol Photomed 21: 142149 (2005) 4. Barbezat R, Dummer R, Hertel I, Huber C, Panizzon R: Basaliom, Spinaliom, Vorstufen: Eine Information der Krebsliga, für Betroffene und Angehörige. In: Lanz S (Hrsg.) Heller Hautkrebs, Krebsliga Schweiz, Bern, S. 21-33 (2008) 5. Bauer A, Diepgen T, Schmitt J: Is occupational solar ultraviolet irradiation a relevant risk factor for basal cell carcinoma? A systematic review and meta-analysis of the epidemiological literature. Br J Dermatol 165: 612–625 (2011) 6. Bayerisches Staatsministerium der Justiz und für Verbraucherschutz: BodyMass-Index-Ergebnisse aus der Mikrozensus-Befragung , URL: http://www.vis.bayern.de/ernaehrung/ernaehrung/uebergewicht/bmi.htm (04.02.2013) 7. Beer TW, Shepherd P, Theaker JM: Ber EP4 and epithelial membrane antigen aid distinction of basal cell, squamous cell and basosquamous carcinomas of the skin. Histopathology 37: 218-223 (2000) 8. Blaeser-Kiel G: Hautkrebsprävention, Deutschland weltweit als Vorreiter. Deutsches Ärtzeblatt 26: 1436-1438 (2008) 9. BMG (Bundesministerium für Gesundheit): Nationaler Krebsplan – Handlungsfelder, Ziele und Umsetzungsempfehlungen, Berlin (2012), URL: https://www.bundesgesundheitsministerium.de/fileadmin/dateien/Publikationen/Pra evention/Broschueren/Broschuere_Nationaler_Krebsplan__Handlungsfelder__Ziele_und_Umsetzungsempfehlungen.pdf (Stand: 15.01.2014). 10. Böer A, Steinkraus V: Empfehlungen für die Diagnostik und Therapie des Plattenepithelkarzinoms, Diagnostik (klinisches Bild und Histopathologie). In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 513-521 (2010) 11. Boulinguez S, Grison-Tabone C, Lamant L, Valmary S, Viraben R, Bonnetblanc JM, Bédane C: Histological evolution of recurrent basal cell carcinoma and therapeutic implications for incompletely excised lesions. Br J Dermatol 151: 623-626 (2004) 12. Brantsch KD, Meisner C, Schönfisch B, Trilling B, Wehner-Caroli J, Röcken M, Breuninger H: Analysis of risk factors determining prognosis of cutaneous squamous-cell carcinoma: a prospective study. Oncol 9: 713-720 (2008) 13. Breitbart EW, Wende A, Mohr P, Greinert R, Volkmer B, Dermatologisches Zentrum Buxtehude ,Elbe Kliniken: Hautkrebs, aus der Reihe „Gesundheitsberichterstattung des Bundes“. Robert Koch-Institut 22: 1-37 (2004) 14. Breibart EW, Volkmer B, Greinert R: Prävention von Hauttumoren. Primäre Prävention. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York S. 747-754 (2010) 15. Breuninger H, Sebastian G, Kortmann RD, Schwipper V, Werner J, Garbe C: Deutsch Leitlinie : Basalzellkarzinom. In: Garbe C (Hrsg.) Interdisziplinäre Leitlinie zur Diagnostik und Behandlung von Hauttumoren. Georg Thieme Verlag, Stuttgart New York, S. 1-11 (2005a) 65 6. Literaturverzeichnis 16. Breuninger H, Bootz F, Hauschild A, Kortmann RD, Wolff K, Stockfleth E, Szeimies M, Rompel R, Garbe C: Kurzleitlinie-Plattenepithelkarzinom der Haut. J Journal der Deutschen Dermatologischen Gesellschaft 6: 5-8 (2008) 17. Breuninger H: Empfehlungen für die Diagnostik und Therapie des Basalzellkarzinoms, Dermatochirurgie inklusive mikroskopisch kontrollierte Chirurgie. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 492-499 (2010a) 18. Breuninger H: Empfehlungen für die Diagnostik und Therapie des Plattenepithelkarzinoms, Dermatochirurgie inklusive mikroskopisch kontrollierte Chirurgie. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 522-525 (2010b) 19. Brewster DH, Bhatti LA, Inglis JHC, Nairn ER, Doherty VR: Recent trends in incidence of nonmelanoma skin cancers in the East of Scotland, 1992-2003. Br J Dermatol 156: 1295-1300 (2007) 20. Brill TJ, Kaufmann R: Maligne epitheliale Tumoren. In: Schöfer H, Baur-Beger S (Hrsg.) Derma-Net-Online 2010: Aktuelle Dermatologie für Dermatologen und dermatologisch Interessierte. BBS Verlag, Wiesbaden, S. 1-17 (2010) 21. Buettner PG, Raasch BA: Incidence rates of skin cancer in Townsville, Australia. Int J Cancer 78: 587-593 (1998) 22. Bundesamt für Strahlenschutz: Geprüftes Sonnenstudio. Zertifizierungskriterien des Bundesamts für Strahlenschutz. Bundesamt für Strahlenschutz (Hrsg.). UV Fibel. Braunschweig-druck Gmbh. Braunschweig, S. 1- 47 (2007) 23. Cantwell MM, Murray LJ, Catney D, Donnelly D, Autier P, Boniol M, Fox C, Middleton RJ, Dolan OM, Gavin AT: Second primary cancers in patients with skin cancer: a population-based study in Northern Ireland. Br J Cancer 100: 174-177 (2009) 24. DDG (Deutsche Dermatologische Gesellschaft): Qualitätssicherung “Kryochirurgie in der Dermatologie“, AWMF-Empfehlung (2008), URL: http://www.awmf.org/fileadmin/user_upload/Die_AWMF/Service/Gesamtarchiv/QSEmpfehlung/Kryochirurgie_in_der_Dermatologie.pdf (Stand: 30.12.2013). 25. de Vries E, Louwman M, Bastiaens M, de Gruijl F, Coebergh JW: Rapid and continuous increases in incidence rates of basal cell carcinoma in the southeast Netherlands since 1973. J Invest Dermatol 123: 634-638 (2004) 26. Diepgen TL, Mahler V: The epidemiology of skin cancer. Br J Dermatol 146: 1-6 (2002) 27. Diepgen TL: Epitheliale Hauttumoren. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 87-92 (2010a) 28. Diepgen TL, Fartasch M, Heinrichs KFB, Siekmann H, Ullrich Jens, Zagrodnik FD: Hautkrebs nach UV-Strahlungsexposition Eine Hilfestellung für die BKSachbearbeitung. In: DGUV Deutsche Gesetzliche Unfallversicherung (Hrsg.) URL: http://www.dguv.de/ifa/de/fac/strahl/pdf/rundschreiben_hautkrebs_nach_UVStrahlungsexposition.pdf S.1-42 (2010b) 29. Diffey B: A Behavioral Model for Estimating Population Exposure to Solar Ultraviolet Radiation. Photochemistry and Photobiology 84: 371–375 (2008) 30. DIMDI (Deutsches Institut für Medizinische Dokumentation und Information) (2013): ICD-10-GM Version 2013, Kapitel II: Neubildungen (C00-D48); Melanom und sonstige bösartige Neubildungen der Haut (C43-FC44), URL: http://www.dimdi.de/static/de/klassi/icd-10gm/kodesuche/onlinefassungen/htmlgm2014/block-c43-c44.htm (Stand: 17.12.2013). 31. Dubas LE, Ingraffea A: Nonmelanoma skin cancer. Facial Plast Surg Clin North Am 21: 43-53 (2013) 32. Eide MJ, Weinstock MA, Dufresne RG Jr, Neelagaru S, Risica P, Burkholder GJ, Upegui D, Phillips KA, Armstrong BK, Robinson-Bostom L: Relationship of treat- 66 6. Literaturverzeichnis ment delay with surgical defect size from keratinocyte carcinoma (basal cell carcinoma and squamous cell carcinoma of the skin). J Invest Dermatol 124: 308- 314 (2005) 33. Fartasch M, Diepgen TL, Schmitt J, Drexler H: The relationship between occupational sun exposure and non-melanoma skin cancer: clinical basics, epidemiology, occupational disease evaluation, and prevention. Dtsch Arztebl Int. 43: 715-720 (2012) 34. Fitzpatrick TB: Soleil et peau. J Med Esthet 2: 33-34 (1975) 35. Frankel DH, Hanusa BH, Zitelli JA: New primary nonmelanoma skin cancer in patients with a history of squamous cell carcinoma of the skin. Implications and recommendations for follow-up. J Am Acad Dermatol 26: 720-726 (1992) 36. Garbe C: Epidemiologie des Hautkrebses. In: Garbe C, Dummer R, Kaufmann R, Tilgen W (Hrsg.) Dermatologische Onkologie . Springer, Berlin, Heidelberg, S. 4056 (1997) 37. Glaeske G: Versorgungsforschung in Deutschland – mit Blick auf die Ernährungsmedizin, Aktuel Ernahrungsmed 37: 337-342 (2012) 38. Glover MT, Niranjan N, Kwan JT, Leigh IM: Non-melanoma skin cancer in renal transplant recipients: the extent of the problem and a strategy for management. Br J Plast Surg 47: 86-89 (1994) 39. Guther S: Entwicklung eines Risikomodells für das Auftreten von Hauttumoren anhand des bayerischen Hautkrebs- Screeningprogrammes unter Berücksichtigung der Kosten- Nutzen- Relation. Med. Dissertation, Universität München (2011) 40. Hafner J, Kempf W, Hess Schmid M, Kurz M, Urosevic M, Drummer R, Burg G: Epithelilale Hauttumore: Eine interdisziplinäre Aufgabe für Grundversorger und Spezialisten, Schweiz Med Forum 16: 369-375 (2002) 41. Häfner HM, Schnabl S, Breuninger H, Schulz C: Chirurgische Therapie der epithelilalen Hauttumore und ihrer Vorstufen, Der Hautarzt 64 (8): 558-566 (2013) 42. Hamm H, Höger PH: Skin tumors in childhood. Dtsch Arztebl Int 108: 347-353 (2011) 43. Hauschild A, Breuninger H, Kaufmann R, Kortmann RD, Schwipper V, Werner J, Reifenberger J, Dirschka T, Garbe C: Short German guidlines: Basal cell carcinoma. Journal der Deutschen Dermatologischen Gesellschaft 6: 2-4 (2008) 44. Heenan PJ, Elder DJ, Sobin LH: Histological typing of skin tumors. 26. WHO International Histological Classification of Tumors. Berlin, Heidelberg, New York: Springer (1996) 45. Hein R: Nachsorge von Hauttumoren, Epitheliale Tumoren und andere Tumorentitäten. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 526-528 (2010) 46. Hensen P, Müller ML, Rompel R, Roeder N: Komplikationen bei Eingriffen. Komplikation nach Infusionen, Transfusionen oder Injektionen. In: Deutschen Dermatologischen Gesellschaft (DDG) und der DRG-Research-Group, Universitätsklinikum Münster (Hrsg.) Kodierleitfaden Dermatologie Version 2011, Ein Leitfaden für die klinische Praxis. Schüling-Verlag, Münster, S. 76 (2011b) 47. Hill D, White V, Marks R, Borland R: Changes in sun-related attitudes and behaviours, and reduced sunburn prevalence in a population at high risk of melanoma. Eur J Cancer Prev 2: 447-456 (1993) 48. Hoey SEH, Devereux CEJ, Murray L, Catney D, Gavin A, Kumar S, Donnelly D, Dolan OM: Skin cancer trends in Northern Ireland and consequences for provision of dermatology services. Br J Dermatol 156: 1301-1307 (2007) 49. HTZ Ulm: Chirurgie epithelialer Tumore am Hauttumorzentrum Ulm. Eine Analyse, Präsentation 2013. 50. Hu B, Castillo E, Harewood L, Ostano P, Reymond A, Dummer R, Raffoul W, Hoetzenecker W, Hofbauer GF, Dotto GP: Multifocal epithelial tumors and field cancerization from loss of mesenchymal CSL signaling. Cell.149: 1207-1220 (2012) 67 6. Literaturverzeichnis 51. IARC, Cancer IAfRo: Solar and ultraviolet radiation. Lyon: International Agency for Research on Cancer. 1-68 (1992) 52. Johnson TM, Rowe DE, Nelson BR, Swanson NA: Squamous cell carcinoma of the skin (excluding lip and oral mucosa). J Am Acad Dermatol 26: 467-484 (1992) 53. Karrer S: Empfehlungen für die Diagnostik und Therapie des Plattenepithelkarzinoms, Kryochirurgie, Lasertherapie und photodynamische Therapie. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 526-528 (2010) 54. Katalinic A: Aktuelle Zahlen zur Häufigkeit von Hautkrebs in Deutschland. In: Pressekonferenz Hautkrebs-Screening, 20.04.2010, Berlin, Krebsregister Schleswig- Holstein(Hrsg.) http://www.krebsregistersh.de/aktuelles/PK_HautkrebsScreening.pdf S.2 (2010) 55. Kaufmann R, Linhart C, Wolter M: Empfehlungen für die Diagnostik und Therapie des Basalzellkarzinoms, Diagnostik (klinisches Bild, Histologie, Dermatoskopie, Fluoreszenzdiagnostik). In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 483-491 (2010) 56. Kempf W: Pathogenese epithelialer Hauttumoren, Vortrag, medicos 2: 21-25 (2008), URL: http://www.rosenfluh.ch/images/stories/publikationen/medicos/200802/06_Hauttumore_2.08_.pdf (Stand: 27.12.2013) 57. Knuschke P, Unverricht I, Ott G, Janßen M: Personenbezogene Messung der UVExposition von Arbeitnehmern im Freien. Abschlussbericht zum Projekt „Personenbezogene Messung der UV-Exposition von Arbeitnehmern im Freien“ - Projekt F 1777 - im Auftrag der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, S.9160 (2007) 58. Kwa RE, Campana K, Moy RL: Biology of cutaneous squamous cell carcinoma. J Am Acad Dermatol 26: 1-26 (1992) 59. Leibovitch I, Huilgol SC, Selva D, Hill D, Richards S, Paver R: Cutaneous squamous cell carcinoma treated with Mohs micrographic surgery in Australia I. Experience over 10 years. J Am Acad Dermatol 53: 253-260 (2005) 60. Mang R, Krutmann J: Sun protection during holidays. Hautarzt 54: 498-505 (2003) 61. Marcil I, Stern RS: Risk of Developing a Subsequent Nonmelanoma Skin Cancer in Patients With a History of Nonmelanoma Skin Cancer. A Critical Review of the Literature and Meta-analysis. Arch Dermatol 136: 1524-1530 (2000) 62. Marks R: Melanoma prevention: is it possible to change a population's behavior in the sun? Pigment Cell Res 7: 104-106 (1994) 63. Marks R: Skin cancer control in Australia. The balance between primary prevention and early detection. Arch Dermatol 131: 474-478 (1995) 64. Miller DL, Weinstock MA: Nonmelanoma skin cancer in the United States: incidence. J Am Acad Dermatol 30: 774-778 (1994) 65. Moll I: Basalzellkarzinom, in: Moll, I: Duale Reihe Dermatologie, Thieme-Verlag, Stuttgart, S. 302-310 (2010). 66. Neckermann V: Sentinel- Lymphknoten- Biopsien beim malignen Melanom in der Klinik für Dermatologie und Allergologie Ulm von 2004 bis 2008. Med Dissertation, Universität Ulm (2011) 67. Petter G, Haustein UF: Seltene und neu beschriebene histologische Varianten des kutanen Plattenepithelkarzinoms : Klassifikation nach Histopathologie, Zytomorphologie und Malignität. Hautarzt 52: 288-297 (2001) 68. Plötz SG, Hein R, Ring J: Epitheliale maligne Hauttumoren („weißer Hautkrebs“). In: Plötz SG, Hein R, Ring J (Hrsg.): Häufige Hauttumoren in der Praxis, SpringerVerlag, Berlin, Heidelberg, S. 101-120 (2012) 69. Pritzkuleit R, Holzmann M, Raspe H, Katalinic A: Krebs in Schleswig-Holstein. Inzidenz und Mortalität im Jahr 2007. Schmidt-Römhild-Verlag, Lübeck, S.18-49 (2010) 68 6. Literaturverzeichnis 70. Pfaff H: Versorgungsforschung – Begriffsbestimmung, Gegenstand und Aufgaben, in: Pfaff et al. (Hrsg..): Gesundheitsversorgung und Disease Management – Grundlagen und Anwendungen der Versorgungsforschung, Bern, S. 13-23 (2003) 71. Pukkala E, Martinsen JI, Lynge E, Gunnarsdottir HK, Sparén P, Tryggvadottir L, Weiderpass E, Kjaerheim K: Occupation and cancer - follow-up of 15 million people in five Nordic countries. Acta Oncol. 48: 646-790 (2009) 72. Rassner G: Plattenepithelkarzinom. In: Rassner G (Hrsg.) Dermatologie Lehrbuch und Atlas, 8. Aufl, Urban &Fischer Verlag, München Jena, S. 246-250 (2008a) 73. Rassner G: Basalzellkarzinom. In: Rassner G (Hrsg.) Dermatologie Lehrbuch und Atlas, 8. Aufl, Urban &Fischer Verlag, München Jena, S. 239-243 (2008b) 74. Ravnbak MH: Objective determination of Fitzpatrick skin type. Dan Med Bull 57: 120 (2010) 75. Reifenberger J, Schön MP: Epitheliale Tumoren der Haut: Molekulare Grundlagen und pathogeneseorientierte Therapie, Hautarzt 54: 1164-1170 (2003) 76. Reifenberger J, Ruzicka T: Basalzellkarzinom. In: Braun-Falco O, Plewig G, Wolff HH. Burgdorf HC, Landthaler M (Hrsg.). Dermatologie und Venerologie. Springer, Berlin, Heidelberg, New York S.1250-1259 (2005) 77. Reifenberger J: Genetische Aspekte. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M (Hrsg.) Tumoren der Haut. Georg Thieme Verlag, Stuttgart New York, S. 23-40 (2010) 78. Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M: Body-mass index and incidence of cancer: a systematic review and meta-analysis of prosSCCtive observational studies. Lancet. 371: 569-578 (2008) 79. Rhodes LE, de Rie M, Enström Y, Groves R, Morken T, Goulden V, Wong GA, Grob JJ, Varma S, Wolf P: Photodynamic therapy using topical methyl aminolevulinate vs surgery for nodular basal cell carcinoma: results of a multicenter randomized prosSCCtive trial. Arch Dermatol 140: 17-23 (2004) 80. Ridky TW: Nonmelanoma skin cancer. J Am Acad Dermatol 57: 484-501 (2007 81. Robert Koch- Institut: Alkoholkonsum [ Gesundheit in Deutschland aktuell (GEDA 2011)]. In: Lange C, Ziese T Robert Koch- Institut (Hrsg.) Beiträge zur Gesundheitsberichtserstattung des Bundes. Oktoberdruck, Berlin, S. 121-124 (2009) 82. Robert Koch-Institut und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg.). In: Krebs in Deutschland 2007/2008, 8. Ausgabe, Berlin, S. 9 (2012) 83. Rowe DE, Carroll RJ, Day CL Jr: Mohs surgery is the treatment of choice for recurrent (previously treated) basal cell carcinoma. J Dermatol Surg Oncol. 15: 424431 (1989) 84. Rowe DE, Carroll RJ, Day CL Jr. : Prognostic factors for local recurrence, metastasis, and survival rates in squamous cell carcinoma of the skin, ear, and lip. Implications for treatment modality selection. J Am Acad Dermatol. 26: 976-990 (1992) 85. Rubin Al, Chen EH, Ratner D: Basal-cell carcinoma. N Engl J Med 353: 22622269 (2005) 86. Sackett D, Rosenberg W, Gray J, Haynes R, Richardson W: Was ist Evidenzbasierte Medizin und was nicht? Munch Med Wochenschr; 139: 644-645 (1997) 87. Sekulic A, Migden MR, Oro AE, Dirix L, Lewis KD et al.: Efficacy and safety of Vismodegib in Advanced Basal-Cell Carcinoma, N Engl J Med 366: 2171-2179 (2012) 88. Sexton M, Jones DB, Maloney ME: Histologic pattern analysis of basal cell carcinoma: study of series of 1039 consecutive neoplasma. J Am Acad Dermatol. 23: 1118-1126 (1990) 89. Skellett AM, Hafiji J, Greenberg DC, Wright KA, Levell NJ: The incidence of basal cell carcinoma in the under-30s in the UK. Clin Exp Dermatol. 37: 227-229 (2012) 90. Slattery ML, Sweeney C, Wolff R, Herrick J, Baumgartner K, Giuliano A, Byers T.: Genetic variation in IGF1, IGFBP3, IRS1, IRS2 and risk of breast cancer in women 69 6. Literaturverzeichnis living in Southwestern United States. Breast Cancer Res Treat 104: 197-209 (2007) 91. Snow SN, Sahl W, Lo JS, Mohs FE, Warner T, Dekkinga JA, Feyzi J: Metastatic basal cell carcinoma. Report of five cases. Cancer 73: 328-335 (1994) 92. Spieth K: Schneiden, Cremen und Rotlicht helfen bei Hautkrebs. Forschung und Praxis. Ärzte Zeitung. 01.08.2005 http://www.aerztezeitung.de/medizin/krankheiten/krebs/hautkrebs/article/366616/s chneiden-cremen-rotlicht-helfen-hautkrebs.html (06.03.2013) 93. St Guily JL, Clavel C, Okaïs C, Prétet JL, Beby-Defaux A, Agius G, Birembaut P, Jacquard AC, Léocmach Y, Soubeyrand B, Riethmuller D, Denis F, Mougin C: Human papillomavirus genotype distribution in tonsil cancers. Head Neck Oncol 3: 6 (2011) 94. Stadt Ulm: Einwohner Bevölkerungsentwicklung http://www.ulm.de/wirtschaft_wissenschaft/standort/einwohner.3969.3076,3894, 8654,3576,3969.htm (2013) 95. Staples MP, Elwood M, Burton RC, Williams JL, Marks R, Giles GG: Nonmelanoma skin cancer in Australia: the 2002 national survey and trends since 1985. Med J Aust 184: 6-10 (2006) 96. Steenvoorden DP, Beijersbergen van Henegouwen G: Protection against UVinduced systemic immunosuppression in mice by a single topical application of the antioxidant vitamins C and E. Int J Radiat Biol 75: 747-755 (1999) 97. Stockfleth E (Ed.): Skin cancer after organ transplantation. Springer: New York (2009) 98. Stoffels I, Müller M, Geisel MH, Leyh J, Pöppel T, Schadendorf D, Klode J: Costeffectiveness of preoperative SPECT/CT combined with lymphoscintigraphy vs. lymphoscintigraphy for sentinel lymph node excision in patients with cutaneous malignant melanoma. Eur J Nucl Med Mol Imaging 41: 1723-1731 (2014). 99. Sung J, Song YM, Lawlor DA, Smith GD, Ebrahim S: Height and site-sSCCific cancer risk: A cohort study of a korean adult population. Am J Epidemiol 170: 5364 (2009) 100. Szeimies RM, Karrer S, Bäcker H: [Therapeutic options for epithelial skin tumors. Actinic keratoses, Bowen disease, squamous cell carcinoma, and basal cell carcinoma]. Hautarzt 56: 430-440 (2005) 101. Tacke J, Dietrich J: Wissenschaftlicher Hintergrund zur Hauttyp-Bestimmung, Die Bestimmung der Sonnenempfindlichkeit mittels Fragebogen, Eine Weiterentwicklung der Fitzpatrick-Hauttypen, S. 1-9 (2010), URL: http://www.melanominfo.org/?q=en/node/47 (Stand: 02.12.2014) 102. Terhorst D: Spinalzellkarzinom und Pseudokanzerosen. In: Terhorst D (Hrsg.) Dermatologie. Urban&Fischer Verlag, München Jena, S. 104-105 (2005) 103. Thissen MR, Neumann MH, Schouten LJ: A systematic review of treatment modalities for primary basal cell carcinomas. Arch Dermatol 135: 1177-83 (1999) 104. Trakatelli M, Ulrich C, Del Marmol V, Euvrard S, Stockfleth E, Abeni D: Epidemiology of nonmelanoma skin cancer (NMSC) in Europe: accurate and comparable data are needed for effective public health monitoring and interventions. Br J Dermatol 156: 1-7 (2007) 105. Universitätsklinikum Ulm: Dermatologie und Allergologie, URL; http://www.uniklinik-ulm.de/struktur/kliniken/dermatologie-undallergologie/home/leistungen/schwerpunkte.html (Stand: 15.01.2014). 106. Wiedemeyer K, Hartschuh W: Trichoblastomie mit Merkelzellvermehrung im Nävi sabacei bei Schimmelpenning-Feuerstein-Mims-Syndrom – bessere histologische Differenzierung zwischen Trichoblastomen und Basaliomen. JDDG 7: 612-615 (2009) 107. Wittekind C, Meyer HJ, Bootz F: UICC (International Union against Cancer), TNM Klassifikation maliger Tumoren. 6. Auflage, Spinger Berlin, Heidelberg, New York, Tokio (2002) 70 6. Literaturverzeichnis 108. Zanetti R, Rosso S, Martinez C, Nieto A, Miranda A, Mercier M, Loria DI, Østerlind A, Greinert R, Navarro C, Fabbrocini G, Barbera C, Sancho-Garnier H, Gafà L, Chiarugi A, Mossotti R: Comparison of risk patterns in carcinoma and melanoma of the skin in men: a multi-centre case-case-control study. Br J Cancer 94: 743-751 (2006) 71 Anhang: Tabellenverzeichnis Anhang Tabellenverzeichnis Tabelle 1: jährliche Hautkrebs-Inzidenz, Hochrechnungen für Deutschland ......... 2 Tabelle 2: Differenzialdiagnosen eines Basalzellkarzinoms der Haut, aufgeteilt nach benignen, malignen und präkanzerösen dermalen Veränderungen ........ 8 Tabelle 3: TNM-Klassifikation für das Plattenepithelkarzinom der Haut ............... 10 Tabelle 4: UICC-Stadieneinteilung von Plattenepithelkarzinomen ....................... 11 Tabelle 5: Korrelation der Tumordicke mit dem Metastasierungsrisiko bei Hautkrebs ..................................................................................................... 12 Tabelle 6: statistische Zusammensetzung des Gesamtkollektivs ......................... 22 Tabelle 7: Konfiguration der Tumortypen insgesamt, n=416 Patienten ................ 24 Tabelle 8: ICD-10-Kodierung C44.- Sonstige bösartige Neubildungen der Haut . 28 Tabelle 9: Anteil der Patienten des Gesamtkollektivs, die operativ behandelt wurden (1,2,3 oder mehr als 3 OPs) sowie Anteil der Patienten mit konservativer Behandlung, n=416 Patienten ................................................. 35 Tabelle 10: ICD-10-Klassifikation der möglichen operativen Komplikationen ....... 37 Tabelle 11: Tumordatenbank (allgemeine Parameter) ......................................... 74 Tabelle 12: Tumordatenbank (diagnostische Parameter) ..................................... 75 Tabelle 13: Tumordatenbank (therapeutische Parameter) ................................... 77 Tabelle 14: Tumordatenbank (Parameter aus den Fragebögen).......................... 78 72 Anhang: Abbildungsverzeichnis Abbildungsverzeichnis Abbildung 1: Tumorsicherung im Kollektiv: Ort der Probenentnahme (PE) und der Histologische Sicherung, n=486 Patienten .................................................... 18 Abbildung 2: Aufteilung der Patienten nach Primärfall und Nachsorge, n=416 Patienten........................................................................................................ 21 Abbildung 3: Feldkanzerierungsrate im Gesamtkollektiv, n=416 Patienten .......... 22 Abbildung 4: Mehrfachtumoren; n=835 Tumore auf n=416 Patienten aufgeteilt .. 23 Abbildung 5: Aufteilung der n=835 epithelialen Hauttumoren auf die jeweiligen Entitäten......................................................................................................... 23 Abbildung 6: Aufteilung der Patienten nach der Anzahl der Tumorvarianten, n=416 Patienten........................................................................................................ 24 Abbildung 7: Geschlechtsverteilung des gesamten Kollektivs, n=416 Patienten .. 25 Abbildung 8: Geschlechtsverteilung der Patienten mit beantworteten Fragebögen, n=206 Patienten............................................................................................. 25 Abbildung 9: Alter der Patienten. Jede Säule stellt Anzahl und Prozentsatz der Patienten in der genannten Altersgruppe dar und ist nach Geschlecht unterteilt, m = männlich (blau), w = weiblich (rot), n= 416 Patienten.............. 26 Abbildung 10: Anzahl der Tumoren verteilt auf die einzelnen Diagnoseschlüssel, n= 835 Gesamttumoren ................................................................................. 28 Abbildung 11: Topographische Verteilung – linkes Seitenprofil (L= links aus Sicht des Patienten)................................................................................................ 31 Abbildung 12: Topographische Verteilung – Frontansicht .................................... 31 Abbildung 13: Topographische Verteilung – rechtes Seitenprofil ......................... 32 Abbildung 14: Topographische Verteilung – Körperhinterseite ............................ 32 Abbildung 15: Topographische Verteilung – Körpervorderseite ........................... 33 Abbildung 16: Anzahl der Patienten mit klinischem Stadium der gesamten Plattenepithelkarzinome, n=180 Patienten .................................................... 34 Abbildung 17: Aufteilung der Operationen aus dem Jahr 2010 nach radikalem Ansatz (n=374, da vom Gesamtkollektiv n=416 42 Patienten nicht operiert wurden) .......................................................................................................... 36 Abbildung 18: Aufteilung der verschiedenen Komplikationsarten. Insgesamt kam es in 2010 bei den Primärpatienten bei n=316 Behandlungsfällen zu 48 Komplikationen .............................................................................................. 37 Abbildung 19: verwendete Therapieformen im Gesamtkollektiv, n=416 Patienten 38 Abbildung 20: Häufigkeitsverteilung der Rezidivtumoren im Nachsorgekollektiv der Gesamtpopulation, n=46 Patienten................................................................ 39 Abbildung 21: Zahl der Patienten mit beruflicher Sonnenexposition, n=206 Patienten........................................................................................................ 41 Abbildung 22: Häufigkeitsverteilung der Berufe mit UV- Exposition, n=58 Patienten ....................................................................................................................... 41 Abbildung 23: Häufigkeitsverteilung der Patienten mit regelmäßiger Sonnenexposition in der Freizeit, n=206 Patienten........................................ 42 Abbildung 24: Urlaub mit Sonnenexposition und Besuch von Sonnenstudios, n=206 Patienten............................................................................................. 43 Abbildung 25: Sonnenbrände in der Kindheit, n=206 Patienten ........................... 44 Abbildung 26: Sonnenbrände seit Diagnose, n=206 Patienten ............................ 45 Abbildung 27: Compliance „Verwendung von Sonnencremes“, n=206 Patienten 45 Abbildung 28: Latenzzeit von der Erstwahrnehmung der Hautveränderung bis zum klinischen Erstkontakt, n=206 Patienten ........................................................ 46 73 Anhang: Abbildungsverzeichnis Abbildung 29: Verteilung der verschiedenen Hauttypen nach Selbsteinschätzung, n=206 Patienten............................................................................................. 47 Abbildung 30: Hauttumor in der Vorgeschichte, n=206 Patienten ........................ 48 Abbildung 31: positive Familienanamnese, n=206 Patienten ............................... 49 Abbildung 32: Patientenzufriedenheit, n=206 Patienten ...................................... 50 74 Anhang: verwendete Parameter In der Tumordatenbank enthaltene Parameter Die gesammelten Daten aus den Krankenakten, sowie aus den Fragebögen sind in der Tumordatenbank nach folgenden Gesichtspunkten unterteilt: Allgemeine Parameter: Items: Definitionenkatalog: Ausfüllschlüssel: Tabelle 11: Tumordatenbank (allgemeine Parameter) Pat.- ID PatientenIdentifikationsnummer Vorstellung 2010 Vorstellung des Patienten 0 = nicht in 2010 in 2010 1 = Vorstellung in 2010 Name Nach/-Vorname m = männlich w = weiblich tt.mm.jjjj de = Deutschland Patient Geschlecht Geburtsdatum Staatsangehörigkeit Analog Systems des SAP- 75 Anhang: verwendete Parameter Diagnostische Parameter: Items: Definitionenkatalog: Ausfüllschlüssel: Tabelle 12: Tumordatenbank (diagnostische Parameter) Diagnose-Schlüssel ICD-10 WHODiagnosecodierungen C44.0,C44.1,C44.2,C44.3, C44.4,C44.5,C44.6,C44.7, C44.8,C44.9 Kategorie DRG-Diagnose Diagnosebezogene Fallgruppen incl. Subtypen und Lokalisation - Basalzellkarzinom incl. Typ/ Lokalisation Beschreibung - Spinozelluläres Karzinoms incl. Typ/ Lokalisation Beschreibung - andere epitheliale Neoplasie incl. Typ/ Lokalisation Beschreibung Diagnose für Statistik Einteilung der verschiedenen epithelialen Tumortypen mit einer definierten Codierung 0 = Basalzellkarzinom 1 = Plattenepithelkarzinom X = für andere Diagnosedatum Genaues Datum der Erstdiagnose tt.mm.jjjj Lokalisation Ersttumor genau Genauer Gesichtsbereich: Kapillitium, präretroaurikulär, Philtrum, Augenwinkel , UnterOberlippe, Extremitäten, Rumpf, genitoanal etc. Stadieneinteilung, releO = unbekannter Primärvant nur für Plattumor tenepithelkarzinome und I/II = Tumorgebiet Merkelzellkarzinome: III = regionäre LymphknoStadium (I/II,III,IV) ten Filia IV = Fernmetastasen Feldkanzerose, OPS Ja = > ein C44 Tumor Code: entweder mehrere Nein = < ein C44 Tumor C44.x parallel oder OPS Code Mehrfachtumoren Klinische Stadieneinteilung Mehrere C44 Tumoren gleichzeitig 76 Anhang: verwendete Parameter Informationsquelle Primärfall oder Nachsorge Ort der Tumorsicherung durch PE Patientenfälle aufgeteilt nach maligne epitheliale Tumoren, mit der Erstdiagnose im Jahr 2010 und nach Fälle mit einer Nachsorge in 2010 Gestorben in 2010 Sentinel-Node Biopsie Biopsie des ersten Lymphknoten im Lymphabflussgebiet eines Tumor (bei C44 nur bei Merkelzell Ca in Frage kommend) Intern = im Haus Extern = auswärts Primärfall = Erstdiagnose in 2010 Nachsorge = Nachsorge in 2010 Ja = gestorben in 2010 Nein = nicht verstorben Ja = durchgeführt Nein = keine Durchführung Wächter-Lymphknoten Nachweis Ja /nein Anzahl positiver Lymphknoten Datum Progress 1,2,3 usw. Neues Stadium bei Progress des Tumors Anzahl der Rezidiven Inzidenz von Metastasen Fortschreiten/ Wachstum des Primärtumors nach dem Zeitpunkt der Erstdiagnose tt.mm.jjjj I/II = Primärtumor III = LK Filiae IV = Fernmetastase Erneutes Auftreten an der 1,2,3 usw. gleichen Hautstelle Ja/nein Metastasen in 2010 Ja/nein Lokalisation der Metastasen Genaue Lokalisation LK Region, Organ Stattfinden einer Tumorkonferenz Wenn im SAP Programm ein HNO-Derma Tumorboard- Brief vorhanden war Ja/nein Tumorkonferenz in 2010 Ja/nein Hautregion, 77 Anhang: verwendete Parameter Therapeutische Parameter: Items: Definitionenkatalog: Ausfüllschlüssel: Tabelle 13: Tumordatenbank (therapeutische Parameter) Ambulante Therapie Operation Operationsart Operation 2010 Anzahl der Operationen insgesamt Anzahl der Operation in 2010 Operationen mit Sicherheitsabstand Operationen ohne radikalem Ansatz Operationen mit histo- Patient war nur ambulant vorstellig und wurde nicht stationär behandelt Primärtumor generell operativ therapiert -Lokale Exzision = Stanz- Exzision (= kleine Exzision z.B. bei einem planen Tumor) Ja = Ambulante Therapie Nein = stationäre Behandlung Ja/nein - Radikale Exzision = Tiefenmesser Exzision (= Durchführung einer radikalen Messabbiopsie mit Entnahme von subkutanen Fett und Einhaltung eines Sicherheitsabstand Radikale Exzision = OPS- Codierungen mit der Nummerierung: 5-895.xx Primärtumor wurde im Jahr 2010 operativ therapiert - Definitionszeitraum: Ab dem Tag der Erstdiagnose bis zum Zeitpunkt, als der Tumor histologisch in Sano war - Auswahlkriterien: Anzahl der 5-895.x, 5-212.1, 5-181.x Operationscodes des DDG-Codierleitfadens bis zum bis Verschluss des Defektes (= Anzahl Resektionen bis Tumor vollständig exzidiert ) Anzahl aller Operation nur für das Jahr 2010 betreffend Anzahl der 5-895.x Code, 5212.1 Code, 5-181.x Codes des DDG-Codierleitfadens Anzahl der lokalen Exzisionen mit der Codierung 5899.x der OPS-Codierung Anzahl der 5-895.1, 5-895.3, Ja/nein Lokale Exzision = OPS- Codierungen mit der Nummerierung: 5-899.xx 1,2,3, usw. 1,2,3, usw. 1,2,3 usw. 1,2,3 usw. 1,2,3 usw. 78 Anhang: verwendete Parameter logische Randkontrolle Lymphknoten Dissektion 5-212.1, 5-181.1 Codes des DDG-Codierleitfadens Entfernung der Lymphknoten sowohl für diagnostische als auch für therapeutische Ziele Ja = Entfernung Nein = keine Entfernung Lymphknoten Dissektion in 2010 Ja/nein Metastasen-Operation Ja/nein Komplikation Komplikationen in 2010 Exzision des Tumors histologisch in Sano T81.x Codes des DDGCodierleitfadens Abschnitt nur im SAP und OP Protokoll betreffend Erfassung der Komplikationen für das Jahr 2010 Entsprechend den histologischen Abschlussberichte Zusätzliche Therapien Chemotherapie Radiatio Ja = KomplikationsErfassung durch den Arzt Nein = keine Komplikation Ja = Komplikation in 2010 Nein = keine Komplikation in 2010 Ja = Tumorresektion in Sano Nein = Tumorresektion nicht in Sano Kryotherapie, PDT, Antibiose, Lasertherapie etc. Ja/nein Ja/nein Parameter aus den Fragebögen: Items: Definitionenkatalog: Ausfüllschlüssel: Tabelle 14: Tumordatenbank (Parameter aus den Fragebögen) Körpergröße Körpergewicht Beruf Erfassung von zusätzlichen Diagnosen Ausübung des aktuellen Berufes, sowie zusätzliche Erfassung der ehemaligen Berufsausübungen der Patienten, die sich im Ruhestand befinden Zusätzliche Allgemeinerkrankungen, die vor oder zum Zeitpunkt der Hauttu- Angabe in cm Angabe in kg Angabe der genauen Berufsbezeichnung Ja/nein Wenn ja, dann eine exakte Angabe der zusätzlichen Er- 79 Anhang: verwendete Parameter morerkrankung vorlagen Regelmäßige Einnahme von Medikamenten Raucher/Nichtraucher Erfassung der aktiven Raucher und der Jahre, in denen kontinuierlich geraucht wurde, sowie die geschätzte durchschnittlich Menge, die am Tag geraucht wird: (keine; weniger als 5; 5 bis 10; 11 bis 20; mehr als 20) Ehemaliger Raucher Aktuell Nichtraucher, waren aber früher aktive Raucher Alkoholabusus Erfassung von regelmäßigen Alkoholkonsum Aussetzung von toxischen Einflüssen Erfassung von evtl. kontinuierliche oder regelmäßige Einwirkungen eines toxischen Stoffes auf den Probanden UV-Belastung Freien im Erfassung der UVBelastung durch eine freizeitorientierte Aktivität und/oder durch eine berufsbedingte Ausübung Zusätzliche Erfassung der Personen, die sich früher viel im Freien aufhielten, aber zum Zeitpunkt der Befragung UV-Belastungen mieden Einteilung der Haut- Hauttyp I typen blaue Augen, rötliche Haare, helle Haut (evtl. Sommersprossen) nach 5-10 min in der Sonne einen Son- krankung Ja/nein Wenn ja, dann eine exakte Angabe des Medikaments Ja/nein Wenn ja, dann mit Angabe der Jahre und der Menge an gerauchten Zigaretten Ja/nein Wenn ja, dann mit Angabe der Jahre, in denen geraucht wurde Ja/nein Zur Auswahl stehende Antwortmöglichkeiten, bei ja: - Nie - Gelegentlich - regelmäßig Ja/nein Wenn ja, dann mit Angabe des Stoffes: - Pestizide - Chemikalien - UV-Strahlung - Ionisierende Strahlung - Fluoreszenz - Elektrosmog - Ja - Nein - jetzt nicht mehr, aber früher I,II,III,IV 80 Anhang: verwendete Parameter nenbrand, braun nie Hauttyp II blonde Haare, blaue/graue/grüne Augen nach 10-20 min in der Sonne Rötung, leichte Bräunung Hauttyp III dunkelblonde Haare, graue/braune Augen nach 20-30 min Sonnenbrand Und dann nach Wiederholter Exposition fortSchreitend braun Hauttyp IV dunkle Haare, braune Augen, kaum Sonnenbrand, Rötung frühestens nach 40 min Anzahl von Strandurlaube pro Jahr Ermittlung der Häufigkeit einer hoher UV-Exposition - 1mal im Jahr > 2 mal im Jahr kein Strandurlaub Anzahl von Bergurlaube pro Jahr Ermittlung der Häufigkeit einer hoher UV-Exposition - 1mal im Jahr > 2 mal im Jahr kein Bergurlaub - keinen 1 2-5 5-10 > 10 - Die Hautveränderung ist mir bis zur Diagnose nicht aufgefallen Wenige Wochen 3 bis 6 Wochen ½ Jahr bis 1 Jahr Anzahl der Sonnenbrände seit Diagnose Zeitraum der Feststellung Wahrnehmung der Hautveränderung durch den Patienten vor der ärztlichen Diagnose - 81 Anhang: verwendete Parameter - Veränderung der Hautveränderung vor der Diagnose Definition der Veränderung des betroffenen Hautareals durch: - Form - Farbe - Größe - Schmerzhaftigkeit Besuch von Sonnenstudios Regelmäßige Verwendung von Sonnenschutz Frequenz von anderen Krebsarten Vorkommen von diversen Hauttumoren Inzidenz von Hauttumoren in der Familie Mehr als 1 Jahr Mehrere Jahre Seit der Kindheit Ja/nein Zur Auswahl stehende Antwortmöglichkeiten, bei ja: - Wenige Wochen bis 3 Monate - 3 bis 6 Monate - Mehr als 6 Monate Ja/nein Verwendung von Sonnenschutz seit der Diagnose, mit Angabe des Lichtschutzfaktors Ja/nein Zur Auswahl stehende Antwortmöglichkeiten, bei ja: Lichtschutzfaktor: - Faktor 8-20 - Faktor 20-30 - > 30 Zusätzliche Neoplasien ne- Ja/nein ben einem Hauttumor Bei ja: Mit der genauen Bezeichnung des jeweiligen Tumors und der Jahresangabe Inzidenz von weiteren Haut- Ja/nein tumoren neben dem PriBei ja: Mit der genauen Bemärtumor im Jahr 2010 zeichnung des jeweiligen Tumors und der Jahresangabe Ja/nein Bei ja: - Eltern - Geschwister - Verwandtschaft 1. Grades Mit zusätzlicher Bezeichnung des Hauttumors 82 Anhang: verwendete Parameter Häufigkeit der Komplikationen Selbsteinschätzung von Beschwerden nach einer Exzision durch den Patienten Ausgang der Komplikationen Selbsteinschätzung der Abheilungsphase einer Komplikation durch den Patienten Art der Behandlungen Neben der Operation zusätzliche Therapien Stattfinden einer regelmäßigen Nachsorge Ja/nein Zur Auswahl stehende Antwortmöglichkeiten, bei ja: - Nachblutung - Wundinfekt - Lymphödem - Schmerzen im Wundgebiet für mehr als 2 Wochen - Taubheitsgefühle - Hässliche Narbenbildung - Sonstiges Angabe in Textform Zur Auswahl stehende Antwortmöglichkeiten: - Nur Nachsorge - PDT - Kryo - Medikamentöse Therapie - Sentinel Operation - Lymphknotenausräumung - Sonstiges Ja/nein Grund der Nachsorge Angabe in Textform Ort der Nachsorge Zur Auswahl stehende Antwortmöglichkeiten: - In die Hautklinik der Universität Ulm - Bei meinem Hautfacharzt oder in eine andere Klinik Und mit Angabe des letzten Nachsorgetermins Ja/nein Persönliche Einschätzungen der Patienten gegenüber Selbsteinschätzung über die Gefährlichkeit Ihres Hauttumors 83 Anhang: verwendete Parameter Hauttumor Angebot einer Befragung der Patienten Psychoonkologischen bezüglich der Betreuung Betreuung während des Klinikaufenthalts Annehmen der BeBefragung der Patienten treuung nach einer freiwilligen Teilnahme an der Betreuung Stattfinden einer SoBefragung der Patienten zialdienstberatung bezüglich der Sozialdienstberatung während des Klinikaufenthalts Zufriedenheit der Be- Befragung der Patienten handlung insgesamt bezüglich der Zufriedenheit während des Klinikaufenthalts Ja/nein Ja/nein Ja/nein Sonstiges Ja/nein Mit Angabe der Gründe in Textform 84 Anhang: Fragebögen Fragebögen der Studienteilnehmer Fragebogen im Rahmen der klinischen Studie: "Retrospektive Studie zur Erfassung der epithelialen Hauttumoren an der Ulmer Universitätsklinik für Dermatologie in 2010 " 1. Wer füllt den Fragebogen aus? Patient gesetzlicher Vertreter/Angehöriger/Freund des Patienten Grund:____________________________________________ Patient verstorben am _______________________________ Todesursache: _____________________________________ anderer: __________________________________________ 2. Name des Patienten: ___________________________________________________ 3. Geburtsdatum: _________________ 4. Körpergröße: _________________ 5. Körpergewicht: _________________ 6. Staatsangehörigkeit ___________________ 7. Geburtsort ________________________ 8. Geburtsland ________________________ 9. In welcher Gegend sind Sie hauptsächlich aufgewachsen? Bitte um möglichst genaue Angaben !! _______________________________________________________ 10. Wie viele Jahre haben Sie dort gelebt bzw. leben Sie schon in dieser Gegend? ca. 0 bis 20 Jahren ca. 20 bis 40 Jahren ca. 40 bis 60 Jahren mehr als 60 Jahren 85 Anhang: Fragebögen 11. Was machen Sie beruflich? ____________________________________________ 12. Wenn Sie im Ruhestand sind, welchen Beruf haben Sie früher ausgeübt? _________________________________________ 13. Litten Sie bereits vor der Diagnose des Hautkrebses an Allgemeinerkrankungen? (z.B. hoher Blutdruck, Diabetes, Übergewicht, Herzkrankheiten, Depressionen, Migräne, Schlafstörungen, etc.) nein ja und zwar: _______________________________________________________ _______________________________________________________ ________________ 14. Wurden diese medikamentös behandelt? nein ja und zwar mit: _______________________________________________________ _______________________________________________________ ________________ 15.Sind Sie Raucher? nein ja Jahren Falls nein, schon immer Nichtraucher? ja nein, seit _____Jahren Falls ja, seit wie vielen Jahren rauchen Sie? Seit _______ Wie viele Zigaretten Rauchen Sie durchschnittlich am Tag? keine weniger als 5 5-10 11-20 mehr als 20 86 Anhang: Fragebögen - Trinken Sie Alkohol? nein, nie ja, gelegentlich ja, regelmäßig und zwar (Art, Menge) ____________________________________________________________ ____________________________________________________________ __________________ - Sind Sie seit der Diagnose des Hautkrebses regelmäßig beruflich oder privat gefährlichen / toxischen Einflüssen ausgesetzt? nein ja und zwar: Sonnenlicht UV-Strahlung ionisierende Strahlung Pestizide Chemikalien Fluoreszenz Computerarbeit anderes: ____________________________________ - Halten Sie sich berufsbedingt oder in Ihrer Freizeit viel im Freien auf? ja jetzt nicht mehr, aber früher (z.B. in der Kindheit/ Mittleren Alters) nein - Hauttyp: Was trifft für Sie am ehesten zu? Typ I: blaue Augen, rötliche Haare, helle Haut (evtl. Sommersprossen) nach 5-10 min in der Sonne Sonnenbrand, braun nie Typ I-II Typ II: blonde Haare, blaue/graue/grüne Augen nach 10-20 min in der Sonne Rötung, leichte Bräunung Typ II-III Typ III: dunkelblonde Haare, graue/braune Augen erst nach 20-30 min Sonnenbrand und dann nach wiederholter Exposition fortschreitend braun 87 Anhang: Fragebögen Typ III-IV Typ IV: - dunkle Haare, braune Augen kaum Sonnenbrand, Rötung frühestens nach 40 min Wie oft im Jahr machen Sie einen Strandurlaub? 1 Mal im Jahr > 2 Mal im Jahr Gar kein Strandurlaub - Wie oft im Jahr machen Sie Urlaub in den Bergen? 1 Mal im Jahr > 2 Mal im Jahr kein Urlaub in den Bergen - Wie viele Sonnenbrände hatten Sie seit der Diagnose des Hautkrebses? Keinen einen 2-5 5-10 >10 ….davon mit Blasenbildung: _________ - An wie viele Sonnenbrände in Ihrer Kindheit (d.h. bis zu dem 15. Lebensjahr) können Sie sich erinnern? keinen sehr wenige einige viele …davon mit Blasenbildung: _________ - Wie lange kannten Sie die Hautveränderung, bevor der Hautkrebs diagnostiziert wurde? die Hautveränderung ist mir bis zur Diagnose nicht aufgefallen wenige Wochen 3 bis 6 Monate 1/2 Jahr bis 1 Jahr mehr als 1 Jahr mehrere Jahre wenn ja? Wie viele ungefähr?_________________ Seit der Kindheit (= ab den 15. Lebensjahr) 88 Anhang: Fragebögen - Hat sich das Hautareal in der Zeit vor der Diagnose des Hautkrebses stark in Form, Farbe, Größe und/oder Schmerzhaftigkeit verändert? nein ja falls ja, innerhalb welchen Zeitraums hat die Veränderung auf? wenige Wochen bis 3 Monate 3-6 Monate mehr als 6 Monate - Durch wen sind Sie vor der endgültigen Diagnose als erstes auf Ihren Hautkrebs in aufmerksam gemacht geworden? Bitte zutreffendes ankreuzen: durch Ihren Hautarzt bzw. Dermatologen durch Ihren Hausarzt bzw. Allgemeinarzt durch einen anderen Arzt, wenn ja aus welchem Fachgebiet?__________________ durch eine andere Person - Besuchen Sie seit der Diagnose des Hautkrebses Sonnenstudios? nein ja - Verwenden Sie seit der Diagnose des Hautkrebses regelmäßig Sonnenschutz? nein ja Wenn ja, dann mit welchem Lichtschutzfaktor? Faktor 8 – 20 Faktor 20 – 30 > 30 - Wie viele Muttermale haben Sie? weniger als 10 10-50 mehr als 50 - Treten die Muttermale an bestimmten Körperregionen gehäuft auf? 89 Anhang: Fragebögen Rumpf Arme / Beine gleichmäßig verteilt - Hat die Anzahl der Muttermale in den vergangenen 10 Jahren zugenommen? nein ja - Wurde bei Ihnen jemals eine andere Form von Krebs diagnostiziert (z.B. Lungenkrebs, Brustkrebs, ect..)? nein ja, und zwar ___________________________________ im Jahr_______________ - Wurde bei Ihnen jemals die Diagnose eines anderen gutartigen oder bösartigen Hauttumors (z.B. Melanom, Solare Keratose etc.) gestellt? nein ja, und zwar ___________________________________ im Jahr_______________ - Gibt es bei Ihnen jemanden in der Familie (Mutter, Vater, Geschwister, Verwandtschaft 1. Grades) bei dem/der ein Hauttumor diagnostiziert wurde? nein ja, und zwar bei _____________________________________________________ Wenn ja, welcher Art von Hauttumor?_____________________________________ - Hatten Sie nach Ihrer Basaliom/Spinaliom-OP Beschwerden oder kam es zu Komplikationen? nein 90 Anhang: Fragebögen ja, (bitte zutreffendes anstreichen) Nachblutung Wundinfekt Lymphödem Schmerzen im Wundgebiet für mehr als 2 Wochen Taubheitsgefühle, die den Alltag beeinträchtigen Hässliche Narbenbildung Sonstiges________________________________________________ Wie war der Ausgang dieser Komplikationen, heilten sie folgenlos aus? Bitte angeben: ____________________________________________________________ ____________________________________________________________ __________________ - Wie wurden Sie nach der Basaliom/Spinaliom -Entfernung zusätzlich therapiert? nur Basaliom/Spinaliom –Nachsorge PDT (=Photodynamische Therapie) Kryotherapie (=Kältetherapie) medikamentöse Therapie bzw. Anwendung einer Salbe, wenn ja welche Medikamente bzw. welche Salbe? ____________________________________________________________ ____________________________________________________________ ______ Sentinel Operation Lymphknotenausräumung Leiste/Hals/Achsel Sonstiges________________________________ - Wurde bei Ihnen mittlerweile ein Fortschreiten der Krankheit diagnostiziert? nein 91 Anhang: Fragebögen weiß ich nicht, weil ich nicht mehr zur Basaliom/Spinaliom -Nachsorge gehe Rezidiv, d.h. im Narbenbereich des Basalioms/Spinalioms entstand wieder Hautkrebs, Diagnose am _________________ Hautkrebs an anderen Stellen, wo: ______________ Diagnose am______________ Lymphknoten-Metastasen Diagnose am _________________ Fernmetastasen (z.B. in Lunge, Bauchraum, Gehirn, ect.) wo: ________________________________, Diagnose am ________________ - - Gehen Sie regelmäßig zur Basaliom/Spinaliom -Nachsorge? nein wenn nein, Warum?___________________________ ja wenn ja, Warum?_____________________________ Wohin gehen Sie zur Nachsorge? in die Hautklinik der Universität Ulm bei meinem Hautfacharzt oder in eine andere Klinik Falls ja, wann war die letzte Nachsorge? _______________________ - Glauben Sie, dass Ihre Tumore bösartig sind? - ja nein Wurde Ihnen eine psychoonkologische Betreuung angeboten? ja nein 92 Anhang: Fragebögen - Würden Sie die Betreuung annehmen? - ja nein Hatten Sie eine Sozialdienstberatung? ja nein sonstiges___________________________________________________ - Waren Sie mit der Behandlung und Betreuung durch die Hautklinik der Universität Ulm zufrieden? ja nein, Gründe: _________________________________________________________________ _________________________________________________________________ ________ Vielen Dank für Ihre Mitarbeit!!! 93 Anhang: Eidesstattliche Erklärung Eidesstattliche Erklärung Ich versichere hiermit, dass ich die Arbeit selbständig angefertigt habe und keine anderen als die angegebenen Quellen und Hilfsmittel benutzt, sowie die wörtlich oder inhaltlich übernommenen Stellen als solche kenntlich gemacht habe. Ferner versichere ich, dass ich mich nicht anderweitig um eine Zulassung zur Promotion beworben habe. Es laufen keine Strafverfahren gegen mich. 94 Anhang: Danksagung Danksagung Die Danksagung wurde aus Gründen des Datenschutzes entfernt. 95 Anhang: Lebenslauf Lebenslauf Der Lebenslauf wurde aus Gründen des Datenschutzes entfernt. 96 Anhang: Lebenslauf