Hauteffloreszenzen bei Infektionskranklheiten, Teil II, H. Klinker, P
Werbung
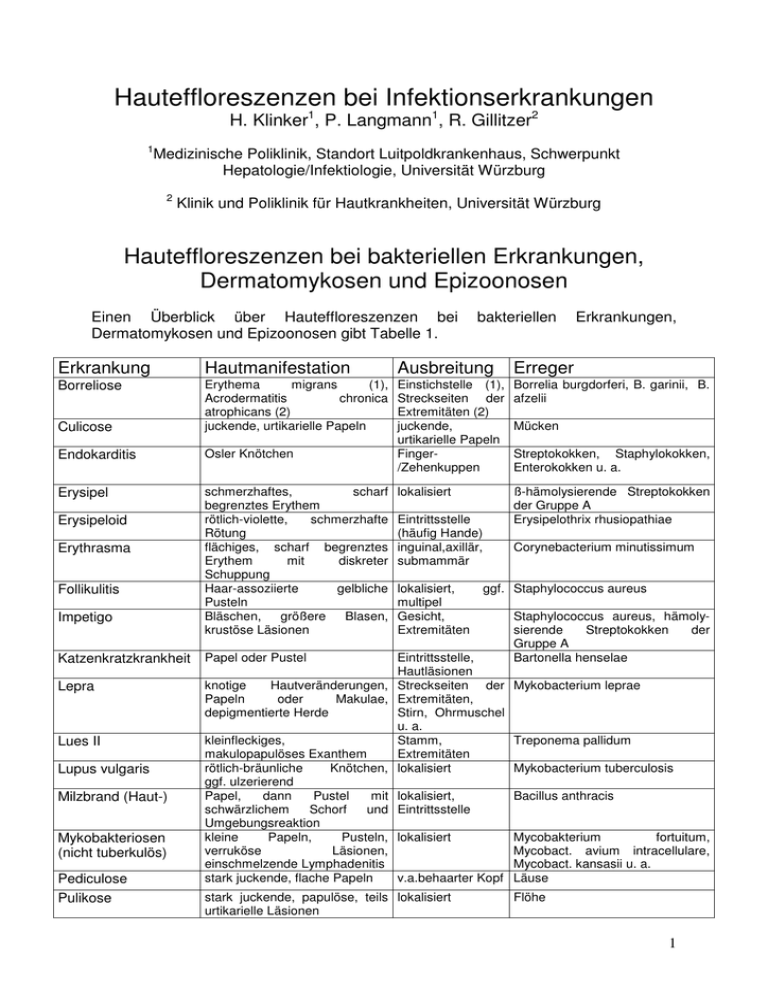
Hauteffloreszenzen bei Infektionserkrankungen H. Klinker1, P. Langmann1, R. Gillitzer2 1 Medizinische Poliklinik, Standort Luitpoldkrankenhaus, Schwerpunkt Hepatologie/Infektiologie, Universität Würzburg 2 Klinik und Poliklinik für Hautkrankheiten, Universität Würzburg Hauteffloreszenzen bei bakteriellen Erkrankungen, Dermatomykosen und Epizoonosen Einen Überblick über Hauteffloreszenzen bei Dermatomykosen und Epizoonosen gibt Tabelle 1. bakteriellen Erkrankungen, Erkrankung Hautmanifestation Ausbreitung Erreger Borreliose Endokarditis Osler Knötchen Einstichstelle (1), Streckseiten der Extremitäten (2) juckende, urtikarielle Papeln Finger/Zehenkuppen Borrelia burgdorferi, B. garinii, B. afzelii Culicose Erythema migrans (1), Acrodermatitis chronica atrophicans (2) juckende, urtikarielle Papeln Erysipel schmerzhaftes, scharf begrenztes Erythem rötlich-violette, schmerzhafte Rötung flächiges, scharf begrenztes Erythem mit diskreter Schuppung Haar-assoziierte gelbliche Pusteln Bläschen, größere Blasen, krustöse Läsionen lokalisiert ß-hämolysierende Streptokokken der Gruppe A Erysipelothrix rhusiopathiae Erysipeloid Erythrasma Follikulitis Impetigo Eintrittsstelle (häufig Hande) inguinal,axillär, submammär lokalisiert, multipel Gesicht, Extremitäten Katzenkratzkrankheit Papel oder Pustel Lepra Lues II Lupus vulgaris Milzbrand (Haut-) Mykobakteriosen (nicht tuberkulös) Pediculose Pulikose Mücken Streptokokken, Staphylokokken, Enterokokken u. a. Corynebacterium minutissimum ggf. Staphylococcus aureus Staphylococcus aureus, hämolysierende Streptokokken der Gruppe A Bartonella henselae Eintrittsstelle, Hautläsionen knotige Hautveränderungen, Streckseiten der Mykobacterium leprae Papeln oder Makulae, Extremitäten, depigmentierte Herde Stirn, Ohrmuschel u. a. kleinfleckiges, Stamm, Treponema pallidum makulopapulöses Exanthem Extremitäten rötlich-bräunliche Knötchen, lokalisiert Mykobacterium tuberculosis ggf. ulzerierend Papel, dann Pustel mit lokalisiert, Bacillus anthracis schwärzlichem Schorf und Eintrittsstelle Umgebungsreaktion kleine Papeln, Pusteln, lokalisiert Mycobakterium fortuitum, verruköse Läsionen, Mycobact. avium intracellulare, einschmelzende Lymphadenitis Mycobact. kansasii u. a. stark juckende, flache Papeln v.a.behaarter Kopf Läuse stark juckende, papulöse, teils lokalisiert urtikarielle Läsionen Flöhe 1 Scharlach Schwimmbadgranulo m Sepsis Skabies Tinea Toxisches Schocksyndrom Thrombidiose fein-makulös, groblamelläre Schuppung entzündliche Papeln mit verruköser Oberfläche petechiale, auch makulöse Effloreszenzen, Nekrosen Milbengänge, an deren Ende punktfömige Parasiten disseminiert ß-hämolysierende Streptokokken der Gruppe A Mykobacterium marinum. Ellenbogen, Finger, Knie v. a. untere Meningokokken u. a., diverse Körperhälfte Finger-Zwischen- Krätzmilbe (Sarcoptes scabiei) räume, Genitalbereich, Axillen konzentrische, rot schuppende lokalisiert Trichophyton, Mikrosporum u. a. Herde, zentrifugale Ausbreitung makulöses Exanthem, disseminiert Streptococcus pyogenes, nachfolgende Desquamation Staphylococcus aureus Quaddeln, Seropapeln und oft v. a. Beine Trombidien (Laufmilben) begleitender Hämorrhagie Bakterielle Erkrankungen Scharlach Ausgelöst wird die Erkrankung durch das ►erythrogene Toxin ß-hämolysierender Streptokokken der Gruppe A. Die Übertragung der Streptokokken erfolgt durch Tröpfcheninfektion. Da es 5 verschiedene Serotypen gibt, kann Scharlach wiederholt auftreten. Die Fähigkeit zur Toxinbildung ist auf labilen DNA-Elementen der Streptokokken kodiert, sodass diese Fähigkeit verloren gehen oder auf andere Stämme übertragen werden kann (9). Als typische Kinderkrankheit (Auftreten zwischen 3 und 10 Jahren) tritt das Krankheitsbild meist in Zusammenhang mit einer Streptokokkenangina auf, selten nach einer Streptokokkeninfektion anderer Lokalisation (Wundscharlach). Nach einer Inkubationszeit von 3 bis 5 Tagen treten plötzlich hohes Fieber, Schluckbeschwerden sowie ein schweres allgemeines Krankheitsgefühl auf. Es findet sich eine Pharyngitis mit diffuser Rötung und Petechien, die Tonsillen sind geschwollen, meist hochrot, mit Stippchen belegt, die Kieferlymphknoten schmerzhaft geschwollen. Das ►Exanthem folgt 12 - 48 Stunden nach Fieberbeginn. Es entwickelt sich in den großen Beugen (axillär, inguinal) stecknadelkopfgroß bis feinfleckig, überzieht das gesamte Integument, wobei es typischerweise die Mundpartie ausspart (periorale Blässe). Beim Betasten vermittelt es einen samtartigen Eindruck. Die Zunge ist weißlich belegt und zeigt am 3. – 4. Krankheitstag die typische Erdbeer- oder ►Himbeerzunge mit den ödematösen, prominenten, hochrot glänzenden Papillen. Am Ende der ersten Krankheitswoche sind Exanthem und Tonsillopharyngitis rückläufig, wobei gleichzeitig eine ►Desquamation einsetzt, die im Gesicht und am Stamm kleieförmig und palmoplantar ausgeprägt groblamellär verläuft. Die Schuppung kann unabhängig von einem vorausgegangenen Exanthem auftreten, was differentialdiagnostisch irreführend sein kann. Komplikationen sind akute bakterielle Infektionen (v.a. Otitis media, septische Arthritis, Myokarditis), sowie in 3% - 4% immunologisch bedingte Folgeerkrankungen wie rheumatisches Fieber oder Glomerulonephritis. 2 Klinisch sind Fieber, Tonsillopharyngitis und ein kleinpapullöses, in den großen Beugen beginnendes Exanthem die wesentlichen Leitsymptome. Gesichert wird die Diagnose durch den Nachweis ß-hämolysierender Streptokokken im Tonsillenabstrich in Kultur (Ergebnis nach 24-48 Stunden) oder Schnelltest. Der Antistreptolysin-Titer steigt im Verlauf der Erkrankung. Nach 3-4 Wochen sollte eine Urinuntersuchung zum Ausschluß einer Glomerulonephritis durchgeführt werden. Differenzialdiagnosen umfassen das Kawasaki-Syndrom, das streptogene toxische Schocksyndrom, die infektiöse Mononukleose, sowie andere virale (Coxsackie, Adeno-, Masernviren), oder medikamentöse Exantheme. Die ►frühzeitige Antibiotikagabe kürzt den Krankheitsverlauf ab und verhindert Komplikationen. Antibiotikum der Wahl ist unverändert Penicillin, z.B. Penicillin V 3 x 1,2 – 2,4 Mio.IE p.o. für 10 Tage. Bei engen Kontaktpersonen soll eine Umgebungsprophylaxe durchgeführt werden. Erkrankte gelten ab dem 2. Tag nach Beginn einer wirksamen Behandlung , ohne Antibiotikatherapie frühestens nach 3 Wochen als nicht mehr infektiös. Toxisches Schocksyndrom Die Erstbeschreibung des Toxischen Schocksyndroms (TSS) als Krankheitsentität erfolgte bei jungen Frauen in Verbindung mit der Verwendung von Tampons (15). Inzwischen tritt es vermehrt im Rahmen anderer Eintrittspforten wie z.B. kutaner Abszesse, Wundinfektionen oder OP-Wunden auf (9). Der fulminante Krankheitsverlauf beruht auf der Produktion von ►Exotoxinen durch Staphylokokken der Phagengruppe I (Toxisches Schocksyndrom I Toxin) oder bei nicht-menstruell assoziierten Formen Staphylokokken-Enterotoxinen B und C. ►Leitsymptome eines Toxischen Schocksyndroms sind hohes Fieber, ein generalisiertes makulöses Exanthem, arterielle Hypotension, eine Multiorganbeteiligung sowie eine charakteristische Desquamation vor allem im Bereich der Hände und Füße während der Rekonvaleszenz in der zweiten Krankheitswoche (12). Ein Toxisches Schocksyndrom kann weiterhin auch von Streptokokken ausgelöst werden. Das streptogene Toxische Schocksyndrom zeigt einen Häufigkeitsgipfel im mittleren Lebensalter (20 - 50 Jahre), wobei Patienten mit anderen Grunderkrankungen z.B. Diabetes mellitus, bei Wundheilungsstörungen oder nach Virusinfektionen, besonders gefährdet sind. Das hauptsächlich ► von Streptokokken der Gruppe A produzierte Toxin bewirkt durch die massive Freisetzung von Zytokinen (TNFα, IL1b, IL6) ein hochtoxisches Krankheitsbild mit Multiorganversagen. Bei vielen Patienten findet sich ebenfalls begleitend ► ein generalisiertes, makulöses Exanthem mit nachfolgender Desquamation, was neben den geschilderten systemischen Manifestationen diagnostisch richtungsweisend sein kann. Bei bestehendem Verdacht auf ein Toxisches Schocksyndrom können Abstriche auch von primär "unverdächtigen" oberflächlichen Hautläsionen, den Nasenvorhöfen, der Vagina, in Achselfalten und der Leistenregion für die Erregerdiagnostik entscheidend sein und sollten deshalb großzügig durchgeführt werden. 3 Bei bis zu 60% der Patienten mit TSS lassen sich die entsprechenden Bakterien in der Blutkultur kulturell nachweisen. Neben einer evtl. Herdsanierung wird die ► antibiotische Therapie mit βLaktamase-stabilen Penicillinen empfohlen. Alternativ kann die systemische Antibiose mit Clindamycin, Erythromycin, Vancomycin oder Teicoplanin erfolgen. Endocarditis Die Häufigkeit einer bakteriellen Endokarditis liegt bei 1-10 Fällen pro 100.000 Einwohner jährlich, wobei die Überlebenswahrscheinlichkeit nach 8 Jahren ca. 60% beträgt und im wesentlichen von einer frühen Diagnosestellung, Fehlen anderer schwerwiegender Begleiterkrankungen und dem Erregerspektrum abhängt. Die ► Klinik der Endokarditis umfasst als häufigstes Symptom Fieber (14), weiterhin Gewichtsverlust, thromboembolische Komplikationen (periphere Gefäßverschlüsse der Extremitäten, Schlaganfall, Zentralarterienverschluß mit Sehstörungen), und Immunphänomene (Glomerulonephritis, rheumatische Beschwerden). An der Haut können gering erhabene, purpurrote Hauteffloreszenzen von 2-5 mm Durchmesser auftreten und diagnostisch wegweisend sein ► (Osler Knötchen). Prädilektionsstellen für diese Veränderungen sind die Finger- und Zehenkuppen. Seltener treten septisch metastatische Herde (Nieren-, Milz-, Hirnabszesse) oder hämorrhagische Komplikationen (rupturiertes Aortenaneurysma) auf. In akuten Fällen steht die Sepsis und/oder die akute Herzinsuffizienz infolge Klappendysfunktion und destruktion im Vordergrund. Laborchemisch finden sich neben einer BSGBeschleunigung eine Anämie sowie Zeichen einer Akut-Phase-Reaktion (Leukozytose mit Linksverschiebung, CRP). Die wichtigsten Symptome sind in Tabelle 2 zusammengefasst. Symptom Fieber Schüttelfrost Nachtschweiß Gewichtsabnahme Husten Kopfschmerz Arthralgien/Myalgien Herzgeräusche Hautmanifestationen Embolische Phänomene Osler-Knötchen Petechien Splenomegalie Tabelle 2 Häufigkeit (%) 90 40 25 25 25 20 15 85 20-50 > 50 10-20 20-40 20-60 Diagnostisch entscheidend ist neben der ►Echokardiographie die Abnahme von mindestens 4-6 ►Blutkulturen vor Beginn der antibiotischen Therapie. Bestimmte Bakteriämieerreger müssen per se den Verdacht auf eine Endokarditis lenken und Indikation für eine Abklärung in der Regel mittels transösophaealer Echokardiographie sein. Dazu gehören vergrünende Streptokokken, Streptococcus 4 bovis, Staphylococcus aureus, Enterokokken (bei nicht erkennbarem Fokus), Haemophilus, Actinobacillus, Cardiobacterium, Eikenella, Kingella (= HACEK) Die Behandlung erfolgt mit einem ß-Laktam-Antibiotikum bzw. Glykopeptid in Kombination mit einem Aminoglykosid (z. B. Penicillin G 4-6 Wochen + Gentamicin 2 Wochen). Die Notwendigkeit zur Klappenersatzoperation ist individuell abhängig von der Größe der Vegetationen und dem Grad der Klappeninsuffizienz (4). Sepsis Eine Sepsis als schwere Allgemeinreaktion wird durch Bakterien oder ihre Bestandteile (gramnegative Keime: Lipopolysacharide, Endotoxin; grampositive Bakterien Peptidoglykan, Lipoteichonsäure, Exotoxine) ausgelöst und führt zu einer ►Freisetzung endogener Mediatoren (TNF-α, IL-1) mit dem klinischen Bild eines „systemic inflammatory response syndrome“ (SIRS) bis zum septischen Schock. Auslöser können Primärherde wie Abszesse, Pneumonie, Venenkatheter, Harnwegsinfektionen, sekundäre Streuherde oder nichtinfektiöse Ursachen wie z.B. Pankreatitis oder Polytraumata sein. Die Kenntnis der Eintrittspforte erlaubt Hinweise auf die Erregerart. ►Häufigste Erreger einer bakteriellen Sepsis sind E. coli, Staphylokoccus aureus, Koagulasenegative Staphylokokken, Enterokokken, Streptokokken, Enterobacter, Pseudomonas aeruginosa und Klebsiella (5). Die Klinik wird bestimmt durch Schüttelfrost, hohes Fieber oder Hypothermie. Initial ist die Kreislaufsituation hyperdynam, dann kommt es zu Zentralisation, Blutdruckabfall, Tachykardie und Tachypnoe. Laborchemisch finden sich eine Leukozytose oder Leukopenie mit Linksverschiebung im Differentialblutbild (>10% Stabkernige), CRP- und oft auch ein Lactat-Anstieg. Bei Verbrauchskoagulopathie zeigt sich ein Abfall von Thrombozyten und Gerinnungsfaktoren, bei Organversagen der Anstieg von Kreatinin, Transaminasen und Bilirubin. An der ►Haut entstehen insbesondere bei Meningokokkensepsis disseminierte petechiale, auch makulöse Effloreszenzen mit Betonung der unteren Körperhälfte. Nekrotische Ulzerationen sind gelegentlich bei Septikämie durch Pseudomonaden oder Stenotrophomonas maltophilia zu beobachten. Die Klinik eines septischen Krankheitsbildes erfordert zum Erregernachweis vor Beginn der Antibiotikatherapie die ►Asservierung von Blutkulturen und, je nach vermutetem Infektionsherd, die mikrobiologische Untersuchung von Sputum, Urin, Wundabstrich, Abszesspunktat, Katheterspitze oder Stuhlprobe. Eine Fokussuche ist unerlässlich. Die ►systemische Antibiotikatherapie erfolgt sofort nach Materialentnahme und richtet sich nach dem vermuten Infektionsherd, dem Erregerspektrum (ambulant, nosokomial) und sollte initial ein maximal breites Erregerspektrum treffen. Bei Patienten mit Antibiotikavorbehandlung sollte eine pseudomonaswirksame Substanz (Ceftazidim, Ciprofloxacin, Carbapeneme) und evtl. ein Antimykotikum zugegeben werden. Neben intensivmedizinischer Stabilisierung und Optimierung vitaler Funktionen ist die Sanierung der Eintrittspforte entscheidend für die Prognose. 5 Erysipel Ein Erysipel stellt eine ►Entzündung des subepidermalen Hautgewebes durch ßhämolysierende Streptokokken der Gruppe A, seltener der Gruppen C und G, oder Staphylococcus aureus dar. Eintrittspforten sind Miniläsionen (z. B. Tinea pedum), wobei sich die Erreger über Lymphspalten in der Dermis ausbreiten. Klinisch imponiert ein ►schmerzhaftes, scharf begrenztes Erythem („flammende Rötung“) mit zunehmender Schwellung, verbunden mit Krankheitsgefühl, ►Schüttelfrost und Fieber. Im weiteren Verlauf können Bläschen bis hin zu Nekrosen auftreten. Laborchemisch findet sich eine massiv beschleunigte Blutsenkung, eine CRP-Erhöhung sowie eine Leukozytose. Unbehandelt breitet sich die Entzündung flächig aus und kann zur Sepsis führen. Ein Problem stellt eine Persistenz der Erreger im Gewebe dar, die nach Wochen oder Monaten zu einem endogenen Rezidiv (rezidivierendes Erysipel) führen kann. Die Diagnose ist bei typischem klinischen Bild einfach zu stellen. Serologisch zeigen sich erhöhte Antikörper gegen Streptolysin oder Streptodornase (A-Streptokokken) und zunehmend Antikörper gegen Staphylokokkenprodukte. ►Differenzialdiagnostisch ist an eine Phlegmone zu denken, die eine Entzündung des subkutanen Gewebes darstellt. Die Begrenzung ist eher unregelmäßig. Erreger sind Staphylokokken oder ß-hämolysierende Streptokokken, nach Tierbissen Pasteurella multocida, nosokomial auch Enterobakterien oder Pseudomonaden. Von einem Erysipel abzugrenzen ist ferner die nekrotisierende Fasziitis, eine rasch progrediente, mit heftigen Schmerzen, starker Rötung und Schwellung einhergehende, später dunkelrote oder blaugraue Hautverfärbung mit Bildung von Nekrosen zusammen mit einem septischen Krankheitsbild und Multiorganversagen. Als Fourniersche Gangrän wird die Infektion des männlichen Genitales mit Gangrän des Scrotums und des Dammes bezeichnet. Erreger der nekrotisierenden Fasziitis sind ß-hämolysierende Streptokokken der Gruppe A (Streptokokkengangrän Typ I), seltener eine Mischinfektion mit Anaerobiern und Enterobakterien (Typ II z.B. nach bauchchirurgischen Eingriffen). Eine unverzügliche chirugische Intervention ist neben der Antibiotikagabe unbedingt erforderlich. Die Therapie eines Erysipels besteht in der Gabe von Penicillin G ( 3-mal 10 Mio IE) für 10 bis 14 Tage i.v., alternativ Erythromycin (3-mal 1g i.v.) oder Cephalosporine der 1. oder 2. Generation (Cefazolin, Cefuroxim). Zusätzlich ist eine Sanierung erkennbarer Eintrittspforten erforderlich. Erysipeloid Erreger des Erysipeloids, einer klinisch dem Erysipel nicht unähnlichen Hautinfektion, ist ►Erysipelothrix rhusiopathiae, ein grampositives Stäbchenbakterium. Das Hauptreservoir des Erregers stellen ►Geflügel und Schweine dar. Die Übertragung erfolgt meistens im Rahmen beruflicher Exposition über kleine Hautverletzungen durch direkten Kontakt. 6 An der Eintrittsstelle der Bakterien bildet sich eine rötlich-violette, schmerzhafte Rötung, die sich allmählich zentrifugal ausbreitet. Begleitend kommt es zu Lymphadenitis und Fieber. Die Erregerdiagnose kann aus Hautbiopsien und Blutkulturen gestellt werden. Selten können Endokarditiden auftreten (1). Die Therapie des Erysipeloids erfolgt mit Penicillin, bei Penicillinallergie können Chinolone eingesetzt werden. Follikulitis, Furunkel, Karbunkel Die ►staphylogene Infektion der Haarfollikel kann oberflächlich oder tief, abszedierend sein. Bei oberflächlicher Infektion im cranialen Teil des Haarfollikels bzw. im Bereich der Haaraustrittstelle kommt es zur Follikulitis mit dem typischen Bild einzelner bis multipler kleiner Haar-assoziierter gelblicher Pusteln, die bei geringer mechanischer Irritation kleine Mengen Pus entleeren. Bei tieferliegender Infektion des Haarbalges ohne Möglichkeit der Spontanentleerung kommt es zur ►Furunkelbildung, die sich meist durch einen zunehmend schmerzhaften, roten Knoten mit Randödem und gelegentlich zentral nachweisbarer Pore manifestiert. Durch zunehmende zentrale Einschmelzung unter teilweiser Einbeziehung angrenzender Follikel kommt es zu Fluktuation und letztendlich mit weiterer Einschmelzung des oberflächlichen Gewebes zur Spontanruptur und Entleerung. Die schwerste Verlaufsform des Furunkels mit Befall multipler Follikel und phlegmonöser Ausbreitung ist der ►Karbunkel. Dieser zeigt multiple Einschmelzungen mit gruppierten Pusteln, die ohne Behandlung zu größeren nekrotischen Arealen konfluieren. Follikulitiden, Furunkel und Karbunkel sind aufgrund der Eintrittspforte Haar auf behaarte Körperpartien beschränkt. Sonderformen eines Furunkels sind z.B. das Gerstenkorn (Hordeolum) durch staphylogenen Befall der Wimpernhaare. Die Diagnose erfolgt klinisch, ein Erregernachweis ist nur in schweren oder rezidivierenden Fällen notwendig. Die Therapie des Furunkels erfolgt lokal mittels ►Inzision. Bei drohenden Komplikationen (Phlegmone, Sepsis, Furunkel im Oberlippen-Nasen-Bereich mit der Gefahr einer Sinus-cavernosus-Thrombose, - cave mechanische Manipulationen im Gesichtsbereich!) oder multiplen Furunkeln oder Karbunkeln erfolgt die antibiotische Abdeckung mit Flucloxacillin oder Clindamycin. Bei rezidivierender Furunkulose ist eine Therapie für 1-2 Monate notwendig, daneben die Diagnostik prädisponierender Erkrankungen (z. B. Diabetes mellitus). Im Gegensatz zu obigen Follikel-assoziierten Entzündungen ist der Begriff ►Abszess ein allgemeiner Oberbegriff und beschreibt eine nekrotisierende, einschmelzende Entzündung unter Bildung eines Eiter gefüllten Hohlraums, der im Prinzip in allen Organen entstehen kann. Abszesse entstehen posttraumatisch, hämatogen oder als fortgeleitete Weichteilinfektion. Typischer Erreger ist Staphylokokkus aureus. Klinisch finden sich eine lokale Rötung, Schwellung, Schmerzen, eine Überwärmung, später eine Fluktuation, Lymphangitis, Lymphadenitis, oft mit Fieber und Leukozytose. 7 Die Diagnose eines Abszesses wird, soweit einsehbar, klinisch gestellt, bei tieferen Prozessen kann je nach Lokalisation eine Bildgebung mittels Sonographie, Computertomographie oder auch Magnetresonanztomographie notwendig sein. Der mikrobiologische Erregernachweis erfolgt nach Inzision oder Punktion. Therapeutisch vordringlich ist die chirurgische Inzision und Drainage. Bei ausgedehnter Weichteilinfiltration erfolgt die Gabe von Antibiotika wie Flucloxacillin, Clindamycin oder Cephalosporin (Cefazolin, Cefuroxim, Cefotiam) zur Verhinderung einer septischen Streuung. Impetigo Als Impetigo wird eine oberflächliche bakterielle Hautinfektion unter Bildung von Bläschen, die bis zu größeren Blasen konfluieren und im späteren Verlauf zu ►krustösen Läsionen führen, bezeichnet. Durch ►Autoinokulation wird die Infektion oft über größere Hautareale verbreitet. Hauptsächlich sind Kinder betroffen. Erreger sind Staphylococcus aureus und hämolysierende Streptokokken der Gruppe A, oft als Mischinfektion. Infektiosität besteht bis zur Abheilung der letzten Effloreszenz. Eine Wiederzulassung zum Besuch von Gemeinschaftseinrichtungen kann 24 h nach Beginn einer wirksamen Antibiotikatherapie erfolgen, ohne Therapie nach Abheilung der befallenen Hautbezirke. Typisch sind vorwiegend im Gesicht und an den Extremitäten lokalisierte, häufig beetartige kleine Bläschen und Pusteln, nach deren Austrocknen dicke gelb-braune Krusten entstehen („Borkenflechte“). Diagnostisch wegweisend ist die typische Morphologie bei positivem Erregernachweis im Abstrichpräparat. Die Therapie erfolgt bei leichtem Verlauf lokal mit ►antiseptischen Maßnahmen in Form von feuchten Umschlägen mit Chinosollösung oder PVP-Jod-Lösung, Fusidinsäure oder Mupirocin, bei schwerem Befall oral mit einem MakrolidAntibiotikum oder Cephalosporin der 1. Generation; bei Nachweis von Staphylokokken wird Flucloxacillin verabreicht. Katzenkratzkrankheit Haupterreger der Katzenkratzkrankheit ist ►Bartonella henselae, eindeutig ist die Ätiologie des Syndroms allerdings bislang nicht geklärt (10). Die weltweit vorkommende Erkrankung wird ►durch Katzen übertragen, die offensichtlich eine symptomlose Bakteriämie aufweisen können. Die Inokulation erfolgt über Kratzverletzungen oder vorbestehende Hautläsionen (Wunden, Rhagaden). Zunächst entsteht an der Eintrittsstelle eine ►Papel oder Pustel. Bei einem Teil der Patienten kommt es zum Auftreten von Allgemeinsymptomen in Form von Müdigkeit, Kopfschmerzen und Fieber. Nach ca. zwei Wochen entsteht eine ►regionale Lymphadenopathie, die eitrig einschmelzen kann. Während die Primärlaäsion über etwa 1-3 Wochen besteht, bildet sich die Lymphknotenschwellung nach 2-4 Monaten zurück. Die Diagnose kann anhand der Anamnese und des klinischen Befundes gestellt werden. Der Erregernachweis erfolgt mikroskopisch oder immunzytochemisch aus 8 Lymphknotengewebe. Darüberhinaus können mittels Immunfluoreszenztest und Enzymimmunoassay Antikörper nachgewiesen werden. In der Regel ist der Verlauf der Erkrankung milde und bedarf keiner Therapie. Nur bei schweren Verläufen wird antibiotisch mit Makroliden oder Doxycyclin behandelt. Erythrasma Das Erythrasma ist eine oberflächliche Dermatitis in Form eines flächigen, scharf begrenzten Erythems mit diskreter Schuppung dar. Die häufigsten Lokalisationen dieser ►intertriginösen Infektion sind inguinal und axillär, gelegentlich submammär. Prädisponierend sind ein feucht-warmes Milieu, besonders betroffen sind deshalb Patienten mit Adipositas, Hyperhidrosis oder Diabetes mellitus. Differentialdiagnostisch ist eine Verwechselung mit Dermatomykosen oder auch einer intertriginösen Psoriasis möglich. Der Erreger des Erythrasmas ist Corynebacterium minutissimum. Das Bakterium ist Bestandteil der normalen Hautflora, führt jedoch unter o. g. Bedingungen zum Bild des Erythrasmas. Therapeutisch im Vordergrund steht die Beseitigung der Milieufaktoren, daneben werden austrocknende oder antiseptisch/antimykotische (Azole) Externa verwendet. Borreliose Der Erreger der Lyme-Disease in Nordamerika ist überwiegend Borrelia burgdorferi (Erstbeschreibung durch W. Burgdorfer 1982(2)), während in Europa und Asien B. garinii und B afzelii überwiegen. Dies bedingt die differenten regionalen Verlaufsformen der Erkrankung. Nach Übertragung der Borrelien durch einen ►Zeckenbiss erfolgt zunächst eine lokale Vermehrung der Erreger, die bei 40%-60% der Patienten als ►Erythema migrans (Stadium I) sichtbar wird. Bei 15% der unbehandelten Patienten entwickeln sich Allgemeinsymptome mit Fieber, Kopfschmerzen, Nackensteife und Zeichen einer Encephalitis. Die Erreger breiten sich im weiteren Verlauf hämatogen und lymphogen aus. 5% der Patienten ohne Behandlung können eine ►chronische Neuroborreliose (Stadium II) entwickeln. Eine ►kardiale Mitbeteiligung im Stadium II der Erkrankung manifestiert sich meist als Rhythmusstörung, gelegentlich in Form einer Myoperikarditis oder einer leichtgradigen linksventrikulären Dysfunktion bei 5% der Patienten. Ungefähr 60% der Patienten ohne Therapie weisen Im Stadium III eine Gelenkbeteiligung auf, die als ►Arthritis bei bis zu 10% der Patienten trotz einer 30 tägigen Antibiotikatherapie persistiert. Diese Patienten weisen als Hinweis auf eine gesteigerte Immunreaktion eine höhere Konzentration spezifischer, gegen das outersurface-protein A von Borrelia burgdorferi (OaspA) gerichteter T-Zellen der Synovia auf. Als weitere, typische Manifestation im Stadium III gilt die Acrodermatitis chronica atrophicans. Die typischen klinischen Manifestationen im Verlauf der Borrelieninfektion sind in Tab. 3 dargestellt: 9 Stadieneinteilung Zeitraum nach Klinisches Bild Zeckenbiss Seropositivität (%) bis - Erythema migrans 20 – 50% Therapie Stadium I Tage Wochen Stadium II Wochen Monate Doxycyclin 2x100 mg/d oder Amoxicillin 3x500 mg/d bei leichten Verläufen: wie oben, ansonsten: Ceftriaxon 1x2g/d oder Cefotaxim 3x2g/d Stadium III Monate Jahre bis - Neuroborreliose 70 – 90% (Meningitis, Meningoenzephaliti s, Meningoradikulitis) - Karditis bis - Arthritis 90 – 100% Akrodermatitis chronica atrophicans chronische Neuroborreliose (Enzephalopathie, Polyneuropathie) Ceftriaxon 1x2g/d oder Cefotaxim 3x2g/d Tabelle 3 Die Diagnostik stützt sich auf den ►Antikörpernachweis. Bei einer akuten Erkrankung (unter einem Monat Dauer) sollen IgM und IgG im Serum zur Differenzierung einer akuten oder chronischen Phase bestimmt werden. Ein positiver Westernblot für IgM wird bei mindestens 2 der 3 Banden gegen 23, 39 und 41 kd angenommen, positive IgG-Antikörper sind beim Nachweis von mindestens 5 der 10 Banden (18, 23, 28, 30, 39, 41, 45, 58, 66, 93) vorhanden. Basierend auf Leitlinen der Infectious Diseases Society of America können folgende ►Empfehlungen für die Therapie Erwachsener gegeben werden: Bei früher Infektion (lokal oder disseminiert) erfolgt die antibiotische Behandlung mit Doxycyclin, 100 mg (2mal /Tag) für 14 Tage oder Amoxicillin, 500 mg (3mal / Tag) für 14 Tage, im Falle einer neurologischen Manifestation (Stadium II) und im Stadium III wird mit Ceftriaxone, 2g i.v. (1x /Tag) für 14 – 21 Tage oder Cefotaxim, 2g i.v. ( 3x/ Tag) für 14 – 21 Tage behandelt. Lues Der Erreger der Lues, Treponema pallidum, wird durch engen Kontakt, in der Regel venerisch, selten durch Bluttransfusion oder diaplazentar übertragen. Die Treponemen durchdringen die intakte Schleimhaut, vermehren sich an der Eintrittspforte, und befallen regionale Lymphknoten. Die Erkrankung verläuft in 3 Stadien: 10 Primärstadium (lokale Infektion) An der Eintrittsstelle bilden sich nach 3 Wochen kleine schmerzlose Papeln, die sich zu derben Geschwüren (harter Schanker, Ulcus durum) weiterentwickeln können, zusätzlich besteht eine lokale Lymphknotenschwellung ► (Primärkomplex). Nach 36 Wochen kommt es zur Abheilung unter Narbenbildung. Die Differentialdiagnose umfasst überwiegend andere sexuell übertragbare Erkrankungen wie das Granuloma inguinale, das Ulcus molle oder den Herpes simplex genitalis. Sekundärstadium (Disseminationsstadium) Hier besteht zu Beginn häufig eine Allgemeinsymptomatik mit Fieber, Krankheitsgefühl, Myalgien und Arthalgien. Über 75% der Patienten entwickeln einen symmetrisch angeordneten, kleinfleckigen, makulopapulösen Hautausschlag ► (Syphilide), besonders am Stamm und den Extremitäten. Die Hautveränderungen zeigen eine große Formenvielfalt („Chamäleon“) mit einem Spektrum von makulösen Syphiliden bis hin zu ulzerösen Läsionen, die allesamt erregerreich sind. Im Gegensatz zu anderen exanthematischen Erkrankungen finden sich diese Veränderungen typischerweise auch an den Handinnenflächen und Fußsohlen. Im Anogenitalbereich treten nässende ► Condylomata lata auf. Diese Effloreszenzen sind hochkontagiös. Differentialdiagnostisch ist in diesem Stadium an Virus- oder Arzneimittelexantheme zu denken, die Zuordnung ist rein klinisch allerdings oft schwierig. Tertiärstadium (Organmanifestationen) Bei bis zu 30% der unbehandelten Patienten kommt es nach einem symptomfreien Intervall von 3 - 30 Jahren zu Manifestationen in vielen Organen. Im Bereich der Haut treten braunrote, derbe, erhabene Knoten mit Tendenz zu Ulzeration und Narbenbildung auf. Derartige ► Gummata können sich in allen Organen entwickeln. Neben den beschriebenen Hautveränderungen manifestiert sich die Lues im Tertiärstadium als ► Neurosyphilis (Gummata, Tabes dorsalis oder Progressive ►kardiovaskuläre Syphilis (Medianekrose, Paralyse) und auch als Aneurysmabildung, in den meisten Fällen im Bereich der Aorta ascendens). Die ►Diagnose kann im Primärstadium (Ulcus durum) und z. T. im Sekundärstadium durch den Direktnachweis von Treponemen im Exsudat gestellt werden. Als serologischer Suchtest ist der Treponema-pallidum-Hämagglutinationstest (TPHA) etabliert. Die unspezifische Cardiolipin-Reaktion (VDRL ) wird erst in der zweiten Phase der Primärsyphilis positiv, im Spätstadium ist sie meist negativ. Die Bestätigung erfolgt mittels indirekter Immunfluoreszenztechnik (FTA-ABS-Test) zum Nachweis Treponemen-spezifischer IgG- und IgM-Antikörper. IgM-Antikörper sind 324 Monate nach Behandlungsende nicht mehr nachweisbar, während IgG-Antikörper lebenslang bestehenbleiben (Seronarbe). Bei Diagnosestellung einer Lues sollte immer auch an die Möglichkeit des Bestehens anderer sexuell übertragbarer Krankheiten, z.B. auch HIV-Infektion (11) oder Hepatitis B, gedacht und die serologische Untersuchung auf diese Erkrankungen ausgedehnt werden! Die ►Therapie der erworbenen Lues (Lues I und II) erfolgt mit Depot-Penicillin 2,4 Mio.E. i.m. für 14 Tage, bei gleichzeitiger HIV-Infektion muß höher dosiert werden 11 (Penicillin G 10 Mio.E. 2mal /Tag). Bei Lues III und Neurolues muß intravenös (Penicillin G 10 Mio.E 2mal /Tag) behandelt werden. Bei Penicillinallergie gibt man Ceftriaxon (2g 1mal/Tag für 2 Wochen), bei gleichzeitiger Cephalosporin-Allergie kann Doxycylin oder Minocyclin gegeben werden. Gyrase-Hemmer sind bei Lues unwirksam. Am 1. Behandlungstag, meist wenige Stunden nach Therapiebeginn, kann eine ►Herxheimer- Reaktion (Fieber, Schüttelfrost, Zunahme der syphilitischen Läsionen) auftreten, die nicht mit einer Penicillinallergie verwechselt werden darf. Ausgelöst wird diese Reaktion durch bakterielle Zerfallsprodukte (Toxine). Eine Therapieunterbrechung ist nicht notwendig. Sie wird mit Antipyretika, bei schweren Manifestationen mit Prednisolon, behandelt. Tuberkulose Die Inzidenz der Tuberkulose hat sich in Deutschland zwar seit 1985 halbiert und beträgt mit 12,7 pro 100.000 Einwohner nur noch ein Zehntel der Inzidenz von 1960, alarmierend ist jedoch der Anstieg der Tuberkulose und der Erregerresistenz in einzelnen Staaten Osteuropas. Die primäre Infektion mit Mycobakterium tuberculosis erfolgt in den allermeisten Fällen durch Exspirationströpfchen, die beim Husten und Niesen freigesetzt werden. Von extrapulmonalen Tuberkulosen (Lymphknoten, Urogenitalsystem, Knochen, Gelenke, Verdauungsorgane) geht ohne direkten Kontakt kein Infektionsrisiko aus. Gefährdet sind hier ggf. Metzger oder Tierärzte. Entsprechend der häufigsten Primärlokalisation einer Tuberkulose entsteht zunächst ein ►pulmonaler Primärkomplex mit einem radiologisch fassbaren, peripheren, nicht einschmelzenden Rundherd sowie unilateraler Vergrößerung von Hiluslymphknoten. Die Initialsymptomatik ist in der Regel mild und unspezifisch, weshalb länger als 3 Wochen bestehender Husten unbedingt, bei blutigem Auswurf sofort, abgeklärt werden sollte. Bei den meisten Infizierten ist die Erkrankung mit der Abheilung des Primärherdes beendet. Die Erreger persistieren allerdings in „abgekapselter“ Form. Eine positive Tuberkulinreaktion findet man 4-12 Wochen nach einer Neuinfektion. Eine ►Reaktivierung latenter Herde kann auch noch nach Jahrzehnten auftreten. Auch bei der postprimären Tuberkulose ist der häufigste Manifestationsort mit 6080% die Lunge, die Erkrankung kann prinzipiell aber jedes Organsystem befallen und präsentiert sich dementsprechend vielgestaltig. Relativ häufig sind das Skelettsystem, Lymphknoten oder das Urogenitalsystem betroffen. Die Haut ist insgesamt ein seltener Manifestationsort einer Tuberkulose. Am relativ häufigsten tritt sie noch als ►Lupus vulgaris auf. Es entwickeln sich zunächst rötlich-bräunliche Lupusknötchen, die allmählich an Größe zunehmen. Das sog. „Sondenphänomen“, d. h. das Einbrechen einer Knopfsonde bei Druck auf das betroffene Hautareal (Einbruch in das zentral nekrotische Granulom), ist typisch für das Vorliegen einer Lupusläsion. Bei gewöhnlich chronischem Verlauf ist eine Ulzeration und auch die Zerstörung des darunterliegenden Gewebes möglich (Lupus ulcerosus bzw. mutilans). Sehr viel seltener als ein Lupus vulgaris ist ein tuberkulöser Primärkomplex der Haut oder eine Tuberculosis cutis miliaris disseminata bei schwerer Immunsuppression. 12 Die Therapie einer Tuberkulose erfolgt mit einer Medikamentenkombination, wobei als Standard eine ►Behandlung über 6 Monate durchgeführt wird. In der Initialphase besteht diese aus Isoniazid (INH), Rifampicin (RMP), Pyrazinamid (PZA) und Ethambutol (EMB) oder Streptomycin (SM) über die Dauer von 2 Monaten, an die sich eine Stabilisierungsphase mit INH und RMP über einen Zeitraum von 4 Monaten anschließt. Unter einer wirksamen tuberkulostatischen Therapie klingt die Ansteckungsfähigkeit nach 2-3 Wochen ab. Bei Vorliegen eines resistenten Stammes (Multiresistenz bei fehlender Empfindlichkeit gegen INH und RMP) muss nach Austestung aller zur Verfügung stehender Medikamente nach dem individuellen Resistenzmuster behandelt werden. Atypische Mykobakteriosen Nicht-tuberkulöse, ubiquitär vorkommende Mykobakterien wie Mycobakterium fortuitum, Mycobacterium avium intracellulare oder Mycobacterium kansasii können bei Patienten mit HIV-assoziierter Immunschwäche schwere, disseminierte Infektionen, z. Teil mit einer Hautbeteiligung, hervorrufen. Diese Hautveränderungen können als kleine Papeln oder Pusteln, verruköse Läsionen oder auch einschmelzende Lymphadenitis oder Ulcera imponieren. Bei Auftreten derartiger Veränderungen bei AIDS-Patienten ist es deshalb wichtig, an eine mykobakterielle Ursache zu denken und entsprechende mikrobiologische Diagnostik (Ziehl-NeelsenFärbung) aus Biopsiematerial o.ä. zu veranlassen. Daneben werden durch atypische Mykobakterien Inokulationsinfektionen der Haut, auch bei Immunkompetenten, hervorgerufen. Bedeutsam ist hier das durchaus häufiger vorkommende ►Schwimmbadgranulom (8). Erreger ist Mycobacterium marinum, welches in warmen Gewässern vorkommt. Etwa 3 Wochen nach einer oberflächlichen Verletzung entstehen lokal langsam wachsende, entzündliche Papeln mit verruköser Oberfläche. Häufig finden sich diese Veränderungen im Bereich der Finger oder Ellenbogen. Zur Diagnose führen die Anamnese (Verletzung in warmen Gewässern), der klinische Befund und die Histologie sowie Kultur. Therapeutisch empfiehlt sich die Exzision der Herde, ggf. ist eine systemische Behandlung mit Minocyclin oder antituberkulöse Therapie mit Rifampicin plus Ethambutol durchzuführen. Lepra Die Lepra wird durch Mycobacterium leprae (säurefeste Stäbchenbakterien) ausgelöst und manifestiert sich als chronisch granulomatöse Erkrankung der Haut, der Schleimhäute, peripherer Nerven und innerer Organe. Die Erkrankung ist weltweit, v.a. in Südostasien, Afrika, Lateinamerika aber auch in den europäischen Mittelmeerländern verbreitet. Die Übertragung erfolgt durch intensiven (d. h. langen und engen) Kontakt mit Patienten mit „offener Lepra“ (lepromatöse Lepra), der genaue Infektionsweg ist nicht bekannt. Klinisch finden sich bei der ►lepromatösen Lepra knotige Hautveränderungen an den Streckseiten der Arme und Beine, Stirn, Wange, Ohrmuschel. Durch 13 Infiltrationen im Gesicht und Keratokonjunktivitis kommt es zum „Löwengesicht“, später tritt ein Schleimhautbefall mit chronischem Schupfen und Heiserkeit auf. Die ►tuberkuloide Lepra betrifft Haut und periphere Nerven. Auf der Haut zeigen sich Papeln oder Makulae, die nach Abheilung depigmentierte Herde hinterlassen, die gegen Berührung oder Hitze unempfindlich sind. Periphere Nerven sind später als verdickte Stränge tastbar, es treten Nervenschmerzen und an den Extremitäten trophische Ulcera und Verstümmelungen auf. Die Diagnosestellung erfolgt zunächst klinisch, wobei ein großes Spektrum an Differenzialdiagnosen zu berücksichtigen ist. Erwogen werden sollte eine Lepra bei Patienten mit einem langen Auslandsaufenthalt in entsprechenden Gebieten. Der mikroskopische Nachweis säurefester Bakterien erfolgt bei der lepromatösen Form in Hautläsionen oder im Nasenschleim (multibazilläre Lepra). Bei der tuberkuloiden Lepra ist M. leprae in Ausstrichpräparaten skarifizierter Haut nicht nachweisbar (paucibazilläre Lepra). Die histologische Untersuchung gestattet eine Klassifikation der Krankheit und eine Aussage zur Prognose. Die Behandlung erfolgt, nach Empfehlung der WHO, als kombinierte Therapie mit Dapson plus Rifampicin (paucibazilläre Lepra), zusätzlich mit Clofazimin bei der multibazillären Lepra (6). Hautmilzbrand Nachdem Milzbrand über viele Jahre fast ausschließlich eine Erkrankung in Entwicklungsgebieten war, ist das Interesse an dieser Erkrankung durch die Ereignisse der letzten Monate im Zusammenhang mit Bioterrorismus auch in den Industrienationen sprunghaft gestiegen. Erreger des Milzbrandes ist Bacillus anthracis, ein grampositives, aerobes, sporenbildendes Stäbchenbakterium. Die Sporen sind sehr widerstandsfähig und können über Jahrzehnte persistieren. ►Bacillus anthracis kommt ubiquitär vor. Anthrax ist primär eine Zoonose, betroffen sind pflanzenfressende Tiere, vor allem Ziegen, Schafe, Schweine und Rinder. Menschen sind nur sehr selten betroffen, ein gewisses Risiko besteht für Personen, die mit Tierhäuten, Fellen oder tierischen Knochen in Berührung kommen. Eine direkte Infektionsübertragung von Mensch zu Mensch findet nicht statt. Eine Infektion vieler Menschen kann nur stattfinden, wenn Milzbrandsporen in großer Menge als Aerosol verbreitet werden. Die für eine Infektion notwendige Erregermenge ist vergleichsweise hoch, die Infektionsdosis beträgt ca. 8.000-50.000 Keime. Die Übertragung von Milzbrand kann über die Haut, die Atemwege oder den Verdauungstrakt erfolgen. Die Inkubationszeit beträgt 2 –7 Tage, in seltenen Fällen bis zu 60 Tagen. Entsprechend der Übertragungswege kommt es zu drei verschiedenen klinischen Manifestationen. Mit Abstand am häufigsten ist der ►Hautmilzbrand nach direktem Kontakt mit erregerhaltigen tierischen Materialien über winzige Hautverletzungen. An der Eintrittsstelle entsteht zunächst eine Papel, die sich im Verlauf von wenigen Tagen zu einer Pustel mit später schwärzlichem Schorf und entzündlicher Umgebungsreaktion entwickelt (Pustula maligna). Die nicht schmerzhaften Läsionen haben einen Durchmesser von 1-3 cm, neben der Primärläsion können Tochtervesikel entstehen. In bis zu 80% der Fälle heilt die Effloreszenz innerhalb von 2-3 Wochen unter Narbenbildung ab. 14 Über eine Lymphangitis und hämatogene Streuung kann es zu einem schweren allgemeinen Krankheitsbild kommen, welches unbehandelt in 5-20% tödlich verläuft (7). Wesentlich verantwortlich hierfür ist ein Exotoxin. Der ►pulmonale Milzbrand verläuft zunächst unter dem Bild einer atypischen Pneumonie und geht dann innerhalb kurzer Zeit in ein septisch-toxisches Krankheitsbild über, welches fast immer letal endet. Radiologisch auffällig ist eine erhebliche Mediastinalverbreiterung. ►Darmmilzbrand ist eine äußerst seltene Erkrankung, die mit starken abdominellen Schmerzen und blutigen Diarrhoen einhergeht und meistens rasch zum Tode führt. Die Therapie erfolgt antibiotisch mit Penicillin G, alternativ Doxycyclin oder Ciprofloxacin (3). Eine Impfung ist möglich, steht allerdings nur begrenzt zur Verfügung und ist aufwendig (mehrere Impfungen über mehrere Monate, häufige Boosterimpfungen) Dermatomykosen Dermatophyten besiedeln entweder die Hornschicht (Epidermomykosen) oder dringen in den Haarfollikel ein (Trichomykosen). ►Epidermomykosen, die prinzipiell an allen Körperstellen auftreten können (Tinea corporis, Tinea manuum, Tinea inguinalis etc.), zeigen in der Regel konzentrische, rot schuppende Herde, von denen der Patient meist berichtet, dass sie eine zentrifugale Ausbreitung zeigen (13). Während der Randbereich aufgeworfen, schuppig und stark gerötet ist, kommt es mit zunehmendem Größerwerden des Herdes zentral zur Abblassung . Die oberflächliche ►Trichophytie zeigt lediglich eine geringe entzündliche Reaktion mit pityriasiformer Schuppung, dagegen findet sich bei der tiefen Trichphytie meistens eine erhebliche Entzündungsreaktion des perifollikulären Gewebes mit Bildung von Pusteln. Wenngleich das klinische Bild einer reifen, unbehandelten Läsion recht typisch ist, gibt es zahlreiche Hauterkrankungen mit ähnlichen Effloreszenzen, die differentialdiagnostisch abgegrenzt werden müssen. Insbesondere nummuläre und intertriginöse Ekzeme, Psoriasisläsionen und erythematöse, annuläre Dermatosen (z.B. chronisch diskoider Lupus erythematosus) zeigen ein ähnliches Effloreszenzbild. Anamnestische Angaben helfen sehr oft bei der Zuordnung. So kommt die Tinea corporis relativ häufig bei Landwirten mit Viehhaltung vor. Auch das Halten von Haustieren mit Fellerkrankungen geben wichtige Hinweise. Die häufigste Manifestation der Pilzerkrankung findet sich in den lateralen Zehenzwischenräumen und zeigt mazerierte, schuppige Läsionen, die vom Patienten oft nicht registriert werden, gelegentlich aber Eintrittpforten für Streptokokken und Staphylokokken sind, die ein Fußerysipel verursachen (s. o.). Die bisher erwähnten oberflächlichen Dermatomykosen können bis auf wenige Ausnahmen (ausgedehnte oder refraktäre Fälle, Nagelmykosen) lokal mit antimykotischen Cremes und Salben behandelt werden. Im Gegensatz dazu entziehen sich tiefe Trichomykosen einer Lokalbehandlung gänzlich und bedürfen einer systemischen Therapie, da durch den Follikelbefall auch tiefe Hautanteile infiziert werden und Lokaltherapeutika nicht so tief mit ausreichendem lokalen Wirkungsspiegel vordringen. Am häufigsten treten diese Trichomykosen im Bartbereich, gelegentlich auch am behaarten Kopf (Mikrosporie, Favus) auf. Typisch sind livid-rote furunkelartige Tumore mit einzelnen kleinen 15 Pusteln und pyogener Superinfektion. In Extremfällen kann der ganze Bartbereich betroffen sein. Durch Epilieren einzelner Haare aus dem Herd kann oft bereits mikroskopisch ein Pilznachweis geführt werden, der jedoch immer durch eine Pilzkultur bestätigt und der Erreger klassifiziert werden sollte. Bei einer Trichomykose sollte eine konsequente systemische Antimykose (Itraconazol oder Terbinafin) meist über Monate, unter Kontrolle der Laborparameter, insbesondere Leberenzyme, erfolgen. Epizoonosen Dabei handelt es sich um ►Hauterkrankungen durch Ektoparasiten, wobei in vielen Fällen der Mensch nur als Nebenwirt fungiert. Wenngleich in unseren Klimazonen Insektenstiche und Bisse eher harmlos verlaufen und eine geringe Komplikationsrate aufweisen, werden wir durch den Fernreisetourismus zunehmend mit blutsaugenden Parasiten konfrontiert, deren Stich bzw. Biss zusätzlich die Gefahr der Übertragung gefährlicher Infektionskrankheiten (Malaria, Schlafkrankheit, Leishmaniose) birgt. Deshalb sollte immer der Ort und Zeitpunkt eines Stichereignisses erfragt und gegebenenfalls eine Tropenerkrankung in das Spektrum der Differenzialdiagnosen eingeschlossen werden. Abgesehen von der Gefahr der Übertragung von Infektionen durch diese Vektoren, sollten Insektenstiche bei Juckreiz differenzialdiagnostisch nicht übersehen werden – die aufwendige und kostenintensive Abklärung anderer Dermatosen kann damit u. U. vermieden werden (z.B. bullöse Insektenstichreaktion vs. blasenbildende Autoimmunerkrankung). Prinzipiell bestehen sehr große interindividuelle Unterschiede bei der Reaktion auf Insektenstiche. Während einzelne Personen kaum Stichreaktionen aufweisen, kann bei anderen Menschen ein Stich zu ausgeprägter Lokalreaktion mit Schwellung und Rötung führen. Im folgenden sollen die in unseren Klimazonen am häufigsten auftretenden Epizoonosen kurz besprochen werden, wobei auf eine zoologische Systematik verzichtet wird und nur die häufigsten Infestationen beschrieben werden. Pedikulose ►Läuse (Kopf, Kleider und Filzläuse) saugen in mehrstündigem Abstand Blut. An der Einstichstelle kommt es zu stark juckenden, flachen Papeln. Intensives Kratzen, welches dazu dient, durch den Kratzschmerz den Juckreiz zu eliminieren, führt häufig zu Sekundärinfektion und Ekzematisation. Epidemisches Auftreten von Kopfläusen in Kindergärten und Schulen ist nicht selten und wird oft bereits von Eltern bei Vorstellung ihres Kindes erwähnt. Die Verdachtsdiagnose kann schnell durch den Nachweis von ►Nissen (an Haaren und Kleidung klebenden Eiern), seltener durch den direkten Nachweis der Läuse bestätigt werden. Therapeutisch müssen sowohl die Laus wie auch die Eier abgetötet bzw. entfernt werden. Neben dem mechanischen Entfernen (Waschen, Lauskamm) kommen verschiedene lokal applizierbare Mittel (Permethrin, Goldgeist, Hexachlorcyclohexan) zum Einsatz. 16 Pulikose Durch ►Flohstiche, meist im Bereich von Stellen, an denen die Kleider dem Körper anliegen, kommt es zu stark juckenden, papulösen, teils urtikariellen Läsionen. Typisch sind meist gruppierte, in Dreierkombination angeordnete und oft durch Kratzen zentral exkoriierte Papeln im Gürtelbereich. Neben der direkten, antipuriginösen Therapie steht die Entwesung der Kleidung und Wohnung im Vordergrund. Meist reicht es aus, die komplette getragene Kleidung zu waschen, wenn Flohstiche außerhalb der eigenen häuslichen Umgebung aquiriert wurden. Mückenstiche (Culicose) Neben den meist sehr juckenden urtikariellen Papeln durch Mückenstiche ist insbesondere die lokale Infektion, die in ein Erysipel (siehe Streptokokken und Staphylokokkeninfektionen) übergehen und persistierende Infiltrate (Pseudolymphome) bilden kann, eine unangenehme Komplikation. Eine Maximalvariante des Mückenstichs ist die bullöse Reaktion mit meist praller Blase auf erythematösem Grund (Culicosis bullosa). Langfristig können durch chronische Irritation (Kratzen) an der ehemaligen Stichstelle ►Histiozytome entstehen, die oft an papulöse Pigmentnaevi errinnern und von Patienten immer wieder mechanisch bearbeitet werden. Die beste Therapie ist wohl das Meiden von Insektenstichen durch Anwendung von Repellents, Tragen langer, luftiger Kleidung, Moskitonetze über dem Bett, um insbesondere Kinder vor den nachtaktiven Insekten zu schützen. Juckende Stiche können durch Externa mit Steroid und antimikrobiellem Zusatz symptomatisch bis zum Sistieren des Juckreizes behandelt werden. Skabies Skabies (Krätze) ist eine relativ häufige, gelegentlich epidemisch auftretende höchst pruriginöse Hauterkrankung, die durch Krätzmilben, die ausschließlich die Hornschicht besiedeln, verursacht wird. Typisch sind die ekzematösen Hautveränderungen an den ►Prädilektionsstellen wie Finger-Zwischenräumen, Genitalbereich, Brustbereich und Axillen. Dabei handelt sich meist um Regionen mit dünner Haut und hoher Temperatur. Sofern keine eindeutigen Milbengänge und an deren Ende punktfömige Parasiten erkennbar sind, ist das Freibleiben von Handinnenflächen und Fußsohlen (cave: nicht bei Säuglingen) sowie des Kopfes eine wesentliche diagnostische Hilfe. Differentialdiagnostisch können aber allergische Hand-Ekzeme mit vorwiegendem Befall der Fingerzwischenpartien und Finger-/Handrücken vor abschließender allergologischer Testung und Berufsanamnese oft schwer abgegrenzt werden. Auch atopische Ekzeme müssen gelegentlich in die Differentialdiagnose einbezogen werden. Wenn eine umgehende diagnotische Zuordnung nicht möglich ist, wird eine Skabies-verdächtige Hautmanifestation ex juvantibus primär als Skabies behandelt. Therapieziel ist die Elimination der Milben (meist nur 10-20 Milben pro Wirt) und das Vermeiden einer Reinfektion. Mittel der Wahl unter den heute angebotenen Externa 17 ist Permethrin. Bei epidemieartigem Ausbruch in Pflegeheimen wird aus organisatorischen Gründen oft systemisch mit Ivermectin (Einmaldosis) erfolgreich behandelt. Während der Lokaltherapie sollte der Bettbereich durch mehrtägiges Lüften und Nichtbenützen saniert werden, da in dieser Periode nicht auf dem Menschen lebende Parasiten absterben. Neben der Therapie von Kontaktpersonen ist auch eine konsequente antiekzematöse Nachbehandlung empfehlenswert, da gerade postskabiöse Papeln stark juckende Beschwerden verursachen und oft durch Kratzen reaktiviert werden. Erntekrätze (Thrombidiose) Der Stich der Larven der Trombidien (Laufmilben), die sich im Herbst oft in großer Dichte im Gebüsch und auf Gräsern aufhalten, führt zu meist zahlreichen Hauterscheinungen mit Quaddeln, Seropapeln und oft begleitender Hämorrhagie. Das anfallsartige Auftreten, die Jahreszeit und die ►stropholusartige Hautveränderung sind meist diagnoseweisend. Aufgrund der in der Regel einmaligen Attacke kommt es zu einem synchronen Abheilen der Läsionen binnen 12 Wochen, weshalb eine symptomatische antipruriginöse Lokaltherapie in den meisten Fällen ausreichend ist. Danksagung: Herrn Prof. Dr. Klaus Fleischer, Chefarzt der Tropenmedizinischen Abteilung der Missions-ärztlichen Klinik Würzburg, danken wir herzlich für die Überlassung der Abbildung 9. Literatur 1. Artz AL, Szabo S, Zabel LT, Hoffmeister HM (2001) Aortic valve endocarditis with paravalvular abscesses caused by Erysipelothrix rhusiopathiae. Eur J Clin Microbiol Infect Dis 20 : 587-588 2. Burgdorfer W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E, Davis JP (1982) Lyme disease – a tick-borne spirochetosis? Science 216: 1317-1319 3. Doganay M, Aydin N (1991) Antimicrobial susceptibility of Bacillus anthracis. Scand J Infect Dis 23:333-335 4. Ehlert O. (1992) Operationsindikationen bei bakterieller Endokarditis. Dtsch Med Wschr 117: 1647-1649 5. Geerdes- Fenge HF, Lode H, Ziegler D, Hund M, Wagner F, Fangmann W, Loehr A (1994) Erregerspektrum der Sepsis. Chemotherapie J 3: 131-143 6. Grosset JH, Cole ST (2001) Genomics and the chemotherapy of leprosy. Lepr Rev 72:429-440 7. LaForce FM (1994) Anthrax. Clin Infect Dis 19: 1009-1014 18 8. Leuenberger R, Bodmer T (2000) Clinical presentation and therapy of Mycobacterium marinum infection as seen in 12 cases. Dtsch Med Wschr 125:7-10 9. Manders SM (1998) Toxin-mediated streptococcal and staphylococcal disease. J Am Acad Dermatol 39: 383-398 10. Maurin M, Birtles R, Raoult D (1997) Current knowledge of Bartonewlla species. Eur J Clin Microbiol Infect Dis 16: 487-506 11. Musher DM, Baughn RE (2000) Syphilis. In: Gorbach SL, Bartlett JG, Blacklow NR (ed.): Infectious Diseases, 2. Auflage: 980-986, W.B. Saunders Company, Philadelphia 12. Reingold A.L., N. T. Hargrett, K. N. Shands et al.(1982) Toxic shock syndrome surveillance in the United States, 1980 to 1981. Ann. Int. Med. 96/2, 875-880 13. Rinaldi MG (2000) Dermatophytosis: epidemiological and microbiological update. J Am Acad Dermatol 43: 120-124 14. Scheld WM, Sande MA (1995) Endocarditis and intravascular infections. In: Mandell GL, Bennet JE, Dolin R (ed.): Principles and practice of infectious diseases, 4. Auflage: 740, Churcill Livingston, New York 15. Todd J, Fishaut M, Kapral F, Welch T (1978) Toxic-shock syndrome associated with phage-group-I staphylococci. Lancet II: 1116-1118 Priv. Doz. Dr. Hartwig Klinker Schwerpunkt Hepatologie/Infektiologie Medizinische Poliklinik, Standort Luitpoldkrankenhaus Josef-Schneider-Str. 2 D-97080 Wuerzburg Tel.: 0931/201-36179 Fax: 0931/201-36485 e-mail: [email protected] www.medpoli.uni-wuerzburg.de/hepinf 19