- R-Biopharm AG
Werbung
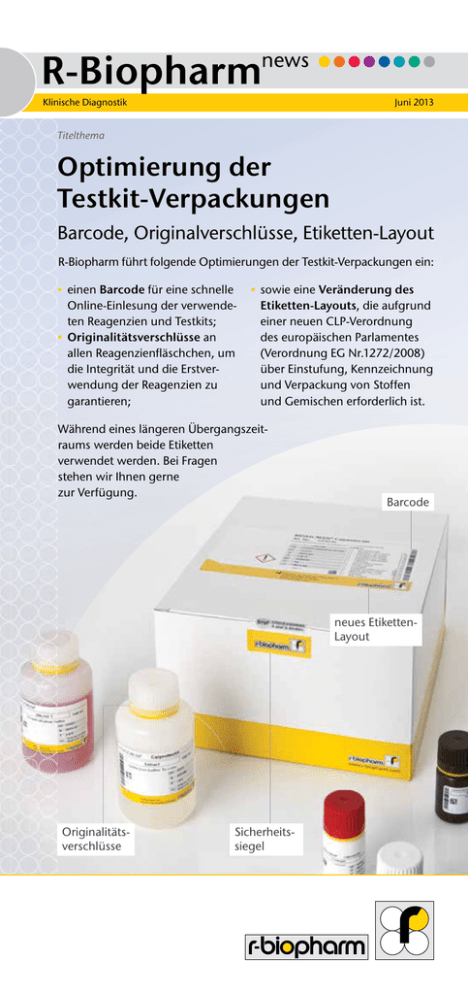
November Juni 2012 2013 Klinische Diagnostik Titelthema Optimierung der Testkit-Verpackungen Barcode, Originalverschlüsse, Etiketten-Layout R-Biopharm führt folgende Optimierungen der Testkit-Verpackungen ein: • einen Barcode für eine schnelle Online-Einlesung der verwendeten Reagenzien und Testkits; • Originalitätsverschlüsse an allen Reagenzienfläschchen, um die Integrität und die Erstverwendung der Reagenzien zu garantieren; • sowie eine Veränderung des Etiketten-Layouts, die aufgrund einer neuen CLP-Verordnung des europäischen Parlamentes (Verordnung EG Nr.1272/2008) über Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen erforderlich ist. Während eines längeren Übergangszeitraums werden beide Etiketten verwendet werden. Bei Fragen stehen wir Ihnen gerne zur Verfügung. Barcode neues EtikettenLayout Originalitätsverschlüsse Sicherheitssiegel RIDA®QUICK Clostridium difficile GDH Mit dem aktuellen Schnelltest ist R-Biopharm nun in der Lage, eine komplette Lösung für die immunologische C. difficileDiagnostik anzubieten, die den neuen internationalen Leitlinien verschiedener Fachgesellschaften (ESCMID, SHEA/ISDA) entspricht. Ob große Probenserien mittels ELISA oder kleine Serien und Einzelbestimmungen mittels Schnelltest, in allen Fällen kann der aktuell empfohlene 2-SchrittUntersuchungsalgorithmus nun bedient werden. Im ersten Schritt wird durch den sehr sensitiven Nachweis der Clostridium difficile-spezifischen Glutamatdehydrogenase festgestellt, ob der klinische Verdacht einer Clostridium difficileInfektion (CDI) weitere Untersuchungen nötig macht. Dies ist erst dann der Fall, wenn der spezifische GDH-Nachweis positiv ausfällt. Statistisch und je nach Prävalenz ist dies nur in etwa 15 - 35 % der auf Verdacht einer CDI untersuchten Proben der Fall. Das heißt, dass 65 - 85 % der im GDH-Test untersuchten Proben negativ sind und eine CDI mit großer Wahrscheinlichkeit auszuschließen ist. Der NPV des GDH-Nachweises liegt bei 98 - 100 %. Bei asymptomatischen Trägern kommen sehr geringe Mengen an Clostridium difficle und somit an GDH vor. Diese haben keine klinische Bedeutung, es sei denn, man befürchtet eine Übertragung der Sporen auf der fäkaloralen Route auf immungeschwächte oder unter Antibiose stehende Patienten in Hospitälern oder Altersheimen. Ist der GDH-Nachweis positiv, müssen die Toxine A und/oder B von C. difficile nachgewiesen werden, welche richtliniengemäß das Vorhandensein einer CDI beweisen. Allein der Nachweis der Toxingene mittels PCR ist nicht beweisend, sondern nur hinweisend. Als Goldstandard zum Nachweis der Toxine gilt der Zytotoxintest (CTA) oder die toxigene Kultur, die allerdings zunächst eine 48-stündige kulturelle Anreicherung von C. difficile aus der Stuhlprobe erfordert. Seite 2 In beiden Fällen wird ein Filtrat aus Stuhl (CTA) oder aus der gewachsenen Kultur auf für die Toxine sensible Zellkultur gebracht und über 1 - 2 Tage ein eventuell eintretender typischer pathogener Effekt (TPE) beobachtet. Beide Verfahren sind sehr zeitaufwendig, kaum standardisiert und dementsprechend auch auf wenige Labors beschränkt. Einfacher und schneller kann der Toxinnachweis immunologisch mittels ELISA (z.B. RIDASCREEN® Clostridium difficile Toxin A/B) oder mit dem entsprechenden Schnelltest (z.B. RIDA®QUICK Clostridium difficile Toxin A/B) erbracht werden. Sollte trotz eines anhaltend starken Verdachtes auf eine CDI und nach Ausschlussdiagnostik anderer möglicher Diarrhoe- und Enteritiserreger der immunologische Toxinnachweis weiterhin negativ sein, dann sollte auf jeden Fall eine PCR zum Nachweis der Toxingene durchgeführt werden. Diese wird Klarheit bringen, um eine sich an die Diagnostik anschließende spezifische Therapie der CDI zu initiieren. Neben der meist verwendeten preiswerten Metronidazol-Therapie gibt es mittlerweile neben Vancomycin und Teicoplanin weitere neue wirksame Antibiotika wie das Fidaxomycin, das sich angeblich durch eine geringere Quote an Rezidiven auszeichnet. RIDA®QUICK Clostrium difficile GDH Art. Nr. N0703 Positiv Negativ Ungültig Ungültig RIDA®GENE Bordetella und RIDASCREEN® Bordetella PT IgG & IgA Die R-Biopharm AG erweitert das Produktportfolio zur Labordiagnostik einer Keuchhusten (Pertussis)-Infektion Bordetella pertussis verursacht eine akute respiratorische Infektion, die als Pertussis oder Keuchhusten bezeichnet wird. Bordetella holmesii, Bordetella parapertussis und Bordetella bronchiseptica verursachen hingegen seltener eine keuchhustenähnliche Erkrankung mit milderem Verlauf. Die WHO (World Health Organization) schätzt, dass weltweit ca. 16 Millionen Pertussis-Fälle in 2008 auftraten, wovon ca. 195.000 Fälle bei Kindern zum Tode führten. Für die Labordiagnostik der PertussisErkrankungen stehen verschiedene Methoden, wie real-time PCR, Kultur und Serologie zur Verfügung. Die Kultur ist fast 100 % spezifisch und kann in den ersten 2 Wochen nach Symptombeginn der Erkrankung eine Sensitivität von bis 50 % aufweisen, die mit der Zeit weiter abnimmt. Die kulturelle Isolierung erfordert spezielle Kulturmedien und benötigt mindestens eine Woche. Die serologische Diagnostik ist in der Frühphase der Erkrankung ungeeignet. Antikörper können frühestens 2 Wochen nach der Infektion oder Impfung nachgewiesen werden. Zum Einsatz kommen ELISA-Tests mit Pertussistoxin (PT) oder filamentösem Hämagglutinin (FHA) als Testantigen. FHA wird von allen Bordetellen gebildet, während PT nur von B. pertussis gebildet wird. Bei einem Großteil der Kinder, Jugendlichen und Erwachsenen sind IgG-und IgA-Antikörper gegen Pertussis-Toxin (PT) nachweisbar. Alle Pertussis-Impfstoffe enthalten PT, während FHA eine Komponente von azellulären Pertussis-Impfstoffen ist. Mit serologischen Tests kann daher eine Impfantwort nicht von einer Infektion unterschieden werden. Die neuen quantitativen RIDASCREEN® Bordetella Seite 3 PT-ELISAs ermöglichen den spezifischen Nachweis einer B. pertussis-Infektion in internationalen Einheiten (IU/ml). Die Quantifizierung erfolgt über eine kostengünstige Ein-Punkt-Kalibration. Alle Reagenzien des Assays sind gebrauchsfertig. Die real-time PCR ermöglicht einen schnellen, sensitiven und spezifischen Nachweis bis zu 4 Wochen nach Symptombeginn der Erkrankung. RIDA®GENE Bordetella Art. Nr. PG2505 Die R-Biopharm AG bietet ab sofort mit dem RIDA®GENE Bordetella Assay eine real-time multiplex PCR zum schnellen und spezifischen Nachweis und der Differenzierung von B. pertussis, B. parapertussis und B. holmesii aus humanem Nasopharyngeal-Abstrich in weniger als 2 Stunden an. Die real-time PCR kann auf den gängigen real-time PCR-Geräten (Mx Serie, LightCycler® 480II, Smart-Cycler®, ABI 7500, m2000rt, Rotor-Gene Q) verwendet werden. Alle erforderlichen Komponenten sind im Kit enthalten und ermöglichen 100 Bestimmungen. Produkte zum Nachweis einer Pertussis Infektion: Produkt Art. Nr. RIDASCREEN® – Enzymimmunoassays RIDASCREEN® Bordetella IgM K2531 RIDASCREEN® Bordetella IgG K2521 RIDASCREEN® Bordetella IgA K2511 RIDASCREEN® Bordetella PT IgG K2621 RIDASCREEN® Bordetella PT IgA K2611 RIDA®GENE real-time PCR RIDA®GENE Bordetella PG2505 RIDA®GENE Clostridium difficile und RIDA®GENE Clostridium difficile LC2.0 Neue Real-time Multiplex Assays zum Nachweis von Clostridium difficile Die neuen Multiplex-Assays RIDA®GENE Clostridium difficile und RIDA®GENE Clostridium difficile LC2.0 ermöglichen die gleichzeitige Bestimmung von Clostridium difficile (16S-rDNA) sowie der Clostridium difficile Toxin-Gene A und B (tcdA/tcdB). Der RIDA®GENE Clostridium difficile LC2.0-Assay kann auf dem LightCycler 2.0 und der RIDA®GENE Clostridium difficile-Assay auf allen weiteren gängigen real-time PCR Geräten wie der Mx Serie, LightCycler® 480II, SmartCycler®, ABI 7500, m2000rt oder Rotor-Gene Q verwendet werden. Beide RIDA®GENE-Teste ermöglichen die Diagnose einer Clostridium difficile assoziierten Diarrhoe direkt aus humanen Stuhl- und Kulturproben in weniger als 2 Stunden. Sie enthalten gebrauchsfertig alle erforderlichen real-time PCRReagenzien für 100 Bestimmungen. Das Detektionslimit liegt bei ≥ 5 DNAKopien / Reaktion. RIDA®GENE Entamoeba histolytica Neu! Mit der neuen RIDA®GENE Entamoeba histolytica real-time PCR erweitert die R-Biopharm AG das RIDA®GENE Produktportfolio zum molekularen Nachweis parasitärer Erreger Entamoeba histolytica ist die einzige humanpathogene Spezies in der Gattung Entamoeba und Erreger der Amöbiasis. Klassisch erfolgt die Diagnose von Entamoeba histolytica durch mikroskopische Untersuchung von Stuhlproben, wofür erfahrenes Personal zur Verfügung stehen muss. Die RIDA®GENE Entamoeba histolytica real-time PCR ist eine neue und attraktive Alternativmethode zur Direktuntersuchung von Stuhlproben und hat sich als hoch sensitiv und spezifisch für den Nachweis von Entamoeba histolytica (18S-ITS) erwiesen. Das RIDA®GENE Kit kann auf den gängigen real-time PCR-Geräten wie der Mx Serie, LightCycler® 480II, LightCycler® 2.0, SmartCycler®, ABI 7500, m2000rt oder Rotor-Gene Q verwendet werden. Der Assay enthält gebrauchsfertig alle für die real-time Seite 4 RIDA®GENE Entamoeba histolytica Art. Nr. PG1735 PCR erforderlichen Komponenten und erlaubt 100 Bestimmungen in weniger als 2 Stunden. Das Detektionslimit liegt bei ≥ 5 DNA-Kopien / Reaktion. Vorteile des RIDA®GENE Enatmoeba histolytica-Assays: • Sensitiver und spezifischer Nachweis von Entamoeba histolytica • Direktnachweis aus Stuhlproben • Ergebnisse in weniger als 2 Stunden • Real-time PCR • Anwendbar auf allen gängigen real-time PCR-Geräten Bestes Abschneiden des RIDASCREEN® Calprotectin im Ringversuch der Instand e.V. Die R-Biopharm hat erfolgreich mit dem Produkt RIDASCREEN® Calprotectin am Instand-Ringversuch „Fäkale Diagnostik“ (RV130) teilgenommen Der RIDASCREEN® Calprotectin hat von allen teilnehmenden Herstellern die beste Gesamtbestehensquote erzielt. Die niedrig konzentrierte Probe (Nr. 21) wurde von 93,3 %, die hochkonzentrierte Probe (Nr. 22) von 80 % der RIDASCREEN® Calprotectin-Anwender im vorgegebenen Zielbereich gefunden. Die Konzentrationen der Ringversuchsproben wurden – in Anlehnung an die RIDASCREEN® Calprotectin Art. Nr. G09036 Equalis-Ringversuche aus Schweden – herstellerspezifisch ermittelt. Hervorragendes Abschneiden des Pankreas-Elastase-ELISAs (Bioserv) im Ringversuch der Instand e.V. Die R-Biopharm AG hat erfolgreich mit dem Pankreas-ElastaseELISA der Firma Bioserv am Instand-Ringversuch „Fäkale Diagnostik“ (RV131) teilgenommen Im ersten von Instand e.V. organisierten Ringversuch zu diesem Parameter hat der Pankreas-Elastase-ELISA von Bioserv mit einer Gesamtbestehensquote von 93 % hervorragend abgeschnitten. Die niedrig konzentrierte Probe (Nr. 21) wurde von 96,7 %, die hochkonzentrierte Probe (Nr. 22) von ebenfalls 96,7 % der Bioserv-Pankreas-ElastaseELISA-Anwender im vorgegebenen Zielbereich gefunden. Bei Interesse an unseren Produkten fordern Sie bitte das entsprechende Informationsmaterial unter der Telefonnummer 0 61 51 - 81 02-0 an oder senden Sie eine E-Mail an: [email protected] . Seite 5 Messen und Tagungen 16.07. - 17.07.2013 PCR-Training Darmstadt 05.09. - 07.09.2013 8. Deutscher Allergie Kongress Bochum 08.09. - 13.09.2013 GUS Product Training Darmstadt 11.09. - 14.09.2013 66. Jahrestagung der DGVS/DGAV Nürnberg 22.09. - 25.09.2013 65. Jahrestagung der DGHM e. V. in Kooperation mit der DGI Rostock 02.10. - 04.10.2013 EMMD 8th European Meeting on Molecular Diagnostics Scheveningen, Niederlande 12.10. - 16.10.2013 UEG Week, United European Gastroenterology Week Berlin 16.10. - 18.10.2013 Freiburger Infektiologie- und Hygienekongress Freiburg 22.10. - 25.10.2013 Medical Biodefense Conference 2013 München 20.11. - 23.11.2013 MEDICA Düsseldorf R-Biopharmnews herausgegeben von R-Biopharm AG Postanschrift: An der neuen Bergstraße 17, 64297 Darmstadt, Sitz: Pfungstadt Telefon: 0 61 51 - 81 02-0, Fax: 0 61 51 - 81 02-40, www.r-biopharm.com Vorsitzender des Aufsichtsrats: Dietrich Mollat Vorstand: Dr. Ralf M. Dreher (Vors.), Dr. Carsten Bruns, Jochen Hirsch, Dr. Peter Schubert Reg.-Nr.: Amtsgericht Darmstadt, HRB 8321 Steuer-Nr.: 07242 / 02 888, USt.ID-Nr.: DE 111 657 409