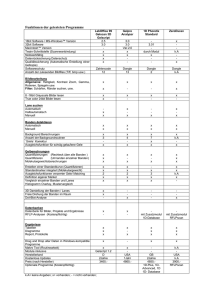
Glykoproteinmuster von ovarialen (neoplastischen)
Werbung

Freie Vorträge: Onkologie Gynäk. Rdsch. 1986;26(suppl. 2):293-294 Glykoproteinmuster von ovarialen (neoplastischen) Zysteninhalten und -epithelien mittels der „Lektinblotting“Methode K. K. H. Czerwenkaa Kremserb Retzekb a I. Universitäts-Frauenklinik, Wien (Vorstand: Prof. Dr. E. Gitsch) bInstitut für Medizinische Chemie, Wien (Vorstand: Prof. Dr. E. Kaiser) OA Dr. K. Czerwenka, I. Universitäts-Frauenklinik Wien, Spitalgasse 23, A-1090 Wien Downloaded by: 88.99.70.242 - 2/13/2017 7:41:29 PM In früheren Untersuchungen an Mamma- und Ovarialkarzinomen zeigte sich, daß diese Tumoren sekretionsassoziierte Lektin-Bmdungsstellen an Zellmembranen besitzen können [1, 2]. Als Lektine [3] faßt man im allgemeinen eine Gruppe nicht antikörperähnlicher Proteine zusammen, die in der Lage sind, spezifisch mit Zucker-Strukturen zu reagieren. Lektine sind daher für Untersuchungen von Membran-Glykoproteinen wertvolle Markie-rungselemente. Von Interesse war, ob sich in serösen Inhalten von Zystadenomen Glyko-proteine nachweisen lassen und ob durch den Kohlehydratanteil nach gelelektrophoretischer Trennung und Transfer der Proteinbanden auf Nitrozellulosepapier (Western-Blot) mittels der Lektinhistochemie spezifische Zucker mit unterschiedlichem Färbemuster erfaßt werden können. 11 seröse Zysteninhalte wurden mit dem Enzym Neuraminidase vorbehandelt und auf einer SDS-Page-Elektrophorese aufgetragen. Dabei konnten die Proteine mit Banden-verschiebungen (bei etwa 90 und 50 KD), die eine Abspaltung von Sialinresten aufzeigten, erkannt werden. Das Lektinfärbemuster (Lektin + HRP-gekoppelt) der auf die Nitrozellu-lose übertragenen Glykoproteine bei drei gut aufschließbaren und miteinander vergleichba-ren Proben aus den Zysteninhalten zeigte etwas differente Kohlehydratanteile auf. Folgende Kohlehydrate konnten unter Anwendung dieser Lektine erkannt werden: WGA [mit der Zuckerspezifität (ß-(l→4)-D-GlcNac)2], RCA 1 (mit der Zuckerspezifität ß-D-Gal), LPA und LFA (mit der Zuckerspezifität Sialinsäure). Unterschiedliches Färbeverhalten fand sich vor allem an 3 Proteinbanden. Eine Proteinbande (bei 90 KD) war mit den Lektinen RCA 1 und LPA sowie LFA anfärbbar. In den zwei anderen Banden (um 50 KD) waren die Lektine RCA 1, LPA, WGA und LFA mit einem positiven Färbeverhalten zu beobachten. Dieses Ergebnis kann für das Vorhanden-sein von terminalen Sialinsäureresten und damit für Kohlehydratanteile mit hohem Verzwei-gungsgrad vom Typ eines „N-linked” Oligosaccharides gehalten werden. Bei einer weiteren Versuchsanordnung wurden von drei ovarialen Tumoren diesmal nicht die Zysteninhalte sondern die epithelialen Wandanteile bzw. direkt Tumorgewebe verwendet. Die Fragestellung lautete diesmal, ob a) sich aus dem Tumorgewebe gelelektro-phoretisch Glykoproteine auftrennen, ob b) sich die so gewonnenen Proteinbanden ebenso auf Nitrozellulosepapier transferieren und ob c) sie sich mit glykostrukturspezifischen Lektinen Downloaded by: 88.99.70.242 - 2/13/2017 7:41:29 PM anfärben lassen und ob d) außerdem die Resultate histologisch am Gewebeschnitt (Tumorepithel) nachvollziehbar und somit vergleichbar sind. Freie Vorträge (Onkologie) 294 Dafür wurden Lektine verwendet, die sich für die Darstellung der Kohlehydratanteile an Oberflächen-Zellmembranen eignen. Die Lektine sind: PNA [mit der Zuckerspezifität Gal-ß(l·→3)-GalNac], WGA [mit der Zuckerspezifität (ß-(l·→4)-D-GlcNac] und LPA (mit der Zuckerspezifität Sialinsäure). Als histochemische Methode wurde die direkte Peroxydase-Technik (Lektin mit Peroxydase konjugiert) am entparaffinisierten Gewebe verwendet und die Negativkontrolle erfolgte durch nichtkonjugierte hemmende Zucker. In der gelelektrophoretischen Auftren-nung (Western-Blot) waren die Proteinbanden im Molekularbereich zwischen 40-200 KD deutlich sichtbar. Ein Unterschied in den Banden zeigte sich hauptsächlich zwischen den Tumorbiopsien „gutartiges (seröses) Zystadenom” zu den Zystadenokarzinomen niedriger („border-line Typ”) und hoher Malignität. Im sogenannten „Lektin-Overlay” ließ das PNA eine fragliche Anfärbbarkeit (bei 45 KD) in der Gruppe der malignen Tumore erkennen. WGA hingegen wies bei mehreren Banden (zwischen 40 und 200 KD) ein deutliches Färbemuster für den gutartigen Tumor auf. Eine Abnahme der Anfärbbarkeit (Intensität) der Proteinbanden und ein Bandenverlust war in den malignen Tumoren zu beobachten, jedoch traten einzelne Banden neu auf (bei 90 KD). LPA zeigte hingegen nur eine Lektinfärbbarkeit in der gutartigen und sogenannten „border-line”Tumorbiopsie. Das Ergebnis des Färbemusters mit Hilfe des Western-Blots und des „LektinOverlays” und das histochemische Verhalten der Lektine an den Tumorepithelien (histologischer Gewebe-schnitt) ließ sich an den Epithel-Membranoberflächen, obwohl lokal unterschiedlich, eini-germaßen nachvollziehen. Zwischen den (serösen) gutartigen, intermediären und malignen Kystomen bestanden hauptsächlich im epithelialen Anteil Unterschiede im Lektin- und damit im Glykoprotein-muster. Die spezifischen Kohlehydratanteile an den Zellmembranoberflächen ließen sich durch die Lektine WGA (spezifisch für die endo- und terminalständige GlcNac, und Sialinsäure) und im geringen Maß durch PNA (spezifisch für Sialinsäure) darstellen. Mit zunehmender Malignität kam es somit zu einem Verlust von Kohlehydratanteilen an den membranständigen Glykoproteinen. Dieser Verlust von spezifischen Kohlehydratanteilen wird unter anderem als Erklärung für das geänderte Verhalten der Oberflächenmembranen von neoplastisch transformierten Zellen herangezogen. Literatur Klein, P. L, Vierbuchen, M., Schulz, K. D., Würz, H., Citoler, P., Uhlenbruck, G., Ortmann, M., Fischer, R.: II. Lektin-Rezeptoren als Indikator einer Hormonsensibili-tät von Mammakarzinomen. In: Tumor Diagnostik 2, pp. 240-245 (Tumor-Diagnostik, Leonberg, 1981). Czerwenka, K., Rokitansky, A., Buxbaum, P., Trubel, W., Hosmann, L: Histochemi-scher Nachweis von Lektin-Bindungsstellen in Zystadenokarzinomen (des Ovars) im Vergleich zum Steroid-Rezeptorgehalt. Gynäk. Rdsch. 25 (Suppl. 2): 47-49 (1985). Goldstein, I. L, Hyes, C. E.: The lectins: Carbohydratebinding proteins of plants and animals. Adv. Carb. Chem. and Biochem. 35: 127-140 (1978).