Stoffklasse Alkane Alkene/Alkine Aromaten funktionelle Gruppe
Werbung
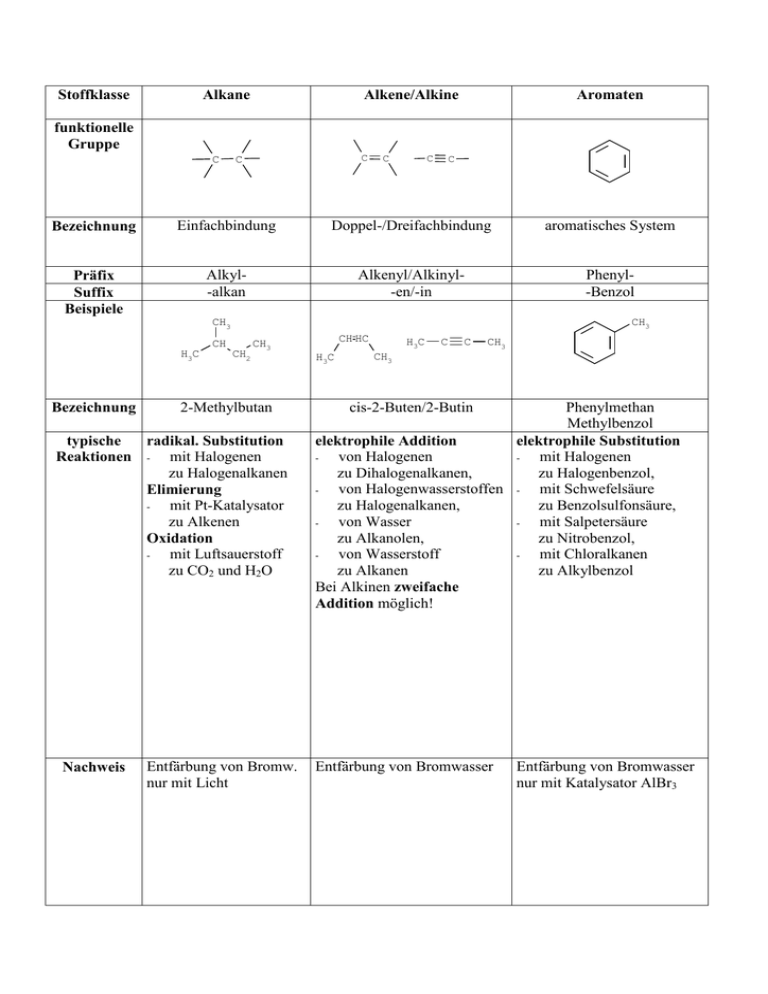
Stoffklasse Alkane Alkene/Alkine Aromaten funktionelle Gruppe C C C C C C Bezeichnung Einfachbindung Doppel-/Dreifachbindung aromatisches System Präfix Suffix Beispiele Alkyl-alkan Alkenyl/Alkinyl-en/-in Phenyl-Benzol CH3 CH3 CH H3C Bezeichnung CH2 2-Methylbutan typische radikal. Substitution Reaktionen - mit Halogenen zu Halogenalkanen Elimierung mit Pt-Katalysator zu Alkenen Oxidation mit Luftsauerstoff zu CO2 und H2O Nachweis CH HC CH3 Entfärbung von Bromw. nur mit Licht H3C H3C C C CH3 CH3 cis-2-Buten/2-Butin Phenylmethan Methylbenzol elektrophile Addition elektrophile Substitution von Halogenen mit Halogenen zu Dihalogenalkanen, zu Halogenbenzol, von Halogenwasserstoffen - mit Schwefelsäure zu Halogenalkanen, zu Benzolsulfonsäure, von Wasser mit Salpetersäure zu Alkanolen, zu Nitrobenzol, mit Chloralkanen von Wasserstoff zu Alkylbenzol zu Alkanen Bei Alkinen zweifache Addition möglich! Entfärbung von Bromwasser Entfärbung von Bromwasser nur mit Katalysator AlBr3 Zusammenfassung funktioneller Gruppen und ihrer Reaktionen primäre/sekundäre/tertiäre primäre/sekundäre/tertiäre Halogenalkane Aminoalkane C X C primäre/sekundäre/tertiäre Alkohole NH2 C OH Halogenatom Aminogruppe Hydroxylgruppe Halogen-halogenid Amino-amin Hydroxy-ol CH3 Cl C H C CH3 CH3 H H2N C H HO C H H H C H H C H H3C H3C H3C L-2-Chlorbutan L-2-Aminobutan L-2-Butylchlorid L-1-Butylamin Säure-Base-Reaktion nukleophile Substitution mit Halogenwasserstoffen - mit Säuren zu Halogenalkanen, zu Alkylammoniumionen mit Natronlauge mit Na zu Alkoholen, zu Alkylamiden mt Ammoniak zu Aminoalkanen, mit Alkoholationen zu Ethern Eliminierung mit Natronlauge zu Alkenen L-2-Hydroxybutan L-2-Butananol nukleophile Substitution (über Alkyloxonium) mit Halogenwasserstoffen zu Halogenalkanen, mit anderen anorganischen Säuren zu Säureestern, mit Alkoholen zu Ethern Eliminierung (über Alkyloxonium) zu Alkenen Oxidation der prim./sek. Alkohole mit CuO, KMnO4 oder H2CrO4 zu Aldehyden/Ketonen Säure-Base-Reaktion mit Säuren zu Alkyloxoniumionen mit Na (als Lewis-Base) zu Alkoholaten Summenformel enthält F, Cl, Br, I Alle Alkohole bilden mit Na Wasserstoff primäre/sekundäre Alkohole lassen sich mit starken Oxidationsmitteln (heißes CuO, KMnO4 oder H2CrO4) oxidieren. tertiäre Alkohole lassen sich nicht oxidieren. Summenformel enthält N wasserlösliche Amine reagieren basisch Ether Aldehyde/Ketone R H O C C C Alkoxy-ether O CH2 O R CH3 O HC C CH3 O Carboxylgruppe/Carboxylatgruppe -säure/-oat O CH C OH H2C CH3 C + H+ CH2 O Methoxyethan 1-Oxobutan/2-Oxobutan Methylethylether Butanal/2-Butanon nukleophile Subst. nukleophile Addition (über Dialkyloxonium) - von Wasser mit Wasser zu n,n-Dihydroxyverb. zu Alkoholen von Alkoholen (Etherspaltung) zu n-Hydroxy, n-Alkoxyverb. (Halbacetalen) und nachfolgende nukleophile Substitution mit Alkohol zu n,n-Dialkoxyverb. (Vollacetalen) Oxidation der primären Carbonylverbindungen mit Cu2+ oder Ag+ zu Carbonsäuren Keto-Enol-Tautomerie der Carbonylverbindungen zu Alkenolen Summenf. enthält O, aber keine Reaktion mit Na oder Oxidationsmitteln R C H3C H2C H2C R O- - H+ O Oxogruppe (=O) Carbonylgruppe (C=O) Aldehyd-/Ketogruppe Oxo-al/-on H3C H3C OH C O R Oxagruppe (−O−) Ethergruppe Carbonsäuren CH3 1-Methylpropansäure/1Methylpropanoat nukleophile Addition von Alkoholen von Aminen und nachfolgende Eliminierung von Wasser zu Carbonsäureestern (→ Fette) zu Carbonsäureamiden (→ Peptide) Säure-Base-Reaktion mit Basen zu Alkanoaten primäre Carbonylverbindungen wasserlösl. Carbonsäuren reagieren lassen sich mit schwachen sauer + 2+ Oxidationsmitteln (Ag oder Cu ) oxidieren und färben fuchsinschweflige Säure violett. sekundäre Carbonylverbindungen lassen sich nicht oxidieren Stoffklasse funktionelle Gruppe Bezeichnung Präfix Suffix Beispiele Bezeichnung typische Reaktionen Nachweis Alkane Alkene/Alkine Aromaten Zusammenfassung funktioneller Gruppen und ihrer Reaktionen primäre/sekundäre/tertiäre Halogenalkane primäre/sekundäre/tertiäre Aminoalkane primäre/sekundäre/tertiäre Alkohole Ether Aldehyde/Ketone Carbonsäuren

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)