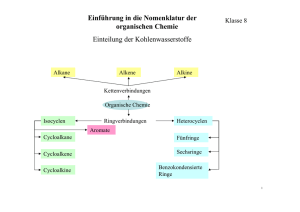
Aminosäuren (Amino acids)
Werbung
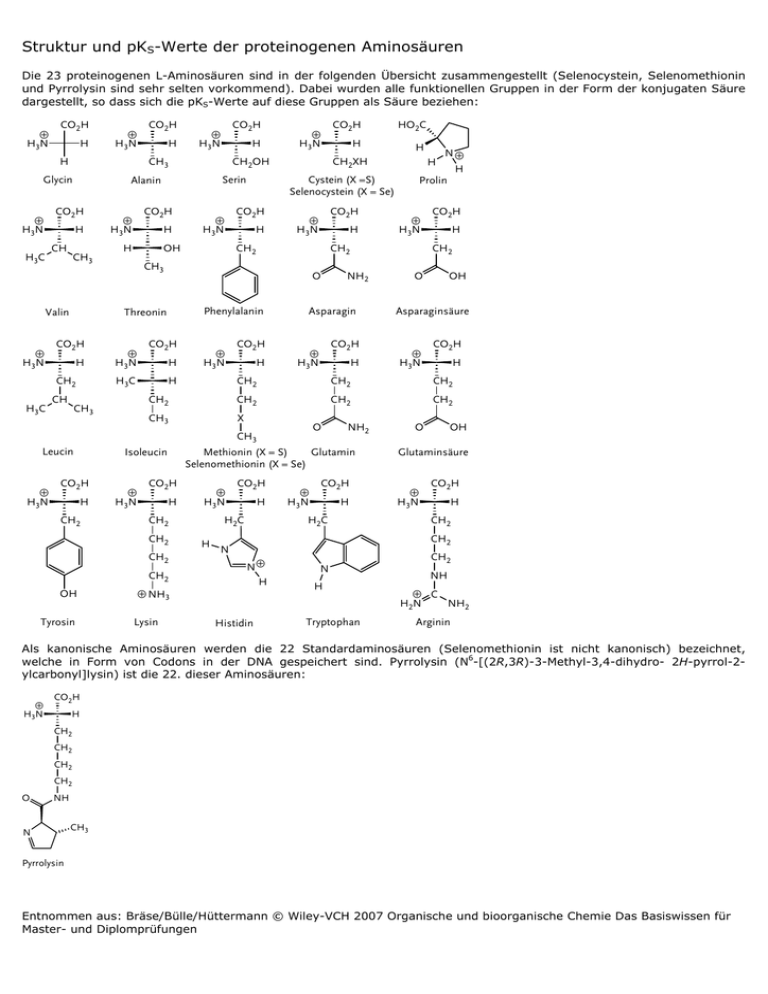
Struktur und pKS-Werte der proteinogenen Aminosäuren Die 23 proteinogenen L-Aminosäuren sind in der folgenden Übersicht zusammengestellt (Selenocystein, Selenomethionin und Pyrrolysin sind sehr selten vorkommend). Dabei wurden alle funktionellen Gruppen in der Form der konjugaten Säure dargestellt, so dass sich die pKS-Werte auf diese Gruppen als Säure beziehen: ² H3N CO2H H ² H3N H H CH CH3 Valin ² H3N CO2H ² H3N H CO2H H CH CO2H ² H3N H OH H H3C CH3 H CO2H H ² H3N H CH2 ² H3N CO2H H CO2H H O OH Asparaginsäure ² H3N CO2H H CH2 CH2 CH2 CH2 CH2 CH3 X O CO2H H ² H3N CH2 CH2 CO2H H H2C H ² H3N CO2H H H2C O OH Glutaminsäure ² H3N CO2H H CH2 CH2 N N² H ² NH3 Lysin NH2 Methionin (X = S) Glutamin Selenomethionin (X = Se) CH2 Tyrosin ² H3N CH2 CH2 OH H Prolin CH2 Isoleucin CO2H NH2 ² H3N N² CH2 Asparagin CH3 Leucin H CH2 Phenylalanin H H H CH2 ² H3N H CO2H ² H3N O CO2H HO2C CH2XH CH3 ² H3N CO2H Cystein (X =S) Selenocystein (X = Se) Serin Threonin CH2 H3C H ² H3N CH2OH Alanin CO2H H3C H CO2H ² H3N CH3 Glycin ² H3N CO2H Histidin N H Tryptophan CH2 NH ² C H2N NH2 Arginin Als kanonische Aminosäuren werden die 22 Standardaminosäuren (Selenomethionin ist nicht kanonisch) bezeichnet, welche in Form von Codons in der DNA gespeichert sind. Pyrrolysin (N6-[(2R,3R)-3-Methyl-3,4-dihydro- 2H-pyrrol-2ylcarbonyl]lysin) ist die 22. dieser Aminosäuren: ² H3N CO2H H CH2 CH2 CH2 CH2 O NH N CH3 Pyrrolysin Entnommen aus: Bräse/Bülle/Hüttermann © Wiley-VCH 2007 Organische und bioorganische Chemie Das Basiswissen für Master- und Diplomprüfungen Der menschliche Organismus ist nicht in der Lage, alle notwendigen Aminosäuren selbst zu synthetisieren. Er ist deshalb auf die Zufuhr dieser Moleküle durch die Nahrung angewiesen. Die Aminosäuren, die der menschliche Körper nicht selbst synthetisieren kann, nennt man "Essentielle Aminosäuren": Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan, Valin pKS-Werte von proteinogenen Aminosäuren. Aminosäure Seitenkette Isoelektrischer Punkt EinbuchstabenCode A C pKS1: COOH pKS2: NH3+ Alanin Cystein Dreibuchstabencode Ala Cys 2.35 1.92 9.87 10.78 8.33 6.11 5.05 Asparaginsäure Glutaminsäure Asp Glu D E 1.99 2.10 9.90 9.47 3.90 4.07 2.85 3.15 Phenylalanin Glycin Histidin Phe Gly His F G H 2.16 2.35 1.80 9.18 9.78 9.33 6.04 5.49 6.06 7.60 Isoleucin Ile I 2.32 9.76 Lysin Leucin Methionin Lys Leu Met K L M 2.16 2.33 2.13 9.78 9.74 9.28 Asparagin Pyrrolysin Asn Pyl N O Prolin Pro P 2.10 Nicht bekannt 2.95 8.84 Nicht bekannt 10.65 Glutamin Arginin Gln Arg Q R 2.17 1.82 9.13 8.99 Serin Ser S 2.19 9.21 5.68 Threonin Thr T 2.09 9.10 5.60 Selenocystein Sec U Val Trp V W Nicht bekannt 9.74 9.44 5.3 Valin Tryptophan Nicht bekannt 2.29 2.43 Tyrosin Tyr Y 2.20 9.11 10.13 6.05 10.79 9.60 6.01 5.74 5.41 Nicht bekannt 6.30 12.48 5.65 10.76 Nicht bekannt 6.00 5.89 5.64 "Grundtyp" der meisten Aminosäuren zwei Cysteine können eine DisulfidBindung ausbilden (um zum Beispiel ein Cystin zu bilden). Reaktionsfolge α-Ketoglutarat → Glu → Gln ermöglicht spontane Bindung des Zellgifts Ammoniak durch Oxidation Reaktion zu Tyrosin achiral pK-Wert im Neutralbereich; ermöglicht Säure/Basen-Katalyse; häufig an enzymatischen Reaktionen beteiligt zusätzliches stereogenes Zentrum in der Seitenkette Methylgruppentransfer der endständigen CH3-Gruppe der Seitenkette durch Thioethergruppe auf andere Moleküle möglich 22. Aminosäure cyclische Aminosäure mit disubstituierter Aminogruppe (früher oft fälschlicherweise als Iminosäure bezeichnet), kann Proteinstrukturen wie α-Helices oder β-Faltblätter unterbrechen und spezielle eigene Motive initiieren. cisoder trans Konformation in Proteinen. universeller NH2-Donor im Stoffwechsel Metabolit im Harnstoffzyklus: Spaltung in Orn und Harnstoff. Kann energiereiches N-Phosphat bilden im Protein phosporylierbar (Kinasesubstrat), besonders kleine polare Seitenkette, häufig im aktiven Zentrum von Proteasen zusätzliches stereogenes Zentrum, im Protein phosporylierbar (Kinasesubstrat) aktives Zentrum von Selenoenzymen (Glutathion-Peroxidase, Deiodase) bestimmt (neben Phe und Tyr) das Absorptionsspektrum von Proteinen im Protein phosporylierbar (Substrat von Tyr-Kinasen) Diese Werte gelten für wässrige Lösungen. In den aktiven Zentren von Proteinen können sich diese Werte aufgrund der veränderten Umgebung drastisch ändern! Entnommen aus: Bräse/Bülle/Hüttermann © Wiley-VCH 2007 Organische und bioorganische Chemie Das Basiswissen für Master- und Diplomprüfungen