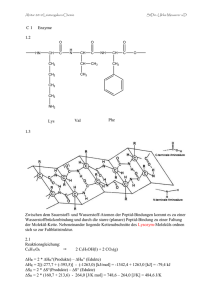
Komplexometrische Titrationen (Chelatometrie) Na2H2Y = 2 Na+ +
Werbung

Komplexometrische Titrationen (Chelatometrie) Die Komplexometrie oder Chelatometrie verwendet mehrzähnige Liganden als Titratoren und ermöglicht die maßanalytische Bestimmung einer Vielzahl mehrwertiger Kationen. (Komplexe mit Liganden, die zwei oder mehrere Koordinationsstellen am Zentralatom besetzen, werden als Chelatkomplexe bezeichnet.) Sie beruht auf der Bildung stöchiometrisch einheitlicher, praktisch undissoziierter und wasserlöslicher Chelatkomplexe. Die Menge an zugesetzten Liganden wird volumetrisch bestimmt. Besonders die Polifunktionsverbindungen entsprechen den erwähnten Bedingungen. Als Chelatbildner werden Anionen von Aminopolycarbonsäuren angewendet. Die größte Bedeutung als Titrator komplexometrische Titrationen besitzt die vierbasige Ethylendiamintetraessigsäure (EDTA=H4Y), HOOC HOOC H2C H2C N CH2 CH2 N CH2 COOH CH2 COOH Da die Wasserlöslichkeit der freien Säure relativ gering ist wird bevorzugt das Dinatriumedetat (=Na2H2Y) als Maßlösung verwendet. Dinatriumedetat dissoziiert in wässriger Lösung überwiegend nach: Na2H2Y = 2 Na+ + H2Y2– EDTA bildet als sechszäniger Ligand mit Metallionen unabhängig von der Ladung des Zentralatoms immer 1:1 Komplexe mit fünfgliederigen Chelatringen. Bei der in einem Schritt erfolgenden Komplexbildung, die mit einem hohen Entropieeffekt verbunden ist, fungieren die beiden Stickstoffatome und 4 Sauerstoffatome der Carboxylgruppen als Koordinationspartner („Liganden“). Wie die Abbildung veranschaulicht ist in den Metall-EDTA-Komplexen das Metallion pseudooktaedrisch von 2 N- und 4 O-Atomen umgeben: O C O O CH2 C CH2 O N Me2+ CH2 O N C O CH2 O C O CH2 CH2 Die Reaktion zweiwertiger Metallionen mit Dinatriumedetat können in neutraler Lösung in Kurzform beschrieben werden durch: Me2+ + H2Y2– [MeY]2– + 2 H+ Da mit steigender Protonenkonzentration die Beständigkeit der gebildeten Komplexe abnimmt (und weil viele metallspezifische Indikatoren auch pH-empfindlich sind), muss bei der Chelatometrie zur Verschiebung des Gleichgewichts zur Produktseite hin stets in neutralen oder basischen Milieu, meist in gepufferter Lösung, titriert werden. (In saurer Lösung verschieben die Protonen das Gleichgewicht nach links.) Komplexbeständigkeit Das Massenwirkungsgesetz kann auf die Komplexbildungsreaktion angewendet werden: Assoziation Me x+ 4– (MeY)x-4 +Y Dissoziation Die Beständigkeit eines Komplexes wird mit der Stabilitätskonstante charakterisiert: [(MeY)x-4] Kstab= ——————— [ Mex+] × [Y4–] Je größer der Wert Kstab ist, desto stabiler ist der Komplex. Ähnlich wie bei der Neutralisationsanalyse können auch in der Komplexometrie Titrationskurven konstruiert werden. Trägt man die pMe-Werte (=-lg[Me]) gegen den jeweiligen Titrationsgrad in ein Koordinationskreutz ein, erhält man die Titrationskurven (s. Abbildung). Indizierungsmöglichkeiten Meist verwendet man in der Chelatometrie sog. Metallindikatoren. Diese Indikatoren bilden mit den zu bestimmenden Metallionen ebenfalls Chelatkomplexe. Sie sind jedoch weniger stabil als die Komplexe der Metallionen mit den Edetatliganden. Am Äquivalenzpunkt liegen die freien Indikator Molekülen vor. Weil der freie und der komplexgebundene Indikator verschiedene Farben haben, wird der Äquivalenzpunkt durch einen Farbumschlag angezeigt. Für die Praxis bedeutet das, dass in der Komplexometrie nicht bis zur Mischfarbe sondern bis zur bleibende Farbe titriert wird! („Bleibende Farbe“ bedeutet die Farbe die nach Zugabe eines weiteren Tropfens der Titrierlösung sich nicht mehr ändert.) Häufig verwendete Metallindikatoren sind Eriochromschwarz T und Murexid. Eriochromschwarz T [1-(1-hydroxi-2-naftilazo)-6-nitro-2-naftol-4-sulfonsaure] OH OH N N SO3H NO2 Die Lösung des Azofarbstoffs Eriochromschwarz T zeigt im pH Bereich 6.3-11 eine blauviolette Farbe. Die Metallkomplexe des Farbstoffs sind rot. Da Eriochromschwarz T polymerisiert unter pH 6, und über pH 10 sehr oxidationsempfindlich ist, werden die Analysen in mit NH3 – NH4Cl gepufferter Lösung (pH 9-10) durchgeführt. Murexid (Ammonium Purpurat) O HN O C C HN NH4 O C C N C O O C NH C O C NH Murexid zeigt bei Zusatz besonders vom Ca2+ Ionen bei pH 12 einen deutlichen Farbumschlag von blauviolett nach rot. Bei der Titration stellen wir den hohen pH Wert mit einigen cm3 1 N NaOH Lösung ein. Da die Metall–Edetat Komplexe 1:1 Zusammensetzung haben ist die Äquivalenzmasse und die Molmasse identisch. Natriumedetat ist sehr stabil und kann in hohen Qualität hergestellt werden. Natriumedetat Maßlösungen können deshalb mit ganz genauer Konzentration hergestellt werden (f=1,000)! Aufgaben 1. Bestimmung des Kalzium - Gehalts eines Blutserummodells Das Kalzium im menschlichen Blut hat trotz seiner relativ kleinen Konzentration eine wichtige physiologische Rolle und wird in der klinischen Labordiagnostik häufig bestimmt. (Bemerkung: Der Normalwert des Kalziums in Serum liegt bei 2.2-2.6 mmol/dm3. Die Proben die in dieser Aufgabe analysiert werden beinhalten aus praktischen Gründen 4-6-mal mehr Kalzium.) Verfahren: Aus dem zu untersuchenden Serummodells wird in drei 100 cm3 Erlenmeyer-Weithalskolben je 10,00 cm3 pipettiert. Zu den Lösungen wird mit Hilfe eines Messzylinders 5 cm3 1 M NaOH Lösung und eine Spatelspitze Murexid-Indikator gegeben. Titriere die Lösung mit 0,01 M Natriumedetat Maßlösung, bis zum Umschlag des Indikators (Lachsrot). Nach der Alkalisierung wird die Titration sofort durchgeführt, andernfalls kann CaCO3 sich aus der Lösung ausscheiden. Das Ergebnis wird in mmol/ dm3 Ca angegeben. Die molare Äquivalentmenge von Ca2+ ist 40,08 g×mol–1. 2. Bestimmung der Gesamthärte Die Bestimmung des Kalzium- und Magnesiumgehalts der natürlichen Wässer ist außerordentlich wichtig. In natürlichen Wässern sind in wechselnder Menge Kalzium- und Magnesium-Salze enthalten, welche die Härte des Wassers bestimmen. Die Wasserhärte wird in Härtegrad ausgedrückt, wobei 1 Deutsche Härtegrad (1 DH) dem Gehalt von 10 mg CaO in 1 Liter Wasser entspricht. Die permanente Härte des Wassers wird vor allem durch gelöstes CaSO4, die temporäre Härte durch Magnesium- und Kalziumhydrogencarbonat verursacht. Weder zum Trinken, noch zu wirtschaftichen Zwecken ist es empfehlenswert Wasser mit Härte über 30 DH zu benutzen. Zur Bestimmung der Gesamthärte ist eine Titration bei pH=10 gegen Eriochromschwarz T als Indikator möglich, wobei sowohl Mg als auch Ca zusammen erfasst werden, da sich ihre EDTA-Komplexe in der Stabilitätskonstante nicht sehr unterscheiden. Verfahren: a) Leitungswasser. In drei 100 cm3 Erlenmeyer-Weithalskolben werden je 25,0 cm3 Leitungswasser gegeben. (Erst 510 Sekunden nach dem Öffnen des Wasserhahns soll die Probe mittels Messzylinder genommen werden. Auf diese Weise wird verhindert dass kleine Stücke von Wassersteinen, die sich im Wasserhahn ansammeln, in die Probe gelangen.) Nach Zugabe von 4 cm3 NH3–NH4Cl Pufferlösung und 2 Tropfen Eriochromschwarz T Indikator wird titriert. Titriere die Lösung mit 0,01 M Natriumedetat Maßlösung, bis zum Umschlag des Indikators (rot → blau). Titer des 0.01 M Natriumedetat ist 0.56 mg CaO, d. h. 1 cm3 Maßlösung zeigt 0.56 mg CaO an. b) Quellwasser (Tettye-Wasser, aus der Quelle an der Tettye). Der Vorgang unter Punkt „a“ wird mit 25,0 cm3 Quellwasser wiederholt. Vergleiche die Härte des Leitungswassers und des Quellwassers!