Metallkomplexe
Werbung

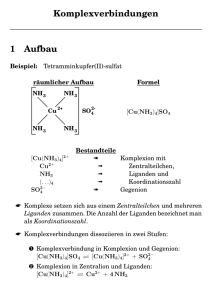
Metallkomplexe Die Komplexchemie (Koordinationslehre), die sich mit der Zusammensetzung und dem Aufbau von Koordinationsverbindungen befaßt, wurde 1893 von Alfred Werner begründet. Im Prinzip werden bei der Komplexbildung an ein Atom (Zentralatom) andere Atome oder Moleküle (Liganden) angelagert. Die koordinative Bindung unterscheidet sich nicht grundsätzlich von der Atombindung. Sie beruht wie diese auf dem Vorhandensein von gemeinsamen Elektronenpaaren, d.h. auf der Besetzung von Molekülorbitalen. Das Ziel eines Zentralkations (z.B. Co3+) ist es, die Außenelektronenzahl des nächst höheren Edelgases zu erreichen. So kann z. B. kann Ammoniak mit seinem freien Elektronenpaar (|NH3) dieses zum Zentralkation verlagern ("Elektronendonor"), wobei das Zentralkation als "Elektronenakzeptor" fungiert. Auf diesem Donor-/Akzeptorprinzip beruht die Komplexbindung, wobei sich das Zentralkation das freie Elektronenpaar des Liganden räumlich mit dem Liganden teilt („Rückbindung - Back-Donation“). Komplexverbindungen werden bevorzugt durch Übergangselemente in ihrem Bestreben gebildet, stabile Elektronenkonfigurationen und hochsymmetrische Strukturen zu erreichen. Die Besonderheit gegenüber der Atombindung liegt aber darin, dass bei der koordinativen Bindung beide Elektronen eines bindenden Elektronenpaares vom gleichen Atom oder Molekül stammen können. Beispiel: Das Co3+-Ion besitzt 24 Elektronen. 5927Co; 8436Kr. Das nächste Edelgas ist Krypton mit 36 Elektronen. Die fehlenden 12 Elektronen müssen durch die Liganden eingebracht werden (z.B. 6 Liganden mit je einem freien Elektronenpaar): oktaederisches [Co(NH3)6]3+ NH3 H3N 3+ NH3 Co H3N NH3 NH3 KZ = 6 Komplexstöchiometrien und -geometrien lassen sich nicht immer so offensichtlich herleiten. Die thermodynamische Stabilität eines Komplexes wird durch die Gleichgewichtskonstante seiner Bildung (Anwendung des Massenwirkungsgesetzes MWG) ausgedrückt und Stabilitätskonstante (Beständigkeitskonstante, Assoziationskonstante) genannt. Sie misst die Differenz zwischen der freien Enthalpie des Komplexes und der freien Enthalpie von Metallionen und Liganden (beide im Standardzustand). Diese Differenz ist um so größer, der Komplex ist also um so stabiler, je größer die mit der Komplexbildung einhergehende Enthalpieabnahme bzw. Entropiezunahme ist. Dies wird am Beispiel des Kupfer(I)-tetracyanokomplexes verdeutlicht. Für unsere weiteren Betrachtungen wollen wir den Umgang mit Komplexstabilitätskonstanten dahingehend vereinfachen, dass wir einen speziellen Kehrwert dieser Konstanten formal als Löslichkeitsprodukt bezeichnen; 6329Cu. Cu+ + 4 |CN[Cu(CN)4]3Komplexbildungskonstante K = 1 [Cu(CN)4]3[Cu+] [CN-]4 = 1027 Typische Liganden sind NH3, CO, CN-, Cl-, I-, -S-CN (Rhodanid), R-COO- (Acetat). Die Annäherung der Liganden mit ihrem freien Elektronenpaar erfolgt in räumlich charakteristischer Weise. Je nach Zahl der beteiligten Liganden resultieren andere räumliche Komplexstrukturen, wobei die Koordinationszahlen KZ, die Anzahl der Liganden, zwischen 2 und 6 schwanken kann, z.B.: CO Cl H3N Ni Pt H3N Ag+ NH3 CO OC H3N Cl CO Cisplatin, KZ = 4 KZ = 4 KZ = 2 Durch Komplexierung werden vielerlei Eigenschaften von Metallionen stark beeinflusst. Dazu zählen z.B. die elektronischen Anregungsenergien, wodurch sich die Farbe durch Komplexierung stark ändern kann. Auch das Redoxpotential oder die Löslichkeit können deutlich verändert werden. O C O Na+ H O O O +- C CH2 CH2 C N CH2 CH2 N C CH2 CH2 C Na O O O O H EDTA O CH2 H2C O CH2 C N O 2+ H2C Ca O- N CH2 CH2 C C O O- O N− N N − N Dianion des Porphyrins Komplexe spielen im täglichen Leben, in der Biochemie und auch in der Medizin eine vielfältige Rolle. Ein wichtiger Ligand zur Auflösung von Kalk (CaCO3) ist das Dinatriumsalz von EDTA, das in der Lage ist, Ca2+ zu komplexieren und damit Kalkablagerungen aufzulösen. In günstigen Fällen kann EDTA zur Auflösung von Nierensteinen verwendet werden. Solche Komplex mit einem mehrzähnigen Liganden nennt man Chelatkomplexe. Diese haben oft besonders hohe Komplexbildungskonstanten, sind also besonders stabil. In der Natur sind Porphyrinderivate besonders effektive Komplexbildner/Chelatliganden. Als Dianionen können sie Nebengruppenmetallionen komplexieren. Dazu gehören Chlorophyll (Mg2+), Häm und Cytochrome (Fe2+) oder Vitamin B12 (Co3+). 2