Kapitel 3-5
Werbung

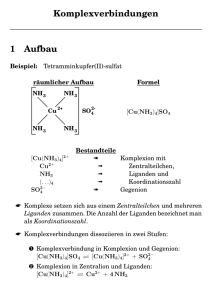
Was ist eine Koordinations- bzw. Komplexverbindung? + Zentralatom Fe(CN)2 Existenzfähige Verbindung + Liganden [Fe(CN)6]4- 4 CN¯ Existenzfähiges Anion Komplexverbindung neue Eigenschaften 3. Koordinationschemie Was zeichnet Komplexverbindungen der Übergangsmetalle aus? Farbe und Löslichkeit Magnetismus Komplexe sind oft paramagnetisch Redox-Verhalten verschiedene Oxidationsstufen der Metallionen Elektronische Konfiguration stabile Komplexe katalytische Aktivität 3. Koordinationschemie 1 Historisches Im Altertum: Naturstoffe (Häm-Derivate aus Tierblut) Erste dokumentierte Komplexverb.: 1597 durch Libavius (Arzt aus Halle): Ca(OH)2 + NH4Cl + Bronze blaue Färbung [Cu(NH3)4]2+ 1704 durch Diesbach und Dippel (Alchemisten): Entdeckung von Berliner Blau Fe4[Fe(CN)6]3 Darstellung des Berliner Blaus: Kaliumhydrogentartrat, Kaliumnitrat, Holzkohle, ferner getrocknetes und fein pulverisiertes Rinderblut, calciniertes Eisen(II)sulfat, Kaliumalaun und Salzsäure. 3. Koordinationschemie Historisches 1798 durch Citoyen Tassaert: ammoniak. Cobaltchlorid-Lösung orangegelben Stoff CoCl3·6NH3 Keine Erklärung für die Struktur: Additionsverbindung? Cobaltchlorid-Ammonikat? Erklärungsversuch mit Hilfe Kekule‘s Strukturtheorie: jedes Element besitzt eine bestimmte Wertigkeit, die durch einen Bindestrich dargestellt wird, der gleichzeitig die Atome miteinander verknüpft 3. Koordinationschemie 2 Alfred Werner (1866 – 1919) Das Problem der Struktur dieser Stoffe muss Werner sehr beschäftigt haben, denn in einer Dezembernacht wachte er um 2 Uhr auf und hatte einen Einfall zur Deutung der Konstitution dieser Verbindungen. Er stand auf und schrieb unter Zuhilfenahme von starkem Kaffee seinen Einfall nieder. Um 5 Uhr nachmittags war die Veröffentlichung fertiggestellt... 3. Koordinationschemie Alfred Werner: Koordinationszahl „...die eingehende Betrachtung von den Metallammoniaksalzen (...) haben uns zur Erkenntnis eines neuen, den Atomen innewohnenden Zahlenbegriffs geführt. Derselbe ist vielleicht berufen als Grundlage für die Lehre der Konstitution der anorganischen Verbindungen zu dienen, wie die Valenz die Basis der Konstitution der Kohlenstoffverbindungen gebildet hat...“ A. Werner, Z. Anorg. Chem. 1893, 3, 267 3. Koordinationschemie 3 Jørgensen vs. Werner Werner Jørgensen Cl Co Cl H3 N N H3 CoCl3 5NH3 H3 N H3 N H 3N NH3 + Cl Cl CoCl3 4NH3 H3 N H3 N H3 N 2 Cl- NH3 H3N Cl H3N N H3 Co H3N Cl Cl Cl- NH3 H3N Cl Co Co H3N Cl Co 2+ Cl H3 N Cl Cl CoCl3 3NH3 H3 N N H3 H3 N H3N Co H3N Cl Cl Cl H3N 3. Koordinationschemie Leitfähigkeitsmessungen an Cobaltamminkomplexen 500 450 400 350 300 250 200 150 100 50 0 1 3 2 2 3 1 [Co(NH3)6]Cl3 [Co(NO2) [Co(NO2)2 (NH3)5]Cl2 (NH3)4]Cl 4 0 [Co(NO2)3 (NH3)3] 5 1 6 2 7 3 [Co(NO2)4 (NH3)2]K 3. Koordinationschemie 4 Werners phänomenologische Erkenntnisse Jedes Zentralatom besitzt neben seiner Hauptvalenzzahl (heute: Oxidationszahl) eine charakteristische Nebenvalenzzahl (heute: Koordinationszahl). Bsp. Fe3+: 3 Haupt- und 6 Nebenvalenzen Ni2+: 2 Haupt- und 4-Nebenvalenzen Nebenvalenzen binden die Bindungspartner fester an das Metall (Hauptvalenzen reagieren zuerst) Neutrale Liganden sind direkt am Metall gebunden Anionische Liganden sind entweder am Metall gebunden oder sind Gegenionen (in der zweiten Koordinationsshäre) Nebenvalenzen sind räumlich gerichtet 3. Koordinationschemie Nomenklatur Formel der Komplexverbindung Komplexbestandteile in eckige Klammern 1. Zentralatom 2. anionische Liganden (jeweils alphabetisch) 3. neutrale Liganden (jeweils alphabetisch) einatomige Liganden ohne Klammern: Cl, Br mehratomige Liganden in runden Klammern: (H2O) Gegenionen: kationische: vor der Komplexformel anionische: nach der Komplexformel 4. Nomenklatur 5 Nomenklatur Name der Komplexverbindung 1. Liganden in alphabetischer Reihenfolge: - unabhängig von Ladung der Ligaden - Zahlwort wird nicht berücksichtigt 2. Zahlwort für die Anzahl der Liganden: - Di-, Tri-, Tetra-, Penta-, Hexa 3. Zentralatom: - anionischer Komplex: Endung –at - Oxidationszahl in runden Klammern in römischen Ziffern 4. Nomenklatur Nomenklatur Name der Liganden 1. Neutrale Liganden - Name bleibt unverändert - in runde Klammern - Ausnahmen (werden nicht in Klammern gesetzt): H2O aqua NH3 ammin CO carbonyl NO nitrosyl 2. Anionische Liganden - Endung –o 4. Nomenklatur 6 Zweizähnige Liganden H2N NH2 N N N N O O Ethylendiamin en Bipyridin bipy N O o-Phenanthrolin phen O O Acetylacetonat acac O O O O S O N O H Diacetyldioxim-Anion O Sulfat Oxalat 5. Liganden σ- und π-Liganden σ-Wechselwirkungen L M M L π-Wechselwirkung M L Beispiel M-CO π-(Rück)-Bindung M C O σ-(Hin)-Bindung 5. Liganden 7 Cyclopentadienyl-Ligand H H H C H C C C - H+ H C C C C H H H H H Cyclopentadien H H C H H C C C C H H H C C H Cyclopentadienyl (Cp): alle C-C-Bdg. gleich lang H H H M koordinierter Cp-Ligand • monoanionisch • 6-Elektronendonor • (3-zähniger Ligand) σ-Ww. π-Ww. 5. Liganden 8