Biochemie_Breitling_Stryer_Kap30_1
Werbung

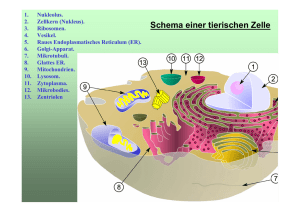
Vertretung durch Frank Breitling (Institut für Mikrostrukturtechnik (IMT), Campus Nord) Vorlesungsdoppelstunde am 03.07.2014 Basis der Vorlesung: Stryer, Biochemie, 6. Auflage, Kapitel 30 Proteinsynthese Das Ribosom ist eine Matrizen-gesteuerte Werkzeugmaschine in Nanodimensionen Das Ribosom ist eine Polypeptidfabrik. Die Aminosäuren, die mit TransferRNA-Molekülen verbunden sind, werden nacheinander zum Ribosom transportiert. Jede Aminosäure wird einzeln an die wachsende Polypeptidkette angefügt, die sich vom Ribosom löst, sobald sie fertig ist. Mit diesem Fließbandverfahren lassen sich sehr lange Polypeptide schnell und mit erstaunlicher Genauigkeit aufbauen. Translation: Nucleotidsequenzen müssen in eine Abfolge von Aminosäuren „übersetzt“ werden Wachstum der Polypeptidkette: Bei der Proteinsynthese wird am Carboxylende eine Aminosäure nach der anderen angefügt. Alle tRNAs haben ein Anticodon, mit dem sie spezifisch an das aus drei Basen bestehende Codon auf der mRNA binden 1. Je drei Basen codieren eine Aminosäure. 2. Der Code ist nicht überlappend. 3. Es gibt keine Zeichensetzung, außer „Start“ und „Stopp“. 4. Der Code ist degeneriert. Wie genau muss die Proteinsynthese sein? Häufigkeit des Einbaus Einer falschen Aminosäure Wahrscheinlichkeit, dass ein fehlerfreies Protein synthetisiert wird Zahl der Aminosäurebausteine 100 300 1000 10-2 10-3 10-4 10-5 0,366 0,905 0,990 0,999 0,049 0,741 0,970 0,997 0,000 0,368 0,905 0,990 Theoretische Überlegung: Damit große Proteine von etwa 1000 Aminosäure Länge effizient gebildet werden darf die Fehlerhäufigkeit einen Wert von ungefähr einen in 104 nicht überschreiten. Warum hat die Evolution den Translationsprozess nicht von vorneherein noch genauer angelegt, was könnte dadurch schwieriger werden? Die tRNA ist ein Adaptermolekül das an ein spezifisches Codon bindet und gleichzeitig die entsprechende Aminosäure mitbringt Sequenz der Alanyl-tRNA: Dargestellt ist die Sequenz der Alanyl-tRNA aus Hefe und die daraus abgeleitete Sekundärstruktur in Form eines Kleeblattes. Das Molekül enthält folgende modifizierte Nucleoside: Methylinosin (mI), Dihydrouridin (UH2), Ribothymidin (T), Pseudouridin (ψ), Methylguanosin (mG) und Dimethylguanosin (m2G). Inosin (I), ein weiteres modifiziertes Nucleosid, ist Teil des Anticodons Alle tRNA-Moleküle haben dasselbe Konstruktionsprinzip Die allgemeine Struktur von tRNA-Molekülen. Beim Vergleich der Basensequenzen vieler tRNAs erkennt man eine Reihe konservierter Merkmale: (1) Länge 73 bis 93 Ribonucleotide (2) Viele „Sonderbausteine“ (3) Große Bereiche bilden eine Doppelhelix aus (4) Phosporyliertes 5‘-Ende (5) Die aktivierte Aminosäure hängt am 3‘-Ende (CCA) (6) Das Anticodon befindet sich in einer Schleife in der Mitte der Sequenz. Alle tRNAs enthalten viele ungewöhnliche Basen Von den 73 bis 93 Ribonucleotiden einer tRNA sind meist 7 bis 15 dieser Ribunucleotide „Sonderbausteine“ Die aktivierte Aminosäure und das Anticodon liegen an en entgegengesetzten Enden der tRNA Struktur der tRNA: Zu beachten ist die Lförmige Struktur, die dieses Skelettmodell der Phenylalanyl-tRNA der Hefe wiedergibt. Ein Arm trägt am Ende den CCA-Abschnitt, der andere die Anticodonschleife. Stapelung von Helices in der tRNA Die vier doppelsträngigen Bereiche der tRNA sind in der L-förmigen Struktur übereinander gestapelt. Aminoacyl-tRNASynthetasen lesen den genetischen Code (1) Durch die Anheftung einer bestimmten Aminosäure an eine spezifische tRNA wird der genetische Code umgesetzt. (2) Aktivierte Aminosäure: Die Aminosäuren sind über Esterbindungen an die 2'- oder 3'-Hydroxylgruppe im Adenosin am 3'-Ende der tRNA gekoppelt. Hier ist eine Bindung an die 3'-Hydroxylgruppe dargestellt. Im ersten Schritt wird die Aminosäure durch die Bildung eines Aminoacyladenylats aktiviert Aminacyl-tRNA-Synthetasen aktivieren die Aminosäuren am C-Terminus: (1) Es wird Aminoacyladenylat gebildet; Aminosäure + ATP Aminoacyl-AMP + PPi (2) Die Aminoacyladenylat wird auf ein bestimmtes tRNA Molekül übertragen. Dabei wird PPi hydrolysiert um die Reaktion in die gewünschte Richtung zu treiben. Aminoacyl-AMP + tRNA Aminoacyl-tRNA + AMP Auch Fettsäuren werden durch ein Acyladenylat-Zwischenprodukt aktiviert Bei der Fettsäuresynthese dient ein CoenzymA als Akzeptor für die Acylgruppe, während bei der Aktivierung der Aminosäuren diese Funktion durch die tRNA ausgeübt wird. Aktives Zentrum der Threonyl-tRNASynthetase Die Aminosäurebindungsstelle enthält ein Zinkion (grüne Kugel), das koordinative Bindungen zur Amino- und Hydroxylgruppe des Threonins ausbildet Jede Aminoacyl-tRNA-Synthetase ist sehr spezifisch für „Ihre“ Aminosäure Wie schafft es die Threonyl-tRNA-Synthetase zwischen Threonin und den sehr ähnlichen Aminosäuren Valin und Serin zu unterscheiden, sodass nur eine von 104 bis 105 Aminosäuren falsch eingebaut wird? (1) Threonin (aber nicht Valin) kann über seine OHGruppe in der Seitenkette mit dem Zinkion des katalytischen Zentrums und mit einem Asp Wasserstoffbrücken ausbilden. (2) Bei Serin gibt es diese Unterscheidungsmöglichkeit nicht. Deshalb haben die Aminoacyl-tRNASynthetasen analog zu den DNA-Polymerasen eine Korrekturlesefunktion. Wird die Threonyl-tRNA-Synthetase mit falsch beladener Ser-tRNAThr inkubiert, so entsteht freies Serin und freie tRNAThr. Aktives Zentrum der Threonyl-tRNASynthetase Die Aminosäurebindungsstelle enthält ein Zinkion (grüne Kugel), das koordinative Bindungen zur Amino- und Hydroxylgruppe des Threonins ausbildet. Spezifität der Beladung durch die in Threonin enthaltene OH-Gruppe in der Seitenkette. Das Korrekturlesen durch die Aminoacyl-tRNA-Synthetase steigert die Genauigkeit der Proteinsynthese Die Korrekturlesestelle: Mit Mutageneseexperimenten konnte man feststellen, wo sich in der Threonyl-tRNA-Synthetase die Korrekturlesestelle (grün dargestellt) befindet. Serin passt in diese „Hydrolysestelle“ genau rein, das größere Threonin aber nicht! Größere Aminosäuren passen wiederum nicht in die Aktivierungsstelle. (Hier und in den folgenden Abbildungen ist nur eine der beiden Untereinheiten des dimeren Enzyms dargestellt.) Korrektur einer Aminoacyl-tRNA Der biegsame CCA-Arm einer Aminoacyl-tRNA kann die Aminosäure von der Aktivierungsstelle zur Korrekturlesestelle schieben. Passt die Aminosäure dort gut hinein, wird sie durch Hydrolyse entfernt. Allgemeines Prinzip: (1) Zu große Aminosäuren passen nicht in die Aktivierungsstelle (2) Zu kleine Aminosäuren passen in die Korrekturlesestelle und werden hydrolysiert. Synthetasen erkennen verschiedene Merkmale „Ihrer“ tRNAs Der Komplex der ThreonyltRNA-Synthetase: An der Struktur des Komplexes zwischen ThreonyltRNA-Synthetase und tRNAThr erkennt man, dass die Synthetase sowohl an den Akzeptorstamm als auch an die Anticodonschleife bindet. Oft, aber nicht immer wird das Anticodon erkannt. Die Alanyl-tRNA-Synthetase erkennt und aminoacyliert auch eine kleine Mikrohelix, die das Anticodon gar nicht enthält Die Mikrohelix, die von der AlanyltRNA-Synthetase erkannt wird: Eine Stamm-Schleife-Struktur von nur 24 Nucleotiden, die dem Akzeptorstamm entspricht, wird von der AlanyltRNA-Synthetase aminoacyliert. Die Aminoacyl-tRNA-Synthetasen kann man in zwei Klassen einteilen Die Klassen der Aminoacyl-tRNA-Synthetasen: Die Synthetasen der Klassen I und II erkennen verschiedene Seiten des tRNA-Moleküls. Der CCA-Arm der tRNA nimmt im Komplex mit den Enzymen der beiden Klassen unterschiedliche Konformationen an. Die Aminoacyl-tRNA-Synthetasen kann man in zwei Klassen einteilen Klasse I Klasse II Arg (a) Cys (a) Gln (a) Glu (a) Ile (a) Leu (a) Met (a) Trp (a2) Tyr (a2) Val (a) Ala (a4) Asn (a2) Asp (a2) Gly (a2b2) His (a2) Lys (a2) Phe (a2b2) Ser (a2) Pro (a2) Thr (a2) Einteilung der AminoacyltRNA-Synthetasen von E. coli und die Zusammensetzung ihrer Untereinheiten Vergleich Klasse I vs. Klasse II: (1) Haarnadel- vs. Helixkonformation des CCA Teils; (2) Acylieren das 2‘-OH vs. 3‘-OH-Gruppe der tRNA des 3‘-Endes; (3) Binden ATP in unterschiedlichen Konformationen; (4) Meist monomere vs. dimere Proteine (5) Binden an unterschiedliche Seiten der tRNA. Ein Ribosom ist ein Ribonucleoproteinpartikel (70S) aus einer kleinen (30S) und einer großen (50S) Untereinheit Detaillierte Modelle eines Ribosoms, erstellt auf Basis von Röntgenstrukturanalysen des 70S-Ribosoms sowie der 30S- und 50S-Untereinheit. Gelb: 23S-RNA, orange: 5S-RNA, grün: 16S-RNA, rot: Proteine der 50S-Untereinheit und blau: Proteine der 30S-Untereinheit. Die Grenzfläche zwischen der 50S- und der 30S-Untereinheit besteht ausschließlich aus RNA. Die entscheidenden Stellen des Ribosoms bestehen fast ausschließlich aus RNA! Die ribosomalen RNAs spielen für die Proteinsynthese eine zentrale Rolle Faltungsmuster ribosomaler RNA: A) Sekundärstruktur der 16SrRNA, abgeleitet aus Sequenzvergleichen und chemischen Untersuchungen. B) Durch Röntgenstruktur-analyse ermittelte Tertiär-struktur der 16SrRNA. Die rRNA faltet sich zu einer definierten Struktur mit vielen kurzen Doppelstrangabschnitten. Die Messenger-RNA wird in 5‘ 3‘-Richtung translatiert Proteine werden vom Amino- zum Carboxylende synthetisiert Diese synthetisch hergestellte DNA ergibt in einem zellfreien Proteinsynthesesystem: Die Transkription läuft auch in 5‘- 3‘-Richtung ab. Deshalb kann auch einen noch nicht vollständig transkribierte mRNA bereits die Synthese von Proteinen steuern. Ein mRNA-Molekül kann von vielen Ribosomen gleichzeitig translatiert werden Polysomen: Bei der Transkription eines DNAAbschnitts aus E.coli entstehen mRNA-Moleküle, die sofort jeweils von mehreren Ribosomen translatiert werden. (Miller OL Jr et al (1970) Science 169: 392–395.) Das Startsignal ist normalerweise AUG. Davor liegen mehrere Basen die sich mit der 16S-rRNA paaren Initiationsstellen: Die Sequenzen der Initiationsstellen für die Proteinsynthese in einigen mRNA-Molekülen aus Bakterien und Viren. Beim Vergleich dieser Sequenzen erkennt man einige immer wiederkehrende Merkmale. Die Proteinsynthese der Bakterien beginnt mit Formylmethionyl-tRNA Formylierung der Methionyl-tRNA: Die Initiator-tRNA (tRNAf) wird zunächst mit Methionin beladen. Anschließend wird eine Formylgruppe vom N10-Formyltetrahydrofolat auf die Methionyl-tRNA übertragen. Nur Methionin-beladene Met-tRNAf ist ein Substrat für diese enzymatische Reaktion. Ribosomen enthalten drei tRNA-Bindungsstellen, die zwischen der 30S- und der 50S-Untereinheit liegen Bindungsstellen für die Transfer-RNA: A) An einem 70S-Ribosom befinden sich drei tRNA-Bindungsstellen. Sie werden als A-(Aminoacyl-), P-(Peptidyl-) und E-(Exit-)Stelle bezeichnet. Alle tRNA-Moleküle treten sowohl mit der 30Sals auch mit der 50S-Untereinheit in Kontakt. B) Die tRNA-Moleküle an der Aund P-Stelle sind über Basenpaarungen mit der mRNA verbunden. Mechanismus der Proteinsynthese Der Zyklus beginnt mit der Peptidyl-tRNA an der P-Stelle. An die A-Stelle wird eine AminoacyltRNA gebunden. Nachdem beide Stellen besetzt sind, bildet sich die neue Peptidbindung aus. Der Elongationsfaktor G verschiebt tRNAs und mRNA, wodurch die deacylierte tRNA zur E-Stelle wandert. Dort angelangt, kann sie frei abdissoziieren und damit den Zyklus abschließen. Bildung der Peptidbindung Die Aminogruppe der Aminoacyl-tRNA greift die Carbonylgruppe in der Esterbindung der Peptidyl-tRNA an. Das dabei entstehende tetraederförmige Zwischenprodukt zerfällt, wobei sich die Peptidbindung bildet und die deacylierte tRNA freigesetzt wird. Allein die Wechselwirkung zwischen Codon und Anticodon bestimmen darüber, welche Aminosäure eingebaut wird Cystein, mit dem bereits „seine“ tRNA beladen war, wurde unter Katalyse durch Raney-Nickel in Alanin umgewandelt. Das Alanin dieser nun „falsch“ beladenen tRNA wurde ohne Umstände in das wachsende Polypeptid eingebaut. Dies wird mittlerweile in zellfreien Translationssystemen ausgenutzt, denn dadurch kann man z.B. Fluoreszenz-markierte Proteine herstellen. Dies geschieht indem eine tRNA mit einem bestimmten Codon mit einer fluoreszierenden künstlichen Aminosäure beladen wird, wobei das Codon den Einbauort in das Protein definiert. Manche tRNAs erkennen durch das „Wobble“ der Basenpaarung mehrere Codons Nach der Wobble-Hypothese erlaubte Paarungen an der dritten Base des Codons Erste Base dritte Base des Anticodons des Codons C A U G I G U A oder G U oder C U, C oder A Die Alanyl-tRNA der Hefe bindet z.B. an drei Codons, nämlich GCU, GCC und GCA. Dies liegt daran, dass die oft in der dritten Position des Anticodons tRNAs eingebaute Base Inosin Wasserstoffbrücken mit drei verschiedenen Basen (U, C und A) ausbilden kann. Die Base Inosin kann Wasserstoffbrücken mit drei verschiedenen Basen (U, C und A) ausbilden Die 16S-rRNA kontrolliert die Basenpaarung zwischen Codon und Anticodon Adenin 1493, eines von drei generell konservierten Basen in der 16S-rRNA, bildet Wasserstoffbrücken sowohl mit den Basen im Codon als auch im Anticodon, aber nur dann, wenn Codon und Anticodon korrekt gepaart sind. Die Formylmethionyl-tRNAf wird während der Bildung des 70SInitiationskomplexes in der PStelle des Ribosoms angeordnet Initiation der Translation bei Prokaryoten: Die Initiationsfaktoren unterstützen zunächst die Zusammenlagerung des 30SInitiationskomplexes und später den Aufbau des 70S-Initiationskomplexes. Diese Abfolge an molekularen Erkennungsprozessen bewirken, dass sich zunächst die mRNA an die 30S Untereinheit anlagert und erst danach „der Deckel zugemacht wird“ indem sich die 50S-Untereinheit dazu gesellt. Die Hydrolyse von GTP gibt der Reaktion dabei eine Richtung vor. Elongationsfaktoren bringen die Aminoacyl-tRNA zum Ribosom Struktur des Elongationsfaktors Tu: Dargestellt ist die Struktur eines Komplexes aus dem Elongationsfaktor Tu (EF-Tu) und einer Aminoacyl-tRNA. Am Aminoende von EF-Tu liegt eine P-Schleife-NTPase-Domäne (violett), wie sie in ähnlicher Form auch in anderen G-Proteinen vorkommt. (Zeichnung nach 1B23.pdb.) Auf die Bildung einer Peptidbindung folgt die von GTP angetriebene Translokation der tRNAs und der mRNA Der Mechanismus der Translokation: EF-G heftet sich in der GTP-Form an die EF-Tu-Bindungsstelle auf der 50S-Untereinheit. Dies regt die Hydrolyse des GTP an. Die Folge ist eine Konformationsänderung von EF-G, durch die die tRNAs und die mRNA um die Strecke durch das Ribosom bewegt werden, die einem Codon entspricht. Die Proteinsynthese wird durch Freisetzungsfaktoren beendet, die Stoppcodons lesen Die Stoppcodons UAA, UGA und UAG werden von kleinen, kompakten Proteinen erkannt, die in ihrer Struktur tRNAs ähneln. Diese werden Freisetzungsfaktoren genannt (release factors, RFs). Der genaue Mechanismus ist nicht bekannt. Termination der Biosynthese Ein Freisetzungsfaktor erkennt ein Stoppcodon an der A-Stelle und bewirkt die Freisetzung des vollständigen Proteins von der tRNA an der P-Stelle. Wie könnte die fertig synthetisierte Peptidkette vom Ribosom freigesetzt werden? Pro- und eukaryotische Proteinsynthese unterscheiden sich vor allem in der Initiation der Translation Initiation der Translation bei Eukaryoten: Bei Eukaryoten bildet sich zu Beginn der Translation am 5'-Cap ein Komplex, der die 40S-Untereinheit und die Met-tRNAi enthält. Durch ATP-Hydrolyse angetrieben, sucht dieser Komplex die mRNA ab, bis er auf das erste AUG trifft. Dann kommt die 60S Untereinheit hinzu, um den 80S-Initiationskomplex zu bilden. (1) Eukaryotische Ribosomen sind größer; (2) Eukaryoten verwenden Met statt Formyl-Met; (3) Eukaryoten haben immer AUG als Startcodon. Sie nehmen das erste am 5‘-Ende; (4) Eukaryoten besitzen wesentlich mehr Initiationsfaktoren als Prokaryoten; (5) Eukaryotische mRNA ist ringförmig; (6) Für Elongation und Termination existieren homologe Proteine. Eukaryotische mRNA wird durch Wechselwirkung mit Proteinen ringförmig (Nach Lodish H et al (2004) Molecular cell biology (5. Aufl.) W. H. Freeman and Company, New York. Abb. 4.31.) An das endoplasmatische Reticulum gebundene Ribosomen produzieren sekretorische und membranspezifische Proteine In dieser elektronenmikroskopischen Aufnahme erscheinen die Ribosomen als kleine schwarze Punkte, die auf der cytoplasmatischen Seite des endoplasmatischen Reticulums gebunden sind und diesem so ein raues Aussehen geben. Im Gegensatz dazu enthält das glatte endoplasmatische Reticulum keine Ribosomen. Signalsequenzen markieren Proteine für die Translokation durch die Membran des endoplasmatischen Retikulums Aminoterminale Signalsequenzen von einigen sekretorischen und membranspezifischen Proteinen bei Eukaryoten: Vor der hydrophoben Core-Sequenz (gelb) liegen einige basische Reste (blau), nach der Core-Sequenz folgt die Schnittstelle für die Signalpeptidase. Das Signalerkennungspartikel Das Signalerkennungspartikel (SRP) besteht aus sechs Proteinen (eines davon ist SRP54) und einem RNAMolekül mit 300 Nucleotiden. Die RNA besitzt eine komplexe Struktur mit vielen doppelhelikalen Abschnitten, die von einzel-strängigen Regionen immer wieder punktuell unterbrochen sind (Kreise). Das SRP „testet“ alle Ribosomen bis es eines mit einem Signalpeptid gefunden hat. Bei diesem wird die Proteinsynthese angehalten bis es an den SRP-Rezeptor angedockt ist. Der SRP-Transportzyklus 1) Die Proteinsynthese beginnt an freien Ribosomen. 2) Nachdem die Signalsequenz aus dem Ribosom herausgetreten ist, wird sie vom SRP gebunden, und die Proteinsynthese hält an. 3) Der SRP-Ribosom-Komplex lagert sich an den SRP-Rezeptor in der ER-Membran. 4) Der SRP und der SRP-Rezeptor hydrolysieren gleichzeitig das jeweils gebundene GTP, die Proteinsynthese wird fortgesetzt und das SRP kann an eine andere Signalsequenz binden. 5) Die Signalpeptidase kann die Signalsequenz entfernen, sobald diese in das Lumen des ER gelangt. 6) Die Proteinsynthese setzt sich fort, während das Protein direkt in das ER synthetisiert wird. 7) Nach Abschluss der Proteinsynthese wird das Ribosom freigesetzt und der Tunnel im Translocon schließt sich. Transportvesikel bringen Proteine an ihre Bestimmungsorte Mechanismen der Proteinverteilung: Neu synthetisierte Proteine im Lumen des ER werden in Ausstülpungen der Membran gesammelt. Diese schnüren sich ab und bilden Transportvesikel. Die Vesikel bringen ihre Proteine zum Golgi-Komplex, wo die Proteine modifiziert werden. Transportvesikel tragen dann, gelenkt durch v-SNARE- und t-SNARE-Proteine, ihre Fracht zu den endgültigen Bestimmungsorten. Eine Reihe verschiedener Antibiotika und Toxine hemmen die Proteinsynthese Das Trisacchardid Streptomyces stört die Bindung der Formylmethionyl-tRNA an die Ribosomen und verhindert so die Initiation der Proteinsynthese. Antibiotische Hemmstoffe der Proteinsynthes Antibiotikum Wirkung Streptomycin hemmt die Initiation und verursacht falsches Ablesen der mRNA (Prokaryoten) Tetracyclin bindet an die 30S-Untereinheit und hemmt die Anheftung der AminoacyltRNA (Prokaryoten) Chloramphenicol hemmt die Peptidyltransferaseaktivität der 50S-Untereinheit (Prokaryoten) Cycloheximid hemmt die Translokation (Eukaryoten) Erythromycin bindet an die 50S-Untereinheit und hemmt die Tranlokation (Prokaryoten) Puromycin wirkt als Analogon der Aminoacyl-tRNA und verursacht vorzeitigen Kettenabbruch (Pro- und Eukaryoten) Die Wirkung des Antibiotikums Puromycin Puromycin ähnelt dem Amino-acylende einer Aminoacyl-tRNA. Seine Aminogruppe verbindet sich mit der Carbonylgruppe der wachsenden Polypeptidkette zu einem Addukt, das sich vom Ribosom löst. Das Addukt ist stabil, weil das Puromycin statt einer Ester- eine Amidbindung (rot) enthält. Inhibition der Translokation durch das Diphtherietoxin Das Diphtherietoxin blockiert die Proteinsynthese in Eukaryoten, indem es den Transfer einer ADP-Ribose-Einheit von NAD+ auf Diphthamid, eine modifizierte Aminosäure im Elongationsfaktor 2 (der Translokase), katalysiert. Diphthamid entsteht bei der posttranslationalen Modifikation (blau) eines Histidinrestes. Die B-Kette (orange) transportiert die enzymatische A-Kette (blau) über die Zellmembran ins Cytoplasma.