Grundzüge des Energiestoffwechsels I
Werbung

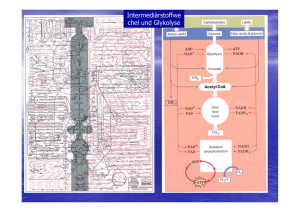
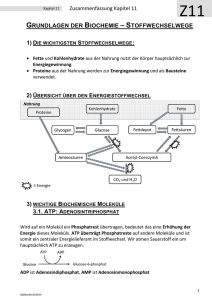
Grundzüge des Energiestoffwechsels I • 4.5 Grundzüge des Energiestoffwechsels – 4.5.2 Glykolyse – 4.5.3 Pyruvatdecarboxylierung – 4.5.4 Citratzyklus – 4.5.5 Glyoxylatzyklus und Gluconeogenese – 4.5.6 Atmung, Endoxidation – 4.5.7 Anaplerotische Reaktionen – 4.5.8 Gärungen Gliederung • Wiederholung Glycolyse • Aerober Stoffwechselweg – Pyruvatdecarboxylierung • Citratcyclus • Anaplerotische Reaktionen/Cataplerotische Reaktionen • Glyoxylatcyclus • Atmungskette Übersicht Stoffwechselvorgänge Glucose Glycolyse Gluconeogenese Pyruvat Aerobe Stoffwechselwege Anaerobe Stoffwechselwege Fettsäuren Milchsäure-Gärung Alkoholische Gärung Lactat Ethanol Pyruvatdecarboxylierung β-Oxidation Acetyl-CoA Glyxoxylat-Cyclus Citratcyclus Atmungskette CO2 RedoxÄquivalente, ATP Kurze Wiederholung Glycolyse • In der Glycolyse wird ein Molekül Glucose enzymatisch zu zwei Molekülen Pyruvat abgebaut. • Es werden zwei Moleküle NAD+ zu NADH/H+ reduziert und 2 Moleküle ATP gewonnen. Aerober Stoffwechselweg • Über die anaeroben Gärungen wird lediglich das NAD+ regeneriert, der energetische Nettogewinn beläuft sich auf zwei Moleküle ATP pro Molekül Glucose. • Der aerobe Stoffwechselweg stellt die optimierte Verwendung der Glucose bezüglich der Energieausbeute dar. Pyruvatdecarboxylierung • • • • • Pyruvat wird in Acetyl-CoA umgewandelt. Das beteiligte Enzymsystem ist die Pyruvatdehydrogenase. Die PDH ist in der mitochondrialen Matrix lokalisiert. Die PDH ist ein Multienzymkomplex. Die PDH benötigt je nach Lehrbuch fünf (bzw. sechs) Cofaktoren: – – – – – – Coenzym A NAD+ Lionsäure (Mg2+) Thiaminpyrophosphat FAD Ablauf der Pyruvatdecarboxylierung • Der Abbau von Pyruvat zu Acetyl-CoA erfolgt durch oxidative Decarboxylierung in drei Teilschritten. • Jeder Teilschritt wird durch eine andere katalytische Untereinheit des Multienzymkomplexes PDH katalysiert. 1. Teilschritt • Pyruvat wird decarboxyliert. Dieser Schritt wird von der Pyruvatdecarboxylase-Domäne der Pyruvatdehydrogenase katalysiert. • Für die Reaktion wird Thiaminpyrophosphat als Coenzym benötigt. Dieses leitet sich von Thiamin (Vitamin B1) ab. • Das dem Stickstoffatom des Thiazolrings benachbarte, sehr reaktionsfähige CAtom greift unter Bildung einer kovalenten Bindung die Carbonylgruppe des Pyruvats an. • Der kovalent gebundene Pyruvatrest wird decarboxyliert. Die hierfür notwendige Elektronenverschiebung wird dadurch erleichtert, dass der Thiazolring das Intermediat mesomer stabilisieren kann. • Das Produkt der Reaktion ist HydroxyethylThiaminpyrophosphat. 2. Teilschritt • Der einem Acetaldehyd entsprechende HydroxyethylRest wird durch die Disulfidgruppe der über eine Säureamidbindung covalent an die LipoattransacetylaseDomäne geknüpften αLiponsäure oxidiert, wobei ein S-Acetyl-Hydroliponamid entsteht. Anschließend wird der Acetylrest auf Coenzym A übertragen. 3. Teilschritt • Das Dihydroliponamid wird durch die DihydrolipoatdehydrogenaseUntereinheit mit FAD zu αLiponamid reoxidiert, das dabei entstehende FADH2 durch NAD+ regeneriert. Restliche Coenzyme der PDH Citratcyclus • Unter dem Citratcyclus (auch Zitronensäurezyklus, Tricarbonsäurecyclus oder Krebs-Zyklus genannt) fasst man eine Folge biochemischer Reaktionen zusammen, die in lebenden Zellen ablaufen und bei denen Citrat als Intermediat auftritt. Durch eine Sequenz von Dehydrierungen und Decarboxylierungen werden Redoxäquivalente gewonnen. • Der Citratcyclus ist für den oxidativen Abbau von ca. ⅔ aller Kohlenstoffverbindungen einer Zelle verantwortlich. • Dabei beruht der Abbau größtenteils auf einer oxidativen Decarboxylierung. • Die hauptsächliche Endprodukte sind: – CO2 – NADH/H+ – FADH2 Diese gehen in die Atmungskette ein, und werden dort in ATP umgewandelt. Ablauf des Citratcyclus • Die Reaktionsfolge des Citratcyclus lässt sich in zwei Teile einteilen: – Oxalacetat reagiert mit Acetyl-CoA unter Bildung von Citrat, das zweimal oxidiert und zweimal decarboxyliert wird, sodass Succinat entsteht. – Durch Oxidation von Succinat wird Oxalacetat regeneriert. Erste Teilsequenz • Die erste Reaktion des Citratcyclus ist die Bildung von Citrat aus Oxalacetat und AcetylCoA. • Das beteiligte Enzym ist die Citratsynthase • Die Thioesterbindung wird dabei hydrolytisch gespalten, so dass CoA frei wird. • Unter Katalyse durch die Aconitase erfolgt eine Umlagerung des Citrats zu Isocitrat. • Das Isocitrat trägt im Gegensatz zum Citrat die Hydroxyl-Gruppe an einem Protonen-bindenden (und damit oxidierbaren) C-Atom. • Der Reaktionsmechanismus beruht auf einer Abspaltung von H2O und anschließender Addition von H2O • Isocitrat wird NAD+-abhängig zu Oxalsuccinat oxidiert. Dieses ist instabil und decarboxyliert spontan zu α-Ketoglutarat. • Das verantwortliche Enzym ist die Isocitratdehydrogenase. • α-Ketoglutarat wird im nächsten Schritt durch dehydrierende Decarboxylierung zu Succinyl-CoA oxidiert. Der Reaktionsmechanismus der für diese Reaktion verantwortlichen αKetoglutaratdehydrogenase entspricht dem der Pyruvatdehydrogenase (wichtig bezüglich der Coenzyme). • Aus Succinyl-CoA wird unter Katalyse durch die Succinyl-CoA-Synthetase Succinat gebildet. • Die durch die Spaltung der Thioester-Bindung frei gewordene Energie wird dazu genutzt, aus GDP und einem anorganischen Phosphat GTP zu erzeugen. Zweite Teilsequenz • Die den Citratcyclus abschließende Reaktionsfolge entspricht mechanistisch den ersten drei Reaktionen der β-Oxidation der Fettsäuren! • Succinat wird durch die Succinatdehydrogenase in einer FADabhängigen Reaktion zu Fumarat oxidiert. • Durch Anlagerung von H2O an Fumarat entsteht Malat (Salz der Äpfelsäure). • Das verantwortliche Enzym ist die Fumarase. • Im letzten Schritt des Citratcyclus wird Oxalacetat in einer NAD-abhängigen RedoxReaktion aus Malat regeneriert. • Die Reaktion wird durch die Malatdehydrogenase katalysiert. Energieausbeute • Die Oxidation von Acetylresten im Citratcyclus verläuft nach der Summengleichung: CH3COOH + 2 H2O 2 CO2 + 8 H • Formal wird somit Acetat vollständig zu CO2 und H2 abgebaut. Das Prinzip des Citratcyclus beruht darauf, dass Acetat an ein Trägermolekül (Oxalacetat) gebunden wird, an dem dann die Dehydrierungen stattfinden. Energiebilanz • Pro Molekül Glucose entstehen somit zwei Acetyl-Reste. • Pro Acetyl-Rest entstehen 3 NADH/H+ und ein FADH2. Deren Reoxidation in der Atmungskette liefert einen Energiebetrag von etwa 8,4 ATP. Desweiteren wird ein dem ATP analoges GTP durch Substratkettenphosphorylierung gebildet. Beziehung zu anderen Stoffwechselwegen • Der Citratcyclus steht in enger Beziehung zum Kohlenhydrat-, Lipidund Aminosäurestoffwechsel. Reaktionen, die aus dem Citratcyclus herausführen, sind die Fettsäurebiosynthese, die Hämbiosynthese, die Synthese der nichtessentiellen Aminosäuren und die Gluconeogenese. • Reaktionen, die vornehmlich zu anabolen Stoffwechselwegen gehören, und für diese dem Citratcyclus Intermediate entnehmen, heißen cataplerotische Reaktionen. Anaplerotische Reaktionen • Die sich durch die vom Citratcyclus ausgehenden Biosynthesen ergebenden Verluste an Intermediaten müssen durch die sog. Anaplerotischen Reaktionen aufgefüllt werden. Dies sind: – Carboxylierung von Pyruvat zu Oxalacetat – Bildung von α-Ketoglutarat aus Glutamat – Bildung von Oxalacetat aus Aspartat – Bildung von Malat aus Pyruvat. Glyoxylatcyclus • Der Glyoxylatcyclus ist ein Stoffwechselweg, der die Synthese von Succinat aus zwei Molekülen Acetyl-CoA ermöglicht. Er ähnelt dem Citratcyclus und ermöglicht es höheren Pflanzen, die in Samen gespeicherten fetten Öle in Kohlenhydrate umzusetzen. • Die Reaktionen des Glyoxylatcyclus besitzen einen anaplerotischen Charakter, da in ihm Metabolite gebildet werden, die in den Citratcyclus eingehen können. • Der Glyoxylatcyclus ist in den Glyoxisomen lokalisiert. Reaktionsfolge des Glyxoylatcyclus • Ausgehend von den Edukten Oxalacetat und Acetyl-CoA läuft der Glyoxylatcyclus bis zur Stufe des Isocitrats analog zum Citratcyclus. • Isocitrat wird jedoch durch die Isocitratlyase in Glyoxylat und Succinat gespalten. Das Succinat kann als Edukt in den Citratcyclus eingeschleust werden. • Aanlog zur Citratsynthase katalysiert die Malatsynthase die Bildung von Malat aus Glyoxylat und Acetyl-CoA. • Die Malatsynthase gehört zur Enzymklasse der Lyasen. • Aus Malat kann anschließend analog zum Citratcyclus Oxalacetat gebildet werden, welches in den Citratcyclus eingehen, oder aber im Zuge der Gluconeogenese für die Synthese von Kohlenhydraten genutzt werden kann. • Die Nettoformel des Glyoxylatcyclus lautet: 2 Acetyl-CoA + 2 NAD+ + FAD Oxalacetat + 2 CoA + 2 NADH/H+ + FADH2 Verbindung Citrat& Glyoxylatcyclus Atmungskette und oxidative Phosphorylierung • Zur Aufrechterhaltung ihrer Funktionen benötigen alle Lebensformen die ständige Verfügbarkeit von Energie. Die energiereichen Phosphorsäureanhydridbindungen des ATP stellen die universelle Energiewährung dar. Deren Erzeugung erfolgt durch Kopplung an exergone Redoxreaktionen. • Der direkte ATP-Gewinn durch Substratkettenphosphorylierung im Verlauf der katabolen Stoffwechselwege (Glycolyse/Citratcyclus) ist relativ gering. Neben ATP entstehen jedoch Reduktionsäquivalente in Form reduzierter Nukleotide (FADH2, NADH/H+). • Da die Gesamtmenge an Nukleotiden als Cofaktoren in der Zelle begrenzt sind, müssen diese regeneriert werden, um die Stoffwechselprozesse aufrecht zu erhalten. • Unter anaeroben Bedingungen wird die Regeneration durch die Reaktionsfolgen der Gärungen sichergestellt. Aerobe Regeneration • Unter aeroben Bedingungen werden NADH/H+ und FADH2 in die Atmungskette eingeschleust. • Formal liefert die Reoxidation des an sie gebundenen Wasserstoffs mit Sauerstoff nach der Gleichung H2 + 0,5 O2 H2O; G0 = -235 KJ/mol Einen hohen Energiebetrag (Knallgasreaktion!) • Statt molekularem Wasserstoff reagieren allerdings die wasserstofftragenden Coenzyme über mehrere Stufen (kontrollierte Knallgasreaktion). Die Reoxidation beinhaltet einen Wasserstoff- und Elektronentransport. • Die Konservierung der hierbei frei werdenden Energie in Form von ATP aus den Edukten ADP und anorganischem Phosphat wird oxidative Phosphorylierung genannt. • Die Enzymkomplexe von Atmungskette und oxidativer Phosphorylierung sind bei Eukaryoten in der inneren Mitochondrienmembran lokalisiert. (bei Prokaryoten in der Cytoplasmamembran) • 1 Mol NADH/H+ → 3 Mol ATP • 1 Mol FADH2 → 2 Mol ATP • Ein Mitochondrium enthält außer seiner äußeren noch eine innere Membran. Den Raum zwischen diesen beiden Membranen nennt man Intermembranraum (perimitochondrialer Raum). Vier der fünf Komplexe der Atmungskette durchspannen jeweils die innere Mitochondrienmembran vollständig, Komplex II hingegen „endet blind“. Es wird ein Protonengradient zwischen dem Intermembranraum und dem Inneren (Matrix) des Mitochondriums erzeugt, der dann in Komplex V zur Synthese von ATP genutzt wird. Ablauf der Atmungskette Komplex I • Die NADH:Ubichinon-Oxidoreduktase katalysiert die Reaktion NADH/H+ + Ubichinon NAD+ + Ubichinol • Der Enzymkomplex besitzt am Elektronentransport beteiligte Eisen-SchwefelZentren, deren Fe-Atome am Elektronentransort teilnehmen. Desweiteren enthält er FMN (Flavinmononukleotid) als prosthetische Gruppe. • NADH überträgt zunächst seine Elektronen auf FMN, sodass FMNH2 entsteht. Dieses gibt die Elektronen weiter an die Eisen-Schwefel-Zentren, die ihrerseits wieder Ubichinon (Coenzym Q) zu Ubichinol reduzieren. • Pro oxidiertem NADH/H+ werden netto 4 H+Ionen in den Intermembranraum gebracht. Komplex II • Die Succinat: UbichinonOxidoreduktase (SuccinatDehydrogenase) ist auch Bestandteil des Citratcyclus und katalysiert die Reaktion Succinat + Ubichinon Fumarat + Ubichinol. • Der Komplex enthält FAD als Coenzym und ebenfalls Eisen-Schwefel-Zentren, allerdings werden keine Protonen in den Intermembranraum gepumpt. • Weitere Möglichkeiten zur Reduktion von Ubichinon stellen die GlycerophosphatOxidase und das elektronentransferierende Flavoprotein (ETF) dar. • ETF wird durch FADH2, das im Zuge der β– Oxidation der Fettsäuren entsteht reduziert. Komplex III • Die Ubichinol:Cytochrom c – Oxidoreduktase (Cytochrom c Reduktase) katalysiert die Reaktion Ubichinol + 2 Cytochrom cox Ubichinon + 2 Cytochrom cred • Dabei werden zwei Protonen vom Matrixraum in den Intermembranraum transportiert. • Der Mechanismus der Kopplung von Elektronentransfer und Protonentransport im Komplex III wird als Q-Cyclus bezeichnet. • Das Enzym enthält ein Eisen-Schwefel-Zentrum und die Cytochrome c und b. • Cytochrome (auch: Zytochrome, griech. chroma = Farbe) sind farbige Proteine (Chromoproteine) (daher der Name, der „Zellfarbstoff“ bedeutet), die Häme als prosthetische Gruppen enthalten und Reduktionsäquivalente übertragen, indem das zentrale Eisen-Atom im Häm die Oxidationsstufe wechselt. Cytochrome werden nach der Variante des Häms, das sie enthalten und nach ihrem LichtAbsorptionsspektrum unterschieden. Komplex IV • Die Cytochrom c-Oxidase katalysiert die Reaktion 2 Cytochrom cred + 0,5 O2 +2 H+ 2 Cytochrom cox + H2O • Der Komplex kann als einziges Protein der Atmungskette mit Sauerstoff reagieren. Der Elektronentransport erfolgt dabei über die Cytochrome a und a3 sowie Kupfer-Ionen. Redoxcarrier • Die Komplexe I-IV der Atmungskette sind relativ ortsfest in der Membran verankert. Der Elektronentransport zwischen den einzelnen Komplexen erfolgt über die mobilen Substrate Ubichinon (Coenzym Q) und Cytochrom c. • Diese Substrate werden auch Redoxcarrier genannt. Mitochondriale Energiekonservierung • Die Atmungskette beinhaltet drei Schritte, deren Änderung der freien Enthalpie groß genug ist, eine ATP-Synthese aus ADP und anorganischem Phosphat zu ermöglichen. • Die Komlexe I, III und IV sind fähig, während des Elektronentransports auftretende Änderungen der freien Energie für den aktiven Transport von Protonen in den Intermembranraum zu nutzen. • Dies verursacht einen pH- und Ladungsgradienten über der inneren Mitochondrienmembran. Dieser wird auch als elektrochemischer Gradient bezeichnet. • Die primäre Energiekonservierung beruht also auf dem Aufbau einer elektrochemischen Potentialdifferenz. • Komplex V der Atmungskette nutzt letztendlich diesen Gradienten zur Synthese von ATP. Komplex V • Die ATP-Synthase benutzt den Protonengradienten zur ATP-Synthese. • Die ATP-Synthase benötigt mindestens e Protonen zur Synthese von ATP. • Die Nettoreaktion lautet: ADP + Pi ATP + H2O Überblick Atmungskette • Foto Wikipedia